Introducción
En la actualidad, la mayoría del semen de cerdo destinado a la inseminación artificial (IA) es preservado con la adición de diluyentes y almacenado a una temperatura de 15 a 20 ºC (Cerolini et al., 2000). Estos diluyentes se utilizan para mantener las características deseables del semen durante varios días y se clasifican según su periodo de conservación: diluyentes de corta acción (3 a 4 d), mediana acción (5 a 6 d), larga acción (7 a 8 d) y extra larga acción (más de 8 d; Pinart et al., 2015). Martín (2013) indicó que el diluyente es uno de los factores principales para la tolerancia del espermatozoide a la conservación. Durante la conservación del semen de cerdo, existe una correlación negativa en cuanto a la fertilidad del espermatozoide y el tiempo de almacenamiento, resultando con distintos cambios estructurales y funcionales en los espermatozoides como los son: alteraciones en la membrana, disminución de la motilidad y viabilidad (Johnson et al., 2000; Kumaresan et al., 2009). Para reducir lo antes mencionado, en los últimos años se han llevado a cabo diversos estudios encaminados a la adición de distintos antioxidantes en los diluyentes para congelación de espermatozoides en diferentes especies (Zhang et al., 2012). Particularmente, se ha demostrado efectos benéficos al adicionar ácido ascórbico (AA) en diluyentes para congelación de semen en bovino (Hu et al., 2010), macho cabrío (Gangwar et al., 2015) y porcino (Giaretta et al., 2015), el cual se creé que puede reducir el estrés oxidativo y así, mejorar las características seminales con respecto al grupo testigo después del descongelado. Sin embargo, se encuentra insuficiente referencia bibliográfica sobre las características seminales resultantes de la adición de AA en un diluyente para la conservación de semen porcino a temperatura ambiente. El objetivo del presente estudio fue evaluar el efecto de la adición de AA en el diluyente sobre las características del semen de cerdo conservado a temperatura ambiente.
Materiales y métodos
El presente trabajo se realizó en el Laboratorio de Reproducción Animal, localizado en la posta zootécnica “M. C. Donato Cortés Bañuelos”, perteneciente a la Unidad Académica de Medicina Veterinaria y Zootecnia de la Universidad Autónoma de Zacatecas, con ubicación en El Cordovel, Enrique Estrada, Zacatecas. Como fuente de células espermáticas se utilizaron cinco eyaculados de un verraco de raza Yorkshire habituado a la recolección seminal, con un peso aproximado de 200 kg y 5 años de edad. Las muestras de semen fueron obtenidas mediante la técnica de mano enguantada, siguiendo la metodología descrita por Ax et al. (2002). La fracción rica en espermatozoides fue diluida a una concentración final de 37.5x106 espermatozoides/ml utilizando el diluyente comercial Androhep LiteMR y posteriormente, cada eyaculado se dividió en cinco tratamientos: T0) 0 mg/ml AA, T1) 0.01 mg/ml AA, T2) 0.02 mg/ml AA, T3) 0.03 mg/ml AA y T4) 0.04 mg/ml AA, los cuales se conservaron en una hielera de unicel a temperatura ambiente durante el experimento. Todas las mediciones se hicieron por duplicado. Como fuente de AA se utilizó CEVALIN®, solución inyectable de uso humano con una concentración de 100 mg/ml. El semen fue evaluado repetidamente cada 24 h en nueve ocasiones. En cada evaluación se midió: Motilidad masal (MM), motilidad progresiva (MP), células vivas e integridad de la membrana celular (IMC). Los parámetros de MM y MP se determinaron visualmente con ayuda de un microscopio óptico de campo claro (Leica DM2500) usando los aumentos de 10x y 40x, respectivamente. Para valorar la motilidad masal se utilizó la escala de Evans y Maxwell (1990). La viabilidad se evaluó mediante tinción de Eosina-Nigrosina (Dilución 1:1) según lo mencionado por Sorensen (1982). La IMC se evaluó mediante la prueba de estrés hipo-osmótico (HOST) realizando una dilución 1:10 con semen y solución hipo-osmótica (1:10), la cual se encubó en baño maría a una temperatura de 37ºC por 30 min. El experimento fue realizado mediante un diseño en parcelas divididas, considerando como parcela grande el tratamiento y como subparcela los tiempos de medición. Los datos fueron analizados utilizando el procedimiento PROC GLM del paquete estadístico SAS (2002). Se realizó una comparación de medias entre tratamientos con el método Tukey aplicando la sentencia MEANS del SAS, posteriormente se realizó una prueba de contrastes con la sentencia CONTRAST del SAS.
Resultados y discusión
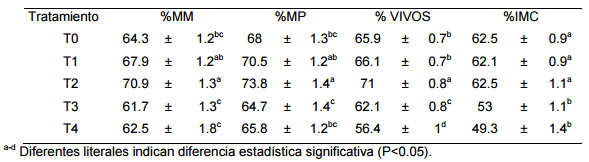
En el presente trabajo se encontró un efecto positivo del AA sobre la MM y MP (Cuadro 1), observándose que la concentración de 0.02 mg/ml logró ser más eficaz (P<0.05) para la conservación de estos parámetros con respecto a los demás tratamientos, así mismo, la viabilidad del semen se conservó de una mejor manera con la adición de AA al diluyente comercial en el semen porcino, resultados similares han sido reportados sobre la adición de AA en diluyentes para congelar semen de bovinos (Hu et al., 2010), porcinos (Giaretta et al., 2015) y caprinos (Gangwar et al., 2015). Durante las primeras 120 horas de muestreo las características seminales se comportaron de una manera similar (P>0.05) para los tratamientos 0 mg/ml AA, 0.01 mg/ml AA, 0.02 mg/ml AA y 0.03 mg/ml AA. A partir de la hora 192 de muestreo se observó una tendencia (P<0.05) de mantener de mejor manera las características seminales (MM, MP y Viabilidad) con el tratamiento 0.02 mg/ml AA con respecto a los demás tratamientos, concordando con lo reportado en semen de carneros por Azawi y Hussein (2013) quienes suplementaron con AA el diluyente Tris, logrando observar un efecto benéfico sobre la conservación de las características seminales por un lapso de 120 horas mediante refrigeración a 5º C. Así mismo, Gangwar et al. (2015) quienes adicionaron al diluyente de congelación del semen bovino 45.42 μM y 56.78 μM de AA observaron una mejora en la motilidad post-descongelación con respecto al grupo control. Sin embargo, existen reportes contradictorios como el de Michael et al. (2008) quienes no encontraron que la suplementación con AA en concentraciones de 0.1 mM, 0.5 mM, 1 mM y 2.5 mM influyera de una manera positiva en la calidad del semen de canino diluido y conservado a 4º C. En el semen suplementado con AA se observaron tanto efectos benéficos como nocivos para mantener la IMC, ya que se encontró una mayor cantidad de espermatozoides con membranas dañadas al aumentar la dosis de AA en el diluyente pero una mejor conservación (P<0.05) de la IMC en los tratamiento con concentraciones de 0, 0.02 y 0.01 mg/ml de AA.
Cuadro 1. Medias (± error estándar) de la adición de cuatro niveles de AA sobre la motilidad masal, motilidad progresiva, viabilidad e integridad de la membrana en semen porcino.
Conclusión
La adición de AA al diluyente comercial a dosis de 0.02 mg/ml mantiene viables las características del semen porcino conservado a temperatura ambiente, pudiendo ser utilizado como una fuente antioxidante barata al diluyente.
Literatura citada
Ax, R. L., M. R. Dally, B. A. Didion, R. W. Lenz, C. C. Love, D. D. Varner, B. Hafez y M. E. Bellin. 2002. Evaluación del semen. En Reproducción e Inseminación Artificial en Animales. Hafez, E. S. E y B. Hafez. 7ª Edición. Ed. Mc-Graw-Hill. Mèxico, D. F. pp. 375-386.
Azawi, O. I. y E. K. Hussein. 2013. Effect of vitamins C or E supplementation to Tris diluent on the semen quality of Awassi rams preserved at 5 °C. Vet. Res. Forum. 4:157–160.
Cerolini, S., A. Maldjian, P. Surai y R. Noble. 2000. Viability, susceptibility to peroxidation and fatty acid composition of boar semen during liquid storage. Anim. Reprod. Sci. 58:99–111.
Evans, G. y W. M. C. Maxwell.1990. Inseminación artificial de ovejas y cabras. Editorial Acribia. Zaragoza, España. pp. 95-108.
Gangwar, C., S. D. Kharche, R. Ranjan, S. Kumar, A. K. Goel, S. K. Jindal y S. K. Agarwal. 2015. Effect of vitamin C supplementation on freezability of Barbari buck semen. Small. Rumin. Res. 129:104–107.
Giaretta, E., E. Estrada, D. Bucci, M. Spinaci, J. E. Rodríguez-Gil y M. Yeste. 2015. Combining reduced glutathione and ascorbic acid has supplementary beneficial effects on boar sperm cryotolerance. Theriogenology. 83:399–407.
Hu, J. H., W. Q. Tian, X. L. Zhao, L. S. Zan, H. Wang, Q. W. Li y Y. P. Xin. 2010. The cryoprotective effects of ascorbic acid supplementation on bovine semen quality. Anim. Reprod. Sci. 121:72– 77.
Johnson, L. A., K. F. Weitze, P. Fiser y W. M. C. Maxwell. 2000. Storage of boar semen. Anim. Reprod. Sci. 62:143–172.
Kumaresan, A., G. Kadirvel, K. M. Bujarbaruah, R. K. Bardoloi, A. Das, S. Kumar y S. Naskar. 2009. Preservation of boar semen at 18 ºC induces lipid peroxidation and apoptosis like changes in spermatozoa. Anim. Reprod. Sci. 110:162–171.
Martín, H. D. 2013. “Fisiología celular y calidad seminal durante la conservación del semen porcino refrigerado” Tesis de Doctorado. Facultad de Veterinaria, Departamento de Medicina Animal. Universidad de Extremadura. Cáceres, España.
Michael, A. J., C. Alexopoulos, E. A. Pontiki, D. J. Hadjipavlou-Litina, Ph. Saratsis, H. N. Ververidis y C. M. Boscos. 2008. Quality and reactive oxygen species of extended canine semen after vitamin C supplementation. Theriogenology. 70:827–835.
Pinart, E., M. Yeste, N. Prieto-Martínez, J. Reixach y S. Bonet. 2015. Sperm quality and fertility of boar seminal doses after 2 days of storage: does the type of extender really matter? Theriogenology. 83:1428–37.
SAS, 2002. Versión 9.0 del sistema SAS para Windows. Copyright SAS Institute Inc., Cary, NC, USA.
Sorensen, A. M. 1982. Reproducción animal, principios y prácticas. 1ª ed. Editorial McGraw-Hill. México. pp. 125-152.
Zhang, W., K. Yi, C. Chen, X. Hou y X. Zhou. 2012. Application of antioxidants and centrifugation for cryopreservation of boar spermatozoa. Anim. Reprod. Sci. 132:123–128.