Control y prevención de las coccidiosis: medidas higiénico-sanitarias y desinfección
Publicado: 5 de octubre de 2006
Por: Caridad Sánchez Acedo; Joaquin Quílez Cinca; Fernando López Bernad y Emilio del Cacho Malo, Dpto. de Patologia animal. Facultad de Veterinaria. Univ. de Zaragoza. España
Resumen
Tanto la Coccidiosis como la Criptosporidiosis, son enfermedades que se transmiten mediante la ingestión de ooquistes, los cuales tienen una gran resistencia y por lo cual las medidas higiénico sanitarias son esenciales en el control y prevención de estas enfermedades. En este sentido, el desinfectante OX-VIRINâ al 5%, según los estudios realizados, ha demostrado ser altamente eficaz, al inactivar tras un período de 120 minutos entre el 95-99% de los ooquistes, por lo cual puede ser de gran utilidad en el control y prevención de estas enfermedades.
Introducción
Los procesos entéricos del ganado porcino son producidos por una gran variedad de agentes bacterianos, víricos y parasitarios. En este último grupo, la coccidiosis y criptosporidiosis constituyen una de las principales causas de diarrea perinatal en ganado porcino.
Etiología
Diversas especies pertenecientes a los géneros Eimeria e Isospora producen la Coccidiosis. Isospora suis es la especie más importante y en el género Eimeria, las de mayor interés son: Eimeria debliecki, E. scabra, E. suis, E. perminuta, E. spinosa, E. polita, E. porci y E. neodebliecki.
Las especies del género Eimeria se desarrollan en las células epiteliales del intestino delgado. Por ejemplo, E. polita, porci, scabra y spinosa se mutliplican en las partes finales del intestino delgado, mientras que E.debliecki lo hace en yeyuno. Los ooquistes (11-35x11-26 m m) pueden ser elípticos u ovoides, piriformes, ovales o esféricos y están rodeados por una membrana externa incolora o de color amarillo, en cuyo interior se encuentran cuatro esporocistos que tienen 2 esporozoítos cada uno cuando han esporulado (Figura 1).
Los ooquistes de Isospora suis (17-25x16-21 m m) son subesféricos o elipsoides, su pared es incolora, carecen tanto de cuerpo de Stieda como del cuerpo residual ooquístico y cuando esporulan contienen dos esporoquistes con cuatro esporozoítos cada uno (Figura 2). Esta especie se multiplica en el epitelio apical de las vellosidades del intestino delgado, preferentemente del primer tercio y también en la zona media del yeyuyo, aunque también pueden encontrarse en el fondo de las criptas, mitad posterior del intestino delgado y en el duodeno, ciego y colon.
Por su parte, la Criptosporidiosis en los mamíferos y en concreto en el ganado porcino, es producida fundamentalmente por Cryptosporidium parvum, que se localiza en el intestino delgado, aunque también puede afectar al intestino grueso, principalmente ciego y colon y ocasionalmente el estómago, vesícula biliar, hígado, páncreas, útero, tráquea, pulmones, corazón, vías urinarias y conjuntiva. Los ooquistes de C. parvum son redondeados, de 4,5-5 m m y están rodeados de una pared que puede ser fina o gruesa; estos últimos constituyen las formas de resistencia responsables de la transmisión entre hospedadores (Figura 3).
Ciclo evolutivo
En la Coccidiosis, los animales infectados eliminan ooquistes con las heces, que con temperatura adecuada (32-35ºC) y alto grado de humedad esporulan al cabo de 12 y 48 horas y pueden mantenerse infectantes en las explotaciones hasta 1 año (Isospora suis).
Cuando los animales, principalmente los jóvenes ingieren estos ooquistes, llegan al estómago donde se desenquistan con los jugos digestivos liberándose los esporozoítos en la luz intestinal, y penetran en los enterocitos del intestino delgado, donde se dividen por endodiogenia, y forman merontes binucleados dentro del enterocito que dan lugar a la liberación de merozoítos en parejas. Posteriormente, se producen dos generaciones esquizogónicas de tipo II multinucleadas, que dan lugar respectivamente a 12-16 merozoítos en la primera generación y 4-16 merozoítos en la segunda.
Los merozoítos de segunda generación penetran en las células del epitelio intestinal y se diferencian sexualmente en gametocitos. El merozoíto masculino, evoluciona a microgamonte y después de una fase de multiplicación mitótica de su núcleo da lugar a microgametos flagelados, mientras que el merozoíto femenino evoluciona a macrogamonte y posteriormente a macrogameto, Posteriormente, los microgametos invaden las células parasitadas por los macrogametos y los fecundan para dar lugar al ooquiste, que al romper la célula que lo alberga alcanza la luz intestinal y es eliminado al exterior con las heces a los 5 días post-infección. Los ooquistes de Eimeria tienen cuatro esporocistos con dos esporozoítos cada uno, mientras que las especies de Isospora contienen dos esporocistos y cada uno contiene 4 esporozoítos.
En C. parvum, la infección se produce también con la ingestión de ooquistes, seguida del desenquistamiento en el tracto gastrointestinal. De cada ooquistes se liberan los cuatro esporozoítos, que alcanzan el borde luminal de los enterocitos mediante movimientos de contracción, extensión y deslizamiento y allí se invaginan a manera de dedo de guante, siendo englobados por la membrana celular, que encapsula al parásito en el interior de una vacuola parasitófora. Posteriormente, en el curso de la merogonia, se forman 8 merozoítos en la primera esquizogonia y posteriormente en una segunda esquizogonia se forman 4 merozoítos. Los merozoítos de la primera esquizogonia pueden generar nuevas merogonias de primera generación o formar merontes de tipo II, a partir de los cuales se desarrollan los macro y microgametos y solo unos pocos forman microgamontes que contienen 16 microgametos en su interior.
Los microgametos se dirigen hacia los macrogametos siguiendo el flujo intestinal, con lo cual penetran a través de la vacuola parasitófora, se fusionan con los macrogametos y dan lugar a la formación de un ooquiste que esporula en el interior de la célula hospedadora. El 80% de los ooquistes tienen una pared doble, y son eliminados con las heces. En definitiva constituyen las formas de resistencia en el medio ambiente y son los responsables de la transmisión. También se producen ooquistes de pared fina, aproximadamente el 20% restante, rodeados de una sola membrana y responsables de la autoinfección. Precisamente la debilidad de su pared permite que estos ooquistes se rompan en el intestino y los esporozoítos penetran en las células epiteliales próximas, reiniciándose el ciclo endógeno. El período de prepatencia es de 3-4 dias.
Epidemiología
La infección está directamente relacionada en todos los casos con la contaminación de los útiles de limpieza, comederos, bebederos y con la introducción en las explotaciones de ganado porcino infectado eliminador de ooquistes, e inclusive con la intervención de otras especies cuando se trata C. parvum, ya que la prevalencia de parasitación por es muy alta en otros animales (22-52% en rumiantes).
Por otra parte, la alta resistencia de los ooquistes tanto de las especies de Eimeria, e Isospora como de Cryptosporidium parvum, mantiene durante largos períodos de tiempo la infección en las explotaciones. Los ooquistes de C. parvum, se mantienen infectantes durante 2-6 meses a 4ºC.
Patogenia
La especie más patógena es Isospora suis, al producir la destrucción de los enterocitos del intestino delgado, principalmente en el ápice de las vellosidades intestinales, provocando la secreción de las criptas. También en la zona final del yeyuno, donde se forman los ooquistes, disminuye el número de células caliciformes y por lo tanto la absorción de los nutrientes, lo que desencadena un síndrome de malabsorción y se produce diarrea con pérdida de fluidos.
El proceso se agrava cuando se producen infecciones secundarias por Escherichia coli, clostridios y rotavirus principalmente, que potencian la patogenia. La infección produce inmunidad específica. Por su parte C. parvum, también invade los enterocitos produciendo la atrofia parcial de las vellosidades y la fusión de éstas, con lo cual disminuye la superficie de absorción con la consiguiente diarrea.
Síntomas
En las eimeriosis, los animales suelen enfermar después del destete y suelen ser asintomáticos, aunque ocasionalmente pueden presentar diarrea con heces acuosas, amarillentas y excepcionalmente con estrías de sangre. Por el contrario, en infecciones por Isospora suis, los lechones enferman generalmente a partir de los 5 días de edad hasta el destete, y a veces incluso en la semana siguiente. Tras un período de incubación de 3 o 4 días, eliminan heces sueltas o pastosas, que huelen a leche ácida, son acuosas, blanquecinas, blancoamarillentas o grisáceas, desciende el apetito, con retraso del crecimiento y polidipsia, deshidratación, ligera palidez de las mucosas y erizamiento piloso. La gravedad de la infección esta relacionada con el número de ooquistes ingeridos y con la edad de los animales. La morbilidad es muy alta, mientras que la mortalidad es escasa (menos del 20%) si no hay complicaciones con otras infecciones bacterianas o víricas.
Las infecciones por C. parvum son generalmente asintomáticas en cerdos adultos. Los lechones de más de una semana de edad (10-12 dias de vida) pueden presentar signos clínicos caracterizados por heces diarreicas, pastosas y de color pardo durante 3 a 5 dias, junto con anorexia, pelo erizado y descenso de peso.
Lesiones
En infecciones por I. suis, los cadáveres están deshidratados y las lesiones más significativas se observan en el intestino delgado que está turgente y no flácido. El yeyuno e ileon están inflamados, con enteritis catarral en las formas más benignas hasta le formación de membranas fibrinonecróticas. El contenido intestinal es cremoso o acuoso y se encuentran copos necróticos. En los cortes histológicos se observa atrofia y fusión de las vellosidades, con regeneración del epitelio cilíndrico apical, que es sustituido por células cuboides o aplanadas, con hiperplasia del revestimiento de las criptas.
En las eimeriosis se produce enteritis difusa catarral aguda, con atrofia de las vellosidades intestinales y enteritis fibrinosa necrosante, con depósitos como de tiza o hemorrágica cuando se trata de E. scabra en yeyuno e íleon (cit. Cordero del Campillo, 1999). La infección por C. parvum afecta al duodeno y yeyuno, que están inflamados, con las vellosidades atrofiadas y se forman membranas diftéricas sobre la superficie de la mucosa. En el intestino grueso, la mucosa aparece engrosada y cubierta de material necrótico, con heces acuosas. En los tramos finales del intestino grueso, se produce el acortamiento de las vellosidades y reacción inflamatoria en la lámina propia.
Diagnóstico
Los datos clínicos, como es la diarrea en los lechones de 7-15 días de edad, en infecciones por isospora e Eimeria, y en los de 1-12 hasta 30 semanasde edadcuando se trata de C. parvum, deben ser tenidos en cuenta.
No obstante, el diagnóstico debe ser laboratorial mediante técnicas de flotación, para identificar los ooquistes en las heces. Sin embargo, hay que tener en cuenta que puede haber diarrea y muerte en el período de prepatencia sin que se puedan aislar ooquistes en las heces. En este caso, deberá realizarse raspado de las lesiones intestinales, principalmente de yeyuno e íleon para aislar merozoítos, esquizontes y gametos y teñir con el método de Giemsa. Por otra parte, es preciso tener en cuenta que la eliminación de los ooquistes tiene lugar en dos o tres oleadas correspondientes a los ritmos de reproducción sexuada, separados por períodos de 5 días, lo cual puede coincidir con la recogida de heces.
La identificación morfológica de los ooquistes requiere el estudio de los ooquistes esporulados y el tiempo de esporulación para establecer la diferenciación de las especies. Los ooquistes de C. parvum se observan sobre material previamente concentrado en extensiones fecales teñidas por el método de Ziehl- Neelsen modificado, la tinción de Heine y las técnicas basadas en la captación de un fluorocromo por parte del parásito (fenol-auramina, auramina-rodamina, auramina caarbolfucsina, naranja de acridina). También se utilizan las técnicas inmunológicas entre las que se encuentran la aglutinación con látex, inmunofluorescencia con anticuerpos monoclonales o policlonales y el ELISA de inmunocaptura de antígenos en heces. De todos los mátodos señalados, el de inmunofluorescencia es el que tiene mayor sensibilidad y especificidad.
Tratamiento y profilaxis
Aparte del tratamiento sintomático contra la diarrea y atender la deshidratación, se recomienda el Toltrazuril (20 mg/kg pv, tanto por vía oral como inyectado) como fármaco más eficaz. Las sulfamidas-trimetoprim, metronidazol y amprol,reducen la eliminación de ooquistes, pero no mejoran sustancialmente la situación clínica. En la coccidiosis, el tratamiento preventivo de las madres 7-10 días antes del parto hasta 2 días después del mismo, administrando amprol, monensina o toltrazuril puede resultar de utilidad, teniendo en cuenta que los animales adultos asintomáticos pueden ser fuente de infección. En los lechones de destete precoz, también puede administrarse preventivamente toltrazuril durante 4-6 semanas.
Por lo que respecta a la Criptosporidiosis, hasta el momento actual todos los fármacos ensayados han resultado ineficaces, por lo que al no existir un tratamiento específico, las medidas preventivas basadas en las medidas higiénico sanitarias y fundamentalmente en la desinfección son fundamentales en el control y prevención de esta enfermedad.
Control y prevención
La cuarentena de los animales de nueva adquisición, el tratamiento de las madres en las Isosporosis e Eimeriosis, junto con las medidas higiénico sanitarias y de desinfección, en este caso también en la Criptosporidiosis, permiten la destrucción de los ooquistes e impiden en definitiva la infección de los animales. No obstante la extremada resistencia de los ooquistes a numerosos desinfectantes como amonio cuaternario, formalina, sulfato de cobre, ácido sulfúrico, hidróxido potásio, ioduro potásico o permanganato potásico entre otros, dificulta enormemente la puesta en marcha de estas medidas.
En este sentido, hemos realizado un estudio para determinar la eficacia desinfectante OX-VIRINâ (OX-CTA, Huesca) frente a los ooquistes de C. parvum, utilizando diversas concentraciones del producto diluido en agua destilada (2, 5 y 10%) y tiempos de exposición de los ooquistes (30, 60 y 120 minutos).
La actividad del desinfectante se ha determinado en base a su capacidad para inhibir el desenquistamiento, comparando los porcentajes de desenquistamiento de los ooquistes tratados con el desinfectante y los ooquistes control. Los resultados obtenidos nos permiten afirmar que el tratamiento de los ooquistes con el desinfectante reduce significativamente el porcentaje de desenquistamiento a todas las concentraciones y tiempos de exposición evaluados, de tal forma que más del 95% de los ooquistes resultaron inactivados cuando fueron expuestos a OX-VIRIN al 5% durante 60 minutos y más del 99% cuando la exposición se prolongó durante 120 minutos. Cabe destacar que el incremento de la concentración del desinfectante al 10% no mejoró estos resultados de forma estadísticamente significativa (Tabla1. Figura 1).
Tabla 1. Porcentaje de ooquistes inactivados cuando son expuestos a diversas concentraciones de OX-VIRIN (técnicas de desenquistamiento in vitro y colorantes vitales). Cada valor representa la media de tres ensayos.
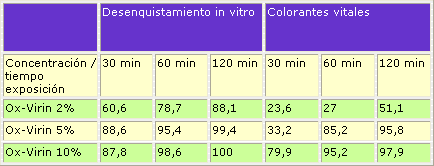
Figura 1. Porcentaje de desenquistamiento de ooquistes de Cryptosporidium expuestos a diversas concentraciones de OX-VIRIN. Cada valor representa la media de tres ensayos.
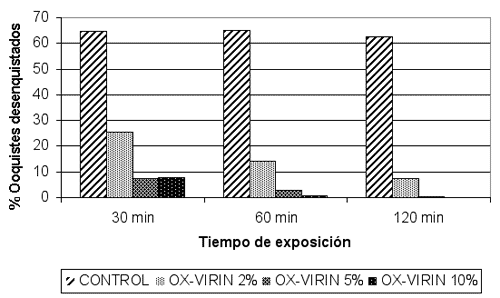

Figura 1. Porcentaje de desenquistamiento de ooquistes de Cryptosporidium expuestos a diversas concentraciones de OX-VIRIN. Cada valor representa la media de tres ensayos.

Resultados similares se obtuvieron utilizando una técnica de tinción con los colorantes vitales 4´6-diamidino-2-phenylindole (DAPI) y ioduro de propidio (PI). En este caso, la actividad del desinfectantes se determinó en base a su capacidad para reducir el porcentaje de ooquistes viables, para lo cual se compararon los valores obtenidos con ooquistes tratados con el desinfectante y ooquistes control. Esta técnica nos ha permitido comprobar que la exposición de los ooquistes de C. parvum a OX-VIRIN 5% durante al menos 30 minutos reduce de forma estadísticamente significativa el porcentaje de ooquistes viables, resultando inactivados más del 95% de los ooquistes con exposiciones de 120 minutos. Los porcentajes de inactivación fueron superiores incrementando la concentración del desinfectante al 10%, aunque las diferencias tampoco fueron estadísticamente significativas en este caso (Tabla 1. Figura 2).
Figura 2. Viabilidad de ooquistes de Cryptosporidium expuestos a diversas concentraciones de OX-VIRIN según los resultados de la técnica de colorantes vitales. Cada valor representa la media de tres ensayos.
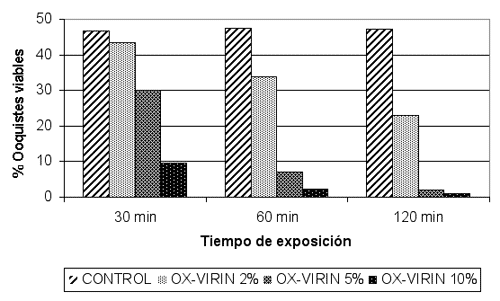

El análisis de los resultados obtenidos pone de manifiesto que la desinfección con OX-VIRIN reduce considerablemente la viabilidad de los ooquistes de C. parvum, ya que entre el 95% y el 99% de los ooquistes son inactivados cuando se exponen a concentraciones del 5% durante 120 minutos, por lo cual es un desinfectante eficaz frente a los ooquistes coccidianos y puede resultar de gran utilidad en el control y prevención de las enfermedades producidas por ooquistes de coccidios.
Referencias
- Adesiyun, AA, Kaminjolo, JS 1994. Prevalence and epidemiology of selected enteric infections of livestock in Trinidad. Prev. Vet. Med., 19: 151-165.
- Cordero del Campillo, M, Hidalgo Arguello, MR, Díez Baños, N. 1999. Eimeriosis e Isosporosis. En: Parasitología Veterinaria. Cordero del Campillo et al. (Edit.). McGraw-Hill Interamericana. Madrid. pp. 451.456.
- Harleman, JH, Meyer, RC. 1984. Life cycle of Isospora suisin gnotobiotic and conventionalized piglets. Vet. Parasitol., 17: 27-39.
- Xiao, L, Herd, RP, Bowman, GL. 1994. Prevalence of Cryptosporidium and Giardiainfections on two Ohio pig farms with different management systems. Vet. Parasitol., 52: 331-336.
- Lindsay, DS, Ernst, JV, Current, WL, Stuart, BP, Stewart, TB. 1984. Prevalence of oocysts of Isospora suis and Eimeriaspp from sows on farms with and without a history of neonatal coccidiosis. J. Am. Vet. Med. Assoc., 185: 419-421.
- Lindsay, DS, Blagburn, BL. 1994. Biology of mammalian Isospora. Parasitol. Tod., 10: 214-220.
- Quilez Cinca, J, Sánchez Acedo, C, Clavel Parrilla, A, Causapé Valenzuela, AC. 1994. Identificación de Isospora suisen lechones con diarrea. X Reunión anual de la Asociación de Parasitólogos españoles. Barcelona. Sitges. Libro de resúmenes, p: 2.
- Quílez, J, Sánchez Acedo, C, Clavel, A, Del Cacho, E., López Bernad, F. 1996. Prevalence of Cryptosporidiuminfections in pigs in Aragón (northeastern Spain). Vet. Parasitol., 67: 83-88.
- Roderick, C.T. 1987. Controlling coccidiosis in neonatal pigs. Vet. Med, 82: 646-650.
- Sánchez Acedo, C, Quílez, J, del Cacho, E, López Bernad, F. 2003. Coccidiosis porcina. Mundo ganadero, nº 156: 52-56.
- Sandford, SE, Josephson, GKA. 1981. Porcine neonatal coccidiosis. Can. Vet. J., 22: 282-285.
- Stuart, BP, Gosser, HS, Allen, CB, Bedell, DM. 1982. Coccidiosis in swine: dose and age response to Isospora suis. Can. J. Comp. Med., 46: 317-320.
Temas relacionados:
Autores:
Universidad de Zaragoza (UNIZAR)
Universidad de Zaragoza (UNIZAR)
Recomendar
Comentar
Compartir
Recomendar
Responder

29 de octubre de 2006
hola ha todos ,, este tema es bastante interesante pero la verdad desearia saber si alguien ha probado el producto y como es su farmacocinetica y que tipo de medidas deberian utilizrse para la aplicacion y ademas en que cuadros de la enfermedad conviene coadyubarlo o no
att
JAIRO NEGRETTE VEGA
Recomendar
Responder

29 de octubre de 2006
al amigo zabulon mercado de puerto rico ...podriamos ponernos en contacto ya que mi compañia posee este producto cual quier infomacion que deseen el numero es 8099194145..republica dominicana.
Recomendar
Responder

29 de octubre de 2006
el articulo aporta mucho para gente como nosotros que estamos en una constante batalla contra microorganismos, en lo personal realizado pruebas con este peroxido con exelentes resultados..
Recomendar
Responder

17 de octubre de 2006
La composición del producto Ox-Virin es la siguiente: 25 Peróxido de Hidrógeno y 5 de ácido peracético
Recomendar
Responder
17 de octubre de 2006
Pienso igual que todos ustedes, un articulo excelente, pero falta el nombre generico del producto, o como se consigue.
Gracias
Recomendar
Responder

14 de octubre de 2006
Saludos: Considero el articulo de mucha inportancia para nuestro negocio porcino.Me gustaria concer los posibles nombres comerciales del producto y si esta aprovado ,tanto como disponble en los Estados Unidos. En nuestro caso, Puerto Rico. Exito
Zabulon Mercado
San German-Puerto Rico
Recomendar
Responder

12 de octubre de 2006
Hola. Muy buen artículo, completa información, pero faltó algo muy necesario: el nombre genérico o el productor de esta droga.
MUCHAS GRACIAS.
EFRAIN
Recomendar
Responder

11 de octubre de 2006
El articulo es interesante`pero se deberia poner el principio activo del producto.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.







