Micotoxinas (Laboratorios Burnet)
Publicado: 1 de enero de 1900
Por: Dr. Leonardo J. De Luca (Laboratorios Burnet) - Cátedra Producción Láctea, Univ. Nac. de Lomas de Zamora (B.A.)
Micotoxinas
Indice
A) Introducción
El hombre conoce los hongos que crecen en los alimentos desde la antigüedad y los ha utilizado en su propio beneficio como alimento directo, para mejorar alimentos y especialmente con fines terapéuticos (antibióticos). Sin embargo, ciertas especies fúngicas son capaces de producir unos metabolitos secundarios con carácter tóxico llamadas micotoxinas. La segregación de estas sustancias se produce bajo ciertas condiciones ecológicas favorables.
Debido a la reciente crisis de encefalopatía espongiforme bovina, listeriosis, salmonelosis y de la presencia de pesticidas o de dioxinas en los alimentos los consumidores hoy son muy sensibles a la noción de riesgo alimentario. Sin embargo, mientras que el riesgo infeccioso o parasitario es bastante entendido por el consumidor, el riesgo asociado a la presencia natural de toxinas o de sus metabolitos en un alimento animal es bastante ignorado por parte de los consumidores.
En este contexto consideramos de vital importancia la realización de una revisión sobre el riesgo alimentario asociado a la presencia de las micotoxinas más importantes desde el punto de vista agrícola y ganadero en los alimentos para rumiantes, los métodos que se pueden utilizar en su prevención y control, así como las legislaciones existentes.
Las micotoxinas son moléculas relativamente pequeñas con una estructura química y una actividad biológica muy diversa. Aunque suelen ser genotípicamente específicas para un grupo de especies, el mismo compuesto puede también ser elaborado por hongos pertenecientes a géneros distintos.
La mayoría de las micotoxinas están producidas por especies de los géneros Aspergillus, Penicillium y Fusarium
La producción de estas micotoxinas se asocia normalmente a un pequeño número de especies, pero estudios recientes han demostrado que otras especies son también capaces de elaborarlas. Estos resultados permiten afirmar que la capacidad toxigénica de algunas cepas es más amplia de lo que inicialmente cabría esperar, por lo que no puede descartarse la posibilidad de que nuevas especies puedan ser una nueva fuente de micotoxinas en su hábitat natural.
Debido a la reciente crisis de encefalopatía espongiforme bovina, listeriosis, salmonelosis y de la presencia de pesticidas o de dioxinas en los alimentos los consumidores hoy son muy sensibles a la noción de riesgo alimentario. Sin embargo, mientras que el riesgo infeccioso o parasitario es bastante entendido por el consumidor, el riesgo asociado a la presencia natural de toxinas o de sus metabolitos en un alimento animal es bastante ignorado por parte de los consumidores.
En este contexto consideramos de vital importancia la realización de una revisión sobre el riesgo alimentario asociado a la presencia de las micotoxinas más importantes desde el punto de vista agrícola y ganadero en los alimentos para rumiantes, los métodos que se pueden utilizar en su prevención y control, así como las legislaciones existentes.
Las micotoxinas son moléculas relativamente pequeñas con una estructura química y una actividad biológica muy diversa. Aunque suelen ser genotípicamente específicas para un grupo de especies, el mismo compuesto puede también ser elaborado por hongos pertenecientes a géneros distintos.
La mayoría de las micotoxinas están producidas por especies de los géneros Aspergillus, Penicillium y Fusarium
La producción de estas micotoxinas se asocia normalmente a un pequeño número de especies, pero estudios recientes han demostrado que otras especies son también capaces de elaborarlas. Estos resultados permiten afirmar que la capacidad toxigénica de algunas cepas es más amplia de lo que inicialmente cabría esperar, por lo que no puede descartarse la posibilidad de que nuevas especies puedan ser una nueva fuente de micotoxinas en su hábitat natural.
Las micotoxinas son metabolitos secundarios fúngicos capaces de desencadenar diversas alteraciones y cuadros patológicos en el hombre y los animales.
Son moléculas relativamente pequeñas (Pm < 700) y suelen genotípicamente específicas para un grupo de especies de un mismo género. El mismo compuesto, no obstante, puede ser también elaborado por hongos pertenecientes a géneros distintos.
En general, cuanto más compleja es la ruta biosintética de una micotoxina, menor será el número de especies fúngicas capaces de elaborarla.
La mayoría de las micotoxinas descritas están producidas por especies de los géneros Aspergillus, Penicillium y Fusarium. Aunque el número de micotoxinas caracterizadas es muy grande, nos concentraremos en las aflatoxinas por su elevada toxicidad en el hombre y en los animales; en las ocratoxinas, las fumonisinas y los Tricotecenos.
B)- FACTORES QUE INFLUENCIAN LA CAPACIDAD TOXIGÉNICA Son moléculas relativamente pequeñas (Pm < 700) y suelen genotípicamente específicas para un grupo de especies de un mismo género. El mismo compuesto, no obstante, puede ser también elaborado por hongos pertenecientes a géneros distintos.
En general, cuanto más compleja es la ruta biosintética de una micotoxina, menor será el número de especies fúngicas capaces de elaborarla.
La mayoría de las micotoxinas descritas están producidas por especies de los géneros Aspergillus, Penicillium y Fusarium. Aunque el número de micotoxinas caracterizadas es muy grande, nos concentraremos en las aflatoxinas por su elevada toxicidad en el hombre y en los animales; en las ocratoxinas, las fumonisinas y los Tricotecenos.
El tipo y cantidad de sustancias producidas no solo depende de las características de la cepa individual, sino también de las condiciones medioambientales (nutrientes, parámetros físico-químicos, etc.) Las condiciones de crecimiento que permiten la toxigénesis son más limitadas que aquellas que posibilitan el crecimiento del hongo. Entre los factores que conducen a la presencia de micotoxinas en los alimentos, hay dos categorías principales:
Factores intrínsecos que dependen de la cepa fúngica.
Factores extrínsecos que dependen de las condiciones medioambientales.
Factores intrínsecos que dependen de la cepa fúngica.
Factores extrínsecos que dependen de las condiciones medioambientales.
1)-Factores intrínsecos
La producción de una determinada micotoxina no está asociada con una especie en particular sino con una cepa en concreto y en algunos casos incluso depende del substrato en que la cepa es aislada.
Los parámetros que afectan al nivel de residuos de micotoxinas en animales son:
1. - Especies y raza de los animales
2. - Concentración de micotoxina, cantidad y duración del consumo de alimento contaminado
3. - Estado de salud del animal
4. - Periodo que transcurre desde la retirada del alimento contaminado a la toma de muestras para el análisis de residuos
Estos residuos no solo implica que el animal se vea afectado por la contaminación de la micotoxina original, sino también por el riesgo que los humanos ingieran alimentos de origen animal como leche, huevos, carne extremadamente afectados.
2)- Factores extrínsecos
Los principales factores extrínsecos que influyen en la toxigénesis son:
Actividad agua (aw). La actividad agua influye considerablemente en la producción de toxinas, particularmente en los productos poco hidratados. La mayor parte de los hongos que contaminan los cereales, por ejemplo, necesitan valores superiores a 0,7%. La toxicogénesis tiene lugar únicamente para una aw ligeramente superior (por ejemplo + 0,02) que la aw límite para el crecimiento.
Descenso de la presión parcial de oxígeno. El descenso de la presión parcial de oxígeno y especialmente el incremento del nivel de CO2 conduce a una más marcada reducción de la toxicogénesis que del crecimiento fúngico.
Composición química del substrato y el pH. La toxicogénesis, al menos para la mayoría de las micotoxinas conocidas, es más dependiente de la composición química del substrato que el crecimiento fúngico.
La temperatura. La temperatura óptima para la toxicogénesis, se define la temperatura a la cual el ritmo de producción de toxinas es máximo. Esta temperatura es, la mayoría de las veces, ligeramente más baja que la óptima para el crecimiento del hongo. Además el rango de la temperatura que permite una toxicogénesis significativa, es más estrecho que la que permite el crecimiento del hongo.
Zonas de microflora. Son pequeñas zonas del alimento con alto contenido en humedad.
Integridad física del grano o del alimento (insectos, roedores y pájaros)
Las micotoxinas que afectan negativamente a la salud del hombre y de los animales se encuentran principalmente en los granos de cereales y forrajes recolectados. Estas toxinas son producidas por hongos saprofíticos durante el almacenaje, o por hongos endofíticos durante el crecimiento de la planta
Hongo Toxina Aspergillus Aflatoxina
Sterigmatocistina
Ocratoxina AFusarium Tricotecenos (DON, Nivalenol, Toxina T2, DAS)
Zearalenonas
Fumonisinas
Fusaria
MoniliforminaPenicillium Patulina
Citrina
Ocratoxina AClavicep Alcaloides
Desde el año 1960, cuando una enfermedad hasta el momento desconocida, afecta matando a 100.000 animales en Inglaterra, numerosos trabajos de investigación se realizaron sobre un grupo de moléculas de propiedad altamente tóxica, LAS AFLATOXINAS.
En el hombre, en 1963, J. Reye anuncia en Australia un caso de afección infantil caracterizada por fiebre, convulsiones y problemas de reflejos. La autopsia mostró una hipertrofia del hígado y una degeneración lipídica. Aunque esta toxina tiene especial predilección por el hígado, otros órganos pueden ser alterados como riñón y estómago.
En el hombre, en 1963, J. Reye anuncia en Australia un caso de afección infantil caracterizada por fiebre, convulsiones y problemas de reflejos. La autopsia mostró una hipertrofia del hígado y una degeneración lipídica. Aunque esta toxina tiene especial predilección por el hígado, otros órganos pueden ser alterados como riñón y estómago.
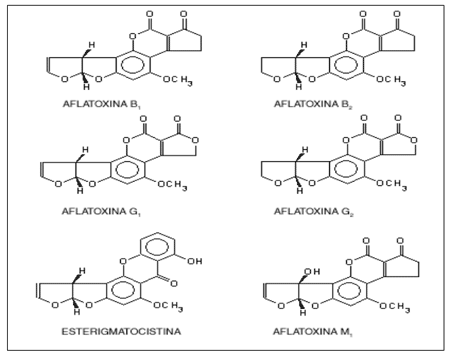
LAS AFLATOXINAS al igual que otras micotoxinas, son metabolitos secundarios generalmente tóxicos producidos por algunas especies fúngicas.
Las aflatoxinas son producidas esencialmente por algunas estirpes de Aspergillus flavus, las más tóxicas son la AFLATOXINA M1 (AFM1) (derivado metabólico de la AFLATOXINA B1 que se forma dentro del organismo animal), la AFLATOXINA B1 (AFB1) y la AFLATOXINA G1 (AFG1).
Las aflatoxinas se pueden encontrar en cereales y sus subproductos, tortas de oleaginosas, mandioca, ensilados, forrajes, frutos secos, especias, leche y derivados y otros alimentos para humanos. Ellas son cancerigenas, teratogénicas y mutagénicas, hepatotóxicas e inmunosupresivas.
Los principales órganos afectados son: hígado, riñón y cerebro.
Las aflatoxinas son producidas esencialmente por algunas estirpes de Aspergillus flavus, las más tóxicas son la AFLATOXINA M1 (AFM1) (derivado metabólico de la AFLATOXINA B1 que se forma dentro del organismo animal), la AFLATOXINA B1 (AFB1) y la AFLATOXINA G1 (AFG1).
Las aflatoxinas se pueden encontrar en cereales y sus subproductos, tortas de oleaginosas, mandioca, ensilados, forrajes, frutos secos, especias, leche y derivados y otros alimentos para humanos. Ellas son cancerigenas, teratogénicas y mutagénicas, hepatotóxicas e inmunosupresivas.
Los principales órganos afectados son: hígado, riñón y cerebro.
Las Aflatoxinas químicamente son un grupo de metabolitos heterocíclicos estrechamente relacionados entre sí, se consideran difuranocumarinas y se clasifican en dos grupos de acuerdo a su estructura química;
serie difurocoumarocyclopentenone (AFB1, AFB2, AFB2A, AFM1, AFM2, AFM2A y aflatoxicol)
serie difurocoumarolactone (AFG1, AFG2, AFG2A, AFGM1, AFGM2, AFGM2A AFB3).
La AFB1, es absorbida vía tracto gastrointestinal dentro del sistema portal sanguíneo y es llevada para el hígado donde se metaboliza.
Una porción de aflatoxina es activada y fijada en el tejido hepático
serie difurocoumarolactone (AFG1, AFG2, AFG2A, AFGM1, AFGM2, AFGM2A AFB3).
La AFB1, es absorbida vía tracto gastrointestinal dentro del sistema portal sanguíneo y es llevada para el hígado donde se metaboliza.
Una porción de aflatoxina es activada y fijada en el tejido hepático
Algunos metabolitos conjugados de la AFB1 solubles en agua, son excretados dentro de la bilis y van a las heces. La Glucurono y Sulfoconjugación se producen específicamente en los microsomas de hígado (Retículo Endoplásmico Liso)
Estas sustancias altamente hidrofílicas son capaces de oxidar sustancias lipofílicas, formando compuestos denominados “epoxis” los cuales pueden reaccionar con los grupos nucleofílicos de ADN y de algunas proteínas.
Estas reacciones necesitan del Oxígeno y del NAPDH (reducido), un átomo de oxígeno se fija sobre el sustrato y el otro es reducido en Agua ( el NADP se oxida).
Estas sustancias altamente hidrofílicas son capaces de oxidar sustancias lipofílicas, formando compuestos denominados “epoxis” los cuales pueden reaccionar con los grupos nucleofílicos de ADN y de algunas proteínas.
Estas reacciones necesitan del Oxígeno y del NAPDH (reducido), un átomo de oxígeno se fija sobre el sustrato y el otro es reducido en Agua ( el NADP se oxida).
Otras formas conjugadas solubles en agua, productos de degradación de la AFB1 y metabolitos no conjugados de ésta, son excretadas en el sistema circulatorio sanguíneo y se distribuyen sistémicamente.
Eventualmente esos residuos mencionados van a la leche, huevos, músculo y tejidos comestibles. La AFM1 es uno de esos derivados metabólicos que van a la leche contaminándola.
Eventualmente esos residuos mencionados van a la leche, huevos, músculo y tejidos comestibles. La AFM1 es uno de esos derivados metabólicos que van a la leche contaminándola.
De la AFB1 se forman otros metabolitos, entre ellos, el aflatoxicol (18 veces menos tóxico que AFB1) y la aflatoxina B2a (no tóxica).
Para otras micotoxinas como ocratoxina A, zearalenona, vomitoxina o deoxinivalenol y toxina T-2 ocurre lo mismo y se forman derivados tales como ocratoxina alfa (no toxica), alfa y beta zearalenol (tóxicos), DOM-1 (toxico) y toxina HT-2 (toxica), respectivamente.
El organismo animal produce generalmente esos productos metabólicos como un sistema de autodetoxificación, la reacción que tiene lugar a partir de la micotoxina original no tiene forzosamente que ser completa ni irreversible
La aflatoxina M1 (AFM1) es el derivado 4-hidroxi de la AFB1 y es excretada en la leche de las hembras de mamíferos que consumen AFB1 en la dieta
En vacas lecheras, el paso de AFB1 a la leche en forma de AFM1 está relacionado de manera lineal con la producción de leche
La aflatoxina M1 (AFM1) es el derivado 4-hidroxi de la AFB1 y es excretada en la leche de las hembras de mamíferos que consumen AFB1 en la dieta
En vacas lecheras, el paso de AFB1 a la leche en forma de AFM1 está relacionado de manera lineal con la producción de leche
En vacas lecheras la relación entre la concentración de AFB1 en la ración y la de AFM1 excretada en la leche oscila entre 34:1 a 1600:1 como consecuencia de los parámetros antes mencionados.
Así pues en vacas lecheras Holstein consumiendo raciones con 80, 86, 470, 557, 1493 y 1089 microgramos AFB1/Kg. (ppb) (sobre sustancia seca) se encontraron concentraciones de AFM1 en leche del orden de, 1,5; 0,245; 13,7; 4,7; 12,4 y 20,2 microgramos / litro (ppb), respectivamente.
Así pues en vacas lecheras Holstein consumiendo raciones con 80, 86, 470, 557, 1493 y 1089 microgramos AFB1/Kg. (ppb) (sobre sustancia seca) se encontraron concentraciones de AFM1 en leche del orden de, 1,5; 0,245; 13,7; 4,7; 12,4 y 20,2 microgramos / litro (ppb), respectivamente.
En vacas Jersey la contaminación en la ración fue 540 ppb de AFB1 y en la leche fue de 0,92 ppb de AFM1
En otras vacas hemos hallado valores de contaminación del maíz de 45 a 64 ppb de AFB1, dando residuos en leche entre 0,34 a 0,66 ppb de AFM1 ( Suárez 2004)
En otras vacas hemos hallado valores de contaminación del maíz de 45 a 64 ppb de AFB1, dando residuos en leche entre 0,34 a 0,66 ppb de AFM1 ( Suárez 2004)
Con una ingesta de AFB1 correspondiente a 2-60 mg / vaca /día, los residuos de AFM1 en leche podrían oscilar entre 1 a 50 ppb
Esto representarían raciones finales contaminadas con 57 a 1714 ppb de AFB1 para consumos de 35 Kg de ración /vaca / día.
La vaca puede ya transformar AFB1 en AFM1 entre las 12 a 24 horas de la ingestión del alimento contaminado
Esto representarían raciones finales contaminadas con 57 a 1714 ppb de AFB1 para consumos de 35 Kg de ración /vaca / día.
La vaca puede ya transformar AFB1 en AFM1 entre las 12 a 24 horas de la ingestión del alimento contaminado
El nivel de residuos de AFM1/día (mg) en leche es aproximadamente el 2,2% de la ingesta diaria de AFB1 (mg), con un CV ( Coeficiente de variación) entre 42 y 59%.
Dividiendo el resultado obtenido por el numero de litros de leche producidos /vaca/ día y multiplicando por 1000 nos daría la concentración de AFM1 (ppb) en la leche.
Esta relación estaría comprendida entre 0 y 4% con una media del 1%, incluso se propone la siguiente ecuación: y = -2,55 + 0,84x (r2 = 0,73; n = 43), donde x = mg AFB1/vaca / día; y = microgramos AFM1/litro de leche (calculando una media de 20 litros de leche /vaca /día).
Definitivamente de acuerdo con esta relación, la producción de leche con un contenido de AFM1 de 400 ng /litro, requeriría un consumo diario de AFB1 de aproximadamente 335 µg. Dividiendo el resultado obtenido por el numero de litros de leche producidos /vaca/ día y multiplicando por 1000 nos daría la concentración de AFM1 (ppb) en la leche.
Esta relación estaría comprendida entre 0 y 4% con una media del 1%, incluso se propone la siguiente ecuación: y = -2,55 + 0,84x (r2 = 0,73; n = 43), donde x = mg AFB1/vaca / día; y = microgramos AFM1/litro de leche (calculando una media de 20 litros de leche /vaca /día).
Si la vaca consume 10 kg. de alimento concentrado al día, el nivel de contaminación del alimento debe estar alrededor de los 33.5 µg / kg, (33,5 ppb).
Estas cifras indican que los alimentos para ganadería de leche no deben contener más de 30 ppb (30 µg /kg) de aflatoxina B1. La mayoría de países del mundo han fijado un nivel máximo permisible de 20 ppb de aflatoxina B1 en alimentos para vacas lecheras.
Estas cifras indican que los alimentos para ganadería de leche no deben contener más de 30 ppb (30 µg /kg) de aflatoxina B1. La mayoría de países del mundo han fijado un nivel máximo permisible de 20 ppb de aflatoxina B1 en alimentos para vacas lecheras.
Parece ser que existen discordancias entre autores probablemente debidas entre otras cosas al sistema metabólico de un poligástrico lo que provoca que las concentraciones de AFM1 en leche varían de un animal a otro y de una producción de leche a la siguiente.
La toxicidad de las Aflatoxinas está sujeta a varios factores:
Concentración de toxina en el alimento, biodisponibilidad, y tipo de Aflatoxina
Sinergismo con otras micotoxina.
Cantidad de alimento consumido, continuidad o intermitencia en la ingestión
Peso de la vaca, edad y estado corporal.
Concentración de toxina en el alimento, biodisponibilidad, y tipo de Aflatoxina
Sinergismo con otras micotoxina.
Cantidad de alimento consumido, continuidad o intermitencia en la ingestión
Peso de la vaca, edad y estado corporal.
Cuando el rodeo de expone a elevadas concentraciones de AFB1 ( alimentos con mas de 500ppb), se presentan en pocos días signos agudos de intoxicación. El órgano blanco de acción fundamentalmente es el hígado donde se produce una infiltración grasa y necrosis considerable, con muerte celular y pérdidas de funciones esenciales.
Se produce una grave inhibición de la síntesis proteica y glucídica ( neoglucogénesis casi anulada).
Las funciones de detoxificación ( Glucuronoconjugación) están inhibidas por lo tanto se eleva extremadamente la Bilirrubina Indirecta.
La sintomatología más evidente de la intoxicación se encuentra relacionada a un síndrome hepato-renal, con Hiperamoniemia, Hipocalcemia-Hipomagnesémica, edemas en extremidades posteriores, vacas caídas en tetania, dolor abdominal, parálisis ruminal, diarreas oscuras a veces con melenas, decúbito esternal y muerte.Cuando la exposición al alimento contaminado es baja pero de larga duración ( 25 a 80 ppb por mas de 25 días) se presenta la toxicidad crónica.Los signos incluyen, disminución de la producción de leche, y del estado corporal, pelo hirsuto y con zonas de depilación fundamentalmente en la zona superior a las pezuñas, edema coronario podal, pododermatitis, verrugas y callos interdigitales.Hemorragia subcutánea, anemia hemolítica e ictericia son signos característicos de la intoxicación crónica.
Infertilidad por alteración del ciclo sexual, hiperestrenismo, quistes ováricos y anovulación, muerte embrionaria, abortos durante el primer tercio de la gestación.La infertilidad está relacionada a la hepatopatía necrótica lipidótica ( hígado graso) la cual conduce a una disminución de la actividad de la Estrinasa microsomal cuya función es la de convertir el 17 Beta Estradiol a Estriol y Estrona, metabolitos poco activos que se eliminan por bilis y orina. Este es el motivo por el cual el estado hiperestrinémico genera infertilidad colectiva.La inmunosupresión es otro de los signos severos de la intoxicación crónica. La AFB1 reacciona específicamente con la T –Cell ( Linfocitos T), destruyéndolos, además producen atrofia tímica y disminución de la capacidad fagocítica de los Macrófagos.Esta característica expone a los animales a diversas infecciones bacterianas ( mastitis, retención placentaria – endometritis) vírales ( IBR, DVB), y protozoáricas (neosporosis)En los terneros la ingesta de 25 ppb durante 15 días conduce a una disminución importante de peso, atrasa el desarrollo corporal, aumenta la proteólisis muscular, los terneros presentan una anemia hemolítica grave con síndrome ictérico, necrosis hepática y muscular ( miositis degenerativa), diarreas, deshidratación con edema en miembros posteriores y bajo vientre, infecciones secundarias, caída y muerte.Es bien conocido que la AFB1 es tanto carcinogénica como citotóxica. El metabolito AFB1 activado en hígado como AFB1-8,9-epóxido se une de forma covalente con el nitrógeno de la posición 7 de la guanina, y forma aductos de AFB1 —N7-guanina en las células diana.Los resultados son transversiones de guanina a tiamina, reparación de las lesiones en el ADN, mutaciones y posteriormente formación de tumorCon respecto a los efectos citotóxicos la AFB1 induce la peroxidación lipídica lo cual conduce a un daño oxidativo en los hepatocitosEsto se demuestra por el aumento de la concentración de Malondialdeido y la disminución extrema del Glutatión intracelular.
Las Aflatoxinas aumentan la formación de Especies Oxígeno Reactivas ( Radicales libres), causando el daño oxidativo, contribuyendo al efecto mutagénico y carcinogénico de estas Micotoxinas.Es evidente que las AFB1 y AFG1 tiene actividad sobre los sistemas enzimáticos que intervienen en la síntesis de los radicales libres, y sobre los antioxidantes enzimáticos ( Glutatión Peroxidasa, Superóxido Dismutasa), y no enzimáticos, ( Vitamina E. Ascorbato, Glutationa)Solo las Dioxinas exceden en potencia carcinogénica a las Aflatoxinas. Estas moléculas son 1000 veces mas potentes como inductoras de tumores que los Benzo – Pirenos usando la DL 50.
Un estudio más reciente, ha demostrado que la AFB1 puede inhibir la actividad de la fosfodiesterasa nucleótido cíclica en el cerebro, hígado, corazón y tejidos renales.Es fundamental tener en cuenta que la intoxicación subaguda o crónica debida a AFB1 ( Aflatoxicosis) en vacas de leche y animales en engorde se caracteriza por presentar un síndrome hepatotóxico tipo distrófico con infiltración grasa ( lipidosis) y colangiopatía tipo obliterante.
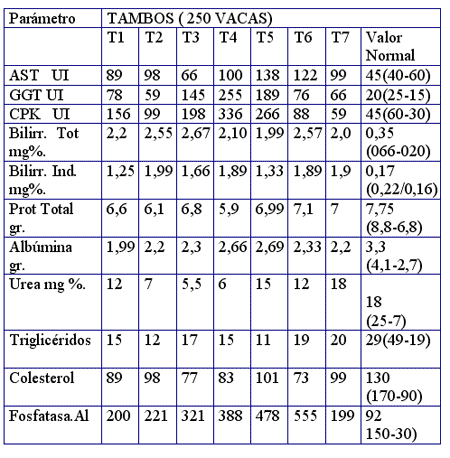
Este síndrome generalmente se encuentra precedido por una Anemia de tipo hemolítica con un estado de hiperbilirrubinemia indirecta la cual agravará la Colangiopatía.El perfil metabólico realizado en 250 vacas lecheras durante el período 3/2/04 al 3/4/04 a los cuales se les diagnosticó Aflotoxicosis arrojó los siguientes resultados promedios.
De Luca L, J.. Prieto, S., 2004.En estos perfiles metabólicos podemos observar lo siguiente.
La GGT se encuentra en valores gravemente elevados en el 100% de las vacas analizadas. Esta enzima es de tipo “crónico” por lo tanto la patología original data de mucho tiempo.
La GOT se mantiene relativamente elevada. Esta enzima tiene una vida media larga, por lo tanto, a nivel hepático se demuestra una alteración de tipo crónico, mientras que a nivel muscular el estado es agudo.
La elevación muy importante y grave de la bilirrubina total en forma indirecta nos está indicando fase de reagudizaciones de las Hepatopatías. La forma indirecta nos indica un fallo en la conjugación hepática (Glucuronoconjugación) una metodología mas para confirmar el daño hepático
La Bilirrubinemia indirecta, extremadamente grave y elevada en todas las vacas se debe a una hemólisis grave generando una importante anemia hemolítica. La elevación de esta fracción del pigmento biliar está ligada tanto a una elevada fragilidad eritrocítica por deficiencia de Selenio - Vit E ( peroxidaciones de membrana), ORIGINADA POR UNA ESTADO DE INTOXICACIÓN DE TIPO MICOTOXINAS LO CUAL EN LA MAYORIA DE LOS CASOS ESTA DEMOSTRADA POR LA INGESTA DE MAIZ, SORGO Y SEMILLA DE ALGODÓN CONTAMINADA CON AFLOTOXINA B1,( 48 A 144 ppb)
Elevación muy grave del sistema enzimático muscular Creatinin Fosfoquinasa en todas las categorías de vacas analizadas.
El sistema enzimático CPK está relacionado a la energía de larga duración a nivel muscular ya que la Creatinina Fosfato es un donante de fósforo para producir ATP, fuente energética necesaria para formar el Complejo contráctil Actomiosina-ATP-Ca++, siendo la enzima CPK la que escinde la molécula en ATP y Creatinina.
Es importante definir que el estado de hepatopatía de las vacas en producción es un hecho real y con seguridad el origen de esta alteración data de CIERTO mucho tiempo, por lo tanto podemos confirmar que las vacas se encuentran en estado de Lipidosis hepática con tendencia a la distrofia degenerativa.
ESTE ESTADO DE ORIGEN MICOTOXICO ES DEBIDO A LA INGESTA DE AFLOTOXINA B1 COMO ESTA INTOXICACIÓN ES ACUMULATIVA Y EL DEPÓSITO SE REALIZA EN EL LUGAR DE SU DETOXIFICACIÓN( HIGADO) ES LÓGICO SUPONER QUE LA AGRESIÓN DE LAS TOXINAS DESENCADENA LA ENFERMEDAD EN EL HEPATOCITOEl hallazgo de 48 A 144 ppb de micotoxinas, consumida por un período superior a los 20 días, lesiona gravemente el parénquima hepático de las vacas más lecheras, o más débiles.
La acción de las toxinas B1 y B2 produce no solo lesiones parenquimatosas a nivel celular, ya que también induce neoplasmas intracelulares sobre todo el hígadoLa B1 produce una disminución de la motilidad ruminal, disminución grave en el aprovechamiento de la celulosa y disminución sustancial de la producción de Acidos Grasos Volátiles y amoníaco, tanto in vitro como in vivo.La intoxicación crónica en las vacas lecheras con menos de 20 ppb de B1, (más de 15 días consumiendo maíz o soja, o ración contaminada con B1) se traduce en una importante alteración de los parámetros reproductivos: fundamentalmente produce muertes embrionarias muy tempranas y ovulares tardías, por fallas en el reconocimiento útero maternal, (déficit de secreción de proteínas endometriales específicas), fallas a nivel del embrión en producir la proteína bTP1 (antiluteolítica), y déficit en la secreción de progesterona por baja concentración de glucosa plasmática (Hipoprogesteronemia).La acción de la B1 sobre el sistema inmune es muy importante, por lo tanto la presencia de toxinas en sangre a niveles muy bajos altera severamente la protección de las vacunas (bajo efecto inmunitario), así como también, produce un acortamiento en el período de incubación de las enfermedades infecciosas, mayor predisposición a lesiones masivas de IBR, por Stress nutricional e inmunodepresión.Los límites de tolerancia para la presencia de toxina B1 en maíz para vacas lecheras son de 15 ppb, y esto depende de la cantidad de días que los animales hayan consumido el alimento contaminado, haciendo que con solo 15 ppb de B1 y 8 ppb de B2 durante 20 días, ocurran lesiones a veces irreversibles.ES IMPORTANTE SABER QUE UNA VEZ QUE SE HAN PRODUCIDO LAS TOXINAS, ESTAS NO DESAPARECEN EN EL PROCESADO DE LOS ALIMENTOS, SALVO QUE SEAN SOMETIDOS A TERMOPROCESADO, ESTE SISTEMA MODIFICA QUIMICAMENTE LA TOXINA POR EL VAPOR A PRESION, CON LO CUAL EL CONSUMO SE TORNA MENOS PELIGROSO.
Las ocratoxinas son metabolitos de los géneros Aspergillus Penicillium y Fusarium. Químicamente se trata de derivados del 3-4-dihidrometillisocumarin unido con un enlace amido a un grupo amino de la l-b -fenilalanina .
Estos compuestos se sabe que tienen toxicidad aguda en ratas y ratones, efectos nefrotóxicos (daño renal) en pollos y efectos carcinogénicos en humanos La ocratoxina A (OTA) es el compuesto más tóxico de este grupo. Fue primeramente aislado del A. Ochraceus y fue más tarde encontrado como un metabolito secundario de las especies del género Penicillium en climas templados.
Las estructuras químicas de la Ocratoxina A y de otras micotoxinas producidas por el género Penicillum se detallan en la siguiente figura.
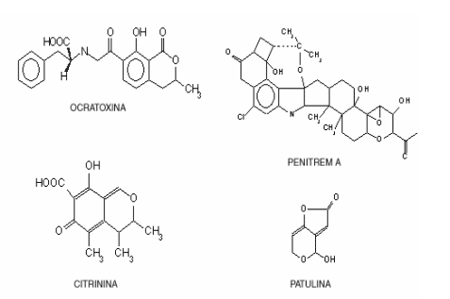
Los penicilios crecen sobre los alimentos preparados o sus materias primas, ya sean de origen vegetal o animal. Sus micotoxinas consumidas regularmente, aún en cantidades mínimas, causan lesiones irreversibles en riñón, hígado, cerebro y tienen actividad teratogénica producen una gran variedad de micotoxinas, siendo algunas de ellas: ácido ciclopiazónico, ácido penicílico, citreoviridina, citrinina, Ocratoxina A, Patulina, penitrem A, rubratoxina A, rubratoxina B, toxina PR, veruculógeno y roquefortina.
El modo de acción de las ocratoxinas y de otras micotoxinas derivadas del Penicillium son las siguientes:
Inhibición competitiva de las enzimas mitocondriales como la ATPasa.
Formación de radicales hidroxilo y peróxido en los lípidos.
Inhibición de la síntesis proteica porque frena de forma competitiva a la fenilalanil-ARNt Sintetasa.
Estimular la apoptosis celular
Inducción de la síntesis de ADN no programada
Ocratoxina A: Producida por P. verrucosum, se encuentra sobre cereales, embutidos y quesos. Produce degeneración grasa del hígado y necrosis del tejido renal en aves de corral. Se acumula en tejido graso de animales y de ésta forma pasa al ser humano.
Citrinina: Es un metabolito de P. citrinum. Incorporada en la dieta de animales puede causarles la muerte por degeneración renal.
Patulina: Producida por el P. griseofulvum, común en cereales y nueces, P. expansum, frecuente en manzanas y P. roquefortii es ubicuo. Es una micotoxina hepatotóxica, nefrotóxica y mutagénica.

Los penicilios crecen sobre los alimentos preparados o sus materias primas, ya sean de origen vegetal o animal. Sus micotoxinas consumidas regularmente, aún en cantidades mínimas, causan lesiones irreversibles en riñón, hígado, cerebro y tienen actividad teratogénica producen una gran variedad de micotoxinas, siendo algunas de ellas: ácido ciclopiazónico, ácido penicílico, citreoviridina, citrinina, Ocratoxina A, Patulina, penitrem A, rubratoxina A, rubratoxina B, toxina PR, veruculógeno y roquefortina.
El modo de acción de las ocratoxinas y de otras micotoxinas derivadas del Penicillium son las siguientes:
Inhibición competitiva de las enzimas mitocondriales como la ATPasa.
Formación de radicales hidroxilo y peróxido en los lípidos.
Inhibición de la síntesis proteica porque frena de forma competitiva a la fenilalanil-ARNt Sintetasa.
Estimular la apoptosis celular
Inducción de la síntesis de ADN no programada
Ocratoxina A: Producida por P. verrucosum, se encuentra sobre cereales, embutidos y quesos. Produce degeneración grasa del hígado y necrosis del tejido renal en aves de corral. Se acumula en tejido graso de animales y de ésta forma pasa al ser humano.
Citrinina: Es un metabolito de P. citrinum. Incorporada en la dieta de animales puede causarles la muerte por degeneración renal.
Patulina: Producida por el P. griseofulvum, común en cereales y nueces, P. expansum, frecuente en manzanas y P. roquefortii es ubicuo. Es una micotoxina hepatotóxica, nefrotóxica y mutagénica.
Los tricotecenos son compuestos que tienen anillos sesquiterpenos caracterizados por un núcleo de 12-13-epoxy-9-tricoteceno. Ellos tienen diferentes constituyentes en las posiciones 3,4,7,8 y 15 de la molécula. Los tricotecenos son producidos principalmente por varías especies del género Fusarium tales como; F. Sporotrichioides, F. graminearum, F. poae y F. culmorum) y pude ser producida por miembros de otros géneros tales como Myrothecium y Trichothecium.
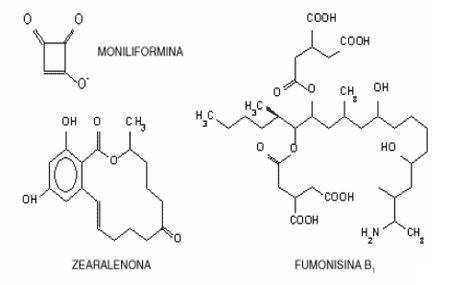
Los tricotecenos incluyen a la toxina T-2, el diacetoxiscirpenol (DAS), el deosinivalenol (DON o vomitotoxina) y el nivalenol. Tanto la toxina T-2 como el DAS son los más tóxicos y son solubles en solventes no polares (por ejemplo, el acetil acetato y el dietil éter) mientras que el DON y el nivalenol son solubles en solventes polares tales como alcoholes

Los tricotecenos incluyen a la toxina T-2, el diacetoxiscirpenol (DAS), el deosinivalenol (DON o vomitotoxina) y el nivalenol. Tanto la toxina T-2 como el DAS son los más tóxicos y son solubles en solventes no polares (por ejemplo, el acetil acetato y el dietil éter) mientras que el DON y el nivalenol son solubles en solventes polares tales como alcoholes
Fusarium es un género de moho que forma parte de la flora de campo (sustratos fitopatógenos, plantas vivas) y de la flora intermedia (sustratos de cereales recién recogidos y aun húmedos). Este moho vegeta entre 6 y 40º C con un optimo entre 18 y 30ºC.
Es aerobio y necesita en general, de una actividad de agua, aw superior a 0,88 para crecer y proliferar y superior a 0,91 para producir micotoxinas. En lo que se refiere a la temperatura hay casos como el Fusarium roseum que necesita de un mínimo de 15ºC para desarrollarse con un optimo entre 24 y 27ºC y que en cambio, una de las micotoxinas que puede producir como es el caso de zearalenona, solo la producirá a temperaturas entre 10-12º C.
No obstante hay variedades de Fusarium roseum como es el caso de Fusarium roseum "gibbosum" y Fusarium roseum "semitectum" que son capaces de producir en un sustrato de sorgo a 25º cantidades de zearalenona equivalentes a las producidas a una temperatura de 10º C
No obstante hay variedades de Fusarium roseum como es el caso de Fusarium roseum "gibbosum" y Fusarium roseum "semitectum" que son capaces de producir en un sustrato de sorgo a 25º cantidades de zearalenona equivalentes a las producidas a una temperatura de 10º C
Fusarium es uno de los grupos de mohos con más capacidad genética para producir micotoxinas cuando se tienen las condiciones físicas, químicas y biológicas adecuadas
Fusarium contamina el cereal en el campo y posteriormente cuando este cereal es sometido a procesos de secado y otros manejos, el moho puede morir y no obstante la micotoxina permanecer en el sustrato.
Así pues, no es de extrañar que en los análisis micológicos y de micotoxinas que se realicen posteriormente al cereal almacenado, se encuentre la micotoxina y no el Fusarium.
Fusarium contamina el cereal en el campo y posteriormente cuando este cereal es sometido a procesos de secado y otros manejos, el moho puede morir y no obstante la micotoxina permanecer en el sustrato.
Así pues, no es de extrañar que en los análisis micológicos y de micotoxinas que se realicen posteriormente al cereal almacenado, se encuentre la micotoxina y no el Fusarium.
Por otro lado también no es extraño que se encuentre Fusarium en ese cereal almacenado, o bien porque el tratamiento del cereal fue insuficiente para matar totalmente a ese moho o bien como consecuencia de recontaminaciones posteriores debidas por ejemplo, a vectores trasportadores como insectos
Las micotoxinas de Fusarium se puede clasificar en;
Tricotecenos estrogénicos, o micoestrógenos donde los más importantes son la Zearalenona (ZEN), y el Zearalenol ambos son lactonas del ácido resorcílico
Tricotecenos estrogénicos, o micoestrógenos donde los más importantes son la Zearalenona (ZEN), y el Zearalenol ambos son lactonas del ácido resorcílico
Tricotecenos no estrogénicos incluyendo a: vomitoxina o deoxinivalenol (DON), fumonisina B1 (FB1), toxina T-2, diacetoxiscirpenol (DAS), monoacetoxiscirpenol (MAS), triacetoxiscirpenol (TAS) y escirpentriol (STO).
1)-Zearalenona (F-2)
La zearalenona es un compuesto fitoestrogénico conocido como ácido 6-(10-hidroxi-6-oxo-trans-1-undecenil)-b -resorcilico m -lactona.
Es un metabolito primario asociado con varias especies del género Fusarium tales como; F. culmorum, F. graminearum y F. sporotrichioides), siendo la F. graminearum la especie responsable en mayor medida de los efectos estrogénicos comúnmente encontrados en los animales de granja. Los metabolitos alcohólicos del ZEN tales como; alfa -zearalenol y beta -zearalenol) también tienen características estrogénicas
La zearalenona (ZEN) es producida esencialmente por Fusarium roseum, F.tricinctum, F.roseum "Culmorum", F.roseum "Equiseti", F.roseum "Gibbosum", F.roseum "Graminearum", F.oxysporum y F.moniliformeEl F. roseum es el que produce zearalenona en mayor concentración (3000-15000 ppm) mientras que el F. moniliforme, sintetiza pequeñas cantidades (1-19 ppm)
Existen unos 16 derivados de la zearalenona de los cuales el más importante es la zearalenona y después el zearalenol.
La zearalenona puede encontrase como contaminante natural en maíz y subproductos, cebada, trigo, avena, sorgo, semilla de sésamo, heno y ensilados
El principal síndrome de la zearalenona es el estrogénico.A pesar e no tener ninguna similitud con los estrógenos esteroides poseen una poderosa actividad estrogénica debido a poseer grupos hidroxilos los cuales son apropiados para orientar su actividad sobre los receptores específicos celulares.
Vacas lecherasA nivel de observaciones de campo parece ser que en vacas lecheras, contaminaciones con zearalenona en la ración final superiores a 250 ppb pueden ya provocar problemas estrogénicos, abortos, disminución del consumo de alimento compuesto y de la producción lechera, vaginitis, secreciones vaginales, deficiencias en la reproducción y un aumento del tamaño de las glándulas mamarias en novillas vírgenes.
En ocasiones se observan casos de prolapso vaginal, e hipertrofia general en el tracto genitalConsumiendo maíz contaminado con 500 ppb de ZEA se presentan signos de hiperestrinemia grave : vacas con celos irregulares, folículos quísticos estrogénicos, celos largos y anovulatorios, vacas preñadas con celos y como dijimos anteriormente abortos en preñeces de 3 a 4,5 meses,Cuando la intoxicación es crónica con un consumo acumulativo de 150ppb durante 30 días se presentan casos de anestros profundos de tipo folicular acompañado de endometritis crónica con hipertrofia del músculo uterino, a veces de muy difícil tratamientoLa Zearalenona a dosis de 800ppb es embriopática produciendo problemas a nivel del esqueleto fetal.La ZEA y sus análogos son capaces de inhibir la esimulación mitogénica proliferativa linfocítica e inducen a una atrofia tímica y a una activación macrofágica.
Los animales expuestos a una dieta con 200 ppb de ZEA por dos semanas se encuentra mas expuesto a enfermedades virales ( IBR-DVB), a listeria y a clostridiales
Los tricotecenos reciben este nombre por poseer en su molécula el esqueleto tetracíclico, 12,13-epoxitricotec-9-eno.
Las toxinas tricotecenas pueden encontrarse como contaminantes naturales en los cereales ( maíz y subproductos, cebada, sorgo, avena, trigo y subproductos, arroz, centeno y mijo).
Las toxinas tricotecenas pueden encontrarse como contaminantes naturales en los cereales ( maíz y subproductos, cebada, sorgo, avena, trigo y subproductos, arroz, centeno y mijo).
El principal síndrome que provocan es el gastroentérico, los sistemas y órganos afectados son, el sistema digestivo, nervioso, circulatorio y la piel. Es característico de la vomitoxina el provocar vómitos y rechazo del alimento, fundamentalmente en monogástricos
Para más detalles, podemos citar las características toxicológicas generales de estas micotoxinas (a depender de la especie animal), a saber
Vómitos en carnívoros taquicardia, diarreas
Hemorragias, edemas, necrosis de los tejidos cutáneos.
Hemorragias de la mucosa epitelial del estómago e intestino.
Destrucción de tejidos hematopoyéticos.
Disminución de los glóbulos blancos y plaquetas circulantes
Meninges hemorrágicas (cerebro).
Alteración del sistema nervioso.
Rechazo del alimento.
Lesiones necróticas en diferentes partes de la boca
Degeneración patológica de las células de la médula ósea, nódulos linfáticos, e intestino.
Para más detalles, podemos citar las características toxicológicas generales de estas micotoxinas (a depender de la especie animal), a saber
Vómitos en carnívoros taquicardia, diarreas
Hemorragias, edemas, necrosis de los tejidos cutáneos.
Hemorragias de la mucosa epitelial del estómago e intestino.
Destrucción de tejidos hematopoyéticos.
Disminución de los glóbulos blancos y plaquetas circulantes
Meninges hemorrágicas (cerebro).
Alteración del sistema nervioso.
Rechazo del alimento.
Lesiones necróticas en diferentes partes de la boca
Degeneración patológica de las células de la médula ósea, nódulos linfáticos, e intestino.
Las micotoxinas tricotecenas tienen una potente actividad inmunosupresiva
Las micotoxinas tricotecenas no estrogénicas se dividen en dos grupos: macro cíclicas y no-macro cíclicas. La toxicología de las micotoxinas macrocíclicas ( roridins, verrucarins, satratoxins y otras) en los animales, esta poco estudiada. Por el contrario, la toxicología de las micotoxinas no-macrocíclicas esta mucho más estudiada.
Las micotoxinas tricotecenas no-macrocíclicas se dividen en dos grupos, A y B.
Las micotoxinas del grupo A son más toxicas para las aves que las del grupo B. Algunas de las micotoxinas del grupo A son: toxina T-2, diacetoxiscirpenol (DAS), monoacetoxiscrpenol (MOS), triacetoxiscirpenol (TAS), escirpentriol (STO) y HT-2 toxina.
Las micotoxinas del grupo A son más toxicas para las aves que las del grupo B. Algunas de las micotoxinas del grupo A son: toxina T-2, diacetoxiscirpenol (DAS), monoacetoxiscrpenol (MOS), triacetoxiscirpenol (TAS), escirpentriol (STO) y HT-2 toxina.
Algunas del grupo B son: fusarenona-X, vomitoxina o deoxinivalenol (DON) y nivalenol (NIV).
Fundamentalmente y a nivel celular, el principal efecto toxico de las micotoxinas tricotecenas no estrogénicas consiste en la inhibición de la síntesis proteica seguida de una interrupción secundaria de la síntesis del DNA y RNA.
Se produce también una división en las células que forman parte de la membrana del tracto gastrointestinal, piel y células linfoides y eritrociticas.
Fundamentalmente y a nivel celular, el principal efecto toxico de las micotoxinas tricotecenas no estrogénicas consiste en la inhibición de la síntesis proteica seguida de una interrupción secundaria de la síntesis del DNA y RNA.
Se produce también una división en las células que forman parte de la membrana del tracto gastrointestinal, piel y células linfoides y eritrociticas.
La acción tóxica de las micotoxinas tricotecenas consiste en una necrosis extensiva de la mucosa de la piel y de la boca cuando hay contacto con la micotoxina. Se producen problemas agudos a nivel del tracto gastrointestinal, degeneración de la medula ósea y una inhibición muy significativa del sistema inmunitario.
Se dan casos de hemorragias de la mucosa epitelial del estómago e intestino con una destrucción de los tejidos hematopoyeticos.
Se dan casos de hemorragias de la mucosa epitelial del estómago e intestino con una destrucción de los tejidos hematopoyeticos.
En las aves, las típicas lesiones orales consisten en una proliferación de placas amarillas caseosas (sustancia albuminoidea) que tienen lugar en la parte superior e inferior del pico, mucosa del paladar, boca y lengua. Las erosiones bucales son patentes. Evidentemente que la gravedad de las lesiones se incrementa con el tiempo de exposición a la micotoxina.
En las aves de postura produce lesiones orales y una disminución de la ingesta, disminución en la producción de huevos y deficiencias en la calidad de la cáscara con un significativo cantidad de huevos blandos
En las aves de postura produce lesiones orales y una disminución de la ingesta, disminución en la producción de huevos y deficiencias en la calidad de la cáscara con un significativo cantidad de huevos blandos
Estas micotoxinas son producidas esencialmente por Fusarium tricinctum, F.nivale, F.roseum, F.graminearum, F.solani, F.oxysporum, F.lateritium, F.sporotrichioides, F.rigidiusculum, F.episphaeria y F.poae
Otros mohos también pueden producir toxinas tricotecenas, a saber, Cephalosporium crotocigenum, Myrotecium verrucaria, Stachybotrys atra, Calonectria nivalis, Trichoderma viride, Tricotecium roseum y Gibberella saubinetti.
Las fumonisinas son producidas esencialmente por Fusarium moniliforme. Existen 6 tipos de fumonisinas, la B1, B2, B3, B4, A1 y A2 (16-18). Sin embargo, las que suelen encontrase con más frecuencia y las más importantes son la fumonisina B1 (FB1) y la B2La FB1 y FB2 pueden encontrase como contaminantes naturales, en los cereales (preferencialmente en el maíz y subproductos del maíz)Los principales síndromes que producen son: neurotóxicos (leucoencefalomelacia), nefrotóxicos, edema pulmonar y cerebral, hepatotóxicos y lesiones cardiacas. Los órganos afectados son: el cerebro, pulmón, hígado, riñón y corazón
Estas micotoxinas inhiben la síntesis de los esfingolipidos.El modo de acción a sido postulado a través de la inhibición de la enzima Ceramida Sintetasa la cual cataliza la acilación de la Esfinganina para formar Dihidroceramida, y de esta manera altera la neobiosíntesis de los EsfingolípidosVACAS LECHERAS
Vacas Jersey en el periodo medio de la lactación que ingirieron durante 14 días una ración final contaminada con 750 ppb de fumonisinas (FB1 + FB2 + FB3) de forma que proporcionan una ingesta de 3 mg de fumonisinas /Kg de peso vivo /día. Presentaron problemas de ligera diarrea al inicio del consumo del alimento contaminado, aumento del colesterol sérico, y alteración en el perfil de las Lipoproteínas. Se observa una elevación de las LDL ( Lipoproteínas de Baja Densidad) alterando de esta manera la síntesis esteroide a nivel ovárico
2)-VOMITOXINA o DEOXINIVALENOL (DON)Es uno de los tricotecenos de gran importancia ya que tiene una gran incidencia sobre cereales tales como maíz, cebada, avena
A nivel celular el efecto tóxico más importante es la inhibición de la síntesis proteica ya que tiene una gran afinidad de unión a nivel ribosomal.
Es importante su acción sobre la neuroqímica ( neurotransmisores ) y sobre el sistema serotoninérgico, provocando una disminución del consumo voluntario y pérdida de peso cuando la concentración en alimento es superior a 20 ppb durante 30 días.VACAS LECHERASConcentraciones elevadas de DON en el alimento compuesto, del orden de 15 a 30 ppm, suministradas durante 10 semanas, provocaron una disminución significativa de la producción lechera y de la grasa en leche.La presencia de DON en concentraciones superiores a 0,3 ppm en la ración, puede provocar una reducción del consumo del alimento, baja en la producción lechera, un aumento significativo en el recuento de células somáticas y una también significativa reducción de la eficiencia reproductiva. Parece ser que la baja en la producción lechera por causa de esta micotoxina puede ser del orden de 12,5 litros /vaca/ día cuando los niveles de contaminación resultan ser de 50 ppb o más en la ración.
3) Toxina T-2Es uno de las tricotecenos del Fusarium más tóxico, aunque menos común es su presencia en los cereales.Vacas LecherasUna ración final contaminada de una forma natural con 18 ppb de toxina T-2 provoco muertes en vacas lecheras que estuvieron a consumir el alimento contaminado durante varios meses, sin embargo los autores indican que podía ser posible que los niveles de contaminación fueran más elevados
En vacas lecheras, la presencia de toxina T-2 puede ir relacionada con el rechazo del alimento, baja en la producción lechera, gastroenteritis, hemorragias intestinales y muerte. La toxina T-2 esta asociada con una marcada reducción de la respuesta inmunitaria en terneros, y en las vacas recién paridas.
Es común encontrar cuaogulopatías, leucopenia, diarreas, depresión y finalmente ataxia y muerte
Datos estadísticos de observaciones de campo aconsejan que el máximo de contaminación tolerable con toxina T-2 no debe exceder 10 ppb en la dieta total
4 )-DIACETOXISCIRPENOL (DAS)
Se han encontrado lesiones intestinales hemorrágicas, disminución del consumo y alteración importante en el crecimiento en terneros que habían consumido raciones contaminadas con 20 ppb durante dos meses. Cuando los alimentos contenían 200 ppb se pudo comprobar lesiones mas profundas a nivel intestinal, agravadas por una intensa inmunodepresión complicando el cuadro una infección sobreaguda a Salmonela y Escherichia Coli.
Los absorbentes de micotoxinas tienen la capacidad de unir e inmovilizar a las toxinas a nivel del tracto gastrointestinal disminuyendo la biodisponibilidad de las mismas.
Los aluminosilicatos son efectivos para la intoxicación con Aflatoxinas pero inefectivos para Zearelonona, DON, DAS y T2.
La dosis de aluminosilicatos es de 500 gramos por Tonelada en profilaxis y 1 Kg por Tonelada cuando se debe actuar en intoxicación ya presente y aguda
Los aluminosilicatos son efectivos para la intoxicación con Aflatoxinas pero inefectivos para Zearelonona, DON, DAS y T2.
La dosis de aluminosilicatos es de 500 gramos por Tonelada en profilaxis y 1 Kg por Tonelada cuando se debe actuar en intoxicación ya presente y aguda
Se realizó una evaluación de la eficiencia de adsorción in vitro de la aflatoxina B1, toxina T-2, ocratoxina a, deoxinivalenol, fumonisina B1 y Zearalenona, con productos formulados a base de glucanmananos de la pared celular de una cepa de saccharomyces cerevisiae.
La dosis utilizada de Glucanmananos es de 1 Kg/ Tonelada de alimento.
Las respuestas a los tratamientos de los alimentos contaminados con las toxinas antes citadas son las siguientes
(%) de Adsorción:
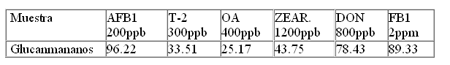
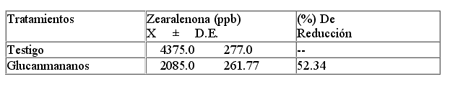
La capacidad inhibitoria de los Glucanmananos sobre la Zearalenona se verifica en la siguiente tabla.
I) Referencias
Las respuestas a los tratamientos de los alimentos contaminados con las toxinas antes citadas son las siguientes
(%) de Adsorción:

La capacidad inhibitoria de los Glucanmananos sobre la Zearalenona se verifica en la siguiente tabla.

I) Referencias
Beardall J.M., and Miller J.D. 1994. Diseases in humans with mycotoxins as possible causes. In: Miller J.D. and Trenholm H.L. (Eds.), Mycotoxins in grain. Compounds other than aflatoxins. Eagan Press, Pt. Paul (MN) USA, pp.487-539.
Bennett G.A., and Richard J.L. 1996. Influence of processing on Fusarium mycotoxins in contaminated grains. Food Technology, 50, 235-238.
Caramelli M., Dondo A., Cantini Cortellazzi G., Visconti A., Minervini F., Doko M.B., Guarda F. 1993. Leucoencefalomalacia nell’equino da fumonisine: prima segnalazione in Italia. Ippologia, 4, 49-56. *CAST (Council for Agricultural Science and Technology). 1989. Mycotoxins - Economic and health risks. Task Force report no. 116. CAST, Ames, Iowa, USA. 92 p.
Charmley L.L., Trenholm H.L., Prelusky D.B., and Rosenberg A. 1995. Economic losses and decontamination. Natural Toxins, 3, 199-203.
Chulze S.N., Ramirez M.L., Farnochi M.C., Pascale M., Visconti A., March G. 1996a. Fusarium and fumonisin ocurrence in Argentinian maize at different ear maturity stages. Journal of Agricultural and Food Chemistry, 44, 2797-2801.
Dahleen L.S. Barley Fusarium head blight research. 1997. ARS Fusarium Workshop, Richard Russell Research Center, Athens, Georgia, USA, September 16-17, pp. 19-20.
De Luca L. J, Prieto S., 2004. Valores metabólicos en vacas intoxicadas con Micotoxinas del Aspergillus. Micotoxicosis a B1. Comunicación personal a colegas. www@engormix.com
De Luca L, J, Prieto, S. 2004. Ocurrencia de Intoxicación con Zearalenona y Fumonisina en vacas de alta producción lechera. Síndromes de hepatopatías y Hiperestrinémicos. Trabajo a publicar en www@engormix.com
de Nijs M. 1998. Public health aspects of Fusarium mycotoxins in food in The Netherlands - A risk assessment. PhD thesis, Landbouwuniversiteit Wageningen, The Netherlands, 140 p.
Doko M.B., and Visconti A. 1994. Occurrence of fumonisins B1 and B2 in corn and corn-based human foodstuffs in Italy. Food Additives and Contaminants, 11, 433-439.
Eriksen G.S., and Alexander J., Eds. 1998. Fusarium toxins in cereals - a risk assessment. Copenhagen, Nordic Council of Ministers., 146 p.
FAO. 1997. Worldwide regulation for mycotoxins 1995. A compendium. FAO Food and Nutrition paper n. 64. FAO, Rome, Italy. 46 p.
Feuerstein G., Powell J.A., Knower A.T., and Hunter K.W. 1988. Monoclonal antibodies to T-2 toxin. In vitro neutralization of protein synthesis inhibition and protection of rats against lethal toxemia. Journal of Clinical Investigation, 76, 2134-2138.
Forsell J.H., and Pestka J.J. 1985. Relation of 8-ketotrichothecene and zearalenone analogue struture to inhibition of mitogen-induced human lymphocyte blastogenesis. Applied and Environmental Microbiology. 50, 1304-1309.
GIMENO, A. (2000). “Los hongos y las Micotoxinas en la Alimentacion Animal; Conceptos; Problemas, Control y Recomendaciones”. En internet: www.engormix.com (area en castellano. Ir a: Micotoxinas) (Consultado en 1-05-04).
GIMENO, A.; MARTINS, M.L. (2000). “ Residuos de micotoxinas en leche, huevos y tejidos comestibles de aves, cerdos y rumiantes (parte I)”, Albéitar, 36: 40-42.
GIMENO, A.; MARTINS, M.L. (2000a). “ Residuos de micotoxinas en leche, huevos y tejidos comestibles de aves, cerdos y rumiantes (parte II)”, Albéitar, 37: 44-46.
GIMENO, A; MARTINS, M.L. (2001). “Metodos de Analisis de Micotoxinas en Alimentos Compuestos y Materias Primas”. En internet: www.engormix.com (area en castellano. Ir a: Micotoxinas) (Consultado en 1-05-04).
GIMENO, A.; MARTINS, M.L. (2002). “Micotoxicosis en Ganado Lechero”. Primer Encuentro Técnico Sobre la Nutrición y Control de la Micotoxicosis en el Ganado Lechero. Abril de 2002. Miami, Florida, USA. pp. 1-19 (Libro del Symposium).
GIMENO, A.; MARTINS, M.L. (2002a). “ La Aflatoxina M1 y otras Micotoxinas: Control y Recomendaciones. Albéitar, 53: 52-54.
GIMENO, A.; MARTINS, M.L. (2003). “Micotoxinas y Micotoxicosis en Animales y Humanos”. Special Nutrients, Inc. USA (Ed.). Talleres graficos del SRL, Buenos Aires (Argentina). pp. 1-160.
Bennett G.A., and Richard J.L. 1996. Influence of processing on Fusarium mycotoxins in contaminated grains. Food Technology, 50, 235-238.
Caramelli M., Dondo A., Cantini Cortellazzi G., Visconti A., Minervini F., Doko M.B., Guarda F. 1993. Leucoencefalomalacia nell’equino da fumonisine: prima segnalazione in Italia. Ippologia, 4, 49-56. *CAST (Council for Agricultural Science and Technology). 1989. Mycotoxins - Economic and health risks. Task Force report no. 116. CAST, Ames, Iowa, USA. 92 p.
Charmley L.L., Trenholm H.L., Prelusky D.B., and Rosenberg A. 1995. Economic losses and decontamination. Natural Toxins, 3, 199-203.
Chulze S.N., Ramirez M.L., Farnochi M.C., Pascale M., Visconti A., March G. 1996a. Fusarium and fumonisin ocurrence in Argentinian maize at different ear maturity stages. Journal of Agricultural and Food Chemistry, 44, 2797-2801.
Dahleen L.S. Barley Fusarium head blight research. 1997. ARS Fusarium Workshop, Richard Russell Research Center, Athens, Georgia, USA, September 16-17, pp. 19-20.
De Luca L. J, Prieto S., 2004. Valores metabólicos en vacas intoxicadas con Micotoxinas del Aspergillus. Micotoxicosis a B1. Comunicación personal a colegas. www@engormix.com
De Luca L, J, Prieto, S. 2004. Ocurrencia de Intoxicación con Zearalenona y Fumonisina en vacas de alta producción lechera. Síndromes de hepatopatías y Hiperestrinémicos. Trabajo a publicar en www@engormix.com
de Nijs M. 1998. Public health aspects of Fusarium mycotoxins in food in The Netherlands - A risk assessment. PhD thesis, Landbouwuniversiteit Wageningen, The Netherlands, 140 p.
Doko M.B., and Visconti A. 1994. Occurrence of fumonisins B1 and B2 in corn and corn-based human foodstuffs in Italy. Food Additives and Contaminants, 11, 433-439.
Eriksen G.S., and Alexander J., Eds. 1998. Fusarium toxins in cereals - a risk assessment. Copenhagen, Nordic Council of Ministers., 146 p.
FAO. 1997. Worldwide regulation for mycotoxins 1995. A compendium. FAO Food and Nutrition paper n. 64. FAO, Rome, Italy. 46 p.
Feuerstein G., Powell J.A., Knower A.T., and Hunter K.W. 1988. Monoclonal antibodies to T-2 toxin. In vitro neutralization of protein synthesis inhibition and protection of rats against lethal toxemia. Journal of Clinical Investigation, 76, 2134-2138.
Forsell J.H., and Pestka J.J. 1985. Relation of 8-ketotrichothecene and zearalenone analogue struture to inhibition of mitogen-induced human lymphocyte blastogenesis. Applied and Environmental Microbiology. 50, 1304-1309.
GIMENO, A. (2000). “Los hongos y las Micotoxinas en la Alimentacion Animal; Conceptos; Problemas, Control y Recomendaciones”. En internet: www.engormix.com (area en castellano. Ir a: Micotoxinas) (Consultado en 1-05-04).
GIMENO, A.; MARTINS, M.L. (2000). “ Residuos de micotoxinas en leche, huevos y tejidos comestibles de aves, cerdos y rumiantes (parte I)”, Albéitar, 36: 40-42.
GIMENO, A.; MARTINS, M.L. (2000a). “ Residuos de micotoxinas en leche, huevos y tejidos comestibles de aves, cerdos y rumiantes (parte II)”, Albéitar, 37: 44-46.
GIMENO, A; MARTINS, M.L. (2001). “Metodos de Analisis de Micotoxinas en Alimentos Compuestos y Materias Primas”. En internet: www.engormix.com (area en castellano. Ir a: Micotoxinas) (Consultado en 1-05-04).
GIMENO, A.; MARTINS, M.L. (2002). “Micotoxicosis en Ganado Lechero”. Primer Encuentro Técnico Sobre la Nutrición y Control de la Micotoxicosis en el Ganado Lechero. Abril de 2002. Miami, Florida, USA. pp. 1-19 (Libro del Symposium).
GIMENO, A.; MARTINS, M.L. (2002a). “ La Aflatoxina M1 y otras Micotoxinas: Control y Recomendaciones. Albéitar, 53: 52-54.
GIMENO, A.; MARTINS, M.L. (2003). “Micotoxinas y Micotoxicosis en Animales y Humanos”. Special Nutrients, Inc. USA (Ed.). Talleres graficos del SRL, Buenos Aires (Argentina). pp. 1-160.
Galvano F., Pietri A., Bertuzzi A., Bognanno T., Chies M., De Angelis L., and Galvano M. 1997. Activated carbons: in vitro affinity for fumonisin B1 and relation of adsorption ability to physicochemical parameters. Journal of Food Protection, 60, 985-991.
Hoosshmand H., and Klopfebstein C.F. 1995. Effects of gamma irradiation on mycotoxins disappearance and amino acid contents of corn, wheat and soybeans with different moisture contents. Plant Foods Human Nutrition, 47, 227-238.
IARC. 1993. Monographs on the evaluation of carcinogenic risks to humans. Vol. 56. Some naturally occurring substance: food items and constituents, heterocyclic aromatic amines and mycotoxins. IARC, Lyon, France, 599 p.
Marasas W.F.O. 1995. Fumonisins: their implications for human and animal health. Natural Toxins, 3:193-198.
Marasas W.F.O. 1997. Risk assessment of fumonisins produced by Fusarium moniliforme in corn. Cereal Research Communications, 25, 399-406.
Merrill A.H. jr., Wang E., Vales T.R., Smith E.R., Schroeder J.J., Menaldino D.S., Alexander C., Crane H.M., Xia J., Liotta D.C., Meredith F.I., and Riley R.T. 1996. Fumonisin toxicity and sphingolipid biosynthesis. Advances in Experimental Medicine and Biology, 392, 297-306.
Minervini F., Gyongyosi-Horvath A., Lucivero G., Visconti A., Barna-Vetro I., and Solti L. 1994. In vitro neutralization of T-2 toxin toxicity by a monoclonal antibody. Natural Toxins, 2, 111-114.
Minervini F., Lucivero G., Visconti A., and Bottalico C. 1992. Immunomodulatory effects of fusarochromanones TDP-1 and TDP-2. Natural Toxins, 1, 15-18.
Nowicki T.W., Gaba D.G, Dexter J.E., Matsuo R.R., and Clear R.M. 1988. Retention of the Fusarium mycotoxin deoxynivalenol in wheat during processing and cooking of spaghetti and noodles. Journal of Cereal Science, 8, 189-202.
O’Neill K., Damoglou A., and Patterson M.F. 1993. The stability of deoxynivalenol and 3-acetyldeoxynivalenol to gamma irradiation. Food Additives and Contaminants, 10, 209-215.
Pascale M., Doko M.B., and Visconti A. 1995. Determinazione di fumonisine nella polenta mediante cromatografia HPLC. In: Dugo G, and Cotroneo A. (Eds) Atti 2° Congresso Nazionale di Chimica degli Alimenti. La Grafica Editoriale, Messina, Italy, pp. 1067-1071.
Pascale M., Visconti A., Pronczuk M., Wisiniewska H., and Chelkowski J. 1997. Accumulation of fumonisins in maize hybrids inoculated under field conditions with Fusarium moniliforme Sheldon. Journal of the Science of Food and Agriculture, 74, 1-6.
Pestka J. J., and Bondy G.S. 1994. Immunotoxic effects of mycotoxins. In: Miller J.D. and Trenholm H.L. (Eds.), Mycotoxins in grain. Compounds other than aflatoxins. Eagan Press, Pt. Paul (MN) USA, pp. 339-358.
Prelusky D.B., Rotter B.A., and Rotter R.G. 1994. Toxicology of mycotoxins. In: Miller J.D. and Trenholm H.L. (Eds.), Mycotoxins in grain. Compounds other than aflatoxins. Eagan Press, Pt. Paul (MN) USA, pp. 359-404.
Ramirez M.L., Pascale M., Chulze S.N., Reynoso M.M., March G., and Visconti A. 1996b. Natural occurrence of fumonisins and their correlation to Fusarium contamination in commercial corn hybrids grown in Argentina. Mycopathologia, 135, 29-34.
Ramos A.J., Fink-Gremmels J., and Hernandez E. 1996. Prevention of toxic effects of mycotoxins by means of non-nutritive adsorbent compounds. Journal of Food Protection, 59, 631-641.
Riley R.T., Wang E., and Merrill A.H. jr. 1994. Liquid determination of sphinganine and sphingosine: use of the sphinganine-to-sphingosine ratio as a biomarker for the consumption of fumonisins. Journal of Association of Analytical Chemists International, 77, 533-540.
Rotter B., Prelusky D.B., and Petska J.J. 1996, Toxicology of deoxynivalenol (vomitoxin). Journal of Toxicology and Environmental Health, 48, 1-34.
Solfrizzo M., Avantaggiato G., and Visconti A. 1997a. Rapid method to determine sphinganine/sphingosine ratio in human and animal urine as a biomarker for fumonisin exposure. Journal of Cromatography B, 692, 87-93.
Solfrizzo M., Avantaggiato G., and Visconti A. 1997b. In vivo validation of the sphinganine/sphingosine ratio as a biomarker to display fumonisin ingestion. Cereal Research Communications, 25, 437-442.
Solfrizzo M., Avantaggiato G., Carratù M.R., Galvano F., Pietri A., and Visconti A. 1998a. The use of biomarkers to assess the in vivo effect of activated carbon on fumonisins fed through diets contaminated with Fusarium moniliforme. Revue de Medicine Veterinaire, 149, 667.
Solfrizzo M., Torres A., Chulze S., and Visconti A. 1998b. Cholestyramine as a binding agent for detoxification of fumonisins: in vitro studies and determination of its effectiveness in rats. (manuscript in preparation)
Sydenham E.W., Stockenstrom S., Thiel P.G., Shephard G.S., Koch K.R., and Marasas W.F.O. 1994. Fumonisin-contaminated maize: physical treatment for the partial decontamination of bulk shipments. Food Additives and Contaminants, 11, 25-32.
Visconti A. 1996. Fumonisins in maize genotypes grown in various geographical areas. Advances in Experimental Medicine and Biology, 392, 193-204.
Visconti A., Minervini F., Lucivero G, and Gambatesa V. 1991. Cytotoxic and immunotoxic effects of Fusarium mycotoxins using a rapid colorimetric bioassay. Mycopathologia 113, 181-186.
Visconti A., Boenke A., Doko M.B., Solfrizzo M., and Pascale M. 1995. Occurrence of fumonisins in Europe and the BCR - Measurements and Testing Programme. Natural Toxins, 3, 269-274.
Visconti A. Solfrizzo M:, Doko M.B., Boenke A., and Pascale M. 1996. Stability of fumonisins at different storage periods and temperatures in gamma irradiated maize. Food Additives and Contaminants, 13, 929-938.
Visconti A., Avantaggiato G. and Solfrizzo M. 1998. Biomarker to display the ingestion of fumonisins through contaminated diet. - Analysis of sphinganine/sphingosine ratio in biological samples. In: Marengo G. and Pastoni F. (Eds.), Proceedings of Sixth International Symposium on Microbiology of Food and Cosmetics in Europe. pp. 260-280.
Hoosshmand H., and Klopfebstein C.F. 1995. Effects of gamma irradiation on mycotoxins disappearance and amino acid contents of corn, wheat and soybeans with different moisture contents. Plant Foods Human Nutrition, 47, 227-238.
IARC. 1993. Monographs on the evaluation of carcinogenic risks to humans. Vol. 56. Some naturally occurring substance: food items and constituents, heterocyclic aromatic amines and mycotoxins. IARC, Lyon, France, 599 p.
Marasas W.F.O. 1995. Fumonisins: their implications for human and animal health. Natural Toxins, 3:193-198.
Marasas W.F.O. 1997. Risk assessment of fumonisins produced by Fusarium moniliforme in corn. Cereal Research Communications, 25, 399-406.
Merrill A.H. jr., Wang E., Vales T.R., Smith E.R., Schroeder J.J., Menaldino D.S., Alexander C., Crane H.M., Xia J., Liotta D.C., Meredith F.I., and Riley R.T. 1996. Fumonisin toxicity and sphingolipid biosynthesis. Advances in Experimental Medicine and Biology, 392, 297-306.
Minervini F., Gyongyosi-Horvath A., Lucivero G., Visconti A., Barna-Vetro I., and Solti L. 1994. In vitro neutralization of T-2 toxin toxicity by a monoclonal antibody. Natural Toxins, 2, 111-114.
Minervini F., Lucivero G., Visconti A., and Bottalico C. 1992. Immunomodulatory effects of fusarochromanones TDP-1 and TDP-2. Natural Toxins, 1, 15-18.
Nowicki T.W., Gaba D.G, Dexter J.E., Matsuo R.R., and Clear R.M. 1988. Retention of the Fusarium mycotoxin deoxynivalenol in wheat during processing and cooking of spaghetti and noodles. Journal of Cereal Science, 8, 189-202.
O’Neill K., Damoglou A., and Patterson M.F. 1993. The stability of deoxynivalenol and 3-acetyldeoxynivalenol to gamma irradiation. Food Additives and Contaminants, 10, 209-215.
Pascale M., Doko M.B., and Visconti A. 1995. Determinazione di fumonisine nella polenta mediante cromatografia HPLC. In: Dugo G, and Cotroneo A. (Eds) Atti 2° Congresso Nazionale di Chimica degli Alimenti. La Grafica Editoriale, Messina, Italy, pp. 1067-1071.
Pascale M., Visconti A., Pronczuk M., Wisiniewska H., and Chelkowski J. 1997. Accumulation of fumonisins in maize hybrids inoculated under field conditions with Fusarium moniliforme Sheldon. Journal of the Science of Food and Agriculture, 74, 1-6.
Pestka J. J., and Bondy G.S. 1994. Immunotoxic effects of mycotoxins. In: Miller J.D. and Trenholm H.L. (Eds.), Mycotoxins in grain. Compounds other than aflatoxins. Eagan Press, Pt. Paul (MN) USA, pp. 339-358.
Prelusky D.B., Rotter B.A., and Rotter R.G. 1994. Toxicology of mycotoxins. In: Miller J.D. and Trenholm H.L. (Eds.), Mycotoxins in grain. Compounds other than aflatoxins. Eagan Press, Pt. Paul (MN) USA, pp. 359-404.
Ramirez M.L., Pascale M., Chulze S.N., Reynoso M.M., March G., and Visconti A. 1996b. Natural occurrence of fumonisins and their correlation to Fusarium contamination in commercial corn hybrids grown in Argentina. Mycopathologia, 135, 29-34.
Ramos A.J., Fink-Gremmels J., and Hernandez E. 1996. Prevention of toxic effects of mycotoxins by means of non-nutritive adsorbent compounds. Journal of Food Protection, 59, 631-641.
Riley R.T., Wang E., and Merrill A.H. jr. 1994. Liquid determination of sphinganine and sphingosine: use of the sphinganine-to-sphingosine ratio as a biomarker for the consumption of fumonisins. Journal of Association of Analytical Chemists International, 77, 533-540.
Rotter B., Prelusky D.B., and Petska J.J. 1996, Toxicology of deoxynivalenol (vomitoxin). Journal of Toxicology and Environmental Health, 48, 1-34.
Solfrizzo M., Avantaggiato G., and Visconti A. 1997a. Rapid method to determine sphinganine/sphingosine ratio in human and animal urine as a biomarker for fumonisin exposure. Journal of Cromatography B, 692, 87-93.
Solfrizzo M., Avantaggiato G., and Visconti A. 1997b. In vivo validation of the sphinganine/sphingosine ratio as a biomarker to display fumonisin ingestion. Cereal Research Communications, 25, 437-442.
Solfrizzo M., Avantaggiato G., Carratù M.R., Galvano F., Pietri A., and Visconti A. 1998a. The use of biomarkers to assess the in vivo effect of activated carbon on fumonisins fed through diets contaminated with Fusarium moniliforme. Revue de Medicine Veterinaire, 149, 667.
Solfrizzo M., Torres A., Chulze S., and Visconti A. 1998b. Cholestyramine as a binding agent for detoxification of fumonisins: in vitro studies and determination of its effectiveness in rats. (manuscript in preparation)
Sydenham E.W., Stockenstrom S., Thiel P.G., Shephard G.S., Koch K.R., and Marasas W.F.O. 1994. Fumonisin-contaminated maize: physical treatment for the partial decontamination of bulk shipments. Food Additives and Contaminants, 11, 25-32.
Visconti A. 1996. Fumonisins in maize genotypes grown in various geographical areas. Advances in Experimental Medicine and Biology, 392, 193-204.
Visconti A., Minervini F., Lucivero G, and Gambatesa V. 1991. Cytotoxic and immunotoxic effects of Fusarium mycotoxins using a rapid colorimetric bioassay. Mycopathologia 113, 181-186.
Visconti A., Boenke A., Doko M.B., Solfrizzo M., and Pascale M. 1995. Occurrence of fumonisins in Europe and the BCR - Measurements and Testing Programme. Natural Toxins, 3, 269-274.
Visconti A. Solfrizzo M:, Doko M.B., Boenke A., and Pascale M. 1996. Stability of fumonisins at different storage periods and temperatures in gamma irradiated maize. Food Additives and Contaminants, 13, 929-938.
Visconti A., Avantaggiato G. and Solfrizzo M. 1998. Biomarker to display the ingestion of fumonisins through contaminated diet. - Analysis of sphinganine/sphingosine ratio in biological samples. In: Marengo G. and Pastoni F. (Eds.), Proceedings of Sixth International Symposium on Microbiology of Food and Cosmetics in Europe. pp. 260-280.
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación21 de mayo de 2007
Un tema interesantísimo y que de una vez por todas debe abordarse con seriedad.
Sintomatologías como : Infertilidad general, causada por diversos problemas como Quistes ováricos, deficiencias en la ovulación, mortalidad embrionaria, abortos etc.
se nos hacen muy familiares atribuibles a factores infecciosos ( DVD, Lesptospirosis) Parasitarios ( Neosporosis). Nutricionales (Macro y microminerales, avitaminosis).
Problemas metabólicos ( Hígado graso): Digestivos (Desplazamiento de abomaso, hemorragias intestinales etc.).
También se ha culpado al aumento de la consaguinidad
El problema es que frente a ello, cada cual acarrea agua para su propio molino ofreciéndonos la panacea para solucionarlos ofreciéndonos todo tipo de vacunas y suplementos nutricionales, productos hormonales para programas reproductivos.
Ta vez el tema de las micotoxinas es el menos recurrido como causalidad y podría estar constituyendo una causa importante, no olvidemos que cada día mas se están urtilizando mayor cantidad de alimentos concentrados y subproductos, que siguen un largo camino desde su fuente de producción hasta el comedero del animal.
Además está el alcance que está cobrando la seguridad e inocuidad alimentaria que será cada vez más restrictivo al momento de comercializar entre los países.
Lamentablemente, la determinación de la presencia y nivel de micotoxinas en alimentos es difícil y costosa, por ello, es que debemos solicitar a las empresas involucradas en este tema, que operen con la máxima transparencia y objetividad al momento de fundamentar la real gravedad del problema, con datos e investigaciones reales, al mismo tiempo quel aseguran la bondad de sus productos para neutralizar sus efectos.
Rodrigo Middleton BN
Médico Veterinario, Asesor.
CHILE.

15 de febrero de 2009
AGRADESCO A LOS SEÑORES INGENIEROS DE SU REPRESENTACION CORRESPONDIENTE POR TODOS LOS MENSAJES Y CONTENIDOS QUE SON DE MUCHO VALOR PARA MICARRERA DIOS LES GUARDE Y MUCHAS BENDICIONES EN SU CARRERA Y HOGARES.

5 de mayo de 2008
El problema de l diagnóstico de mycotoxicosis, está ralentizado por la falta de kits para emplear sobre muestras biológicas (orina, sueros, riñón, hígado etc). Muchas veces durante el diagnóstico en anatomía patológica o en el análisis clínico (hematología, bioquímica etc) sospechamos mycotoxicosis u obtenemos datos compatibles, pero no lo podemos demostrar. A veces se trata de casos crónicos y el alimento consumido ya no existe, en otras ocasiones las muestras de alimentos no son obtenidas con homogeneidad, o la mycotoxicosis es el resultado del consumo de diferentes mycotoxinas que terminan por enfermar al animal. Repito es necesario contar con herramientas de diagnóstico para el estudio específico de las diferentes mycotoxinas en las muestras clínicas. ¿ Tenéis información de alguna casa que los comercialice?. Me refiero a sistemas de ELISA, inmunocromatografías o similar. Gracias. Dra. aleida Villa

5 de mayo de 2006
La legislación en México es muy flexible con la presencia de ocratoxina en café, los exportadores que venden café a USA o Europa, como les exigen ese tipo de análisis, están establecidos en sus legislaciones.
Es necesario realizar la cuantificación de ocratoxina en el café, sea tostado y soluble u otros alimentos derivados.
El trabajo está bien desarrollado. Felictaciones al autor.

17 de marzo de 2006
En principio, decir que está muy bien el trabajo desarrollado. Esto me da pie para realizar una explicación sobre la utilización de micotoxinas en las fermentaciones vínicas.
En un tomo de enología llamado:´´TEORIA Y PRÁCTICA EN ENOLOGÍA´´indica en un apartado donde explica sobre la proteína, o más bien, sobre la toxina conocida en enolología como ´´FACTOR KILLER´´, que todos sabemos que la segrega la levadura ´´SACCHAROMYCES CEREVISIAE´´ en las fermentaciones vínicas, y esta toxina lo que hace es eliminar todo microorganismo del medio para así sólo actuar ella misma en la fermentación. Pues bien, los autores indican en ese apartado que si la toxina es muy agresiva puede paralizar la fermentación, y una de las soluciones era introducir ´´MICOTOXINAS DE FUSARIUM´´ para eliminar ´´EL KILLER´´ en cuestión, y luego iniciar de nuevo la fermentación introduciendo levadura inoculada (es decir, inocular). Mi pregunta es: ¿SI LAS MICOTOXINAS SON TAN PELIGROSAS PARA EL SER HUMANO, CÓMO PODEMOS UTILIZAR ESTE TIPO DE MICOTOXINAS, SI EN REALIDAD HAY OTROS MÉTODOS MÁS SENCILLOS PARA REACTIVAR UNA FERMENTACIÓN VÍNICA?

10 de mayo de 2005
Por qué, si se sabe que los aluminosilicatos no son efectivos más que contra aflotoxinas las diferentes marcas insisten e incluso muestran estudios de absorciones para todas las micotoxinas con diferentes niveles de inmovilizacion de las toxinas o es que sólo se trata de pruebas invitro, porque de ser asi seria una manera muy cínica de comercio y en ningún momento de servicio.