Micotoxinas en porcinos
Toxicidad por la combinación de la aflatoxina B1 y la ocratoxina A en cerdos y el uso de un organoaluminosilicato comercial para disminuir sus efectos
Publicado: 19 de julio de 2011
Por: Jose Antonio Fierro Huesca, Pérez, F. Rubén, Duran, M. Leticia, Altamirano C. Mariana, Juan Carlos Medina Bravo (NUTEK SA de CV) y Moreno, S. Verónica y Rodríguez, G. Elizabeth (Investigación Aplicada SA. de CV), México
La ocratoxina A (OA), es una micotoxina con propiedades carcinogénicas, teratogénicas e inmunosupresoras, producida por varias especies de hongos del genero Aspergillus y Penicillium, los órganos blanco que afecta principalmente son el riñón (nefrotoxicidad) e hígado (hepatotoxicidad). Al igual que la OA, las aflatoxinas (AFs) tienen las mismas propiedades, pero su órgano blanco es el hígado, principalmente. Los cereales y sus derivados son los productos más susceptibles a la contaminación con OA y AFs. Además de otros productos de origen vegetal. Los efectos nefrotóxicos por OA en cerdos, son la mayor preocupación en varios países. Los cerdos afectados muestran signos de dolor en el área del riñón, aumento en el consumo de agua, disminución en el consumo de alimento. El daño en la función renal resulta en una glucosuria y proteinuria. Patológicamente, los riñones son bilateralmente afectados, aparecen alargados y pálidos, con gran cantidad de tejido conectivo sobre la capa externa, cuando se realiza un corte. Histopatológicamente se observa degeneración de los túbulos proximales y posteriormente se presenta atrofia del epitelio tubular, fibrosis intersticial en la corteza renal y algunas veces hialinización de los glomérulos (Hald 1991, Elling y Moller, 1973).
Por otra parte, la mayor concentración de OA, se encuentra en torrente sanguíneo, unida a la albúmina, por lo cual persiste por largos periodos de tiempo. La OA aparentemente previene la degeneración grasa del hígado, causada por las AFs, cuando las dos toxinas son administradas simultáneamente en pollos parrilleros (Huff el at. 1984). Algunos experimentos revisados en la literatura nos mencionan que 39 cerdos alimentados con niveles de OA de 200 a 4000 ppb, después de 4 meses, desarrollaron nefropatía (Krogh et al. 1974). 9 cerdos alimentados con 1 ppm de OA cristalina por tres meses, presentaron severos daños en la función tubular del riñón. El estudio continuo por dos años, en el cual el daño renal se agravó ligeramente sin alcanzar un estado de riñón terminal (Krogh & Elling, 1977; Elling, 1979, 1983).
Los efectos de las AFs en cerdos son: perdida de peso, pelo áspero, anorexia, ataxia (Trastorno caracterizado por la disminución de la capacidad de coordinar los movimientos), temblores, coma y muerte. (Coppeck et al 1989). Otros efectos: disminución en la conversión alimenticia, hepatitis, nefrosis y hemorragias sistémicas (Hoerr et al 1983, Miller et al. 1981, 1982). Los efectos de las Afs en cerdos, dependen de la edad, dieta, concentración y tiempo de exposición. Monegue et al, 1977, mencionan que cerdos alimentados con concentraciones superiores a 300 ppb, parecen ser resistentes, desde el destete hasta su venta a mercado.
Fierro et al, 2006, estudiaron el efecto de ambas micotoxinas en cerdos de 25 días de edad, a concentraciones de 1080 ppb de OTA y 520 ppb de AFB1 durante 33 días, en donde se observo rechazo de alimento, efecto sobre la ganancia de peso, conversión alimenticia, aumento sobre el peso relativo y grasa en hígado, además de afectar los parámetros bioquímicos (glucosa, creatinina, bilirrubina, GGT). De acuerdo a nuestra experiencia, ambas micotoxinas pueden encontrarse simultáneamente como contaminantes en materias primas y alimento terminado, por lo cual es de gran importancia buscar alternativas para disminuir sus afectos tóxicos.
Objetivo.
Evaluar la efectividad de un organoaluminosilicato comercial (OZ), para disminuir los efectos tóxicos de una dieta contaminada con 520 ppb (µg/kg) de OA y 440 ppb de AFB1, presentes en alimentos balanceados para cerdos.
Material y métodos.
16 cerdos machos, recién destetados y se colocaron en corrales individuales con piso porcino, bebederos de chupón, comederos para destete. La primera semana fue de adaptación.
Los alimentos utilizados fueron comerciales (Lactomax), se demostró la ausencia de contaminación con otras micotoxinas, tales como aflatoxinas, fumonisinas, ocratoxina A, vomitoxina y toxina T-2. Además se le realizo el análisis proximal, calcio, fósforo, carotenos, xantofilas, vitamina A, manganeso, zinc y cobre.
4 tratamientos: T1 y T2 con 2 cerdos cada uno y T3 y T4 con 6 cerdos cada uno:
- T1 control: sin adsorbente ni micotoxinas.
- T2 dieta de inocuidad: alimento control + 1.5 kg de adsorbente por tonelada de alimento.
- T3 dieta con micotoxinas: alimento control + aflatoxinas (ppb): B1: 432, G1: 110, B2: 30, G2: 15 + 520 ppb de OTA.
- T4 dieta de desafío: alimento control + aflatoxinas (ppb): B1: 452, G1: 115, B2: 32, G2: 15 + 513 ppb de OTA + 1.5 kg de adsorbente por tonelada de alimento.
El tiempo de experimentación fue de 21 días. La OTA y AFs, fueron obtenidas de cultivos efectuados en NUTEK. La concentración de ambas micotoxinas en los alimentos contaminados fue confirmada por medio de la cuantificación vía HPLC.
Los cerdos fueron pesados al inicio de la prueba (28 días de edad) y se registró el peso individual a los 7, 14 y 21 de experimentación. La conversión alimenticia se calculó de la misma manera.
No ocurrió la muerte de ninguno de los animales. Los cerdos fueron sacrificados el día 21 de experimentación. Se pesaron los órganos, se obtuvieron muestras para ensayos histopatológicos, se cuantificó la grasa, biometría hemática (sangre completa) y los parámetros bioquímicos (suero). La información obtenida fue analizada como un sistema factorial 2 x 2 para análisis de varianza utilizando el ensayo de Fischer (prueba de las mínimas diferencias significativas). El valor de significación se basó en 0.05 de probabilidad.
Resultados.
En cuanto a la ganancia de peso y conversión alimenticia, se presentaron diferencias estadísticamente significativas, a partir del día 14 hasta el día 21, entre los animales que consumieron las 4 dietas.
Ganancia de peso:
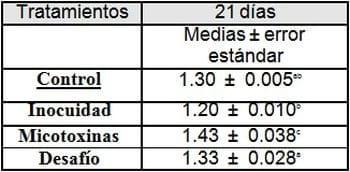

Medias con letras diferentes son estadísticamente significativas para (p < 0.05)
Medias con letras diferentes son estadísticamente significativas para (p < 0.0
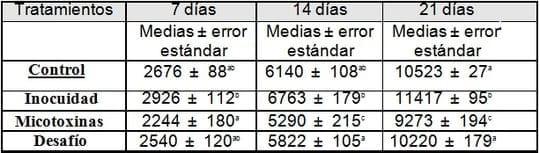
Conversión alimenticia:
| Tratamientos | Consumo de alimento durante el periodo de experimentación (kg) | 7 días | 14 días |
Medias con letras diferentes son estadísticamente significativas para (p < 0.05).
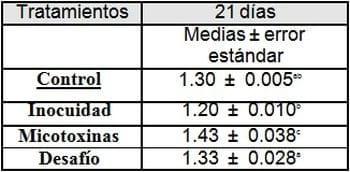
Medias con letras diferentes son estadísticamente significativas para (p < 0.05).
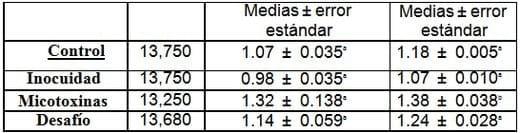
Otros parámetros analizados con diferencia estadísticamente significativa:

Medias con letras diferentes son estadísticamente significativas para (p < 0.05)
Medias con letras diferentes son estadísticamente significativas para (p < 0.05)
Parámetros bioquímicas, pesos de los órganos y biometría hemática, en donde solo se observaron diferencias numéricas:
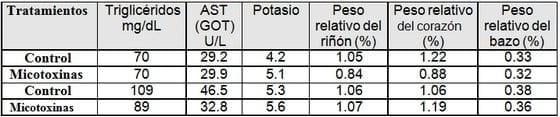
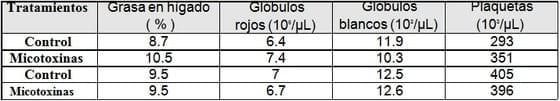
A la necropsia, los 16 cerdos presentaron las siguientes características:
Aparato respiratorio:
Traquea: sin cambios patológicos aparentes (16/16).
Pulmón: Se observa congestión de leve a moderada difusa (16/16).
Traquea: sin cambios patológicos aparentes (16/16).
Pulmón: Se observa congestión de leve a moderada difusa (16/16).
Aparato cardiovascular: Corazón: Sin cambio patológicos aparentes (16/16).
Aparato digestivo:
Hígado: de normales a ligeramente pálidos (16/16).
Estomago e intestino: Sin cambio patológicos aparentes (16/16).
Hígado: de normales a ligeramente pálidos (16/16).
Estomago e intestino: Sin cambio patológicos aparentes (16/16).
Sistema linfoide: Bazo, linfónodos: Sin cambio patológicos aparentes (16/16).
Aparato urinario: Riñón: se observan ligeramente pálidos (16/16).
Los análisis histopatológicos mostraron los siguientes efectos:
Grupo control:
Hígado: Se observan en el citoplasma, discretas vacuolas que corresponden a grasa, así como congestión moderada difusa. (esteatosis leve difusa).
Hígado: Se observan en el citoplasma, discretas vacuolas que corresponden a grasa, así como congestión moderada difusa. (esteatosis leve difusa).
Pulmón: Se observa en algunos septos alveolares, moderado engrosamiento y discretos focos de infiltrado, así como congestión moderada difusa (neumonía broncointersticial leve multifocal). Además de congestión moderada difusa de los capilares aéreos (congestión moderada difusa).
Riñón, bazo, corazón, intestino y linfonódo; sin cambios significativos.
Grupo inocuidad:
Hígado: Se observan en el citoplasma, discretas vacuolas que corresponden a grasa, así como congestión moderada difusa, además de focos de hematopoyesis extramedular (esteatosis leve difusa).
Hígado: Se observan en el citoplasma, discretas vacuolas que corresponden a grasa, así como congestión moderada difusa, además de focos de hematopoyesis extramedular (esteatosis leve difusa).
Pulmón: Se observa en algunos septos alveolares, moderado engrosamiento y discretos focos de infiltrado, así como congestión moderada difusa (neumonía broncointersticial leve multifocal). Además de congestión moderada difusa de los capilares aéreos (congestión moderada difusa).
Riñón, bazo, corazón, intestino y linfonódo; sin cambios significativos.
Grupo con micotoxinas:
Hígado: Se observan en el citoplasma abundantes vacuolas que corresponden a grasa, las cuales desplazan al núcleo hacia la periferia con distribución centrolobulillar, así como congestión moderada difusa y focos de hematopoyesis extramedular e hiperplasia leve multifocal de los conductos biliares (esteatosis grave centrolobulillar).
Hígado: Se observan en el citoplasma abundantes vacuolas que corresponden a grasa, las cuales desplazan al núcleo hacia la periferia con distribución centrolobulillar, así como congestión moderada difusa y focos de hematopoyesis extramedular e hiperplasia leve multifocal de los conductos biliares (esteatosis grave centrolobulillar).
Pulmón: Se observa en algunos septos alveolares, moderado engrosamiento y discretos focos de infiltrado, así como congestión moderada difusa (neumonía broncointersticial moderada multifocal).
Riñón: Se observa en los túbulos, degeneración y necrosis grave difusa de las células epiteliales, algunos núcleos presentan aumento de tamaño (cariomegalia). Se aprecia marcada dilatación de los tubúlos y descamación de algunas células epiteliales hacia el lumen (tubulonecrosis grave difusa). En el intersticio se aprecia discreta fibroplasia y focos de infiltrado mononuclear (linfocitos). (nefritis intersticial linfocitica moderada con focos de fibroplasia y atrofia glomerular moderada).
Bazo, corazón, pulmón, intestino y linfonódo; sin cambios significativos.
Grupo con adsorbente:
Hígado: Se observan en el citoplasma abundantes vacuolas que corresponden a grasa, las cuales desplazan el núcleo hacia la periferia con distribución centrolobulillar y coalescente, discreta hiperplasia de los conductos biliares, así como congestión moderada difusa y focos de hematopoyesis extramedular e discreta hiperplasia de los conductos biliares y focos de linfocitos (esteatosis grave centrolobulillar y coalescente).
Hígado: Se observan en el citoplasma abundantes vacuolas que corresponden a grasa, las cuales desplazan el núcleo hacia la periferia con distribución centrolobulillar y coalescente, discreta hiperplasia de los conductos biliares, así como congestión moderada difusa y focos de hematopoyesis extramedular e discreta hiperplasia de los conductos biliares y focos de linfocitos (esteatosis grave centrolobulillar y coalescente).
Pulmón: Se observa en algunos septos alveolares, moderado engrosamiento y discretos focos de infiltrado, así como congestión moderada difusa (neumonía broncointersticial leve multifocal).
Riñón: Se observa en los túbulos, degeneración y necrosis moderada multifocal de las células epiteliales, algunos núcleos presentan aumento de tamaño (cariomegalia). Se aprecia descamación de algunas células epiteliales hacia el lumen (tubulonecrosis moderada multifocal). Algunos glomérulos presentan atrofia leve y en su interior material hialino (glomeruloesclerosis moderada multifocal). Se observa moderado engrosamiento de la membrana (glomerulonefritis membranosa moderada multifocal).
Bazo, corazón, pulmón, intestino y linfonódo; sin cambios significativos.
Discusión. La OTA y las aflatoxinas a las concentraciones en que se experimentó, afectaron a los animales principalmente en su parámetros productivos, el uso del adsorbente mejoro estos parámetros con diferencias estadísticamente significativas, no así en algunos otros parámetros analizados. Además que microscópicamente no se observa ningún daño provocado por estas micotoxinas. Estos hallazgos son de gran relevancia, ya que el efecto toxico por la combinación de estas micotoxinas fue diferente en cada animal, tanto en la parte bioquímica como en la histopatológica. Esto puede ser resultado, debido a la interacción de otros factores (ambientales, biológicos) o bien debido a que se trabaja con cultivos de micotoxinas en los cuales pudiera existir algún otro metabolito toxico, o bien la afectación se debe a la combinación de ambos factores mencionados.
Conclusión. Los resultados obtenidos nos permiten comprobar la toxicidad de las micotoxinas, reflejado sobre los parámetros productivos, los cuales son la principal preocupación para los productores pecuarios, además de demostrar la efectividad del adsorbente ZEOTEK para disminuir los efectos tóxicos. Los resultados de histología no son tan contundentes como los parámetros productivos.
Bibliografía.
Coppeck, R. W., R. D. Reynolds, W. B. Buck, B. J. Jacobsen, S. C. Ross, and M. S. Mostrom.
1989. Acute aflatoxicosis in feeder pigs, resulting from improper storage of corn. J. Am Veter Med Assoc 195: 1380-1381.
Fierro, J. A. 1999. Cinética de la producción de micotoxinas por una cepa de Aspergillus flavus. XVI Congreso Latinoamericano de Avicultura. Lima, Perú.
Fierro, J. A.; Medina J.C.: 2006. Memorias curso de capacitación IASA-NUTEK. Ixtapa, Zihuatanejo.
Hald,B. 1991. Ochratoxin A in human blood in european countries. Pp. 159 - 164.
Helling, F. 1979. Ochratoxin A induced mycotoxic porcine nephropathy: Alterarions in enzyme activity in tubular cells: Acta Pathol. Microbiol. Scand., 87, 237-243.
Helling, F. 1979. Enzyme histochemical studies of ochratoxin A induced mycotoxic porcine nephropathy (abstract). In: 6th International Symposium Animal, Plant Microbial Toxins, Vol. 17.
Helling, F. 1983. Feeding experiments with ochratoxin A contaminated barley to bacon pigs. IV. Renal Lesions. Acta Agric. Scand., 33, 153-159.
Hoerr, F. J. and G. H. D''''''''''''''''Andrea. 1983. Biological effects of aflatoxin in swine. Pp. 51-55. In U.L.
Diener; R. L. Asquith, and J. W. Dickens (Eds.). Aflatoxin and Aspergillus flavus in corn. Southern Cooperative Series Bulletin 279. Auburn University, Auburn, Alabama.
Huff, W. E., J. A. Doerr, C. J. Wabeck, G. W. Chaloupka, J. D. May and J. W. Merkley. 1984. The individual and combined effects of aflatoxin and ochratoxin A on various processing parameters of broiler chickens. Poultry Sci. 63: 2153-2161.
Krogh, P. 1974. Mycotoxic porcine neprophathy: A possible model for Balkan endemic nephropathy. In: Puhlev, A.., ed., Endemic Nephropathy, Sofìa: Publishing House of the Bulgarian Academy of Science. Pp. 226 - 270.
Krogh, P. & Elling, F. 1977. Mycotoxic neprophathy: Vet. Sci. Commun., 1, 51 - 63.
Miller, D. M., B. P. Stuart, and W. A. Crowell. 1981. Experimental aflatoxicosis in swine: Morphological and clinical pathological results. Can. J. Comp. Med 45: 343-351.
Miller, D. M., B. P. Stuart, and W. A. Crowell. 1981. Experimental aflatoxicosis in swine: Morphological and clinical pathological results. Can. J. Comp. Med 45: 343-351.
Miller, D. M., B. P. Stuart, and W. A. Crowell. 1982. Acute aflatoxicosis in swine: Clinical pathology, histopathology, and electron microscopy. Am. J. Vet Res 43: 273-277.
Monegue, H. J., C. E. Combs, G. T. Edds, and H. D. Wallace (Eds). 1977. The effects of various levels of aflatoxinas on young swinw. Florida agriculture experiment station report AL-1977-5.
Prohibida su reproducción sin la expresa autorización de sus autores
Prohibida su reproducción sin la expresa autorización de sus autores
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación20 de julio de 2011
Antes de leer este trabajo conociamos ya la eficacia del ZEOTEK utilizandolo en las granjas porcinas. Después de leer el artículo se comprueba que el producto es una buena arma para prevenir estos graves problemas que son las micotoxicosis. Los felicito por lo bién desarrollado y presentado el trabajo. Desgraciadamente como está la crisis en la porcicultura, los propietarios de las granjas cuando ven que las cosas van bién, sin problemas clínicos o con parámetros buenos de producción, y entonces retiran el producto, o lo substituyen por otro de menor precio y ahí es cuando vuelven a presentarse problemas mas adelante.








