Introducción
Las aflatoxinas son un grupo de metabolitos heterocíclicos sintetizados por hongos, principalmente Aspergillus flavus Link y Aspergillus parasiticus Speare [10]. Se conocen aproximadamente 18 tipos de aflatoxinas, de las cuales sólo las aflatoxinas (AF) B1, B2, G1 y G2 son producidas directamente por el hongo [33]. Se ha observado que los niveles de colesterol, triglicéridos, calcio, fósforo, así como la actividad enzimática de la aspartato aminotransferasa (AST), alanino aminotransferasa (ALT), lactato deshidrogenasa (LDH) y glutamil aminotranspeptidasa (GGT) se ven afectados al administrar dosis de 0,5; 2,5 y 5 ppm de AFB1 [2,9,11,18]. La actividad de los leucocitos y la respuesta inmune también son alteradas por la presencia de aflatoxinas; el efecto negativo sobre el complemento, interferón, proteínas séricas, interleucinas y actividad leucocitaria son, presumiblemente, resultado del daño hepático y de la inhibición de la síntesis de proteínas, así como de la lesión directa a las células del sistema inmune [26].
Las fumonisinas, una familia de micotoxinas con capacidad carcinógena y citotóxica, son producidas por Fusarium verticillioides (Saccardo) Nirenberg (Fusarium moniliforme Sheldon), uno de los hongos más comúnmente encontrados en el maíz y otros cereales. La contaminación del maíz con fumonisina B1 (FB1) provoca en los animales diversos padecimientos: en equinos causa leucoencefalomalacia, siendo nefrotóxica en ratas, conejos y borregos, y hepatotóxica en todas las especies examinadas [3,5,40]. En cerdos es causa de edema pulmonar, fallo hepático y toxicidad cardiovascular [15]. Esta toxina también ha sido descrita como carcinógena en roedores [12] y un factor que contribuye al desarrollo de cáncer esofágico en el ser humano [30]. Se sabe que la FB1 es tóxica para diferentes líneas celulares en cultivo, incluyendo células epiteliales. Recientes estudios in vivo e in vitro soportan la hipótesis de que el mecanismo biológico de acción es por alteración en el metabolismo de los esfingolípidos, los cuales participan en el crecimiento y diferenciación celular [7,23,36,41].
El aparato digestivo, y especialmente el epitelio intestinal, es la primera barrera para la entrada de agentes extraños [27]. Algunos autores mencionan que la biodisponibilidad de FB1 en cerdos después de una administración intragástrica es solo del 4%, siendo una de las primeras funciones de las células epiteliales intestinales (CsEI) la actuar como una barrera física [29]. Un segundo mecanismo de protección es un proceso interactivo entre las CsEI y las células que participan en la respuesta inflamatoria e inmune ubicadas en la submucosa (síntesis de inmunoglobulinas y citocinas pro-inflamatorias) [25].
La co-contaminación de alimentos con AFB1 y FB1 es ampliamente conocida en muchas partes del mundo, y ha sido implicada en el desarrollo de carcinomas hepatocelulares en humanos y animales [8,38,39]. El efecto individual de AFB1 y FB1 ha sido motivo de varios estudios; sin embargo, existen pocos trabajos que caractericen el efecto sinérgico de la presencia de AFB1 y FB1 in vivo e in vitro. Se ha sugerido que en China la presencia de cáncer hepático primario se asocia a AFB1 y FB1, presentes en el alimento [38]. En un trabajo realizado en ratas tratadas con AFB1 y FB1, la administración continuada de estas toxinas incrementaba significativamente el potencial cancerígeno de FB1 [13]. Del mismo modo se observó un efecto sinérgico en pavos al ser alimentados con alimento que contenía AFB1 y FB1 [17].
El objetivo de este trabajo es observar la respuesta de células intestinales porcinas al estar en contacto con dos micotoxinas diferentes, de forma individual o combinada, así como poder utilizar el intestino porcino como modelo de extrapolación al humano [22].
Material y métodos
Cultivo celular y toxinas
Se utilizó la línea celular denominada IPEC-1, correspondiente a células de epitelio intestinal provenientes de intestino delgado de cerdo recién nacido, libre de calostro. La línea celular utilizada se obtuvo del Instituto Nacional de Investigación Agronómica INRA, Unidad de Farmacología-Toxicología, Toulouse, Francia, lugar en el que se realizó el trabajo de investigación.
Las células fueron mantenidas en botellas Falcon para cultivo celular de 75 cm2 en una incubadora humidificada a 37 °C, con 5% de CO2. Se utilizó medio mínimo esencial de Eagle modificado por Dulbecco (DMEM; Eurobio, Francia), suplementado con 10% de suero fetal bovino (FBS; Perbio Sciences, Francia), antibióticos (penicilina 50 μg/ml y estreptomicina 4 μg/ml), L-glutamina 2 mM, HEPES 15 mM (Eurobio, Francia), factor de crecimiento epidérmico (5 μg/ml; Becton Dickinson Lab. Francia) e ITS Premezcla (insulina 5 μg/ml, transferrina 5 μg/ml y selenio 5 ng/ml SIGMA, Francia). Cuando se observó confluencia del monoestrato, las células fueron tripsinizadas; la acción de la tripsina se detuvo agregando medio de cultivo sin suero (DMEM s/SFB) [6]. El siguiente paso fue centrifugar a 1.500 rpm durante 10 min a 4 °C. Se eliminó el sobrenadante y se agregaron 3 ml de DMEM s/SFB, se homogeneizó y se mezclaron 10 μl de la suspensión de células con 90 μl de colorante azul tripán para realizar el conteo celular en una cámara de Neubauer.
La AFB1 purificada se obtuvo de Alexis Biochemical (San Diego, EE.UU.), presentación de 5 mg, con un peso molecular de 312,3 g/mol (C17H12O6). Se utilizó etanol para preparar la solución madre a una concentración de 10 mM, diluyendo posteriormente en medio de cultivo a las concentraciones requeridas (0; 1,3; 2; 5; 10; 50 y 100 μM). La FB1 purificada fue obtenida de Promec (South Africa), presentación de 10,9 mg, con un peso molecular de 721,8 g/mol (C34H59NO15), fue diluida en agua destilada para preparar la solución de almacenamiento y, posteriormente, diluida en el medio de cultivo a las concentraciones requeridas (0; 3,7; 5; 10; 20; 50; 100 y 500 μM). La combinación AFB1/FB1 se diluyó en medio de cultivo a las concentraciones requeridas (0/0; 1,3/3,7; 2/3,7 y 5/10 μM).
Morfología celular
Las células obtenidas de la tripsinización se sembraron en placas de 24 pocillos (2 cm2 por pozo) a razón de 3 x 105 células por pocillo. Una vez que se observó unión a la placa (a las 48 h), se añadió AFB1, FB1, y la combinación AFB1/FB1, en las concentraciones previamente mencionadas. Los cultivos celulares fueron observados y fotografiados a las 24 y 48 h.
Proliferación y viabilidad celular
Se evaluó la proliferación y viabilidad celular a través de un método colorimétrico, usando el Kit CellTiter 96R AQueous Non- Radiactive Cell Proliferation Assay (Promega, EE.UU.). Para esta prueba se colocaron las células IPEC-1 en placas para cultivo celular de 96 pocillos (Polylabo-Nunc, Francia) a una concentración de 1 x104 células por pocillo en 100 μl de DMEM, agregándose tras 24 h de incubación diferentes concentraciones de AFB1, FB1 y de la combinación AFB1/FB1. Después de 48 h de exposición a las micotoxinas se añadieron 20 μl de solución de MTS/PMS (3-(4,5-dimetiltiazol-2-yl)-5-(3-carboximetoxifenil)-2- (4-sulfofenil)-2H-tetrazolium/fenazin metosulfato) por pocillo, incubando de 2 a 4 h. La cantidad de formazán soluble producido por las células después de la reducción del MTS fue medida en un lector de ELISA (Tecan, Francia) a 490 nm.
Prueba de citotoxicidad
El efecto de la citotoxicidad de AFB1 y FB1 sobre células IPEC-1 fue evaluado a través de la determinación de LDH en el medio de cultivo. Para este fin fue usado el kit comercial Cytotox 96R, Non- Radiaoactive Cytotoxicity Assay (Promega). Se utilizaron placas de 24 pocillos (2 cm2 por pocillo) con 0,35 x 106 células por pozo en 1 ml de medio de cultivo. Después de 48 h a una temperatura de 37 °C, el medio de cultivo fue reemplazado por otro medio conteniendo las concentraciones descritas anteriormente de AFB1, FB1 y AFB1/FB1. La actividad LDH fue medida 48 h después de la adición de las micotoxinas. Los resultados fueron expresados como porcentaje de citotoxicidad (LDH en medio de cultivo/[LDH en medio de cultivo + LDH de células lisadas] x 100).
Evaluación de la síntesis de interleucina-8
Para la evaluación de la concentración de IL-8 se utilizó el kit comercial Porcine IL-8 (Laboratorio R&D System, Inc, EE.UU.). En placas para cultivo celular de 96 pocillos (Polylabo-Nunc) se colocaron 1 x 104 células por pocillo en 100μl de medio DMEM completo. Tras 24 h, se agregaron diferentes concentraciones de AFB1, FB1 y la combinación de ambas. El sobrenadante se recogió a las 24 y 48 h para determinar la concentración de IL-8 por la técnica de ELISA. La absorbancia fue medida en un lector de ELISA (Tecan) a una longitud de onda de 490 nm.
Análisis estadístico
Se utilizó un diseño completamente al azar. Los datos fueron evaluados con un análisis de la varianza (ANOVA), y la comparación de medias se realizó según la prueba de Tukey, utilizando el paquete estadístico Statgraphics plus 5.0. El valor de significancia fue del 95% (_ = 0,05) para distinguir la diferencia entre los tratamientos.
Resultados
Morfopatología
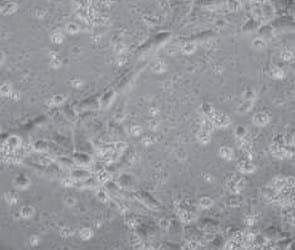
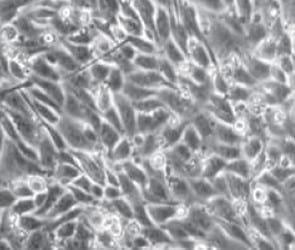
Los cambios morfológicos observados en las células tratadas con AFB1 denotan necrosis celular a partir de la concentración de 5 μM, siendo más grave la lesión en las concentraciones más altas (50 y 100 μM). Este efecto se observó desde las 24 h posteriores al contacto con AFB1 (Figura 1). No se apreciaron cambios morfológicos en las células tratadas con FB1. Lo más relevante a la inspección visual fue un aumento en la cantidad de detritos celulares en el medio de cultivo a las 24 h del contacto y en la concentración más alta de FB1 (500 μM). Del mismo modo, al utilizar la combinación AFB1/FB1 no se apreciaron cambios morfológicos importantes en ninguna de las concentraciones utilizadas en los diferentes tiempos de exposición (Figura 2).
Proliferación y viabilidad celular
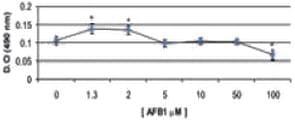
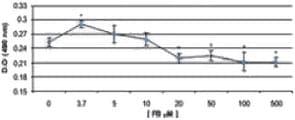
El mayor grado de lesión celular según esta técnica se observó en las concentraciones de 50 y 100 μM de AFB1, y el menor daño en las células expuestas a AFB1 1,3 y 2 μM, y FB1 3,7 μM. Las células que fueron expuestas a AFB1 5, 10 y 50 μM, FB1 50, 100 y 500 μM, y a la combinación 5 μM AFB1/ 10 μM FB1 se afectaron significativamente (p < 0,05) en comparación con el grupo control. Es importante destacar que la exposición de las células a las combinaciones 1,3 μM AFB1/3,7 μM FB1 y 2 μM AFB1/3,7 μM FB1 afectó la viabilidad celular, en comparación con el grupo control, y a las mismas concentraciones con AFB1 y FB1 cuando se manipulan de manera individual (Figura 3).
Citotoxicidad
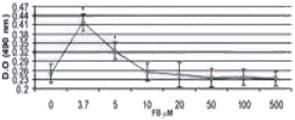
La evaluación de la presencia de LDH se realizó a las 48 h de contacto de las células con las micotoxinas, observándose que la concentración de LDH tuvo un incremento lineal (dosis-respuesta) en los tratamientos en los cuales se utilizó AFB1 y la combinación AFB1/FB1. Respecto a la respuesta de las células expuestas a FB1 el incremento fue menor, ya que las concentraciones de 20, 50 y 100 μM mostraron concentraciones similares de LDH en el sobrenadante (p > 0,05). Cuando las células fueron expuestas a 500 μM de FB1 la cantidad de LDH observada se incrementó tres veces respecto al grupo control (p < 0,05).
Sin embargo, cuando las células fueron expuestas a la combinación 1,3 μM AFB1/3,7 μM FB1 y 2 μM AFB1/ 3,7 μM FB1, la LDH se elevó de manera significativa (p < 0,05) al compararla con el grupo control y al tratamiento con AFB1 (1,3 y 2 μM) y FB1 (3,7 μM) de manera individual, observándose un efecto sinérgico al estar presentes las dos micotoxinas (Figura 4).
Síntesis de IL-8. La mayor producción de IL-8 se observó al utilizar 1,3 y 2 μM de AFB1, con resultados similares a las 24 y 48 h de la exposición (p < 0,05). La menor producción de IL-8 se observó a las 24 y 48 h del tratamiento con AFB1 a una concentración de 100 μM, siendo más importante el descenso a las 24 h (p < 0,05).
Con las concentraciones de 0, 5, 10 y 50 μM de AFB1 las células sintetizaron cantidades similares de IL-8 a las 24 y 48 h (p > 0,05) (Figura 5).
En las células con FB1 se observó que la mayor producción de IL-8 se presentaba en las concentraciones de 3,7 μM (24 y 48 h) y 5 μM (24 h), mostrando una diferencia significativa (p < 0,05) en relación a las demás concentraciones utilizadas y al tratamiento control. La menor producción de IL-8 se observó a las 48 h de contacto con FB1 en las concentraciones de 20, 50, 100 y 500 μM, mostrando diferencia (p < 0,05) con las concentraciones de 0, 3,7, 5 y 10 μM de FB1 a las 24 y 48 h (Figuras 6 y 7).
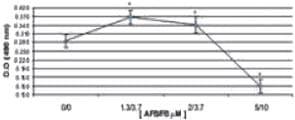
La combinación de 1,3 μM AFB1/3,7 μM FB1 y 2 μM AFB1/3,7 μM FB1 favoreció la síntesis de IL-8, en los dos periodos de tiempo evaluados, con un ligero descenso a las 48 h. La síntesis de IL-8 se afectó de manera importante con la combinación 5 μM AFB1/10 μM FB1 (p < 0,05) (Figura 8).
Discusión
En el presente estudio es posible observar el efecto in vitro individual y combinado de AFB1 y FB1 sobre células epiteliales intestinales a distintas concentraciones, siendo de especial interés el efecto que causa la combinación de AFB1 y FB1 en concentraciones de 1,3 μM/3,7 μM, 2 μM/3,7 μM y 5 μM/10 μM, respectivamente.
Las células epiteliales intestinales porcinas en proliferación y diferenciadas mostraron ser susceptibles a concentraciones de 3,7 μM o superiores de FB1, observándose este mismo efecto, pero con concentraciones de 10 μM FB1 o superiores, en dos líneas celulares de epitelio intestinal porcino (IPEC-1 y LLC-PK1) [6]. Se observó un efecto similar al utilizar concentraciones de 10 μM o superiores de FB1 y FB2 en células provenientes de hematoma de rata (H4TG) y células de riñón de perro (MDCK) [32]
La micotoxina AFB1 en concentraciones de 1,3 y 2 μM sobre las células IPEC-1 afectó su capacidad proliferativa, siendo el daño más grave a concentraciones iguales o superiores a 5 μM. Estos hallazgos concuerdan con los de otros investigadores, utilizando células HepG2 (células de hematoma humano) expuestas a periodos similares de 24 h. Además, observaron que esta línea celular es menos sensible a FB1 y que concentraciones menores a 10 μM de FB1 favorecían la proliferación celular [19].
Al utilizar la combinación AFB1/FB1 la proliferación y la viabilidad celular se vieron afectadas de forma más marcada que en aquellas células que recibieron una sola micotoxina. Esto también concuerda con lo observado por otros investigadores [19,30] al utilizar la combinación AFB1/FB1, incluso a concentraciones mayores respecto a la fumonisina (44,4 μM de FB1) en células HepG2 y BEAS- 2B (células de epitelio bronquial humano). Por otra parte, se ha publicado que existen numerosas líneas celulares de mamíferos sensibles a FB1 en un rango de 2,8 a 69,3 μM, lo que concuerda con el presente trabajo al utilizar una concentración de 3,7 μM de FB1 [14]. Otros autores mencionan que el efecto de FB1 y el mecanismo de acción de esta micotoxina son muy complejos, y es posible que la respuesta celular dependa en gran medida del tipo específico de célula [35].
Se observó que la integridad de las células epiteliales intestinales porcinas fue susceptible a la acción de AFB1 y a la combinación AFB1/FB1; no fue así para la FB1, ya que se necesitaron concentraciones de 500 μM para incrementar significativamente los niveles de LDH en el sobrenadante. El efecto mencionado también se observó en ratas tratadas con AFB1 y FB1, mostrando mayor susceptibilidad a AFB1 y solo en concentraciones altas a FB1 [28].
Esto no concuerda con otros estudios, en los que señalan un incremento en la concentración de LDH a partir de valores de 50 μM de FB1 [6,31].
La AFB1 fue la toxina que causó mayor lesión celular desde la concentración de 5 μM. Esto concuerda con lo descrito por un grupo de investigadores que observaron lesión celular (necrosis y apoptosis) y aumento de LDH al utilizar concentraciones de AFB1 que iban desde 5 hasta 80 μM sobre células HepG2 [37]. Otros investigadores observaron resultados similares al trabajar in vivo (pollos de engorda y ratas), utilizando 1 ppm (1,3 μM = 1,6 ppm) de AFB1, incrementándose la LDH sérica, así como la aspartato aminotransferasa (AST) [1].
Respecto a las interleucinas se sabe que son citosinas que participan en la respuesta inflamatoria e inmune, y que las citocinas pueden ser secretadas por células del sistema inmune, como los macrófagos y los linfocitos. Sin embargo, también las CsEI pueden sintetizarla. De hecho las CsEI pueden sintetizar citocinas y quimiocinas, cruciales para el reclutamiento de células y activación del sistema inmune [34]. Otras citocinas, como IL-1, IL-6 e IL-8, son producidas por células epiteliales como respuesta a infecciones bacterianas [16]. Sin embargo, diversos investigadores mencionan que las micotoxinas son capaces de modular la producción de citocinas en órganos o tipos celulares diferentes [4,5,24]. También es cierto que son pocos los trabajos de investigación encaminados a observar el efecto de las micotoxinas, de forma individual o en combinación, sobre la modulación de la expresión de citosinas por células intestinales. Esto ayudaría a comprender mejor el efecto directo de las micotoxinas o bien cómo ellas predisponen o incrementan la susceptibilidad del sistema digestivo hacia otros agentes infecciosos y no infecciosos al alterar los mecanismos de permeabilidad, de respuesta inflamatoria o inmune.
En el presente trabajo se puede observar que la síntesis de IL-8 aumentó al utilizar concentraciones bajas de AFB1 (1,3 μM), FB1 (3,7 y 5 μM) y de la combinación AFB1/FB1 (1,3/3,7 μM y 2/3,7 μM). Por el contrario, el porcentaje de IL-8 disminuyó a concentraciones mayores de AFB1 y AFB1/FB1, relacionándose con el daño celular observado en la prueba de MTS. Este importante daño celular (células degeneradas, en necrosis o apoptosis) impediría responder al estímulo de las micotoxinas, inhibiéndose, por tanto, la síntesis de IL-8.
Con respecto a la FB1, la expresión de IL-8 solo se ve afectada en concentraciones de 100 y 500 μM. Esto concuerda con lo descrito por diversos autores, quienes mencionan que el consumo humano o animal de alimentos contaminados con fumonisina, afecta la capacidad de células primarias y líneas celulares expuestas in vitro para sintetizar citocinas y otros metabolitos [6]. La disminución de IL-8 puede impedir el reclutamiento adecuado de células inflamatorias en el intestino durante una infección, aumentando la susceptibilidad intestinal a la invasión de agentes infecciosos [16,24]. La disminución en la síntesis de IL-8 por acción de FB1 podría deberse al hecho de que FB1 presenta una estructura análoga a la de los esfingolípidos, lo que interferiría con la síntesis de todo el complejo [21].
Investigaciones recientes indican que FB1 tiene acción sobre globósidos y gangliósidos, se sabe que estos últimos modulan la producción de inmunoglobulinas y la síntesis de citocinas [20].
Los resultados indican un efecto tóxico sinérgico sobre células diferenciadas y no diferenciadas a concentraciones de 1,3 μM AFB1/3,7 μM FB1 y 2 μM AFB1/3,7 μM FB1, en comparación con las mismas concentraciones al administrar una sola micotoxina. Estas concentraciones estimulan la síntesis de IL-8 y de otros mediadores que participan en la respuesta inflamatoria [4,24], además de incrementar la permeabilidad y lesión celular, manifestándose como disminución de la viabilidad celular e incremento en la liberación de LDH. Sería conveniente en investigaciones futuras la evaluación de otras enzimas celulares (AST, ALT, GGT, etc.) como una variable más en la valoración del daño celular y las vías metabólicas afectadas, además de evaluar el grado de necrosis o apoptosis presentes. Las herramientas utilizadas en este estudio para la evaluación de la viabilidad (MTS) y lesión celular (LDH e IL-8) son métodos no radiactivos, proporcionando a técnicos e investigadores la seguridad laboral necesaria, y facilitando la eliminación adecuada de los desechos generados en el laboratorio [14].
Agradecemos el apoyo económico brindado por las cátedras “Producción y mejoramiento de material educativo en el área de patología y enseñanza en producción porcina”- Clave MVZ003, “Estudios del efecto de los hongos y sus micotoxinas en granos y alimentos utilizados para la alimentación humana y animal“- Clave IN2-35 nivel 2, “Micotoxinas y micotoxicosis en salud animal”- Clave IN1-61 y “Afecciones bacterianas y virales del cerdo”, así como al Dr. Ernesto Moreno Martínez, responsable del proyecto CONACYT “Determinación de mecanismos hereditarios y moleculares en la pérdida de vigor, longevidad y contaminación por aflatoxinas en maíz“- Clave 43544 modalidad A-1, por el apoyo económico, técnico e intelectual.
Bibliografía
1. Allameh A, Safamehr A, Mirhadi SA, Shivazad M, Razzaghi-Abyaneh M, Afshar-Naderi A. Evaluation of biochemical and production parameters of broiler chicks fed ammonia treated aflatoxina contaminated maize grains. Animal Feed Science and Technology 2005; 122: 289-301.
2. Arshad S, Khan MZ, Siddique M, Javed MT. Studies on enzymes level and residual effects of aflatoxins in experimentally induced mycotoxicosis in broiler chick. Ind Vet J 1993; 70; 10: 898-902.
3. Bolger M, Coker RD, Dinovi M, Gaylor D, Gelderblom MO, Paster N, Riley RT, Shephard G, Speijers JA. Fumonisins. En: Safety Evaluation of Certain Mycotoxins in Food. Food and Agriculture Organization of the United Nations, paper 74. World Health Organization Food Additives 2001; 47: 103-279.
4. Bondy GS, Pestka JJ. Immunomodulation by fungal toxins. J Toxicol Environ Health B Crit Rev 2000; 3: 109-143.
5. Bouhet S, Hourcade E, Loiseau N, Fikry A, Martinez S, Roselli M, Galtier P, Mengheri E, Oswald IP. The mycotoxin fumonisin B1 alters the proliferation and the barrier function of porcine intestinal epithelial cells. Toxicol Sci 2004; 77: 165-171.
6. Bouhet S, Oswald IP. The effects of mycotoxins, fungal food contaminants, on the intestinal epithelial cell derived innate immune response. Vet Immunol Immunopathol 2005; 108: 199-209.
7. Caloni F, Spotti M, Pompa G, Zucco F, Stammati A, De Angelis I. Evaluation of fumonisin B(1) and its metabolites absorption and toxicity on intestinal cells line Caco-2. Toxicon 2002; 40: 1181-1188.
8. Carpenter DO, Arcaro KF, Bush B, Niemi WD, Pang S, Vakharia DD. Human health and chemical mixtures: an overview. Environ Health Perspect 1998; 106: 1263-1270.
9. Dafalla R, Yagi AI, Adam SEI. Experimental aflatoxicosis in Hybro-type chicks: sequential changes in growth and serum constituents and histopathological changes. Vet Hum Toxicol 1987; 29: 222-226.
10. Ellis WO, Smith JP, Simpson BK, Oldham JH. Aflatoxin in food: occurrence, biosynthesis, effects on organisms, detection and methods of control. Crit Rev Food Sci Nutri 1991; 30: 403-439.
11. Fernández A, Verde MT, Gascón M, Ramos J, Gómez J, Luco DF, Chávez G. Variation of clinical biochemical parameters of laying hens and chickens fed aflatoxin-containing feed. Avian Pathol 1994; 23: 37-47.
12. Gelderblom WC, Krick NP, Marasas WF, Thiel PG. Toxicity and carcinogenicity of the Fusarium moniliforme metabolite, fumonisin B1 in rats. Carcinogenesis 1991; 12: 1247-1251.
13. Gelderblom WCA, Marasas WFO, Lebepe-Mazur S. Interaction of fumonisin B1 and aflatoxin B1 in a short term carcinogenesis model in rat liver. Toxicology 2002; 171: 161-173.
14. Gutleb AC, Morrison E, Murk AJ. Cytotoxicity assays for mycotoxins produced by Fusarium strains: a review. Environ Toxicol Phar 2002; 11: 309–320.
15. Haschek WM, Gumprecht LA, Smith G, Tumbleson ME, Constable PD. Fumonisin toxicosis in swine: An overview of porcine pulmonary edema and current perspectives. Environ Health Perspect 2001; 109: 251-257.
16. Jung HC, Eckmann L, Yang SK, Panja A, Fierer J, Morzycka-Wroblewska E, Kagnoff MF. A distinct array of pro-inflammatory cytokines is expressed in human colon epithelial cells in response to bacterial invasion. J Clin Invest 1995; 95: 55-65.
17. Kubena LF, Edrington TS, Kampsholtzapple C. Effects of feeding fumonisin B1 present in Fusarium moniliforme culture material and aflatoxin singly and in combination to Turkey poults. Poultry Sci 1995; 74: 1295.
18. Kumar AA, Chand SK, Roa AT, Bisoi PC, Mishra PK. Clinicopathological changes in experimental aflatoxicosis in quail. Ind J Poult Sci 1993; 28: 150-153.
19. McKean C, Tang L, Tang M, Billam M, Wang Z, Theodorakis CW, Kendall RJ, Wang JS. Comparative acute and combinative toxicity of aflatoxin B1 and fumonisin B1 in animals and human cells. Food Chem Toxicol 2006; 44: 868-876.
20. Meivar-Levy I, Futerman AH. Up-regulation of glicosphingolipid synthesis upon long term inhibition of ceramide synthesis by fumonisin B1. J Biol Chem 1999; 274: 4607-4612.
21. Merrill AH, Hannun YA, Bell RM. Sphingolipids and their metabolites in cell regulation. En: Bell, RM, Hannun, YA, Merrill, AH (Eds.), Advances in Lipid Research: Sphingolipids and their Metabolites. Orlando, Academic Press, 1993: 1-24.
22. Miller ER, Ullrey DE. The pig as a model for human nutrition. Annu Rev Nutr 1987; 7: 361-382.
23. Mobio TA, Baudrimont I, Sanni A, Shier TW, Saboureau D, Dano SD, Ueno Y, Steyn PS, Creppy EE. Prevention by vitamin E of DNA fragmentation and apoptosis induced by fumonisin B1 in C6 glioma cells. Arch Toxicol 2000; 74: 112-119.
24. Oswald IP, Desautels C, Laffitte J, Fournout S, Peres SY, Odin M, Le Bars P, Le Bars J, Fairbrother JM. Mycotoxin fumonisin B1 increases intestinal colonization by pathogenic Escherichia coli in pigs. Appl Environ Microbiol 2003; 69: 5870-5874.
25. Oswald IP, Marin DE, Bouhet S, Pinton P, Taranu I, Accensi F. Immunotoxicological risk of mycotoxin for domestic animals in Europe. Food Addit Contam 2005; 22: 354-360.
26. Pier AC, McLoughlin ME. Mycotoxic suppression of immunity. En: Lacey J (Ed.) Trichothecens and Other Mycotoxins. Chichester, Wiley and Sons, 1985: 507-519.
27. Pitman RS, Blumberg RS. First line of defense: the role of the intestinal epithelium as an active component of the mucosal immune system. J Gastroenterol 2000; 35: 805-814.
28. Pozzi CR, Correa B, Xavier JG, Direito GM, Orsi RB, Matarazzo SV. Effects of prolonged oral administration of fumonisin B1 and aflatoxin B1 in rats. Mycopathologia 2001; 151: 21-27.
29. Prelusky DB, Trenholm HL, Savard ME. Pharmacokinetic fate of 14C-labeled fumonisin B1 in swine. Nat Toxins 1994; 2: 73-80.
30. Rheeder JP, Marasas WFO, Thiel PG, Sydenham EW, Shepard GS, van Schalkwyk DJ. Fusarium moniliforme and fumonisinas in corn in relation to human esophageal cancer in Transkei. Phytophatology 1992; 82: 353-357.
31. Schmelz EM, Dombrink-Kurtzman MA, Roberts PC, Kozutsumi Y, Kawasaki T, Merrill AHJr. Induction of apoptosis by fumonisin B1 in HT29 cells is mediated by the accumulation of endogenous free sphingoid bases. Toxicol Appl Pharmacol 1998; 148: 252-260.
32. Shier WT, Abbas HK, Mirocha CJ. Toxicity of the mycotoxins fumonisins B1 and B2 and Alternaria alternata f. sp. Lycopersici toxin (AAL) in cultured mammalian cells. Mycopathologia 1991; 116: 97-104.
33. Smith JE, Ross K. The toxigenic Aspergilli. En: Mycotoxins and Animal Foods. Smith JE, Henderson RS (Eds.). Boca Ratón, CRC Press, 1991: 101-108.
34. Stadnyk AW. Intestinal epithelial cells as a source of inflammatory cytokines and chemokines. Can J Gastroenterol 2002; 16: 241-246.
35. Terse P, Madhyastha MS, Zurovac O, Stringfellow D, Marquardt RR, Kemppainen BW. Comparison of in vitro and in vivo biological activity of mycotoxins. Toxicon 1993; 31: 1-7.
36. Tolleson WH, Melchior WBJr, Morris SM, McGarrity LJ, Domon OE, Muskhelishvili L, James SJ, Howard PC. Apoptotic and anti-proliferative effects of fumonisin B1 in human keratinocytes, fibroblasts, esophageal epithelial cells and hepatoma cells. Carcinogenesis 1996; 17: 239-249.
37. Travies O, Babcock G, Cornelius J, Dingeldein M, Talaska G, Warshawsky D,Mitchell KA. Comparison of apoptosis and necrosis induced by hepatotoxins in HepG2 cells. Toxicol Appl Pharmacol 2000; 164: 280-290.
38. Ueno Y, Iijima K, Wang SD, Sugiura Y, Sekijima M, Tanaka T, Chen C, Yu SZ. Fumonisins as a possible contributory risk factor for primary liver cancer: a 3-year study of corn harvested in Haimen, China by HPLC and ELISA. Food Chem Toxicol 1997; 35: 1143-1150.
39. Wang DS, Liang YX, Chau NT, Dien LD, Tanaka T, Ueno Y. Natural co-occurrence of Fusarium toxins and aflatoxin B1 in corn for feed in North Vietnam. Nat Toxins 1995; 3: 445-449.
40. WHO. Environmental Health Criteria 219: Fumonisin B1, United Nations Environmental Programme, the International Labour Organization and the World Health Organization. Geneva, International Programme on Chemical Safety, 2000.
41. Yoo H, Norred WP, Wang E, Merrill AHJr, Riley RT. Sphingosine inhibition of de novo sphingolipid biosynthesis and cytotoxicity are correlated in LLC-PK1 cells. Toxicol Appl Pharmacol 1992; 114: 9-15.









.jpg&w=3840&q=75)