Introducción.
Es una enfermedad de amplia distribución mundial, producida por un protozoario difásico del género Leishmania (familia Tripanosomatidae, orden Kinetoplastidia). En el continente americano prevalece en las regiones tropicales y subtropicales, afectando al ser humano y a numerosos vertebrados silvestres y domésticos. Dentro de éstos, se incluye al perro doméstico principalmente, que padece la enfermedad con diferentes niveles de gravedad, según la variedad de parásito involucrado y el estado inmune del huésped.
Etiología.
Es un protozoario difásico del género Leishmania y de la familia Tripanosomatidae, orden Kinetoplastidia.
Leishmania braziliensis y Leishmania chagasi (o L. infantum) son capaces de producir enfermedad en el perro, aunque la que mayor impacto tiene sobre la población canina es L.chagasi que produce la llamada leishmaniosis visceral canina1, 10, 35,37. L. infantumy L. chagasi son consideradas idénticas, desde el punto de vista genético.
Las especies que por ahora se sabe que pueden afectar al perro son: L. infantum /L. chagasi, L. tropica, L. major y L. braziliensis braziliensis.
Transmisión.
Es una enfermedad sistémica que se caracteriza por producir una amplia variedad de alteraciones, con un gran componente cutáneo, además del compromiso en distintos órganos internos. Estas parasitosis se transmiten en América, por medio de la picadura de las hembras de insectos vectores del género Lutzomyia, siendo diferentes especies de éstos a su vez, las responsables de la transmisión específica de las variedades de leishmanias existentes; así Lutzomyia whitmani y neivai, son las principales transmisoras de la leishmaniosis cutánea, y Lutzomyia longipalpis, lo es de la leishmaniosis visceral12.
En algunas zonas donde la leishmaniosis canina es endémica, pero los principales vectores no se han encontrado, se ha sospechado que las garrapatas, desempeñan un papel en la transmisión. Recientemente un equipo de investigadores del Departamento de Sanidad Pública y Zootecnia de la Universidad degli Studi di Bari en Italia10, ha llevado a cabo un estudio para comprobar si efectivamente las garrapatas son capaces de actuar como vectores de la leishmaniasis e informaron que se pudo detectar la presencia de Leishmania infantum kinetoplast minicircle ADN (kDNA) en las garrapatas de los perros infectados del sur de Italia y de Brasil. Este hallazgo es el primer paso en la búsqueda de otros vectores de este protozoario, lo que permitiría explicar la presencia de la enfermedad en lugares donde no se ha detectado el vector específico. Quedaría ahora demostrar el rol que desempeñan las garrapatas como vector accesorio de esta enfermedad.
Ciclo biológico.
Cuando un insecto vector parasitado pica a un huésped sano, inocula las leishmanias, que se vuelven infestantes al pasar del estadio promastigote (flagelado) al de amastigote (aflagelado) dentro de las células. Al momento de la picadura sobre el huésped, es de particular importancia la presencia en la saliva del flebótomo, de un péptido inductor de eritema llamado maxadilan, que provoca una reacción local en el área inoculada, favoreciendo el flujo de sangre y posterior diseminación de las leishmanias en el huésped. El ciclo se completa cuando a su vez un flebótomo ingiere macrófagos parasitados, que en su tubo digestivo pasan de amastigotes, a su forma promastigote para multiplicarse por división longitudinal. Esta multiplicación no es un proceso pasivo, sino que se encuentra influenciada en gran medida por las condiciones microambientales en el intestino del insecto, que determinan también la supervivencia y transmisión de los protozoarios. Este ciclo lleva un tiempo que oscila entre 4 y 20 días, y se completa cuando un nuevo huésped es inoculado15,21,33.
Cuando un vertebrado es picado, los promastigotes penetran en las células (principalmente macrófagos) desarrollando una serie de mecanismos defensivos que evitan su destrucción, y comienzan a multiplicarse como amastigotes por división binaria dentro de las mismas, provocando finalmente la lisis de éstas, con lo que posteriormente continúan su diseminación a otras células y la consiguiente propagación por el organismo. El período de incubación puede variar de uno a varios meses.
Signos clínicos.
Durante este proceso de multiplicación, las leishmanias generan una serie de alteraciones inflamatorias en distintos tejidos, afectando principalmente el estrato córneo de la piel, lo que se evidencia clínicamente por la aparición de seborrea, sobrecrecimiento ungueal (onicogrifosis) y dermatitis costrosa generalizada. Internamente, la multiplicación de las leishmanias puede producir cambios inflamatorios a nivel de los ganglios linfáticos, hígado, médula ósea, bazo, y en otros epitelios como el digestivo y respiratorio a nivel de la cavidad nasal principalmente14,28,32,37.
Además de estas lesiones producidas por la multiplicación del parásito, en el organismo se comienzan a gestar una serie de trastornos vinculados a la respuesta inmune generada por el mismo, con la formación de inmunocomplejos responsables de procesos de vascultis, trastornos hemostáticos, uveítis, miositis, aplasia medular, etc.; así como una glomerulonefritis por depósitos a nivel de la membrana basal glomerular, que suele ser la causa más común de muerte en los animales afectados.
La leishmaniosis por otra parte, aunque menos frecuentemente, puede afectar otros órganos tales como el corazón, aparato genital, huesos y articulaciones, sistema nervioso, etc.2,31,36.
De la forma en que el huésped responde a la presencia de las leishmanias al entrar en contacto con su sistema inmune, depende enormemente la gravedad y el curso que tomará la enfermedad en un individuo determinado. Es así que se puede activar un sistema de respuesta de tipo Th 1 de inmunidad celular, que desencadena una respuesta defensiva adecuada en el animal, limitando la multiplicación del parásito, llegando inclusive en algunos casos a evitar que se produzca la enfermedad. Si por el contrario, se activa principalmente un sistema de respuesta de tipo Th 2 de inmunidad humoral, la producción consecuente de anticuerpos se muestra incompetente para detener el proceso, y se generan inmunocomplejos que son los responsables de los trastornos inmunes que caracterizan a esta enfermedad con las consecuencias anteriormente citadas.
Según las manifestaciones clínicas presentes en cada caso y en un momento dado, los enfermos de leishmaniosis pueden clasificarse en tres estadios evolutivos que son como se detalla en el cuadro siguiente:
1- Asintomáticos (clínicamente sanos con diagnóstico confirmado).
2- Oligosintomáticos (con escasos síntomas, estadios iniciales o animales resistentes).
3- Sintomáticos (con enfermedad activa y crónica).
4- Resistentes: animales que además de ser asintomáticos no van a enfermarse en ningún momento24,27.
La leishmaniosis es una enfermedad sistémica que provoca un compromiso multiorgánico, cuya expresión puede tomar distintos aspectos que son los que se observan al examen clínico17,30.
Se caracteriza por producir una gran variedad de manifestaciones clínicas:
a) cutáneas: son las más evidentes y por lo general, el principal motivo de consulta por parte de los propietarios. Se detecta una dermatitis exfoliativa difusa (caspa), alopecia progresiva, principalmente periocular, en orejas y miembros, así como lesiones ulcerosas y heridas costrosas en orejas, hocico y eminencias óseas. También suelen aparecer onicogrifosis. Y nódulos múltiples o solitarios en distintas partes del tronco y cabeza.
b) extracutáneas: consisten sobre todo en linfadenomegalia generalizada (los ganglios suelen estar aumentados 3 a 5 veces su tamaño), adelgazamiento, en ocasiones caquexia, anemia, hepato y esplenomegalia, ocasionalmente artritis o sinovitis, y una variada gama de afecciones oculares como conjuntivitis, queratoconjuntivitis, uveítis, glaucoma etc.
La enfermedad en el gato.
El gato se afecta raramente y cuando lo hace se detectan lesiones en la piel, labios, nariz, párpados y orejas. Son muy raras las lesiones viscerales.
Los mecanismos patogénicos parecen ser semejantes a los que ocurren en el perro, aunque clínicamente predominan cuadros con alteraciones cutáneas más circunscriptas tales como lesiones nodulares o ulcerosas solitarias. También son frecuentes las alteraciones oftalmológicas principalmente las uveítis, coriorretinitis y queratitis. En esta especie es alta la correlación existente entre la presencia de enfermedades inmunosupresoras (ViF, ViLef) y la infestación con Leishmania.
Diagnóstico.
El diagnóstico de esta enfermedad se lleva a cabo teniendo en cuenta la signología clínica, el ambiente adecuado con presencia del vector, los métodos complementarios de rutina y los siguientes métodos específicos.
1-Citológico e histopatológico:
Consiste en la identificación de los amastigotes en muestras citológicas de raspajes e improntas de lesiones cutáneas, y en aspirados de linfonódulos, médula ósea, bazo y nódulos cutáneos o subcutáneos. Los amastigotes son redondeados a ovales, miden de 2 a 5 micras de diámetro, y tienen un núcleo central y un kinetoplasto (con ADN mitocondrial y una base flagelar) que se tiñen de color basófilo (Tinción 15- Giemsa); los mismos se pueden visualizar libres o fagocitados dentro de macrófagos. Normalmente se observa una inflamación mixta (presencia de polimorfonucleares neutrófilos y eosinófilos, y mononucleares macrófagos y plasmocitos), o una inflamación granulomatosa; los ganglios habitualmente presentan una hiperplasia reactiva. Esta es una técnica de alta especifidad (100%, la sola presencia de un amastigote tiene valor diagnóstico), aunque la sensibilidad es variable, dependiendo también del origen de la muestra (las muestras de bazo y médula ósea son las de mayor sensibilidad)5,9.
También se pueden identificar parásitos en cortes histológicos de piel u órganos. Por aplicación de métodos inmunohistoquímicos, aumenta la sensibilidad de los estudios, siendo de particular utilidad en casos donde la presencia de parásitos es pequeña.
2-Serológicos:
Existen numerosos métodos serológicos de diagnóstico, y cada uno posee sus ventajas y desventajas en cuanto a la utilidad clínica. El más comúnmente aceptado es la inmunofluorescencia indirecta, aunque puede presentarse el problema de la aparición de falsos positivos por interferencia con otras enfermedades como Tripanosomiasis americana (Mal de Chagas) o con Ehrlichiosis, por lo que su utilidad en áreas donde coexisten estas enfermedades es relativa. También se utilizan la prueba de ELISA, Western Blot, la Aglutinación Directa, etc. Existen además métodos inmunocromatográficos rápidos con el antígeno rK39, que se consideran de gran especifidad para L. infantum, aunque diferentes estudios en distintos lugares del mundo, arrojan resultados muy variables entre sí en cuanto a sensibilidad, por lo que se requiere una interpretación cautelosa en cada situación dada3,6,8,11,22,30.
3-Métodos moleculares:
PCR: la reacción de cadena de polimerasa permite amplificar el ADN parasitario e identificar su presencia en las muestras. Es de gran utilidad porque evidencia la presencia parasitaria aunque sea mínima. En la clínica, sirve además para evaluar la persistencia del parásito luego de los tratamientos.
La Inmunohistoquímica también es de gran utilidad pero se encuentra poco difundida por su costo26.
Tratamiento.
Existe una gran variedad de fármacos y protocolos terapéuticos que se utilizan, y se siguen investigando alternativas para el control de la enfermedad en los perros, en este momento, los productos y dosis que más consenso tienen por su eficacia en el tratamiento son19,23,24,27:
Antimoniales pentavalentes: principalmente el antimoniato de N-metil glucamina (Glucantime). Existen numerosos protocolos, pero los más aceptados son de 50 mg/kg, BID, s/c., o 75-100 mg/kg, BID, s/c.
Anfotericina B: como segunda elección, es más tóxica que el Glucantime. Dosis: 0.1-1 mg/kg/día, i/v. Existe una forma encapsulada en liposomas (Anfotericina liposomal) que reduce los efectos tóxicos y mejora su biodisponibilidad.
Allopurinol: es una droga que actúa como leishmaniostática, con excelentes resultados de mejora clínica, aunque limitada en su eficacia curativa. Se recomienda especialmente en combinación con el Glucantime. Dosis: 15-30 mg/kg/día, (c/8-12 hs) PO16,34.
Otros fármacos: paramomicina (aminosidina), pentamidina, espiramicina, metronidazol, quinolonas, ketoconazol, etc25. También parece ser una droga promisoria la Miltefosina, es efectiva en el hombre y tiene la ventaja de administrarse por vía oral. En este momento se encuentra disponible en algunos países una suspensión oral (20 mg/cc) y se utiliza a una dosis de 2 mg/kg durante 28 días. El tratamiento en todos los casos es de larga duración, comprendiendo generalmente un período de ataque de entre 20 y 30 días, continuado por un mantenimiento de varios meses o de por vida con Allopurinol.
El tratamiento en todos los casos es de larga duración, comprendiendo generalmente un período de ataque de entre 20 y 30 días, continuado por un mantenimiento de varios meses o de por vida con Allopurinol.
En estos protocolos terapéuticos pueden utilizarse además diversas drogas para mejorar la eficacia de los tratamientos, principalmente inmunomoduladores como el Levamisol, Interferón Gamma, Domperidona, etc13.
Respecto a la terapéutica en el gato, se debe tener en cuenta la especial sensibilidad del gato a muchos fármacos, incluyendo los antimoniales, por lo que algunos autores recomiendan el uso del Fluconazol como droga de elección. También se han utilizado, y sin certeza acerca de su eficacia, allopurinol y metronidazol– enrofloxacina.
Un tema muy importante es definir que pacientes deben tratarse y la respuesta a esta es que deben ser tratados los animales sintomáticos, oligosintomáticos y asintomáticos con la intención de reducir la carga parasitaria. En cambio no deben recibir tratamiento los animales resistentes.
Profilaxis.
Se han venido desarrollando hace muchos años vacunas que puedan ser eficaces contra la leishmaniosis. En la actualidad existen varias con posibilidades de poder aplicarse exitosamente, siendo una desarrollada a partir de una subunidad llamada FML (Fucose manose ligand) la que mejores perspectivas de eficacia y seguridad ofrecería.
El protocolo de aplicación de la misma, comprende la inoculación de 3 dosis con diferencia de 21 días cada una, a partir de los 4 meses de edad en individuos que sean seronegativos a la enfermedad. La revacunación es anual4,7.
Control de la enfermedad.
La organización Mundial de la Salud (WHO) ha adoptado para luchar contra esta grave enfermedad los cinco puntos enumerados a continuación:
1- Diagnóstico precoz y rápida instauración del tratamiento.
2- Control del vector por medio del empleo de insecticidas.
3- Educación pública y producción de manuales para entrenamiento.
4- Detención de las epidemias en forma precoz.
5- Diagnóstico precoz y tratamiento efectivo de los pacientes coinfectados con HIV.
Distribución geográfica de leishmaniosis visceral en los Viejos y el Nuevo Mundo.
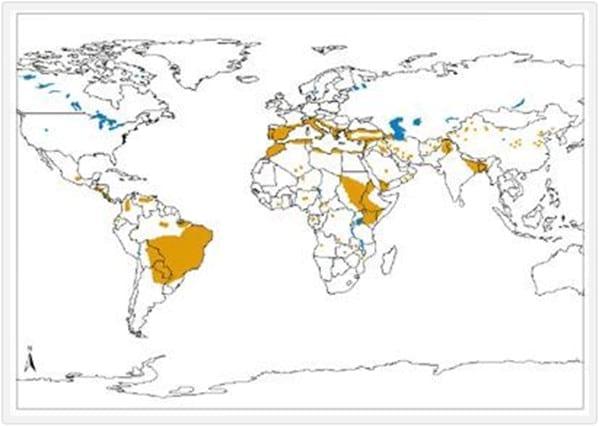
Fuente de datos y producción de Mapa: WHO/NTD/IDM VIH/SIDA, Tuberculosis y Malaria (HTM) Organización Mundial de la Salud, octubre de 2010.
Conclusiones.
Si bien la leishmaniosis es una zoonosis que se caracteriza por poseer en el perro uno de sus principales reservorios, sobre todo en el ambiente doméstico, se debe tener presente que el contacto con un animal enfermo no es causal de contagio, ya que es indispensable la presencia del insecto vector como huésped intermediario obligatorio.
Es fundamental el control de los insectos en el ámbito de vida de los animales, así como una adecuada protección repelente sobre éstos. Existen numerosos productos y formas de aplicación de los mismos, aunque los más utilizados y más eficaces, son las pipetas y collares con piretroides.
Hay una gran controversia respecto a las medidas profilácticas a considerar en relación a esta enfermedad, dado que en muchas regiones del mundo se preconizó y se continúa haciéndolo, el sacrificio de los perros seropositivos a leishmania. Esta medida, además de ser intrínsecamente irritativa para los médicos veterinarios clínicos así como para los propietarios, ha demostrado en numerosas situaciones y bajo distintas condiciones socioeconómicas, su poca utilidad para controlar el avance de la enfermedad, por lo que actualmente inclusive la OMS, no ubica el sacrificio de los animales positivos como la primera de las medidas recomendadas para el control.
Un gran obstáculo en todos los sistemas de monitoreo de poblaciones caninas en áreas endémicas, es la falta por el momento, de métodos de diagnóstico que puedan ser lo suficientemente confiables en cuanto a especificidad para determinar los animales afectados con precisión, por lo que continuamente aparecen evidencias de errores en el sacrificio de animales falsamente positivos. Además de eso, en general en áreas de malas condiciones socioeconómicas, donde se llevan a cabo campañas de sacrificio masivo de perros seropositivos, la rápida reposición de la población canina con nuevos cachorros que ingresan a estas áreas de transmisión intensa, torna inviable el control por esta vía, en la medida que no se modifican las condiciones de vida (pobreza, falta de salubridad) en estas poblaciones.
Es de remarcar que el avance de este tipo de enfermedades, como queda evidenciado al observarse la expansión de la misma en América del Sur, está notablemente influenciado por la creciente degradación ambiental de regiones tropicales y subtropicales, así como por la explosiva urbanización (generalmente bajo condiciones de mala infraestructura y pobreza) de dichas regiones.
Dentro de los aspectos epidemiológicos más importantes a tener en cuenta por lo tanto, es conocer la dinámica de las poblaciones de insectos; su presencia y actividad puede variar desde circunscribirse a algunos meses al año en ciertas regiones templadas, o encontrarse a lo largo de prácticamente todo el año con muy escasas fluctuaciones, en regiones tropicales y subtropicales.
Se debe destacar por otra parte, que numerosos estudios entomológicos demuestran que en el continente americano L.longipalpis es la más sinantrópica de lasLutzomyias por lo que su adaptación a diferentes ambientes humanos es notable4,19.
También son necesarios futuros estudios que avancen en la comprensión del rol de las garrapatas en el desencadenamiento de esta enfermedad, puesto que recientemente se ha demostrado la presencia de la leishmania en las garrapatas de Europa y de Brasil. Esto resulta importante no solo para explicar el porqué de la aparición de casos en lugares en los que no se encuentra el vector principal, sino también por la implicancia epidemiológica que tiene este hallazgo.
Bibliografía:
Acha, P.N.; Szyfres, B –1986 –Zoonosis y Enfermedades transmisibles comunes al hombre y a los animales– Organización Panamericana de la Salud– p: 626- 634.
Agut Giménez, A; Corzo Menéndez, N.- 2005- Modelos radiográficos de las lesiones óseas y articulares en la Leishmaniosis canina- Información Veterinaria– Septiembre– p. 34- 38.
Alexandre Alves, Waneska; Dias Bevilacqua, Paula– 2004- Reflexões sobre a qualidade do diagnóstico da leishmaniose visceral canina em inquéritosepidemiológicos: o caso da epidemia de Belo Horizonte, Minas Gerais, Brasil, 1993-1997- Cad. Saúde Pública, Rio de Janeiro, 20(1): 259- 265, jan-fev.
Alunda, José María- 2005- Leishmaniosis canina: Perspectivas futuras de control: del tratamiento a la profilaxis- Información Veterinaria– Junio– p. 48– 50.
Baker, Rebecc; Lumsden, John. Atlas de cytologie canine et feline. (Trad.)- Masson, Paris, 2001.
Cañavate,Carmen; Cruz, Israel; Flores, María– 2005- Leishmaniosis canina: Diagnóstico- Información Veterinaria– Junio– p. 28– 32.
Carcelén, J.; Molano, I.; Iniesta, V.; Corraliza, I.; Monroy, I. y Gómez Nieto, L.C.- 2005- Leishmaniosis canina: Inmunoprofilaxis, desarrollo de vacunas- Información Veterinaria– Junio– p. 42– 46.
Cortés, E.; Sanz, A. J.; Vela, C. y Ranz, A. I.- 2005 – Diagnóstico serológico de la leishmaniosis: análisis comparativo de ensayos inmunoenzimáticos e IFI. Información Veterinaria– Septiembre– p. 30- 33.
Cowell, R. L.;Tyler, R. D.; Meinkoth, J. H.-1998- Diagnostic Cytology & Haematology of the Dog & Cat- 2da Ed. Elsevier.
Dantas-Torres F, Lorusso V, Testini G, de Paiva-Cavalcanti M, Figueredo LA, Stanneck D, Mencke N, Brandão-Filho SP, Alves LC, Otranto D. Detection ofLeishmania infantum in Rhipicephalus sanguineus ticks from Brazil and Italy. Parasitol Res. 2010 Feb 3.
De Almeida Curi, N.H.; Miranda, I; Talamoni, S. Serologic evidence of Leishmania infection in free-ranging wild and domestic canids around a Brazilian National Park. Mem. Inst. Oswaldo Cruz, Rio de Janeiro. Vol. 101 (1): 99-101, February 2006.
Ferreira Gontijo, Célia Maria; Melo, Maria Norma– 2004- Leishmaniose Visceral no Brasil: quadro atual, desafios e perspectiva- Rev. Bras. Epidemiol. Vol. 7, Nº 3, P 338- 349.
Gómez Ochoa, Pablo– 2004- Nuevo tratamiento inmunomodulador de la leishmaniosis canina. Valoración clínica, inmunológica y hematopoyética de la domperidona. Ilustre Colegio Oficial de Veterinarios de Almería– VI Premio de Investigación.
Hervás Rodríguez, José; Chacón M. de Lara, Fernando; Sánchez Cordón, Pedro; Moreno Boiso, Antonio; Sánchez Isarria, Miguel A. y Gómez Villamandos, José C.- 2005- Leishmaniosis canina: Aproximación a la leishmaniosis canina y felina– Información Veterinaria– Septiembre– p. 20- 26.
Lainson, Ralph; Rangel, Elizabeth F.– 2005- Lutzomyia longipalpis and the eco-epidemiology of American visceral leishmaniosis, with particular reference to Brazil – A Review- Mem. Inst. Oswaldo Cruz, Rio de Janeiro, Vol. 100(8): 811-827.
Lester, Sally Jean; Kenyon, Jim Edmund. Use of allopurinol to treat visceral leishmaniosis in a dog. Journal of American Veterinary Association. Vol. 209, N° 3, Aug.1, 1996.
Marcondes Feitosa, Mary – 2006- “Avaliação clínica de animais naturalmente infectados”- ANALES 1º FÓRUM SOBRE LEISHMANIOSE VISCERAL CANINA Jaboticabal, SP. Brasil– p: 9- 14.
Margonari, Carina; Rezende Freitas, Christian; Campos Ribeiro,Rosemary; Mourão Moura, Ana Clara; Timbó, Marcos; Heckert Gripp, Adriano; Pessanha, José Eduardo; Santos Dias, Edelberto- February 2006- Epidemiology of visceral leishmaniosis through spatial analysis, inBelo Horizonte municipality, state of Minas Gerais, Brazil- Mem. Ins.t Oswaldo Cruz, Rio de Janeiro, Vol. 101 (1): 31- 38.
Miró Corrales, Guadalupe– 2007 Leishmaniosis canina: situación actual en Europa, diagnóstico y control- Acta Scientiae Veterinariae. 35 (Supl 2): s227-s229.
Miró Corrales, Guadalupe- 2005– Manejo clínico de la leishmaniosis canina: ¿Podemos unificar criterios?- Información Veterinaria– Septiembre– p. 44– 48.
Molina, Ricardo- 2005- Los flebotomos: importancia sanitaria- Información Veterinaria– Junio– p. 20– 24.
Moreira, Marcio Antônio Batistela; Luvizotto, Maria Cecília Rui; Nunes, Cáris Marone et al. Aplicação da técnica de imunofluorescência direta para o diagnóstico da leishmaniose visceral canina em aspirado de linfonodo. Braz. J. Vet. Res. Anim. Sci. vol.39, no.2, p.103-106. ISSN 1413- 9596, 2002.
Nieto, Javier– 2005- Leishmaniosis canina: Terapéutica- Información Veterinaria– Junio– p. 34– 40.
Oliva, G.; Foglia Manzillo, V.; Pagano, A.- 2004 - Evoluzione dei protocolli terapeutici in corso di leishmaniosi canina – Parassitologia 46: 231- 234.
Pennisi, M. G.; De Majo, M.; Masucci, M.; Britti, D.; Vitale, F.; Del Maso, R.– 2005- Efficacy of the treatment of dogs with leishmaniosis with a combination of metronidazole and spiramycin- The Veterinary Record 156: 346- 349.
Reithinger R; Dujardin J. Molecular diagnosis of Leishmaniosis: Current status and future applications. Journal of Clinical Microbiology, Vol 45(1): 21-25. 2007
Ribeiro, Vitor Márcio– 2007- LEISHMANIOSE VISCERAL CANINA- Critérios de Tratamento- www.apasfa.org/quem/protocolo_leish.doc -
Rui Luvizotto, Maria Cecília- 2006- “Alterações patológicas em animais naturalmente infectados”- ANALES 1º FÓRUM SOBRE LEISHMANIOSE VISCERAL CANINA- Jaboticabal, SP. Brasil– p :15- 22.
Salomon, OD; Sinagra, A; Nevot, MC Barberian, G; Paulin,P; Estevez, JO; Riarte, A; Estevez, J. First visceral leishmaniasis focus un Argentina. Memorias do Instituto Oswaldo Cruz, Vol 103, nº 1, Río de Janeiro 2008
Salomón, O.D.; Orellano, P.W. Lutzomyia longipalpis in Clorinda, Formosa province, an area of potential visceral leishmaniosis transmission in Argentina. Mem. Inst. Oswaldo Cruz, Rio de Janeiro. Vol.100 (5), 475- 476, Aug 2005.
Sanchez, Martin A.; Diaz, Nilka l. ; Zerpa, Olga; Negron, Emilia; Convit, Jacinto; Tapia, Felix J. – 2004 – Organ-specific immunity in canine visceral leishmaniosis: analysis of symptomatic and asymptomatic dogs naturally infected with leishmania chagasi- Am. J. Trop. Med. Hyg., 70(6), , PP. 618- 624.
Tovar Sauquillo, Mª Carmen- 2005– Manifestaciones oculares en la leishmaniosis canina- Información Veterinaria 2005– Septiembre– p. 39– 43.
Leishmune- Manual Técnico Leishmaniose Visceral Canina-Lab. Fort Dodge Brasil.
Vásquez, L.; Sierra, D. y Rojas, E.- 2002- Mecanismos de transmisión de la leishmaniosis- Revista de la Sociedad Venezolana de Microbiología- v.22 n.2 Caracas- jul. 2002.
Vercammen, F.; De Deken, R.; Kageruka, P. First evaluation of the use of allopurinol as a single drug for the treatment of canine leishmaniosis. Vlaams Diergeneeskd Tijdschr. 64, 208- 214, 1995.
Vicent, Nuria – 2004– Etiología de la leishmaniosis- Ponencia en el II Congreso JG del Hospital Veterinario JG de Mutxamel Alicante– España.
Zabala, Eduardo E.; Ramírez Oneyda J.; Bermúdez, Víctor- 2005- Leishmaniosis Visceral en un Canino- Revista de la Facultad de Ciencias Veterinarias- v.46 n.2 Maracay jul. 2005.
Zorio Grima, María- 2005- Leishmaniosis canina: Panorámica general de la enfermedad- Información Veterinaria– Junio– p. 14-18.
***El trabajo fue originalmente publicado en Revista Veterinaria Argentina.
Vet. Arg. – Vol. XXVIII - Nº 282 – Octubre 2011.
La republicación de los artículos de la Revista Veterinaria Argentina se hace por autorización expresa de Veterinaria Argentina.
http://www.veterinariargentina.com/revista/2011/10/leishmaniosis-visceral-en-los-caninos-y-felinos-actualizacion/
 Fuente de datos y producción de Mapa: WHO/NTD/IDM VIH/SIDA, Tuberculosis y Malaria (HTM) Organización Mundial de la Salud, octubre de 2010.
Fuente de datos y producción de Mapa: WHO/NTD/IDM VIH/SIDA, Tuberculosis y Malaria (HTM) Organización Mundial de la Salud, octubre de 2010.
