Introducción
Anualmente, mueren millones de perros debido al nacimiento no deseado de éstos, los cuales son eliminados ya sea a través de abortos inducidos por métodos farmacológicos o quirúrgicos, de sacrificios masivos o de propietarios que deciden no conservarlos.1-3 La sobrepoblación canina lleva a la presencia de perros vagos o de vida libre en la vía pública, lo que constituye un factor de alto impacto en la salud humana, por ser considerados los responsables de accidentes, mordeduras y propagación de enfermedades zoonóticas como la leptospirosis, echinococcosis, salmonelosis y rabia, entre otras.3-7 En muchos países en desarrollo se utiliza como método de control la eutanasia de los perros para lograr la reducción de la densidad y evitar así la transmisión de enfermedades zoonóticas, sin embargo, esta estrategia no es eficaz a largo plazo, sin la aplicación de leyes y la educación de las personas; además, se ha establecido que para lograr un control permanente de la sobrepoblación canina es necesario incluir estrategias para el control de la sobrepoblación.5,8 Para evitar el sufrimiento innecesario de los animales y para controlar el crecimiento de la población de perros vagos, se han empleado diversos métodos para el control de la capacidad reproductiva de esta especie, los cuales se enfocan mayoritariamente en las hembras caninas. Sin embargo, se debe considerar al macho, ya que también cumple un rol prioritario en la reproducción, teniendo el potencial de producir un mayor número de hijos que las hembras,6 por lo tanto, los métodos contraceptivos quirúrgicos o químicos deberían aplicarse también en machos con la misma frecuencia que en hembras.2,3
Castración química
La castración química es un método no quirúrgico de esterilización en machos, que presenta grandes ventajas al ser económico, seguro, de alta facilidad de realización y de mayor rapidez que los métodos tradicionales de castración quirúrgica.
Las desventajas que presentan los métodos tradicionales como la vasectomía y orquiectomía son las complicaciones en el postquirúrgico, debido a la necesidad de cuidados especiales producto de la inflamación en la zona de incisión, presencia de edema o hematomas11, además de presentar complicaciones como la dehiscencia de puntos o infecciones.9,10 Estos hechos hacen que los métodos tradicionales sean considerados como poco prácticos para su utilización en los programas de control masivo de reproducción canina.2,12
El método de castración química se realiza a través de la inyección de agentes esclerosantes en distintos sectores anatómicos del testículo, siendo de elección la vía intratesticular o intraepididimal; en este último caso se puede realizar en la cola o en el cuerpo del epidídimo.2,13 Son considerados como agentes esclerosantes aquellos que producen un reemplazo del tejido noble por tejido conectivo.
Uso de agentes esclerosantes.
La aplicación de esterilizantes químicos dentro del testículo, conducto deferente o epidídimo resulta en azoospermia14, alteración en la composición física del testículo y alteración en la producción de testosterona.10,15
Para realizar una castración química se han propuesto diversos agentes esclerosantes tales como formaldehido, sales de plata y zinc12, clorhexidina, cloruro de calcio, etanol, fenol, permanganato de potasio y metacrilato1,11,13,16,17, ácido acético y ácido láctico.12 Algunos efectos conseguidos son oligoespermia con formaldehido o etanol, dolor para el animal como el producido por el metacrilato o bien no producen cambios en la producción de espermatozoides ni en el volumen del eyaculado como el cloruro de calcio.1,12,16
El ácido láctico es un agente esclerosante que produce azoospermia, siendo considerado uno de los pocos agentes efectivos para la castración química de novillos y ratas.18,19 Cabezas (1993) muestra que la castración química realizada en terneros con ácido láctico provoca azoospermia en los animales estudiados, causando una atrofia testicular, junto con la falta de espermatogénesis activa.19 En la actualidad, se utiliza como protocolo de castración de terneros en predios, donde realizar cirugías es difícil, lento y de un elevado costo, debido a la gran cantidad de animales.19 Por lo anterior y debido a la escasez de antecedentes bibliográficos en la literatura consultada sobre la utilización de ácido láctico en perros, es que el presente trabajo tiene por objetivo el evaluar su utilización como protocolo de castración química en esta especie.
Materiales y método
Animales.
El estudio se realizó con 15 perros machos de entre 1.5 y 6 años de edad, con un peso entre 10 y 30 Kg, sin distinción de raza, sexualmente maduros, enteros, y reproductivamente sanos según los rangos normales para su especie, así como en su respuesta eyaculatoria y de concentración espermática (valor normal: 1,2±0,7 mL por eyaculado21).
Grupos de experimentación.
Los 15 perros estudiados se dividieron en tres grupos de cinco individuos, a los cuales se les inyecto vía intratesticular 0,5 mL de cada tratamiento en ambos testículos. El grupo A se consideró como control de la inyección, administrándose NaCl 0,9%. El grupo B fue considerado como control del vehículo de administración, inyectándose en ellos propilenglicol. El grupo C o grupo tratado recibió la administración de una solución de ácido láctico al 88% en propilenglicol.
Inyección intratesticular.
La administración de los productos se realizó en la sala de prácticos de cirugía de la Universidad de Concepción. Se tranquilizó al individuo con acepromacina inyectable, a dosis de 0,2 mg/Kg. vía I.M. y se efectuó la analgesia con tramadol clorhidrato a dosis de 3 mg/Kg. vía S.C cada 12 horas durante tres días. Se desinfectó la zona de inyección en el testículo con alcohol y povidona yodada.
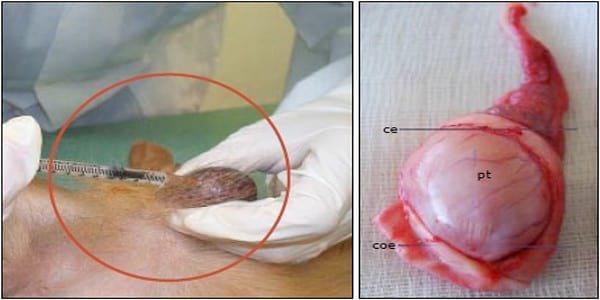
La inyección se aplicó en la región dorsocraneal del testículo, en la zona cercana a la cabeza del epidídimo; se introdujo desde el polo superior hasta el mediastino, depositando la solución a nivel del tercio medio.9,7,20 (Fig 1).
Examen físico testicular.
A cada grupo se le realizó un examen físico testicular donde se evaluaron los siguientes parámetros:
- Sensibilidad testicular : normal, dolor leve
- Consistencia testicular : normal, dura, blanda
- Grado de movilidad escrotal:normal, moderada, nula
Extracción y análisis del semen.
La extracción de semen en el perro fue realizada por manipulación digital. Se realizó en un lugar tranquilo, sin espectadores innecesarios y evitando sensaciones de miedo o dolor que impidieran la eyaculación.23
Una vez obtenidas las muestras de eyaculado, se procedió a realizar el análisis macroscópico y microscópico de éstas.
El análisis macroscópico consistió en la determinación del aspecto (acuoso, lechoso o grumoso),22 color (blanco, amarillo, verde) 22 y volumen de la primera y segunda fracción espermática (valor normal 1,2±0,7 ml por eyaculado).21
El análisis microscópico consistió en la determinación de la concentración de espermatozoides (nº/mL).23
Se consideró el diagnóstico de azoospermia permanente para este estudio cuando un perro presente en forma repetitiva muestras de ausencia de espermatozoides en el eyaculado por un período de un mes.2
Análisis Histopatológico
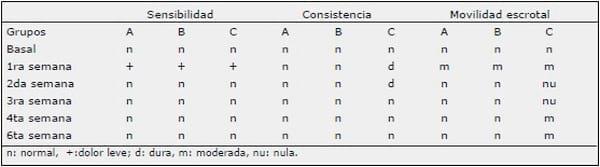
Para éste análisis las muestras, éstas fueron colectadas en frascos de formalina al 10% tamponada y se evaluaron tres cortes por cada testículo, considerándose dos cortes transversales, uno que involucró a tejido testicular y la cola del epidídimo (coe) y el otro que involucró tejido testicular y la cabeza del epidídimo (ce). Además, se consideró un corte longitudinal del parénquima testicular (pt) (Fig 2). Todas las muestras fueron teñidas con hematoxilina-eosina para su posterior análisis.
Figura 1. Inyección intratesticular en el parénquima testicular en la región dorso-craneal del testículo. Figura 2. Aspecto y zona para los cortes histológicos realizados en los testículos de los perros inyectados con ácido láctico. ce: cabeza del epidídimo, coe: cola del epidídimo, pt: parénquima testicular.
Diseño experimental
Inmediatamente previa inyección testicular, se realizó a cada perro en estudio la toma de valores basales por medio de un examen físico testicular y un análisis del eyaculado macroscópico y microscópico. Posteriormente, fue realizada la inyección intratesticular según grupo de estudio, sin sedación o anestesia tópica o regional de los perros.
Sólo se consideraron para el estudio los perros con una inyección intratesticular de todo el volumen de tratamiento. El examen físico fue repetido cada 24 horas por una semana y previo a la obtención de cada eyaculado. El análisis de semen fue realizado cada siete días por cuatro semanas y con un último análisis a las seis semanas postinyección intratesticular. El análisis histopatológico se realizó a las seis semanas.
Análisis estadístico
Los grupos de ensayo fueron comparados mediante la prueba no paramétrica de Kruskall Wallis. Se hicieron comparaciones de los tres grupos a la vez, con la concentración espermática, volumen del eyaculado, sensibilidad testicular, movilidad testicular dentro del escroto y consistencia testicular.
Resultados
La inyección intratesticular se realizó en forma normal en los 15 perros incluidos en el estudio, existiendo un perro el que no fue considerado dentro de los grupos de tratamiento debido a que, al inyectar parte del tratamiento con ácido láctico, éste alcanzó el escroto, lo que posteriormente produjo necrosis periférica, por lo que fue sometido a castración quirúrgica, y se administró tratamiento antinflamatorio, antimicrobiano y analgésico. La evolución fue evaluada en forma independiente de los grupos de estudio.
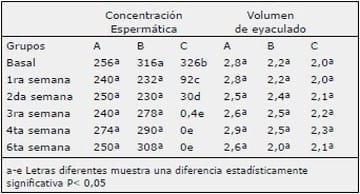
La evaluación de los testículos mediante palpación mostró algún grado de sensibilidad en todos los perros sólo hasta el día 5; desde el día 6 en adelante y hasta el término del estudio ninguno de los grupos presentaron molestia alguna. La consistencia de ambos testículos sufrió cambios sólo en el grupo C durante la primera y segunda semana, regresando a una consistencia normal a partir de la tercera semana. El grado de movilidad del testículo dentro del escroto tuvo variaciones para el grupo C entre la segunda y tercera semana post inyección volviendo a la normalidad a partir de la cuarta semana (Tabla 1).
El color del semen no tuvo variaciones en ningún grupo, sin embargo, el aspecto fue cambiando de lechoso a acuoso en el grupo C a partir de la tercera semana.
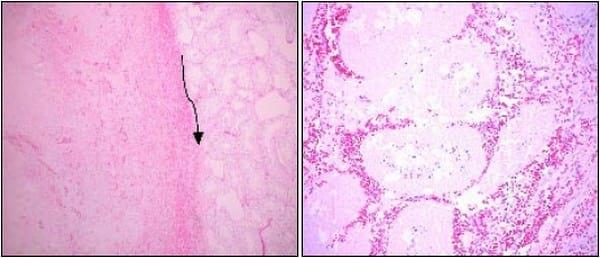
El análisis de la concentración espermática, según la prueba de Kruskall Wallis, demostró que en todas las semanas los grupos tenían distinta concentración espermática, no habiendo diferencia significativa entre los grupos A y B al término del estudio; en el grupo C la concentración espermática va disminuyendo cada semana significativamente hasta llegar a cero a partir de la cuarta semana (Tabla 2 ). El volumen del eyaculado no presentó diferencias significativas entre los grupos tratados, durante todo el período de estudio (Tabla 2).
Tabla 1. Examen físico testicular de los grupos inyectados intratesticular con NaCl 0,9% (A), propilenglicol (B) y ácido láctico al 88% (C).
Tabla 2. Media de la Concentración espermática (nº/mL) y volumen de las dos primeras fracciones del eyaculado (mL), de los grupos inyectados intratesticular con NaCl 0,9% (A), propilenglicol (B) y ácido láctico al 88% (C).
Los perros tratados con ácido láctico presentaron cambios histológicos similares, siendo lo más característico el observar que en el lugar de la inyección ocurrió una destrucción total del tejido, donde se distingue una esclerosis generalizada con el depósito de colágeno intertubular (Fig 3).
En las zonas aledañas al sitio de inyección, el tejido testicular presentó una escasa formación de células productoras de espermatozoides (espermatogonias); el lumen de los túbulos seminíferos se encuentra vacío o limpio, sin alteraciones (Fig 4).
Figura 3. Fotografía de corte histológico del parénquima testicular de perro con inyección intratesticular con ácido láctico 88%. Flecha indica la zona de delimitación de la esclerosis ocurrida por la inyección. 40X, HE. Figura 4. Fotografía de corte histológico del parénquima testicular de perro con inyección intratesticular con ácido láctico 88%. TB: Túbulos seminíferos sin producción de espermatozoides y sin espermatogénesis. 200X, HE.
Discusión
Al igual que lo descrito por otros autores, se puede establecer que la inyección intratesticular realizada en este estudio es una técnica fácil de realizar, bajo sedación y con mínimas molestias posteriores para los perros,7, 9, 20 por lo que puede ser realizada por médicos veterinarios con un entrenamiento previo.
El examen físico testicular establece que la gónada se vuelve sensible, lo que es atribuido solo al hecho de la inyección intratesticular ya que tanto en el grupo control y el grupo con propilenglicol, así como el grupo tratado con ácido láctico, presentaron sensibilidad durante los cinco primeros días, hecho que ha sido descrito como uno de los efectos de la inyección intratesticular 12 y que es atribuido al proceso inflamatorio que la inyección produce.24 Es importante además destacar que, al igual que en otros trabajos, la inflamación testicular producida no interfiere con el comportamiento general del perro ya que continúa activo, su apetito se mantiene normal y no presenta problemas para caminar.18 El hecho particular observado en el grupo de perros tratados con ácido láctico respecto a la generación de cambios de consistencia testicular, desde blanda a dura, y la disminución de la movilidad testicular, es atribuido al grado de esclerosis intratesticular, efecto que no fue observado en los perros controles y tratados con propilenglicol, lo cual concuerda con los resultados obtenidos por varios autores.16,20
Otros autores indican, además, que probablemente la aplicación de ácido láctico intratesticular induciría una respuesta inmune provocada por la interrupción de la barrera conformada por las células de Sertoli, asociada a la inflamación local que genera la liberación de antígenos desde el testículo.17
En cuanto a los efectos generados por una mala técnica de inyección intratesticular, es considerada a la necrosis testicular la principal desventaja, la que ha sido descrita en otras especies, que debe ser evitada por medio de un entrenamiento básico y previniendo movimientos imprevistos por parte del animal.19,7,24
En cuanto a los resultados observados en el examen de semen, el parámetro significativo que se vio alterado en este estudio fue el de la concentración espermática, que en el caso del grupo control y de los perros tratados sólo con propilenglicol se mantuvieron dentro del rango normal para la especie canina.23 Sin embargo, las variaciones experimentadas en los perros tratados con ácido láctico revelaron una disminución estadísticamente significativa, la que se desarrolló a lo largo del estudio en forma gradual y progresiva hasta presentar azoospermia. Estos resultados indican que la inyección intratesticular es un método relativamente fácil16, que requiere de un mínimo entrenamiento del operador y que es efectivo, ya que ocasionó azoospermia en todos los perros tratados a diferencia de otros trabajos que han obtenido tan solo un 50% de animales azoospérmicos o muchos de ellos sólo presentan oligospermia16, lo que puede ser causado a que el grado de esclerosis y daño de las células germinales fue insuficiente, ocasionando que sea reversible o que sólo disminuya la producción de espermatozoides. La esterilidad producida se presenta en su totalidad a los 21 días post-inyección, lo que se asemeja a los resultados encontrados por otros autores en terneros.19, 20 La disminución en la producción de espermatozoides ha sido atribuida al daño de células germinales y al epitelio germinal, produciendo la disminución y depresión total en la espermatogénesis.13
El volumen de semen no se vio afectado significativamente en ninguno de los grupos tratados (evaluación de primera y segunda fracción), esto se puede atribuir a que la composición del eyaculado no sólo está formada por la secreción testicular de espermatozoides, sino que la principal contribuyente del volumen es la secreción prostática, la que no se ve afectada su funcionamiento por alteraciones testiculares.23,25 En cuanto al aspecto del semen, éste se presentó lechoso al principio del estudio en los tres grupos tratados, lo que fue cambiando con el paso del tiempo sólo en el grupo C, llegando a tener un aspecto acuoso y transparente; esto se explica por la disminución de la fracción espermática, que es la que brinda el de color blanco al semen.13
En este trabajo, en los perros del grupo C se produjo una fibrosis o esclerosis de los túbulos seminíferos y espacios intersticiales en la zona de inyección de ácido láctico dejando a los túbulos seminíferos sin actividad espermatogénica, lo que concuerda con lo documentado por otros autores tanto con la utilización de ácido láctico19 como con cloruro de calcio9 o cloruro de zinc.15
El hecho que los túbulos seminíferos no hayan sido afectados de manera uniforme puede deberse a una baja dosis del producto, como fue señalado en otros trabajos al utilizar cloruro de calcio donde se observó que con dosis bajas no se afectaba todo el parénquima testicular de manera uniforme9,17, también esto justificó que los cambios histopatológicos fueran mayores en áreas cercanas al sitio de la inyección debido a la concentración y cantidad del producto. A pesar de que los cambios histológicos fueron menores en zonas alejadas de la región de la inyección, la espermatogénesis se afectó considerablemente, caracterizándose por la presencia reducida de células germinales y baja producción de espermatozoides que probablemente sean inviables. Por otro lado, la presencia de eritrocitos dentro del lumen de los túbulos seminíferos observados en los cortes histológicos es debida a la ruptura de los vasos sanguíneos y del efecto irritativo de la sustancia esclerosante.
Esto es lo que contribuye a una disminución drástica de los espermatozoides, además del hecho de que el pH disminuye (menor a 6,3) dentro del lumen, condición generalmente mortal para los espermatozoides.2
En el presente trabajo se puede concluir que la administración de ácido láctico al 88% genera molestias mínimas, sin cambios conductuales en los perros, provocando esclerosis y disfuncionalidad de las células germinales de los túbulos, siendo eficaz en producir azoospermia. Se debe señalar que son necesarios estudios con un mayor número de individuos para establecer una dosis adecuada a ser utilizada en perros para generar una destrucción mayor del tejido germinal que permita proponer esta maniobra como un método eficaz para ser utilizado en la castración química de los perros.
Referencias bibliográficas
1. Galván M, Páramo R, Esquivel C, Valencia J. Esterilización en el perro por inyección de metilcianoacrilato en la cola del epidídimo. Vet. Méx. 1994; 25(3): 261-265.
2. Goicochea J, Ureta E, Chavera A. Control de la capacidad reproductiva del perro con la aplicación de sustancias esclerosantes. Investig.Valdizana [Seriada en línea] 2007; 1(1):14- 20. Disponible en: http://www.unheval.edu.pe/investigacion/ revista/Revista%20Virtual.pdf consultado diciembre 20, 2010.
3. Bowen R. Male contraceptive technology for nonhuman male mammals. Anim. Reprod. Sci; 2008, 105(1-2): 139-143.
4. Tepsumethanon V, Wilde H, Hemachudha T. Intratesticular injection of a balanced zinc solution for permanent sterilization of dogs. J. Med. Assoc. Thail. [Seriada en línea] 2005; 88(5): 686-689. Disponible en: http://www.mat.or.th/journal/readpdf. php?link=files/Vol88_No5_686.pdf Consultado diciembre18, 2010.
5. Ortega-Pacheco A. Reproduction of dogs in the tropics with special reference to the population structures, reproductive patterns and pathologies, and a non-surgical castration alternative. Doctoral thesis, Swedish University of Agricultural Sciences. Uppsala, Sweden; 2006.
6. Jana K, Samanta P. Sterilization for male stray dogs with a single intratesticular injection of calcium chloride: a dosedependent study. Contraception 2007; 75(5): 390-400.
7. Soto F, Viana W, Sousa A, Pinheiro S, Mucciolo G, Hosomi F, Azevedo S, Dias R. Evaluation of zinc gluconate, either associated or not to dimethyl sulfoxide, as contraceptive method for male dogs. Anim. Reprod. 2007; 4(3-4): 119-124.
8. Howe L. Surgical methods of contraception and sterilization Theriogenology 2006; 66(3): 500-509.
9. Jana K, Samanta P, Ghosh D. Evaluation of single intratesticular injection of calcium chloride for nonsurgical sterilization of male black bengal goats (Capra hircus): a dose-dependent study. Anim. Reprod. Sci. 2005; 86(1-2): 89-108.
10. Jana K, Samanta P. Evaluation of single intratesticular injection of calcium chloride for nonsurgical sterilization in adult albino rats. Contraception 2006; 73(3): 289-300.
11. Emir L, Dabali M, Sunay M, Erol D, Caydere M, Üstün H. Chemical castration with intratesticular injection of 20% hypertonic saline: a minimally invasive method. Urology Oncology: Seminars and Original Investigation 2008; 26(4): 392-396.
12. Gunn M, Allen P, Bonneau M, Byrne D, Cinotti S, Fredriksen B, Hansen L, Karlsson A, Linder M, Lundström K, Morton D, Prunier A, Squires J, Tuyttens F, Velarde A, Von Borell E, Wood J. Welfare aspects of the castration of piglets EFSA. [Seriada en línea] 2004 Disponible en: http://www.efsa.europa.eu/EFSA/ Scientific_Opinion/report_ahaw03_ej91_pigcast_v2_en1,0.pdf Consultado Septiembre 15, 2010.
13. Moreno A. Castración química en perro con gosipol. Memoria de título, Universidad de Concepción, Fac. Med. Vet. Chillán, Chile; 2001.
14. Bloomerg M. Surgical neutering and nonsurgical alternatives. J. Am. Vet. Med. Assoc; 1996, 208(4): 517-519.
15. Oliveira E, Moura M, Silva V, Peixoto C, Saraiva K, Cavalcanti M, Douglas R, De Pinho A. Intratesticular injection of a zincbased solution as a contraceptive for dogs. Theriogenology 2007; 68(2): 137-145.
16. Canpolat I, Gur S, Gunay C, Bulut S, Eroksuz H. An evaluation of the outcome of bull castration by intra-testicular injection of ethanol and calcium chloride. Revue Méd. Vét. (Toulouse) 2006, 157(8-9): 420-425.
17. Santos E. Esterilização de cães com injeção intratesticular de solução a base de zinco. Tese, Doutor em Ci_ncia Animal, Universidad Federal de Minas Geras, Esc. Vet. Belo Horizonte, Brazil; 2007.
18. Nishimura N, Kawate N, Sawada T, Mori J. Chemical castration by a single intratesticular injection of lactic acid in rats and dogs. J. Reprod. Dev. [Seriada en línea] 1992; 38(4):263- 266. Disponible en: http://www.journalarchive.jst.go.jp/jnlpdf. php?cdjournal=jrd1992&cdvol=38&noissue=4&startpage=263 &chr=en Consultado Octubre 18, 2010.
19. Cabezas, O. Dinámica de los niveles plasmáticos de testosterona, LH y GH en terneros enteros y castrados químicamente. Memoria de título, 1993. Méd. Vet. Universidad de Concepción, Fac. Med. Vet. Chillán, Chile.
20. Mora G, Quezada M, Bonati C. Estudio clínico y morfopatológico de la castración química en terneros con ácido alfa-hidroxipropiónico. Av. Cienc. Vet. 1991; 6(1): 55-61.
21. Andrade A. Influencia en la calidad espermática de la adición de distintas concentraciones de crioprotectores para conservación del semen canino. Memoria Grado Doctor. 2005. Universidad Complutense de Madrid, Fac. Vet. Madrid, España.
22. Fontbonne A, Guérin P. Abord de L`infertilité du chien male. Rec. Méd. Vét. 1998 ; 174(3-4): 39-55.
23. Navarrete Y. Castración química en perros machos con digluconato de clorhexidina al 3% en dimetil sulfóxido al 50%. Memoria de título, Méd. Vet. Universidad de Concepción, Fac. Med. Vet. Chillán, Chile; 1997.
24. Levy J, Crawford P, Appel L, Clifford E. Comparison of intratesticular injection of zinc gluconate versus surgical castration to sterilize male dogs. Am. J. Vet. Res. 2008; 69(1):140-143.
25. Pineda M, Reimers T, Faulkner L, Hopwood M, Seidel G. Azoospermia in dogs induced by injection of sclerosing agents into the caudae of the epididymides. Am. J. Vet. Res. 1977; 38(6): 831-838.
26. Kutzler M, Wood A. Non-surgical methods of contraception and sterilization. Theriogenology 2006; 66(3): 514-525.
***El trabajo fue originalmente publicado por la revista HOSPITALES VETERINARIOS - Vol. 3 Nº 1 - 2011.