INTRODUCCIÓN
En el reino vegetal existen especies de probada hepatotoxicidad para el ganado bovino. La mayoría de las intoxicaciones en animales de producción provocadas por plantas hepatotóxicas corresponden a especies que producen cuadros agudos a sub-agudos y con menor frecuencia cuadros crónicos. Dentro de los vegetales hepatotóxicos agudos más conocidos en Argentina se encuentran: “duraznillo negro” (Cestrum parqui L´Her., Solanaceae), “sunchillo” (Wedelia glauca Hoff. ex. Hicken, Asteraceae), “abrojo grande” (Xanthium cavaniliensi Schouw, Asteraceae) y “transparente” o “siempre verde” (Mioporum laetum G. Forst, Scrophulariaceae), entre otras. Para el caso de las plantas hepatotóxicas crónicas varias especies de Senecio provocan, esporádicamente, intoxicaciones.
Figura 1. “Duraznillo negro” (Cestrum parqui L´Her., Solanaceae).
El Cestrum parqui (CP), también conocido con los nombres comunes de “palque”, “palqui”, “cestrum verde” o “yellow cestrum”, pertenece a la familia Solanaceae (Figura 1). Es un arbusto perenne que puede alcanzar hasta 2 m de altura. Sus hojas son de color verde claro brillante en el envés y verde grisáceo en el revés; son simples, enteras, de pecíolo corto y lámina lanceolada, generalmente aguda en el ápice y atenuada en la base, de unos 12 cm de longitud. Una característica particular de las hojas es el fuerte olor desagradable que emanan cuando son trituradas.
Las flores se reúnen en cimas o inflorescencias corimbiformes de color verde amarillento y de forma tubular, de aproximadamente 2,5 cm de largo, floreciendo desde finales de primavera hasta el otoño. El fruto es una baya globosa de color negro brillante con cáliz persistente, presente en la planta desde verano a otoño; su raíz es profunda y resistente.
La composición fitoquímica de CP es muy variada. Algunos autores establecen que los principios activos tóxicos son de difícil identificación química debido a la presencia de diversas sustancias como saponinas y una variedad de glicósidos 6 . Sin embargo ciertos investigadores lograron aislar parquina y carboxiparquina, los cuales son glicósidos semejantes a atractilósidos y carboxiatractilósidos 15 . Otro grupo de investigación demostró que los frutos y las hojas de la planta contienen saponinas cuya hidrólisis da como productos gitogenina y digitogenina 3 , o bien lograron aislar un alcaloide, un glicósido y saponinas.
Los principios activos tóxicos son utilizados por las plantas como mecanismos de defensa contra insectos y la herbivoría. En el caso particular de las saponinas de CP, poseen efecto insecticida contra artrópodos. Los glicósidos en CP serían responsables de la cardiotoxicidad, mientras que parquina y carboxiparquina de la hepatotoxicidad, todos efectos que ocurren en herbívoros. Este último grupo de sustancias tóxicas provoca la inhibición de la respiración mitocondrial y la síntesis de ATP por lo cual también se ve afectado el sistema carrier ADP/ATP a través de la membrana de la organela mediante un bloqueo de la traslocación del dinucleótido de adenina. Estos efectos provocan una alteración inicial de la circulación intrahepática que culmina con necrosis de hepatocitos y hemorragia periacinar.
El objetivo del presente trabajo fue presentar los hallazgos anatomopatológicos macroscópicos, microscópicos y hematológicos, así como el estudio micrográfico del contenido ruminal de muestras obtenidas de bovinos que ingirieron CP en forma accidental.
MATERIAL Y MÉTODOS
El cuadro de mortandad se produjo en el mes de junio de 2012 en un establecimiento de engorde a corral (latitud: 34,49 S; longitud: 58,46 O), Provincia de Buenos Aires, Argentina. Sobre un total de 234 vaquillonas cruza Abeerdeen Angus x Hereford se seleccionaron para venta 75 hembras de 22 meses de edad y 350 kg en promedio; los animales presentaban excelente estado corporal. Debido a inconvenientes climáticos surgidos por las intensas lluvias registradas se postergó la operación de venta. Por tal motivo los animales fueron alojados en un potrero de 2,5 ha, con buena disponibilidad forrajera, cercano al lugar donde se encontraba la instalación para cargar los animales al camión. Al día siguiente y durante la recorrida de rutina el personal encargado del establecimiento observó animales muertos por lo que solicitó la asistencia profesional para el estudio del caso.
Luego del arribo al establecimiento se recolectaron muestras de sangre con y sin anticoagulante por punción de la vena yugular de tres animales que presentaban signos clínicos al momento de la visita. Se realizó la necropsia completa de 3 animales muertos recientemente de los cuales se extrajeron muestras de diferentes órganos que fueron colocadas en formol bufferado al 10%; además se recolectaron diez muestras de 50 g cada una de contenido ruminal (estrato inferior cerca del orificio retículo-omasal, estrato superior, saco dorsal y ventral) en bolsas de polietileno que fueron rotuladas y conservadas refrigeradas para su posterior estudio por micrografía. También se realizó la necropsia de dos animales que presentaban un avanzado grado de putrefacción, de los que se tomaron muestras de contenido ruminal para determinación micrográfica del mismo modo descripto anteriormente.
Las muestras en formol fueron incluidas en parafina, cortadas y coloreadas con hematoxilina y eosina según técnicas de rutina. Las muestras de contenido ruminal fueron procesadas de acuerdo a la siguiente técnica: se lavaron con abundante agua corriente y luego se filtraron con el objeto de remover el exceso de licor ruminal. Porciones de 1 g de contenido fueron sometidas a una disociación leve con NaOH al 5% en caliente y hasta ebullición durante 8 minutos en vaso de precipitados. Pasado dicho tiempo el material vegetal diafanizado se lavó sucesivas veces con agua corriente a fin de remover el exceso de solución alcalina. Finalmente el material fue colocado entre porta y cubreobjeto adicionando una gota de agua y se observó con microscopio óptico con cámara digital incorporada.
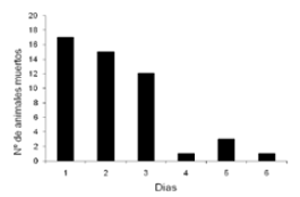
Gráfico 1. Evolución de la mortandad durante la intoxicación con Cestrum Parqui.
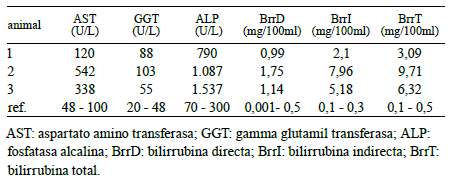
Tabla 1. Química clínica de animales con signos de intoxicación por Cestrum parqui.
RESULTADOS
En la visita al establecimiento se observaron 6 animales con signos clínicos y 17 animales muertos. Entre los signos más evidentes se destacaronn marcada depresión y decúbito permanente; en otros animales se observó incoordinación en la marcha -especialmente de miembros pelvianos- agresividad y tremores musculares. Al tercer día de comenzada la mortandad se contabilizaron 44 animales muertos y 3 animales con signos clínicos, mientras que a los 6 días la mortalidad alcanzo el 65,3% (49 de 75) y la letalidad el 100%; momento en que no aparecieron nuevos casos. La progresión de aparición de animales muertos se muestra en el Gráfico 1.
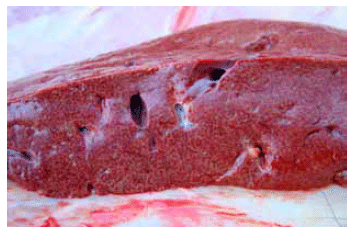
A la inspección externa de los animales muertos se observó espuma saliendo por ollares, líquido de color rojo por el ano, mientras que en otros se constató timpanismo ruminal leve. A la apertura del cadáver se verificaron hemorragias petequiales y sufusiones en serosas. En duodeno y primera porción de yeyuno el contenido apareció de color rojo y se comprobó la presencia de hemorragias petequiales en la mucosa. El hígado se encontraba aumentado de tamaño, con bordes redondeados; en la superficie de corte se observó demarcación del patrón lobulillar distribuido en forma difusa en el parénquima (“reticulado tóxico”, Figura 2). En vesícula biliar se constató la presencia de hemorragias en napa desde la serosa. El corazón presentaba hemorragias petequiales y en napa en el pericardio. A la apertura del rumen se encontró gran cantidad de material vegetal (hojas). No se observaron lesiones de carácter diagnóstico en otros órganos y sistemas.
Figura 2. Hígado con demarcación difusa del patrón lobulillar.
A la observación microscópica el hígado evidenció marcada necrosis de distribución periacinar (centrolobulillar) con pérdida de la arquitectura y disposición de los cordones hepáticos. En la zona de la lesión se observaron hepatocitos con diferentes estados de degeneración y núcleos con marcada picnosis y cariorrexis.
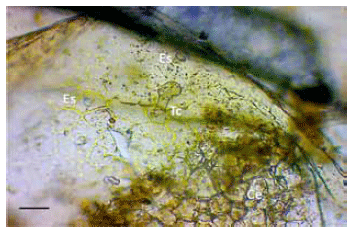
Figura 3. Fragmento de hoja de Cestrum parqui. Ce: célula epidérmica; Es: estoma; Tc: tricoma glandular. Disociación leve, 40X. Escala: 50mm.
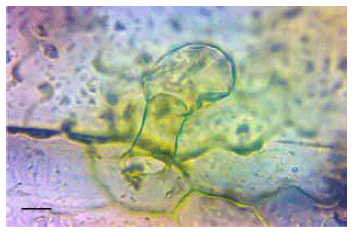
Figura 4. Detalle de un tricoma glandular de Cestrum parqui. Disociación leve, 100X. Escala: 20 mm.
Los recuentos eritrocitario y leucocitario, así como los índices hematimétricos no se apartaron de los rangos fisiológicos. Los valores séricos obtenidos para la bilirrubina y la actividad de enzimas hepáticas se presentan en la Tabla 1.
El análisis micrográfico de los fragmentos vegetales (hojas) hallados en el contenido ruminal demostró repetidamente las siguientes características: a) estomas anfistomáticos (en ambos lados de la hoja) anomocíticos de 40 a 50 mm de longitud (Figura 3); b) tricomas glandulares formados por un pie de dos células con cabezuela bicelular de 70 a 80 mm de largo (Figuras 3 y 4); c) células epidérmicas de bordes sinuosos, de 50 mm de longitud (Figura 3).
DISCUSIÓN
Para el diagnóstico de las intoxicaciones por vegetales tóxicos se deben tener en cuenta los antecedentes del caso, signos clínicos predominantes, lesiones post mortem, evidencias del consumo de plantas, presencia de la misma en el contenido gastrointestinal y, cuando el tóxico es conocido, su determinación por técnicas de laboratorio. En el presente caso las características epidemiológicas, los signos clínicos observados, los hallazgos anatomopatológicos macroscópicos y microscópicos, los resultados de laboratorio -enzimas y metabolitos hepáticos y la micrografía del contenido ruminal- señalan a la intoxicación por CP como causa de muerte.
Diversos factores son los responsables para que ocurra intoxicación por CP, dado que los bovinos no lo ingieren voluntariamente. Algunas condiciones epidemiológicas como animales hambrientos luego de encierres o viajes prolongados, escasa disponibilidad forrajera, o desconocimiento de la planta, pueden contribuir a la presentación de la intoxicación. En el presente caso los animales cambiaron abruptamente de una dieta de confinamiento -alta en energía y escasa en fibra- (9% sobre base seca) a una alimentación con pasturas naturales que -si bien constituía una buena disponibilidad forrajera- coexistían con una alta densidad de plantas de CP en estado vegetativo. Estas características epizootiológicas pueden haber favorecido la presentación abrupta del caso y los altos índices de letalidad y mortalidad.
Existen discrepancias en cuanto a la dosis tóxica de CP, además de citarse variaciones en su capacidad tóxica a lo largo del año y la diferente concentración de principios tóxicos en las hojas, flores y frutos. En el presente caso las plantas se encontraban en estado vegetativo y si bien se considera que durante esta fase del crecimiento poseen una menor concentración de principios activos, la gran cantidad de hojas consumidas resultó suficiente para provocar la muerte de los animales.
En una intoxicación experimental en bovinos con CP los investigadores hallaron cambios en el leucograma, destacándose un aumento de los glóbulos blancos circulantes, algo que no se observó en el presente caso donde el recuento leucocitario se mantuvo dentro del rango considerado normal para todos los animales muestreados. Sin embargo se observó un marcado aumento de las enzimas hepáticas y la bilirrubina sérica, hallazgo que coincide con reportes previos de intoxicaciones por CP como así también otras plantas que poseen principios hepatotóxicos agudos.
El análisis micrográfico evidenció la presencia de tricomas, estomas y células epidérmicas en el contenido ruminal compatibles con CP de acuerdo a las descripciones anatómicas realizadas por diferentes autores. El estudio micrográfico de plantas es un método utilizado con diversos fines, como por ejemplo la identificación botánica de material vegetal y, aplicado a la biología animal, para la determinación del comportamiento nutricional en animales silvestres y domésticos mediante el análisis de contenido estomacal, ruminal o intestinal, lo que evidencia que el proceso digestivo no modifica las estructuras foliares características tales como tricomas, estomas y células epidérmicas.
Gracias a que no se producen modificaciones sustanciales en las estructuras mencionadas, pudo corroborarse la ingestión de CP por micrografía del contenido ruminal. La técnica es sencilla, económica, pero requiere conocimientos de anatomía vegetal a la vez de deber contarse con una base de datos de plantas tóxicas particulares de una región geográfica determinada. Con todo esto, puede ser considerada como método de diagnóstico complementario para la confirmación de la intoxicación producida por CP.
REFERENCIAS
1. Alipayo D, Valdez R, Holechek JL, Cardenas M. 1992. Evaluation of microhistological analysis for determining ruminant diet botanical composition. J Range Manage 45: 148-152.
2. Botha CJ, Penrith ML. 2008. Poisonous plants of veterinary and human importance in southern Africa. J Ethnopharmacol 119: 549-558.
3. Canham P, Warren F. 1950. Saponins 2. Isolation of gitogenin and digitogenin from Cestrum parqui. S Afr Chem Inst 3: 63-65.
4. Freire SE, Arambarri AM, Bayón ND, Sancho G, Urtubey E, Monti C, Novoa MC, Colares MN. 2005. Epidermal characteristics of toxic plants for cattle from the Salado River basin (Buenos Aires, Argentina). Bol Soc Argent Bot 40: 241-281.
5. Ikbal C, Mounia BH, Habib BH. 2007. Toxicity experimentos of the saponic extract of Cestrum parqui on some insect species. J Etnomol 4: 113-120.
6. Kudo K, Kelly W, Oelrichs P. 1985. Experimental poisoning of mice and sheep with Cestrum parqui. Proceedings of the Australia-USA Poisonous Plants Symposium, Brisbane, Australia, p. 533-540.
7. Lemaster J, Sowers A. 1979. Phosphate dependence and atractyloside inhibition of mitochondial oxidative phosphorylation. J Biol Chem 254: 1248-1251.
8. Liskovsky IJ, Cosa MT. 2005. Anatomía comparativa de hoja y tallo en los representantes de Cestreae G. Don (Solanaceae) de Argentina. Gayana Bot 62: 33-43.
9. López TA, Keeler RF, Sharma J, Shupe L. 1985. Asociación de compuestos esteroidicos con la toxicidad de Cestrum parqui L´Heritier. Vet Arg 2: 935-941.
10. Marzocca A. 1997. Vademecum de malezas medicinales de la Argentina indígenas y exóticas, Orientación Gráfica Editora, Buenos Aires, 363 p.
11. McLennan MW, Kelly WR. 1984. Cestrum parqui (green cestrum) poisoning in cattle. Aust Vet J 61: 289-291.
12. Morrison J, Smith S, Aiken G, Huo C. 2008. Using microhistological techniques to predict botanical composition of horse diets on cool-season grass pasture. Proceedings Joint IGC/IRC International Meetings Grassland Society (Mongolia, China). On line: http://www2.ca.uky. edu/pss/publications.php
13. Odriozola E. 2004. Limitantes de la producción: causas tóxicas. Anales 2ª Jornada de Actualización Ganadera, Balcarce, Buenos Aires (Argentina). On line: http://www. produccion-animal.com.ar/sanidad_intoxicaciones_metabolicos/ intoxicaciones/48-limitantes_produccion_causas_ toxicas.pdf
14. Odriozola E. 2005. Intoxicación por plantas tóxicas en bovinos. Anales 10º Jornadas Veterinarias de Corrientes, Facultad Cs. Vet., UNNE. http://www.produccionanimal. com.ar/sanidad_intoxicaciones_metabolicos/ intoxicaciones/60-plantas_toxi-cas.pdf
15. Oelrichs PB, Pearce CM, Kudo K, Kelly WR. 1994. The isolation, structure, elucidation and toxicity of the kaurene glycosides parquin and carboxiparquin in Cestrum parqui. In: Plants Associated Toxins (Colegate SM, Dorling PR ed.), CABI International, Wallingford, UK, p.251-256.
16. Ragonese AE, Milano VA. 1984. Vegetales y substancias tóxicas de la flora argentina. En: Enciclopedia Argentina de Agricultura y Jardinería, Tomo II, Fascículo 8, 2da. ed., Acme, Buenos Aires, 413 p.
17. Raposo JB, Mendez MC, Andrade GB, Riet-Correa F. 1998. Experimental intoxication by Myoporum laetum in cattle. Vet Hum Toxicol 40: 275-277.
18. Rasmann S, Agrawal AA. 2009. Plant defense against herbivory: progress in identifying synergism, redundancy, and antagonism between resistance traits. Current Opin Plant Biol 12: 473-478.
19. Riet-Correa F, Schield AL, Mendez MC, Pinheiro MH. 1986. Intoxicaçào por Cestrum parqui (Solanaceae) em bovinos no Río Grande do Sul. Pesq Vet Bras 6: 111-115.
20. Riet-Correa F, Mendez MC, Shild AL. 1993. Intoxicações por plantas e micotoxicoses em animais domésticos, Ed. Hemisferio Sur, Montevideo, 340 p.
21. Riet-Correa F, Schild AL, Méndez MC, Lemos RA, Borges JR. 2007. Doenças de ruminantes e equinos, 3ª Ed. Palloti, Santa Maria (Brasil), 694 p.
22. Santos JC, Riet-Correa F, Simõs SV, Barros CS. 2008. Patogênese, sinais clínicos e patología das doenças causadas por plantas hepatotóxicas em ruminantes e eqüinos no Brasil. Pesq Vet Bras 28: 1-14.
23. Sparks DR, Malechek JC. 1968. Estimating percentage dry weight in diets using a microscope technique. J Range Manage 21: 261-265.
24. Tokarnia CH, Brito MF, Barbosa JD, Peixoto PV, Döbereiner J. 2012. Plantas tóxicas do Brasil para animais de produção, Ed. Helianthus, Rio de Janeiro, p. 154- 156.
25. Yagueddú C, Cid S, López T. 1998. Microhistological analysis of sheep gastro-intestinal content to confirm poisonous plants ingestion. J Range Manage 51: 655-660.








.jpg&w=3840&q=75)