Evaluación de la respuesta del conjugado citokina/bacterina inactivado de Moraxella bovis ß hemolítica en bovinos con queratoconjuntivitis
Publicado: 3 de enero de 2014
Por: Med. Vet. Diego Jorge Sabatini. UCA
I. INTRODUCCIÓN
El estatus sanitario de los rodeos de cría y recría es uno de los pilares más importantes en los resultados productivos, ya que se ve reflejado en la empresa pecuaria, impactando económicamente en los resultados. Los sistemas de producción han intensificado sus planteos productivos imponiendo mayores exigencias sin desmedro que los animales puedan expresar su mérito genético expresado en el potencial productivo a través de estado sanitario. Estos nuevos modelos con distintas exigencias técnicas (ej.: sistemas de encierre a corral y/o feedlot) trajeron aparejados una mayor atención en el manejo del riesgo sanitarios, en especial a las enfermedades de carácter infectocontagiosas.
Para una mejor comprensión se definieron conceptos básicos que permitieron tomar mejores decisiones.
A. QUERATOCONJUNTIVITIS INFECCIOSA BOVINA
Se trata de una enfermedad infecciosa de alta contagiosidad y de alta difusión, que afecta las estructuras oculares de los bovinos.
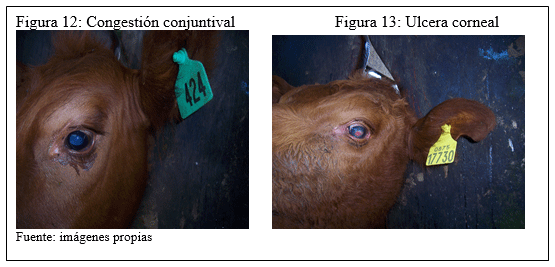
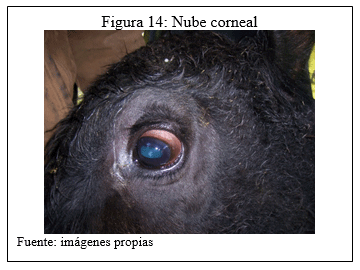
Como su nombre lo indica, se caracteriza por un síndrome caracterizado por inflamación de la córnea y tejido conjuntival de magnitud y severidad variables acompañados de signos como lagrimeo intenso o epifora, opacidad de la córnea llegando a producir ulceras sobre esta estructura, como también, síntomas de incomodidad, intolerancia a la luz, dificultad en la visión hasta la ceguera y posible muerte por panolftalmía y septicemia.
Es una enfermedad de amplia distribución mundial, apareciendo en los rodeos de cría, invernada y tambo (Zielinski et al. 1997), los sistemas intensivos con altas cargas son los de mayor riesgo al contagio, debido al contacto directo entre los animales, ya que la transmisión de esta enfermedad se produce entre otros factores por infección de las descargas oculonasales, como también por vectores artrópodos y otros vehículos entre ellos la manipulación del hombre durante el manejo de la hacienda en la manga (Quinteros Cornejo). Por tanto los sistemas como recría e invernada intensiva, encierres a corral y feedlot son más propensos a la aparición de la enfermedad. No obstante presentarse brotes en rodeos de cría extensivos.
La M. bovis es el agente etiológico fundamental, esta bacteria puede estar presente “contaminando los ojos” pero sin necesariamente producir signos de enfermedad. Se lo ha podido aislar de la mucosa conjuntival, mucosa de ollares y mucosa vaginal de los bovinos sin signos de enfermedad. Esta condición de portadores asintomáticos, puede perpetuar y constituirse como foco de infección manteniendo la enfermedad en forma endémica.
La QIB (Queratoconjuntivitis Infecciosa Bovina) se presenta mayormente en animales jóvenes pudiendo aparecer cuadros de enfermedad en otras categorías. Habitualmente en Argentina el síndrome se presenta en primavera verano, a comienzos del otoño esporádicamente existen brotes en invierno. No obstante los factores más importantes en la presentación de la enfermedad, son el aumento de la intensidad de los rayos UV y la mayor actividad de las poblaciones de moscas, que son los vectores que diseminan la enfermedad (Musca autumnalis y M. bezzii), otros factores que agravan la enfermedad son resecamiento de la superficie corneal, irritación causada por el polvo, pastos lignificados o encañados, carencia de nutrientes (vitamina A), animales con defensas bajas o débiles, y factores estresantes como altas cargas de animales (feedlot) problemas de manejo, destete, etc.
La falta de pigmentación en los parpados es otro factor predisponente; se ha encontrado una correlación entre el grado de pigmentación y la incidencia e intensidad de las lesiones. Por esto las razas británicas como, Hereford, Holando y Shorton son las más propensas a la QIB, la raza Aberdeen Angus en mucha menor medida y, en las Indicas generalmente las tasas de incidencia son menores.
Existen también otros agentes causales que pueden aparecer en forma combinada con M. bovis y de esa manera provocar lesiones más graves. Entre estos agentes encontramos el Herpesvirus Bovino (virus IBR/IPV), Neisseria catarrhalis, Mycoplasma spp. y Chlamidya spp. colaborando sinérgicamente con la patogenicidad característica de la QIB.
La mayoría de los autores consideran a los agentes nombrados anteriormente como oportunista secundarios, siendo el único agente etiológico que produce esta enfermedad la bacteria M. bovis. Se sostiene que sin esta bacteria no se producirían la queratitis y conjuntivitis características de la afección, de hecho el virus IBR produce conjuntivitis, pero no queratitis.
Los síntomas iniciales son contracción de pupilas, fotofobia (los animales cierran sus ojos por intolerancia y molestia de la luz) y procesos inflamatorios en las estructuras del ojo.
Se pueden producir desde leves opacidades en las córneas, como nubéculas, a procesos más graves como úlceras con perforación de los medios refringentes e infección de todo el globo ocular (panolftalmía). Otra lesión característica es la formación de queratocono consistente en la deformación de la convexidad corneal con respuesta a un proceso inflamatorio grave. El animal puede recuperarse espontáneamente, pero también se puede llegar a la ceguera bilateral por infiltración fibroblástica y cicatrización del tejido corneal afectado.
Esta enfermedad es de suma importancia ya que produce un impacto negativo como pérdidas de peso en los animales, mayores costos por tratamientos locales y atención por parte del personal y/o veterinario cuando aparecen los brotes de enfermedad.
El conjunto de factores predisponentes y desencadenantes influyen directa o indirectamente en la rentabilidad de cualquier sistema de gestión productiva si la enfermedad no es controlada o no se toman las medidas preventivas adecuadas.
1. Moraxella bovis
Moraxella bovis es una bacteria Gram (-) en forma de coco o bastón, aerobios, correspondientes a la familia Neisseriaceae. Esta bacteria presenta dos factores de virulencia, que son desencadenantes de esta enfermedad: una hemolisina y fimbrias o pilis. La hemolisina es citotóxica, destruye la cornea produciendo un proceso inflamatorio que deforma al ojo y le produce lesiones de moderadas a graves. Las fimbrias son unas prolongaciones citoplasmáticas que se adhieren en forma específica en determinado tipo de células que conforman las estructuras cornéales. Éstas se identifican como pilli “I” y “Q”, siendo aquellas cepas con pilli “Q” en su estructura bacteriana más infecciosas que los agentes con pilli “I”. Existen distintos tipos de fimbrias, de muy variada composición proteica, cada pilis genera anticuerpos que protegen únicamente contra ese tipo antigénico, pueden llegar a proteger a otros tipos de fimbrias pero en mucha menor medida (Zielinski 2005).
2. Tratamiento
Los tratamientos para buscar la curación tienen altos costos directos, ya que son realizados en forma individual buscando mayor efectividad. No obstante el buen resultado terapéutico, el control de esta enfermedad es muy difícil de lograr y la eficiencia de los tratamientos preventivos existentes termina siendo incierta. La descripción precedente de la enfermedad y del agente etiológico, muchas son el fundamento de la difícil prevención de la enfermedad.
Por un lado la diversidad antigénica de los pilis de las diferentes cepas, que a su vez tienen varios serogrupos de M. bovis, hace difícil el control de la queratoconjuntivitis. En un mismo rodeo se han observado diferentes tipos piliares infectando los ojos, por esta razón, los anticuerpos protectores tendrían que estar dirigidos contra todos los tipos piliares que poseen las M. bovis que infectan al rodeo (Zielinski 2005). La protección con una bacterina monovalente tiene por lo general una respuesta antigénica muy buena, pero sólo si el serogrupo homólogo del pilli está contenido en la vacuna. Contrariamente la respuesta antigénica no es beneficiada cuando en lugar del uso de bacterinas monovalentes se utilizan bacterinas con diversos serogrupos . Otra característica fundamental que hace a la M. bovis más patógena, es la capacidad de cambiar su mecanismo de virulencia, el pilli "I" puede cambiar a pilli "Q" convirtiéndose en un serogrupo altamente patógeno.
Una razón más que explica el dificultoso control, son las toxinas producidas por esta bacteria, las que se inactivan fácilmente, por lo que las vacunas deberían contener altos títulos de antígenos capaces de generar una respuesta inmune eficaz contra esas toxinas, cuestión hasta el momento dificultoso de lograr.
Hay que tener en cuenta que en infecciones localizadas causadas por organismos no invasivos, como en el caso de la M. bovis, el desarrollo de anticuerpos secretores parece ser un importante mecanismo de defensa específicos (Nayar; Saunders 1973). La clase principal de anticuerpo encontrado en las secreciones lacrimales que bañan la superficie corneal es la Inmunoglobulina A (IgA). Esta es generada mayormente por la estimulación antigénica de los tejidos linfoides cercanos a la superficie a defender, en este caso la conjuntiva ocular y la cornea. Su misión es neutralizar las toxinas y evitar que la bacteria se adhiera a la cornea. Las lagrimas tiene poca o nula cantidad de inmunoglobulinas G (IgG), que se producen por la aplicación de vacunas por las vías habituales como son subcutáneas o intramuscular (Zielinski 2005). Las vacunas piliadas estimulan tanto la producción de Ig A en las lágrimas y de Ig G en el torrente sanguíneo (Schering Plough Veterinaria S.A).
En estudios realizados con distintas vacunas en un rodeo con un brote importante de QIB, no se han detectado diferencias en el índice de lesión entre grupos vacunados y grupos sin vacunar - testigos - (Zielinski 2000). En Estados Unidos las respuestas a las vacunaciones son muy inciertas como en nuestro país; en Australia no se vacuna contra esta enfermedad, la recuperación ocurre sin tratamiento (Zielinski 2000).
Una forma de prevenir esta enfermedad infectocontagiosa es a través del control de las moscas, que como se señaló, son el principal vector de M. bovis, esto resulta difícil y no muy eficiente y sólo aporta un resultado relativo estacional, y no para la aparición de brotes invernales. También podrían intentarse la prevención mediante la administración de vacunas en forma previa a los momentos de mayor estrés del animal como por ejemplo, el momento del destete y transporte, o durante la etapa de crianza artificial y recría en caso de ganado lechero. En estas circunstancias los animales disminuyen sus defensas quedando con mayor riesgo por exposición a una infección.
B. SISTEMA INMUNOLÓGICO
El sistema inmunológico se define en un conjunto de estructuras y procesos biológicos, en funcionamiento constante protegiendo al animal con capacidad de detección de la identidad antigénica agentes extraños, reconociendo lo propio de lo ajeno a través de sus receptores.
La detección no es siempre efectiva, los patógenos pueden producir adaptaciones logrando evitar el sistema inmunitario, o pueden llegar a evolucionar rápidamente, consiguiendo infectar al organismo.
En el sistema inmune ocurren tres etapas:
- Presentación del antígeno.
- Expansión clonal o cooperación.
- Efectores.
Estas etapas ocurren en los ganglios de todo el cuerpo. El tejido linfático asociado a mucosas (TLAM) comprende el tejido ocular, el orofaringeo, el intestinal, el genital, el urinario, y algunos autores incluyen a la piel dentro de este tejido ya que puede actuar de manera similar a las mucosas. Este tejido con autonomía fisiológica y anatómica se divide en organizado y difuso, en este último, solo ocurre la etapa en los que actúan los efectores a diferencia del TLAM organizado donde el sistema inmune es similar al de los ganglios, ocurriendo las tres etapas mencionadas, presentación del antígeno, expansión clonal y la actuación de los efectores.
Una característica que tiene la inmunidad de las mucosas es el proceso llamado transitosis u homming, es aquel mecanismo donde al ser estimulado uno de estos tejidos, por la aparición de agentes extraños, se desencadenan los procesos del sistema inmune transfiriendo el estímulo a los otros tejidos pertenecientes al TLAM, logrando una protección a nivel de otro tejido donde no se produjo el ingreso directo del patógeno. Un estímulo antigénico que pueda aparecer en la mucosa bucal por ejemplo puede proteger a nivel mucosa genital.
1) Presentación del antígeno:
La presentación del antígeno a los linfocitos genera una cascada de eventos que va a resultar en las reacciones inmunes humorales y celulares. (Vandeputte 2004)
Al ingresar el patógeno al organismo es reconocido primeramente por los llamados macrófagos o células presentadoras de antígenos (CPA), éstas procesan y presentan al antígeno a los linfocitos T, generando la respuesta inmune. El antígeno procesado, se une a los linfocitos T CD4, llamados linfocitos T helper, gracias a receptores de linfocitos T (TCR), éstos poseen péptidos asociados al complejo mayor de histocompatibilidad en la membrana plasmática de macrófagos y otras CPA. Cuando se logra la unión se secretan Citocinas, las Interleuquinas 2 (IL2) estimulan la acción de los linfocitos B, y vuelven a actuar sobre los LT CD4. Los linfocitos B gracias a sus Inmunoglogulinas G de membrana reconocen al antígeno directamente tal como entra al organismo sin necesitar que este sea procesado por las CPA.
2) Expansión clonal o cooperación:
Al recibir la información los linfocitos T de la presencia del antígeno se activan, éste prolifera y se diferencia en múltiples células derivadas, todas tienen idéntico receptor de membranas, estas células se las denomina “clon celular”. Se generan así dos subpoblaciones, por un lado representados por los Linfocitos T de memoria que son los que se encargan de mantener la memoria inmunología sobre un antígeno en el organismo, por otro lado una subpoblación de Linfocitos T efectores. Estos se dividen a su vez en Linfocitos T Helper 0, 1 y 2. Una de las acciones del Linfocito TH2 es el estimulo de la liberación de IL4, IL6 e IL10 , estos colaboran con la acción de los linfocitos B (LB). Cuando los linfocitos B reciben la información estimulados por IL2 del antígeno presente en el organismo, se activan, una población queda como linfocitos B de memoria y otra se diferencia en células plasmáticas, es la que secreta la inmunoglobulina y constituye la inmunidad humoral. (Tapia 1997)
Tantos las células B y T de memoria son aquellas que han sido expuestas a un antígeno y que se convierten rápidamente, en células efectoras al encontrarse nuevamente con el mismo antígeno.
3) Efectores:
En esta etapa se generan las respuestas inmune celular y también la respuesta inmune humoral. A partir de los TH 1, se produce la secreción de citoquinas como la IL-2 (Interleuquina 2), el IFN-γ (Interferon γ), el factor de necrosis tumoral b (TNF-b) y otras interleuquinas, como la IL-12 (Interleuquina 12). Los Th1 (Linfocitos T helper 1) dirigen la respuesta celular la cual esta mediada por los Linfocitos CD8 (llamado citotoxico), las células NK (células Natural Killer), macrófagos, neutrofilos y eosinofilos. Estas células tienden a romper tejidos del organismo, así de esta manera quitarle el sustrato al patógeno. Generan una respuesta de tipo inflamatoria. Por otra parte los TH2 (Linfocitos T helper 2) dirigen la respuesta humoral, relacionada con la secreción de interleuquinas (IL), IL-4, IL-5, IL-7, IL-9, IL-10 e IL-13. Esta respuesta humoral está mediada por Inmunoglobulinas.
Los elementos celulares y humorales que forman el sistema inmune, son los responsables de la defensa del organismo en su totalidad, siendo capaces de diferenciar lo propio de lo ajeno.
1. La Respuesta inmune
a) Respuesta primaria y secundaria
Al ingresar por primera vez un antígeno al organismo y ponerse en contacto con él, se produce una respuesta inmune que se denomina respuesta inmune primaria. Por el contrario, cuando el mismo patógeno después de un tiempo vuelve a activar el sistema inmune se genera una respuesta que se denomina respuesta inmune secundaria o adaptativa.
La respuesta primaria antigénica desde la entrada del patógeno al organismo dura aproximadamente siete (7) días, se podría decir que esta respuesta prepara al organismo a un próximo ataque. Si existiera un desafío, un estimulo a los 21-28 días, se desencadenaría la respuesta secundaria, esta tardara entre 12 y 36 hs, es una respuesta más eficiente y rápida que la primera ya que el organismo está preparado, y no solo van actuar los efectores si no también la parte del sistema de la memoria.
Figura 1: Respuesta inmune primaria y secundaria.
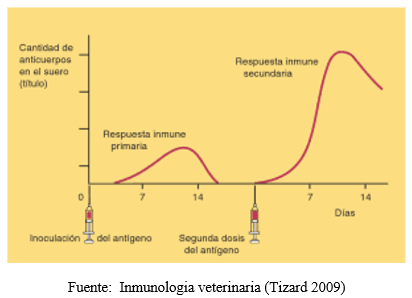
Esta curva muestra el nivel de anticuerpos circulantes en el plasma frente a la primera y segunda exposición a un antígeno determinado. Se logra observar la demora en la aparición, la baja potencia y la vida breve de la respuesta primaria, comparándose con la respuesta secundaria después de la exposición al mismo antígeno, la cual empieza rápidamente, es mucho más potente y forma anticuerpos durante meses.
Esta diferencia que existe en las respuesta primaria y secundaria se debe a que cuando un antígeno activa por primera vez a los linfocitos B, éstos tardan más en diferenciarse en células plasmáticas (responsables de la síntesis de Igs), a diferencia de lo que ocurre en la respuesta secundaria, que gracias a las células memoria el número de linfocitos sensibles es mayor y se alcanza más rápido el nivel de células plasmáticas.
2. Citoquinas
Las citoquinas son proteínas de bajo peso molecular sintetizadas y secretadas por diferentes tipos celulares del sistema inmune y células no inmunes (Aguirre de Avalos et al. 2002). Su denominación tiene que ver con las células que las producen, se llaman monocinas, las que son secretadas por macrófagos, linfocinas, por linfocitos o se denominan interleucinas las citoquinas secretadas por las células hematopoyéticas, también pueden ser producidas por otro tipo de células como las células endoteliales, epiteliales, del tejido conjuntivo y por leucocitos polimorfonucleares.
Las citoquinas son secretadas durante respuestas inmunológicas o como señal intercelular tras la estimulación de una de ellas (Sánchez Vizcaíno). Capaces de mediar e interactuar entre diferentes células, son responsables de la comunicación intercelular, regulan la función tanto de las células que las producen como también de células más alejadas. Su manera de actuar es uniéndose a receptores específicos, tanto de las células que las producen teniendo un efecto autocrino, como también uniéndose a receptores de células vecinas en donde su efecto es paracrino, o pueden diseminarse por el organismo afectando a células más alejadas y este efecto se denomina endocrino (Tizard 2009). Estas proteínas también actúan en la diferenciación celular y en funciones de proliferación, quimiotaxis, crecimiento y modulación de la secreción de inmunoglobulinas, interviene en la hematopoyesis. Su acción fundamental es la participación en la regulación del mecanismo de inflamación, existiendo citoquinas pro-inflamatorias y anti-inflamatorias. Asimismo, participan en muchos otros procesos biológicos.
Las citoquinas tienen diferentes cualidades, como producir múltiples efectos al actuar sobre diferentes células, también tiene la particularidad de poder ejercer el mismo efecto diferentes citoquinas, otra cualidad de las citoquinas es el sinergismo donde dos o más citoquinas producen un efecto sinérgico donde se potencian mutuamente. Por otro lado pueden bloquear o inhibir mutuamente sus efectos, produciendo antagonismo.
Desde que están disponibles las citoquinas producidas por ingeniería genética, muchos investigadores han estudiado su uso para tratar enfermedades. (Tizard 2009) Entre las citoquinas se incluye las interleuquinas (IL), los interferones (INF), y factor de necrosis tumoral (TNF).
a) Interferón
Los interferones fueron descritos por Isaacs y Lindenmann en 1957 (Ferreira; Schafield 1988). Son proteínas, pertenecientes a las citoquinas producidas en respuestas a la infección vírica o a la estimulación inmunológica (Tizard 2009). Generalmente la producción de los interferones es inducida por otras citoquinas. Su metabolismo y excreción se produce principalmente en hígado y riñones. Parte de su mecanismo de acción está definido por la capacidad de bloquear la réplica de ARN vírico e interferir en la producción de las proteínas del virus.
Existen dos tipos de interferones: de tipo 1 y de tipo 2. Al primer tipo pertenecen los interferones alfa y beta son los más importantes de este grupo, los interferones tau y omega son subtipos dentro del tipo 1 (Bosch 1999).
Los interferones de tipo 1 son principalmente antivirales y presentan actividad antiproliferativa, su papel secundario es el de inmuno-reguladores; muchos interferones pertenecientes a este grupo tiene un papel importante en el mantenimiento de la gestación (Tizard 2009).
Los interferones gama pertenecen al tipo 2, tienen una función principalmente inmuno-reguladora. En cuanto a la producción de los interferones podemos mencionar que los principales productores de interferón alfa son los linfocitos B, los linfocitos natural killer y los macrófagos. Si hablamos de interferón beta los principales productores son los fibroblastos, las células epiteliales y los macrófagos. Y por ultima los únicos productores conocidos de interferones gama son los linfocitos T, los macrófagos y las células natural killer. (Aguirre de Avalos et al. 2002).
La administración de interferones debería inhibir la replicación de los virus así como estimular algunas funciones celulares, como la actividad de los neutrófilos, promoviendo de ese modo la resistencia a la enfermedad, este último punto ha sido en parte el objeto el presente ensayo.
Se han utilizado interferones en el tratamiento de distintas enfermedades bovinas, como también se ha administrado en cerdos, los resultados obtenidos han sido positivos. El inconveniente que tiene el uso del interferón es la necesidad de administrarlos en dosis altas, ya que en tratamientos de enfermedades infecciosas a pesar de dar respuestas positivas produce efectos secundarios tóxicos (dosis tóxicas). (Tizard 2009).
Lo que se ha buscado en el presente ensayo a través de la aplicación del interferón alfa y beta es una vía alternativa de inmunidad. Los interferones alfa y beta tienen la misma función, pero difieren en la forma de estimulación. Así, se buscó un efecto mimético con el IFN gama bovino a modo de favorecer la mitosis en la expansión clonal de LT y LB. El uso de IFN tiende a reforzar el perfil TH1 el cual va a promover la respuesta celular en mucosas.
b) Interleuquinas
Las interleuquinas son un conjunto de citocinas, que estimulan la proliferación, y diferenciación de células inmunes. Estas citocinas se numeran secuencialmente según el orden de su descubrimiento y se nombran numéricamente, IL-1, IL-2, IL-3 sucesivamente. Hasta el 2007 se habían descrito treinta y cuatro (34) interleuquinas diferentes (Tizard 2009). Las células que segregan interleuquinas son, los macrófagos IL-1, IL-6, IL-8, IL-10, IL-12, IL18), células B(IL-10,il-12), células Th1 (IL-2), células Th2 (IL-4,IL-5,IL-6,IL-9,IL-10,IL-13), mastocitos (IL-4), células dendríticas (IL-6,IL-12,IL-13,IL-18,IL-23,IL-27), neutrófilos (IL-1,IL-8,IL-10,IL-12) y las NK (IL-2), entre otras. La función principal es regular los eventos de las funciones de las células del sistema inmune, como la activación, diferenciación o proliferación, la secreción de anticuerpos, la quimiotaxis, regulación de otras citocinas y factores, etc. (Taleisnik 2006).
La IL 2 provoca una cascada de efectos inmunomoduladores, incluyendo la activación de células T y la expansión, la estimulación de las células presentadoras de antígenos, la secreción de citocinas proinflamatorias, y el aumento de la función celular de las NK y las killer activadas por linfocinas. Las IL-2 son necesarias para el establecimiento de la memoria inmunitaria celular, así como para el reconocimiento de auto antígenos y antígenos extranjeros. (Tizard 2009)-
La IL2 es una CPA, al vacunar a los animales con esta citocina, lo que se busco es amplificar la especificidad. Las inmunoglobulinas están presentes en mayor concentración en mucosas, las inmunoglobulinas A se encuentran en mayor concentración en la mucosa ocular. Asimismo, con IL2 que se busco favorecer la mitosis de los LB y estos indirectamente que pudieran favorecer la aparición de IgA.
c) Bacterina
Los objetivos de la aplicación de una vacuna son, imitando la enfermedad natural, estimular las células específicas del sistema inmunológico y también estimular la memoria inmunológica de las células, de esta forma, cuando la enfermedad se presente, el sistema inmunológico da una respuesta rápida y eficaz (Pfizer Animal Health 2001). Las vacunas están compuestas por antígenos, éstos son sustancias extrañas al organismo, que pueden unirse a los receptores de superficie de los linfocitos, induciendo a una respuesta inmune (Tizard 2009). Al hablar de bacterina estamos hablando de un inmunógeno bacteriano, elaborado a partir de cepas de bacterias patógenas muertas o inactivadas por métodos físico / químicos.
Si bien restringidas para el control de otras enfermedades, existen vacunas vivas atenuadas, donde la bacteria conserva su poder patógeno permitiendo estimular una respuesta inmune de mayor intensidad al de la vacuna inactivada. La ventaja de la bacterina es que es más estable y segura a comparación con la bacteria viva atenuada. (Sánchez Vizcaíno).
En el caso particular de la M. bovis, es una bacteria de naturaleza proteica, lo que les confiere la capacidad para actuar como antígenos en vacunas al inactivarse, y así generar anticuerpos capaces de neutralizar su acción. Los pilli también pueden actuar como componentes antigénicos, ya que son de naturaleza proteica. Los anticuerpos generados por éstos logarían impedir que la M. bovis se adhiera a la superficie, colonice y produzca toxinas, y de esta manera evitarían el desarrollo de la enfermedad (Zielinski 2005). Pero como mencionamos anteriormente la bacteria tiene desarrollado un sistema para evadir los anticuerpos, por lo tanto no bastaría la prevención solo con un buen antígeno.
El uso de la bacterina elaborada a partir de cepas patógenas de M. bovis inactivada, tuvo por motivo el de estimular el sistema inmune de los animales a los que fueron administrado, con el propósito de generar una barrera inmunitaria a través de anticuerpos para el momento del desafío.
II. OBJETIVOS PLANTEADOS
A partir de lo expuesto anteriormente se plantean los objetivos que dieron origen a este ensayo:
- Evaluar la efectividad preventiva de una bacterina coadyuvada con una citocina, inoculada sobre la conjuntiva ocular de bovinos, desafiados experimentalmente con una cepa patógena de M. bovis;
- Analizar la evolución de la respuesta inmunitaria local y sistémica evaluando si el conjugado bacterina/citocina exhibió ventajas sobre un grupo instilado con bacterina frente a un grupo testigo tratado con un placebo;
- Analizar la presencia del patógeno y su correspondencia con parámetros clínicos encontrados, la severidad y la magnitud de las lesiones y los recuentos hematológicos.
III. MATERIALES Y MÉTODOS
Este estudio experimental tuvo una etapa de trabajo a campo realizado en el establecimiento “La Espadaña” ubicada en la ciudad de Verónica, partido de Punta Indio, provincia de Buenos Aires. Otra etapa fue ejecutada en Laboratorio de Sanidad Animal de la Facultad de Ciencias Agrarias de la Pontificia Universidad Católica Argentina.
A. Diseño experimental
Los animales sometidos a ensayo fueron seleccionados al azar a partir de una población de ciento cuarenta (140) terneras de recría. Antes de iniciar el ensayo todos los animales fueron desparasitados con la combinación de sales bencilmidazólicas y avermectinas, respetando el manejo del establecimiento. El manejo sanitario que se realizó en el establecimiento a todos los reproductores a partir del destete, fue la inmunización contra enfermedades virales reproductivas, como IBR y DVB, aplicando refuerzos antes de la temporada de servicios.
El trabajo se realizó sobre un grupo seleccionado de treinta y cuatro (34) terneras de recría, raza Aberdeen Angus, clínicamente sanas. Las condiciones de explotación para todo el grupo sometido a ensayo eran las mismas, el peso oscilaba entre 160 kg y 185 kg, y la edad estaba comprendida entre once y doce meses, todas las terneras se encontraban en un lote de pastizal natural.
Del lote seleccionado se conformaron tres (3) grupos de terneras, homogéneos, realizándose la asignación de los tratamientos a cada unidad experimental de manera aleatoria. Quedando así un grupo testigo (Grupo T, 12 terneras), un grupo instilado en la conjuntiva ocular con el conjugado bacterina/citocina (Grupo B, 11 terneras) y otro grupo al cual se le aplico bacterina (Grupo A, 11 terneras). Se obtuvieron muestras oculares y de sangre de todos los treinta y cuatro (34) animales, antes del comienzo del ensayo.

1. Obtención de la bacterina de M. bovis spp
La preparación de bacterina de Moraxella bovis se llevó a cabo en el laboratorio de sanidad animal de la Facultad de Ciencias Agrarias de la Pontificia Universidad Católica Argentina (UCA). Se procedió a la elaboración de una bacterina mixta a partir de tres (3) cepas producto de aislamientos de campo identificadas como Moraxella bovis por el Laboratorio de Sanidad Animal de dicha Unidad Académica (Mx Chajarí, Q8 Tandil, EPP63). Estas cepas fueron conservadas a -80°C, luego de descongeladas se procedió a su cultivo en agar base sangre bovina al 5% y se incubaron a 37°C durante 48 hs. Luego de la incubación, las colonias desarrolladas se resuspendieron en 10 ml. caldo cerebro corazón (BHI). A partir de este procedimiento se realizó su cultivo progresivo en medio líquido BHI en volúmenes crecientes, a 37°C, con agitación y aireación intensa, hasta un volumen final de cultivo de 10 lts.
Se tomaron muestras para verificar la identidad del cultivo al final del período de incubación de 48 hs., posteriormente se inactivaron con formaldehido a una concentración final de 0,5%, manteniéndolo a 37°C durante 48 hs, con agitación. Luego de esto se tomaron muestras para verificar la inactivación. Posteriormente se procedió a la concentración de los cultivos por centrifugación a 5000 rpm durante 30’ y posteriormente se resuspendieron los sedimentos obtenidos en solución buffer fosfato pH 7.2 (PBS).
Se ajustó la concentración de cada una de las suspensiones en 1010 bacterias/ml según referencia nefelométrica (curva de Mc Farland), mediante agregado de PBS. Se utilizó como conservante de las suspensiones obtenidas formaldehido concentración final 0,2%. El producto final constituye la bacterina que se aplico en uno de los grupos.
2. Obtención de la citokina
Se utilizó una solución compuesta de IL2 recombinante humano e interferón α y β recombinante humano. La dosis de 1 ml de esta solución estaba compuesta por:
- 300.000 UI de INF α.
- 300.000 UI de INF β.
- 50 microgramos (μg) de IL2.
La obtención de la citokina se llevó a cabo en el Centro de Inmunoterapia Veterinaria® (CIV).
3. Obtención de la suspensión bacteriana de M. bovis
La metodología utilizada siguió el siguiente protocolo: a partir de cada una de las cepas utilizadas para la preparación de la bacterina, se realizaron cultivos en medio sólido utilizando botellas de Roux conteniendo agar base sangre enriquecido con 5% de sangre bovina estéril, incubándolas a 37º C durante 48 hs. Se utilizó caldo cerebro corazón (BHI) como solución para el lavado del desarrollo bacteriano en superficie. Se recolectaron las suspensiones bacterianas en un recipiente estéril, ajustando su concentración final a 1010 bacterias/ml según referencia nefelométrica (curva de Mc Farland), mediante agregado de PBS.
Finalmente se obtuvo es la suspensión que constituye el desafío que se aplicó por aspersión en la conjuntiva ocular de todos los animales del ensayo.
4. Inoculación
Luego de la obtención de la bacterina, la citocina y la suspensión bacteriana se procedió a las inoculaciones correspondientes en los diferentes grupos del ensayo.
Se inoculó a un grupo de terneras con la bacterina de M. bovis (Grupo A), a otro grupo con el conjugado citokina/bacterina (Grupo B), a ambos grupos aplicándole doble dosis separadas por tres semanas. Al tercer grupo se lo trato con un placebo de solución fisiológica buffereada de cloro de sodio estéril.
La inoculación en los tres grupos fue realizada por atomización en los dos ojos. En el caso del conjugado, primero se atomizó con la bacterina e inmediatamente después se aplicó la citokina. A los cuarenta y cinco (45) días posteriores de este suceso se realizó el desafío con la suspensión bacteriana obtenida de la manera descrita anteriormente. Los treinta y cuatro (34) animales volvieron a los potreros donde se encontraron a lo largo de todo el ensayo hasta su finalización.
5. Muestreo
A lo largo del ensayo se tomaron muestras de las conjuntivas oculares de todos los animales del ensayo mediante hisopados de ambos ojos, también se tomaron muestras de sangre, se determino el valor del pH de las estructuras locales, se realizaron improntas en ambos ojos de los animales implicados, y se determinó el peso vivo de cada animal, estas muestras fueron tomadas a los 15, 21, 24, 27, 30, y 33 días de iniciado el ensayo. En dos fechas se observaron las lesiones oculares.
a) Toma de sangre
La sangre fue extraída directamente de la vena coccígea media, se recolectó en tubos que contenían anticoagulante E.D.T.A..
Preparados comerciales con gotero: 2 4 gotas de E.D.T.A. al 10 % por cada 5 ml. de sangre. A partir de las muestras de sangre se realizaron recuentos celulares y determinación de hematocrito.
b) Determinación del peso vivo de las terneras
La variable ganancia de peso se tuvo en cuenta como un indicador indirecto, tomándose el peso de todos los animales antes, durante, después de finalizado el ensayo. Los tres grupos seleccionados comenzaron en el ensayo con pesos similares constituyendo grupos de peso homogéneos.
Esta variable se valorizó conociendo las características de la queratoconjuntivitis, sabiendo que la molestia de los animales por las lesiones y el malestar puede derivar en una mala alimentación, disminución del apetito, dificultad por parte del animal para la elección de pastoreo y de más factores que proviene indirectamente de la enfermedad.
c) Hisopado
Determinación de la actividad de la Inmunoglobulina A (IgA) en film lacrimal: El fin de esta determinación fue identificar la concentración en el film lacrimal de inmunoglobulinas (Ig A), y de esta manera evaluar la respuesta inmunitaria local a partir de los hisopados bilaterales de cada animal.
Los hisopados obtenidos a campo se suspendieron en tubos que contenían 1 ml de solución salina tamponada (PBS). A cada tubo se adiciono azida sódica como conservante en una concentración de 0.01 %. Las muestras hasta el momento de la utilización en el laboratorio se conservaron a -70 °. El método que se utilizo en el laboratorio es el método Single Radial Immunodiffusion VMRD Inc. que indica la concentración de Ig A, a través de un medio de cultivo especial contenido en una placa rectangular en concentraciones conocidas.
d) Recuperación del patógeno
Una vez finalizado el ensayo, se procedió a recuperar el patógeno, posteriormente se cultivó y se desarrolló en el laboratorio, satisfaciendo así los postulados de Koch Se tomaron muestras de conjuntiva ocular de los animales al azar tanto de inmunizados como testigos, mediante hisopado de ambos ojos de cada animal. Se realizó la recuperación del patógeno a partir de los focos de infección que fueron apareciendo a lo largo del ensayo.
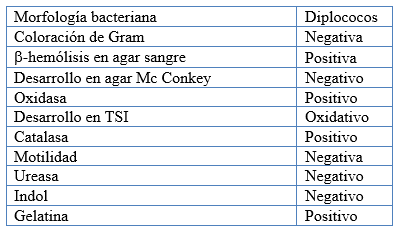
Luego de obtener una muestra de el film lacrimal, los hisopos fueron conservados en medio Stuart y enviados al laboratorio para su cultivo dentro de las 6 hs. de su extracción, se conservaron durante su traslado a 4°C. Se realizo el cultivo de los hisopados en agar base sangre bovina al 5%, incubándose a 37°C durante 48 hs. Luego se procedió a la observación y estudio de las colonias desarrolladas, y de esta manera identificar M. bovis entre las especies presentes. Para esto se tomo como criterio de identidad positivo a M. bovis el siguiente perfil microbiológico:
Perfil microbiológico:
e) Toma de pH de la conjuntiva ocular
Al total de animales y en forma individual se procedió a la determinación del valor del pH para cada uno de los momentos en que se realizaron los muestreos.
f) Improntas
Durante los muestreos se realizaron improntas conjuntivales, se procedió a colocar portaobjetos directamente sobre los ojos de las terneras, con el objetivo de evaluar la presencia celular y la identificación de linfocitos.
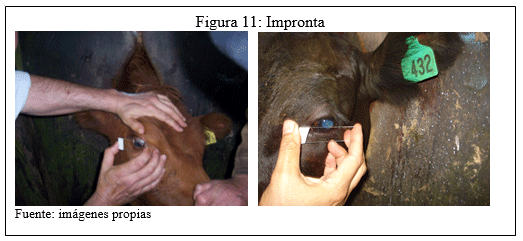
g) Clasificación de las lesiones oculares
Se elaboró una tabla de puntajes (score) de acuerdo a presencia o no de lesiones en las estructuras oculares. El procedimiento consistió en observar las lesiones en las estructuras oculares de las terneras y, para clasificarlas se estableció la tabla asignando un score (un valor numeral) de acuerdo al grado de las manifestaciones clínicas de cada animal, en un ojo o en ambos para todas las terneras, teniendo en cuenta la presencia, magnitud y severidad de las lesiones encontradas.
En los ojos de los animales se colocó fluoresceína, cuya función fue facilitar la detección de las lesiones corneales. Se fueron tomando todos los valores hallados a lo largo del ensayo, a partir de iniciado el desafío, de esta manera se logró establecer y orientar una tendencia de la respuesta inmunitaria local ante la actividad del patógeno. Se tuvieron en cuenta dos fechas puntuales: a la tercera semana y a los cuarenta y cinco días (45) de iniciado el desafío con la cepa patógena.
Referencia tabla de score y puntaje:

Análisis estadístico
Se realizó el análisis de la varianza (ANOVA) bajo el Diseño de medidas repetidas comparando las medias poblacionales de los tres tratamientos, en cada tiempo y para cada variable respuesta. Se asumieron como factores claves el tratamiento y el tiempo transcurrido. Fueron consideradas como evidencias el recuento de glóbulos blancos, porcentaje de hematocritos y peso vivo.
Se planteó una hipótesis acerca si existían diferencias significativas entre las medias poblacionales, correspondientes a las variables, glóbulos blancos, hematocritos y peso vivo, de los tres grupos de tratamientos. El diseño de medidas repetidas fue utiliza en una misma unidad experimental. Este diseño proporcionó información sobre las tendencias mostradas a lo largo del tiempo para las diferentes mediciones en los tres grupos sometidos a ensayo.
El modelo estadístico según el Diseño de Medidas Repetidas para este estudio fue el siguiente:
yijk = µ + ai + bj(i) +gk + agik + eijk
Donde:
- yijk es la respuesta de cada individuo a cada tiempo (recuentos de glóbulos blancos, porcentaje de hematocritos y peso vivo)
- µ es la media de la respuesta de la población de vaquillonas
- aies el efecto fijo del tratamiento i
- bj(i)es el efecto aleatorio del individuo anidado en tratamiento
- gkes el efecto del tiempo k
- agik es el efecto de la interacción Tratamiento-tiempo
- eijkes el error aleatorio
Las hipótesis derivadas del modelo estadístico son las siguientes:
- Ho: agik = 0 es decir no hay interacción tratamiento-tiempo (Prueba de paralelismo)
- Ho: ai = 0 o bien µ1. = µ2. es decir no hay efecto de los tratamientos
- Ho: gk = 0 o bien µ.1 = µ.2 = µ.3= µ.4 es decir no hay efecto del tiempo
Previo al análisis de la varianza, se verificaron los supuestos del modelo:
Las muestras fueron aleatorias e independientes, las terneras fueron elegidas al azar dentro de una población de ciento cuarenta (140) vaquillonas.
El supuesto de normalidad de los errores se verificó con los gráficos de QQ plot y los histogramas. (Ver resultados)
El supuesto de Homogeneidad de varianza se verificó con los diagramas de dispersión. (Ver resultados).
Para el análisis de la varianza se utilizó el software estadístico Infostat. Se trabajó con un nivel de significación del 5 %.
IV. RESULTADOS
Se probaron los supuestos del modelo, diseño de medidas repetidas, antes de realizar el análisis de la varianza.
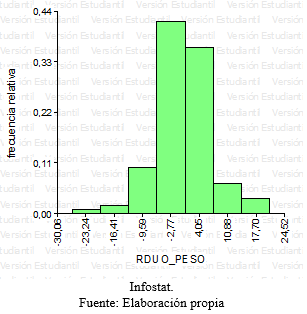
Se realizaron gráficos, histogramas, verificando que los datos provenían de una población con distribución normal. Para cada residuo de las variables respuestas se realizó un QQ plot y un grafico de histograma, para ser más certeros con respecto a la distribución normal de las respuestas, ya que los gráficos de QQ plot podían generar vacilaciones con respecto a la normalidad.
Grafico 1: QQ plot- Residuos hematocritos
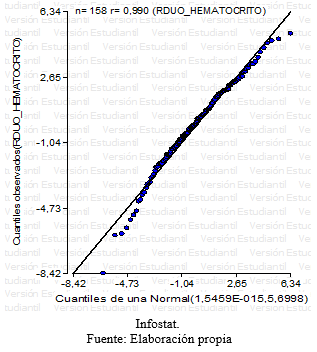
Grafico 2: Histograma – Residuos Hematocrito
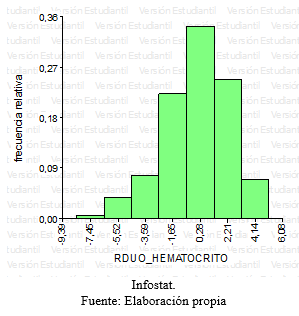
Grafico 3: QQ plot- Residuos globulos blancos
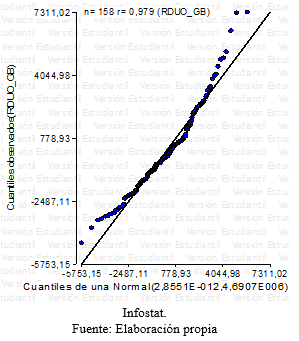
Grafico 4: Histograma-Residuos glóbulos blancos.
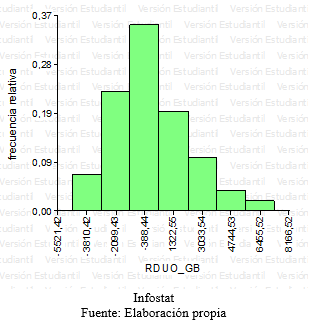
Grafico 5: QQplot – Residuos peso
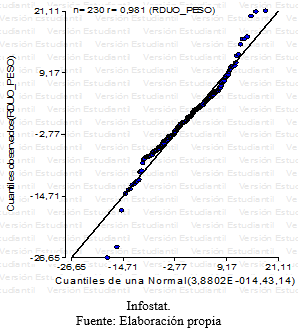
Grafico 6: Histograma-Residuos peso.
Se realizaron diagramas de dispersión verificando la homocedasticidad de los errores, para cada variable respuesta
Grafico 7: diagrama de dispersión- residuos vs predichos para la variable hematocrito
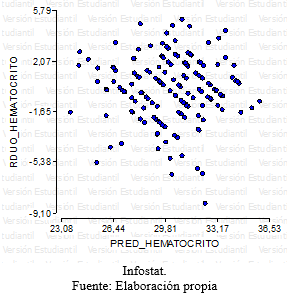
Grafico 8: diagrama de dispersión- residuos vs predichos para la variable glóbulos blancos
Grafico 9: diagrama de dispersión- residuos vs predichos para la variable glóbulos blancos
Ya comprobados los supuestos, el análisis de la varianza dio como resultado lo siguiente:
a) Toma de sangre
Técnicas de laboratorio:
- Método del hematocritos
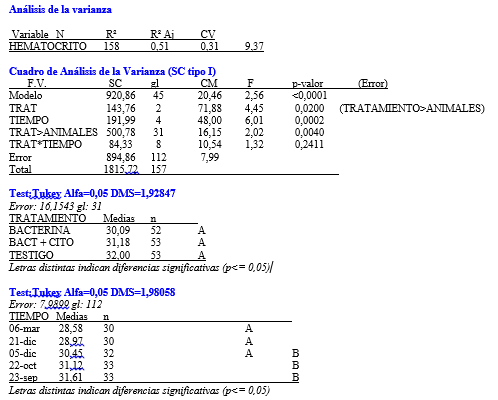
Grafico 10: Comparación del hematocrito para los diferentes tratamientos en función del tiempo.
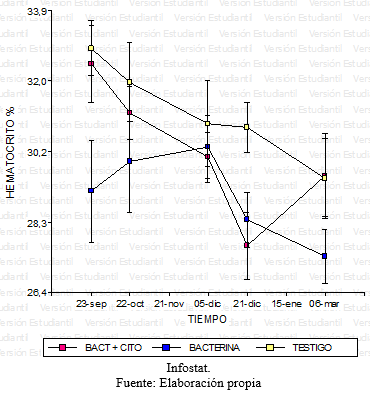
Grafico 11: Comparación del hematocrito para los diferentes tratamientos.
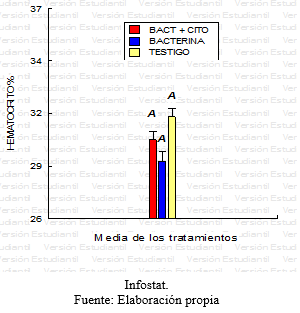
Grafico 12: Comparación del hematocrito para los diferentes tiempos
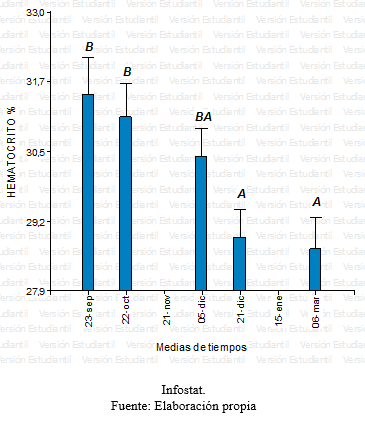
En base el diseño de medidas repetidas, se realizó un análisis de la varianza para la variable respuesta definida en el Hematocrito. No se encontró evidencia de interacción significativa entre los factores tratamiento y tiempo, en un primer momento se encontraron sólo diferencias marginales (p<0,02) entre los tres tratamientos para esta variable. Al realizar el test de Tukey se halló que estas diferencias no eran estadísticamente significativas, teniendo en cuenta las medias de cada tratamiento (grafico 11). Sin embargo, a lo largo de las series cronológicas entre las diferentes fechas se encontraron diferencias estadísticamente significativas (Grafico 12). Estas diferencias entre la última fecha y la primera fue aproximadamente 3%, ocurriendo un descenso gradual desde el inicio del ensayo hasta el final con diferencias diarias mínimas. Este descenso se verificó en los tres tratamientos en forma similar.
- Recuento de glóbulos blancos
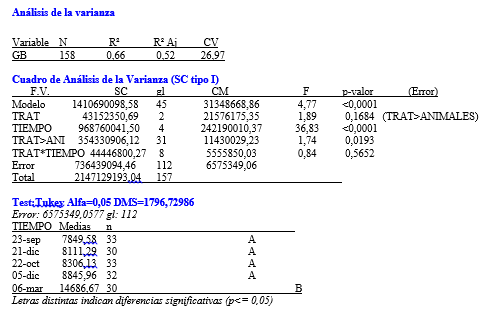
Grafico 13: Comparación de los glóbulos blancos para los diferentes tratamientos en función del tiempo.
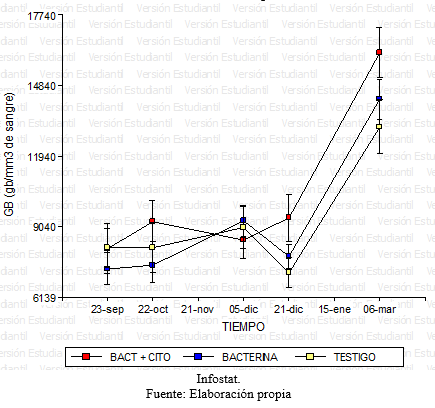
Grafico 14: Comparación de los glóbulos blancos para los diferentes tiempos.
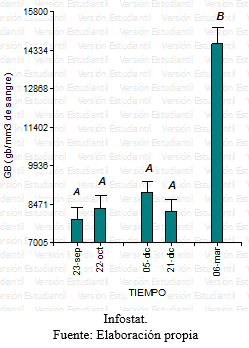
Para la variable glóbulos blancos luego de no encontrarse evidencia de interacción significativa entre los factores tratamiento y tiempo, se halló que no había diferencia estadísticamente significativa entre los tres tratamientos. No obstante se evidenciaron diferencias a lo largo de las series cronológicas, entre el inicio y el final, con un aumento en todos los animales de los tres tratamientos. (Grafico 13 y 14).
- Formula leucocitaria
La formula leucocitaria no se analizó estadísticamente, ya que el método adecuado a utilizar es demasiado complejo.
b) Determinación del peso vivo de las terneras
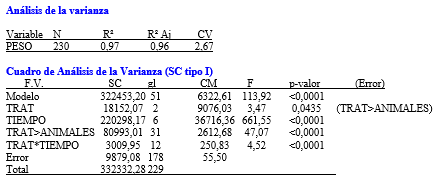
Grafico 9: Peso de cada tratamiento en función del tiempo
Con respecto a la variable peso, se vio al realizar el análisis de la varianza que había interacción entre los factores tratamiento y tiempo, y que la diferencia entre los tratamientos era significativa (p<0, 05). Luego de estas evidencias, se efectuaron mediciones simples para tres tiempos diferentes, uno inicial (23 de septiembre) un tiempo medio (05 de diciembre) y el tiempo final (06 de marzo). Al inicio del ensayo como era de esperar no se encontró diferencia significativa entre los pesos de los animales para los tres tratamientos, encontrando diferencias en la fecha media y al final del ensayo. También se pudo observar que hubo un aumento progresivo de peso en todos los animales. Sin embargo, se asumió que la ganancia promedio de pesos estuvo influenciada por diferentes factores, como la receptividad del campo, condiciones de carga animal, manejo y condiciones climáticas desfavorables. Al tener estos factores un impacto directo sobre la interpretación de la diferencia de peso, no permitió explicar que la diferencia fuera debida a las condiciones del desafío para los tres grupos.
c) Hisopados
Los resultados que se obtuvieron con el método utilizado no fueron significativos, probablemente esto fue debido a la baja sensibilidad del método o a la dilución en 1 ml en PBS del hisopado obtenido en el campo, ya que no se encontraron concentraciones entre 50 y 400 mg/ 100 ml (rango del método).
d) Recuperación del patógeno
Se lograron recapturar en todos los casos al patógeno M. bovis en los tres grupos; una recuperación del patógeno del grupo bacterina, una del grupo conjugado y del grupo testigo se recuperó de cinco (5) animales. Coincidiendo estas colonias desarrolladas de M. bovis., con el perfil de identidad microbiológico expuesto anteriormente. En la siguiente tabla se muestran los animales que han dado positivos a M. bovis.
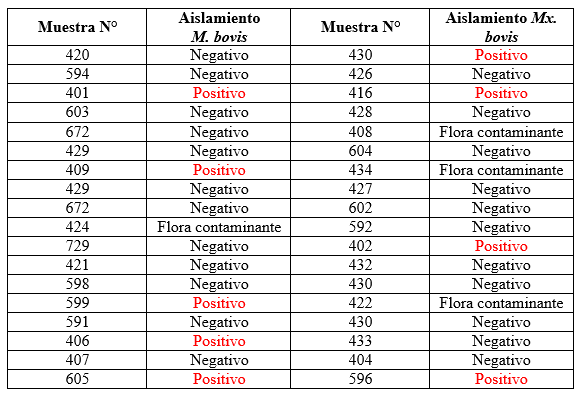
Seis (6) animales con caravanas Nº 409, 599, 406, 430, 416, 596 pertenecían al grupo testigo, dos (2) animales con caravanas Nº 605 y 402 fueron inoculados con la bacterina y el animal con caravana Nº 401 perteneció al grupo conjugado. Quedando demostrado que en el grupo testigo se pudo obtener la M. bovis en mayor número de casos.
e) pH en el film lacrimal
A lo largo del ensayo los valores arrojados en los muestreos de pH se mantuvieron entre 6 y 6, 5 de manera constante. No presentando diferencias entre los ojos lesionados y los ojos sanos.
f) Improntas
Los resultados obtenidos con las improntas no fueron significativos, ya que al analizar las observaciones celulares por microscopía directa no fueron relevantes.
g) Clasificación de las lesiones oculares
Como fue explicado anteriormente se realizaron en dos fechas diferentes observaciones en las estructuras cornéales de las terneras, clasificando las lesiones encontradas de acuerdo al grado de manifestaciones, su severidad y magnitud, asignándole un puntaje o “score”.
Primera observación luego del inicio del desafío a las tres (3) semanas: de todos los animales sometidos al ensayo se observó que el 30 % presentaba lesiones evidentes en las estructuras oculares:
a) En el grupo inoculado con bacterina (GA) presentó un (1) animal con lesión congestiva purulenta, nube y úlcera corneal. La severidad de la lesión fue en ambos ojos. El score para este grupo fue de 4.50 puntos.
b) En el GB (grupo con el conjugado) se registraron dos (2) animales con congestión conjuntival y nube corneal, en ambos casos fue afectado un sólo ojo. Para este grupo la magnitud y severidad de las lesiones no fueron clínicamente significativas logrando un score de 1.50 puntos.
c) El grupo testigo (GT), se registró un (1) animal con úlceras cornéales severas bilaterales logrando un score de tres (3) puntos.
Se puede concluir que los tres grupos presentaron lesiones en alguna de las estructuras oculares, en el grupo testigo, estas lesiones fueron más evidentes y severas. Y de los animales inmunizados el grupo bacterina presentó lesiones de mayor severidad. El grupo con el conjugado tuvo lesiones menores, presentándose en un sólo ojo nubéculas y congestión oculares.
La segunda observación se realizó a los cuarenta y cinco (45) días después de iniciado el desafío, encontrándose:
Del total de los animales un valor superior al 45% presentaron lesiones de distinta magnitud en sus estructuras oculares:
a) El grupo GA presentó en cuatro (4) animales, dos (2) úlceras bilaterales, uno (1) con conjuntivitis mucopurulenta y otro con nubes cornéales bilaterales. El score fue de 11.50 puntos.
b) En el grupo GB se encontró un (1) animal con úlcera corneal unilateral y otro con nube corneal también en un sólo ojo. Este grupo presentó lesiones en menor número de animales y de menor magnitud y severidad que los otros grupos, el puntaje asignado fue de 5.50 puntos
c) El grupo GT presentó nueve (9) animales con lesiones severas, desde congestión mucopurulenta a úlceras cornéales. Dos (2) animales con úlcera corneal, uno (1) con opacidad corneal completa, dos (2) con nubes cornéales y cuatro (4) con conjuntivitis purulenta. En todos los casos las lesiones fueron bilaterales. En este caso el puntaje para este grupo fue 15 puntos.
Score:

Observando el puntaje total que obtuvieron los diferentes grupos a lo largo del ensayo podemos ver una tendencia en las lesiones (manifestaciones clínicas), demostrando que el grupo inoculado con el conjugado (bacterina + citocina) tuvo una mejor respuesta inmune local con respecto a los dos grupos restantes.
V. DISCUSIÓN
A lo largo de este trabajo experimental se buscó evaluar la eficacia preventiva del conjugado bacterina/citocina recombinante humana utilizado como método preventivo ante la infección experimental con cepas patógenas de Moraxella bovi. Comparándolo frente a un grupo inmunizado con bacterina y un grupo testigo, analizando primordialmente el comportamiento de inmunidad local y sistémica.
Las lesiones oculares fueron halladas en los tres grupos involucrados en el ensayo. En la primer observación, a las tres semanas del desafío el 30 % de los animales presentaban lesiones, a los 45 días del desafío, el porcentaje de manifestaciones clínicas había aumentado a un 45 % y estas lesiones eran más severas y de mayor magnitud. Las lesiones más importantes fueron halladas en el grupo sin tratamiento.
Los resultados estadísticos, respecto al recuento de glóbulos blancos permitieron observar la ausencia de diferencia entre los tres grupos, teniendo en cuenta la recaptación del patógeno y las manifestaciones clínicas donde el grupo no inmunizado, el grupo testigo presento mayor severidad y magnitud en las lesiones. Se puede inferir observando los valores de los recuentos de glóbulos blancos que las diferencias no fueron estadísticamente sensibles pero sí pudieron observarse diferencias desde el punto de vista biológico (magnitud y severidad de las lesiones oculares).
VI. CONCLUSIONES
Son muchos los indicios que hay que observar para llegar a una conclusión, ya que se realizaron muchas pruebas, por esta razón en el caso de los resultados obtenidos de las series blancas donde las diferencias estadísticas no eran significativas. Sin embargo se concluyó que desde el punto de vista biológico se evidenciaron diferencias entre los tres grupos, indicando que en el grupo con el conjugado se obtuvo un recuento de glóbulos blancos mayor, siguiendo el grupo tratado con la bacterina y por último el grupo testigo fue el que menor recuento tuvo.
Esto nos revela que los grupos inmunizados tuvieron mayor reacción celular y el grupo tratado con la bacterina y citocina se diferenció teniendo una mayor estimulación de la respuesta inmunitaria, siendo el grupo testigo el que menor estimulación tuvo.
Se llega a esta conclusión teniendo en cuenta que el grupo del conjugado tuvo un menor número de animales afectados al compararlos con el grupo testigo y el grupo bacterina, comprobado esto con las lesiones encontradas, y con la recuperación del patógeno y su posterior desarrollo en el laboratorio. Esto permite concluir que el conjugado bacterina/citokina generó una respuesta de inmunidad local diferente a las los otros dos grupos.
Hay que tener en cuenta que los factores de esta enfermedad como ya se han mencionados, son muchos. El establecimiento donde se desarrolló este trabajo contaba con un plan sanitario contra IBR, un factor importante predisponente y que puede agravar un cuadro de queratoconjuntivitis.
VII. BIBLIOGRAFÍA
- Bosch P., Bosch R. Reconocimiento materno de la preñez en rumiantes. Monografías de medicina veterinaria, vol. 19 N°1 y N°2. Rio Cuarto, Córdoba, 1997-1999.
- Cobo A, Leaniz G y C Gil-Turnes. (1985) Queratoconjuntivitis infecciosa bovina y queratoconjuntivitis ovina en el Uruguay XII Jornadas Uruguayas de buiatría. Paysandú, R.O.U.
- Coffin L. David. Laboratorio clínico en medicina veterinaria. 2da ed. Mexico. Editorial La Prensa Médica Mexicana, 1977. Pp 148-161.
- George L. Clinical infectious bovine keratoconjuctivitis (1984) Comp. Cont. Educ. Pract. Vet., Vol6: S712-S720.
- Kopecky K, Pugh G and T McDonald. Infectious bovine keratoconjunctivitis: Contact transmission.1986. Am.J.Vet.Res., 47: 622-624.
- Knop, Erich; Knop, Nadja. (Mar 2005) The role of eye-associated lymphoid tissue in corneal immune protection. Journal Anatomy v. 206 (3): 271-285
- Kopecky K, Pugh G and T McDonald. Infectious bovine keratoconjunctivitis: Contact transmission(1986) Am.J.Vet.Res., 47: 622-62
- Fiorentino, A; Peralta, M; Odeón, A; et col. (2001) Lesiones oculares en terneros con queratoconjuntivitis infecciosa bovina infectados experimentalmente y en forma natural con Moraxella bovis. Revista de Medicina Veterinaria Vol. 82 N° 3: 166-170.
- Ian R. Tizard. Señalización celular: las citoquinas y sus receptores. En Introducción a la Inmunología Veterinaria 8va ed. Ediciones El Sevier Español s.r.l 2009 pag.71-79.
- Ian R.Tizard. Fármacos y otros agentes que afectan al sistema inmune. En Introducción a la inmunología Veterinaria 8va ed. Editorial El Sevier Español s.r.l 2009 pág. 487-488.
- Lázaro, Reinaldo;González; Xiomara, Enrique; Betáncourt, A et col Aislamiento de Moraxella bovis en terneros afectados de queratoconjuntlvitis. Veterinaria Tropical. 1993. Vol. 18: 39-44.
- Nayar P.S.G., Saunders J.R. Infectious Bovine Keratoconjuntivitis II. Antibodies in Lacrimal Secretions of Cattle Naturally or Experimentally infected with Moraxella bovis. Diario Canadiense de investigación veterinaria, Vol. 39.Canada, Enero 1975.
- Odeón, A. y Paolicchi, F., INTA Balcarce - Combessies, G., Laboratorio Azul S.A. - Margaritte, J., Biogénesis S.A. 2005. Expochacra. Documento INTA EEA Balcarce. Ruta 226 Km 73,5 (7620) Balcarce, Buenos Aires, Argentina.
- Paolicchi F, Casaro A y Odeón A. Evolución de las lesiones oculares en bovinos infectados con Moraxella bovis. 1998. Revista de Medicina Veterinaria. 79: 410 – 416.
- Pugh GW Jr; Hughes, DE. Bovine infectious keratoconjunctivitis: carrier state of Moraxella bovis and the development of preventive measures against disease. American Journal Veterinary Association. 15;167(4): 310-3 Aug 1975
- Pugh GW Jr; McDonald TJ; Larsen, AB. Experimentally induced infectious bovine keratoconjunctivitis: potentiation of a Moraxella bovis pilus vaccine's immunogenicity by vaccination with Mycobacterium paratuberculosis bacterin. American Journal Veterinary Research 1986 Oct;39(10):1656-61
- Schalm O.W., Jain N.C., Carrol E.J. Hematologia Veterinaria Argentina. 1° ed., Argentina. Editorial Hemisferio sur s.a, 1981. Pp 42-63.
- Taleisnik S. Receptores celulares y la Transduccion de señales. 1era ed.Argentina. Grupo Editor Encuentro, 2006. Pp 97-104.
- Zielinski G., Descarga C., Piscietelli G. Sanidad en invernada: Parasitosis gastrointestinal, queratoconjuntivitis infecciosa, enfermedades virales, plan sanitario. Córdoba, 1997. Agro 2 de Córdoba cap. 6:141-164
Fuentes de información de internet:
- Brandan N.. Citoquinas. Bioq. Quintana R., Aguirre de Avalos MV. [publicación en línea]: Universidad Nacional del Nordeste. Facultad de medicina, 2002. Disponible desde internet en Http://www.med.unne.edu.ar/catedra/bioquimicaanterior/citoquinas.pdf. [con acceso el 03-05-2010].
- Centro de Inmunoterapia Veterinaria® (CIV). http://www.cancer-perros-gatos.com.ar/index.asp
- Gonzalez Álvarez R., Rodríguez Z., Alonso González Y.Citocinas anti-inflamatorias y sus acciones y efectos en la sepsis y el choque séptico. [publicación en línea]. Revista Electrónica de Veterinaria, vol. 10 N°8, Agosto 2009. http://www.veterinaria.org/revistas/redvet/n080809.html [con acceso 28-10-2010].
- Quinteros Cornejo G. Libro de enfermedades infecciosas. [publicación en línea]. [México]. Queratoconjuntivitis infecciosa bovina, pág. 153-154. Disponible en internet en Http://www.scribd.com/doc/20575568/Libro-enfermedades-infecciosas-en-veterinaria [con acceso el 30-04-2010].
- Ferreira A., Schafield L. Evaluación de la actividad de anticuerpos, interferon y células inmunocompetentes contra parásitos intracelulares. Revista Avances en Medicina veterinaria, vol. 3 N°1 , Enero- Junio 1988 [publicación en línea]. Chile. Disponible desde internet en Http://www.avancesveterinaria.unichile.cl [con acceso el 28-04-2010].
- 6. Cómo funcionan las vacunas. [publicación en línea]. Pfizer Animal Health. Revista hereford, Bs As. 2001. Disponible desde internet en Http://www.produccion-animal.com.ar [con acceso el 28-04-2010]
- [s.n]. Efecto de la administración de un compuesto inmunomodulador como adyuvante en la vacunación frente a la enfermedad Aujeszky. [publicación en línea]. Mayo, 2001. Disponible desde internet en Http://www.e-campo.com/?event=news.print&id=BEE94D19-4EGF-11D5-9B2300010226AA51& [con acceso el 03-04-2010]
- Instituto Químico Biológico. http://www.iqb.es/farmacologia/notas/notas.htm
- Informe laboratorio Schering veterinaria s.a. Prevención de la queratoconjuntivitis infecciosa bovina. [publicación en línea]. Disponible desde internet en: HttP://www.produccion-animal.com.ar [con acceso el 01-05-2010].
- Sánchez Vizcaíno. Curso de Introducción a la inmunología porcina 3 ed. [publicación en línea]. [España]. Cap. 6-8. Disponible desde internet en Http://www.sanidad animal.info/cursos/inmunologia3 [con acceso 01-05-2010].
- Tapia J. Sistema Inmune y Sistema Nervioso. Cuadernos de Neurología, vol. XXII, 1997. [publicación en línea]. Disponible desde internet en: http://escuela.med.puc.cl/publ/Cuadernos/1997/pub_18_97.html [con acceso el 22-10-2010].
- Vandeputte J. Información técnica para el médico veterinario. Introducción a la Inmunología y Vacunología. Mayo 2004. [publicación en línea]. Disponible desde internet en: HttP://www.webveterinaria.com/merial/inmunologia.pdf [con acceso el 22-10-2010]
- Zielinski G. Queratoconjuntivitis Infecciosa bovina: Etiología, Patogenia e Inmunología. Grupo de Sanidad Animal de la EEA INTA Marcos Juárez [publicación en línea]. 2005. Disponible desde internet en Http://www.covetcba.com.ar/verarticulo.asp?id=967 [con acceso el 30-04-2010].
- Zielinski G. El control de la queratoconjuntivitis. INTA Marcos Juárez. [publicación en línea]. Revista Fleckvieh N° 77, 2000. Disponible desde internet en Http://www.produccionbovina.com.ar . [con acceso el 01-05-2010].
Temas relacionados
Autores:
Pontificia Universidad Catolica Argentina - UCA
Recomendar
Comentar
Compartir
Pontificia Universidad Catolica Argentina - UCA
17 de enero de 2016
Muy estimado Uziel: no pude determinar IgA de la mucosa conjuntival ya que la cantidad de analito no fue suficiente para su determinación por medio de ELISA (que era en su momento el método de elección). A nivel serológico no detectamos cambios significativos que pudieran ser explicados por estadística no paramétrica. Sin embargo debo comentarle que clínicamente hubo una diferencia evidente entre los grupos testigo y blanco.
Le agradezco mucho por su consideración y opinión.
Recomendar
Responder
Universidad Autónoma de Nuevo León - México
28 de septiembre de 2015
Estimado Dr Diego, obtuvieron datos sobre las concentraciones de IgA a nivel de mucosa conjuntival o hubo diferencias significativas entre los grupos? así mismo me gustaría saber si a nivel serológico hubo cambios en las otras inmunoglobulina. muchas gracias, de ante mano me pareció que es muy interesante e innovador la manera en que abordo la vacunación. felicidades.
Recomendar
Responder
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.







