Epidemiología y control del parasitismo gastrointestinal en bovinos
Publicado: 12 de mayo de 2017
Por: Dildo Marquez Lara* Gabriel Jiménez Pallares** * M.V. Esp. Programa de Salud Animal Corpoica - Ceisa. ** Zoot. M.S. Programa de Socioeconomía. Tibaitatá.
INTRODUCCIÓN
Por parasitismo gastrointestinal se conocen las infecciones producidas por una variedad de parásitos, distribuidos en toda Colombia, causantes de daños que dependen del tipo de parásito, cantidad de parásitos alojados en el animal, edad y estado nutricional de los animales. Aunque la presentación aguda del parasitismo interno de los animales puede causar incluso la muerte de éstos, generalmente su presencia en los animales pasa de manera desapercibida debido a que no producen síntomas espectaculares en el ganado.
Los efectos de los nematodos gastrointestinales en los bovinos dependen de la(s) especie(s) de parásito(s) y del grado de infección, los cuales, dependen, a su vez, de diversos factores como las con diciones climáticas, el suelo, la vegetación, el sistema de producción, el manejo de las fincas, la raza, la edad del animal y el tipo de pastura.
Generalmente, los parásitos gastrointestinales del ganado, como los daños ocasionados por éstos, pasan desapercibidos, ejerciendo efectos subclínicos, debido al carácter endémico de estas infecciones. Sin embargo, los endoparásitos actúan de manera insidiosa, minando la capacidad productiva de los animales, lo cual se nota en la escasa ganancia de peso y el de crecimiento de la fertilidad, generando de esta manera innumerables pérdidas en los sistemas de producción ganaderos (Echevarria, 1996; Soulsby, 1987).
Cuando los síntomas clínicos hacen presencia en los animales, las enfermedades por endoparásitos varían desde disturbios menores hasta la muerte de éstos, en especial en los jóvenes. Estas variaciones pueden originarse por factores genéticos, geográficos o por factores inherentes a un determinado sistema de producción. Las diferencias genéticas entre razas y entre individuos de una misma raza pueden hacer variar de manera significativa el efecto que los parásitos ocasionan en los animales, siendo aun más importante el manejo dado a los animales, lo cual se reflejará en una mayor o menor exposición a los daños potenciales de los parásitos. Así mismo, se han demostrado diferencias locales y regionales, asociadas a la carga parasitaria de los bovinos (Craig, 1996).
Según el sitio de alojamiento de los endoparásitos pueden manifestarse cuatro tipos de parasitismo gastrointestinal:
- Parasitismo gastrointestinal propiamen te dicho.
- Parasitismo broncopulmonar o bronquitis verminosa.
- Fasciolosis.
- Teniosis.
En las infecciones gastrointestinales pueden distinguirse dos tipos de parasitismo (Parra, 1990):
- Parasitiasis, o parasitismo subclínico, en el cual la acción permanente de los parásitos merma el potencial productivo de los animales (disminución en la producción de carne y/o leche, afección de la capacidad reproductiva, desarrollo lento e incremento de la susceptibilidad al padecimiento de otras enfermedades) sin que se presenten signos aparentes de enfermedad.
- Parasitosis, o parasitismo clínico, la cual ocurre cuando aparecen todas o la mayor parte de las manifestaciones clínicas de la enfermedad, siendo evidentes los daños ocurridos en el huésped a causa de la acción injuriante de los endoparásitos. Es importante resaltar que el parasitismo subclínico reviste la mayor importancia debido a que por la acción oculta y dañina de los parásitos, son pocos o ninguno los correctivos que se implementan en los sistemas de producción ganaderos.
Cuando las infecciones por endoparásitos son agudas, como ocurre muchas veces en ganaderías intensivas (lecherías), éstas pueden ocasionar la muerte de los animales, mientras que en explotaciones de bovinos de carne el parasitismo se manifiesta, por lo general, mermando el crecimiento y desarrollo de los bovinos jóvenes, y disminuyendo la capacidad productiva de los bovinos en general.
El parasitismo interno del ganado es ocasionado por cuatro grandes grupos de endoparásitos, con características morfológicas y parasíticas diferentes (Domínguez, 1993; Rodríguez, 1996), a saber:
- Nematodos (gusanos redondos)
- Céstodos (tenias)
- Tremátodos (Fasciola hepatica)
- Protozoos (intestinales y tisulares)
Estos parásitos están constituidos por familias y géneros con características diversas como sigue:
- Características morfológicas de sus diferentes estados.
- Localización en distintos órganos del huésped de las formas larvaria y adulta de los parásitos.
- Biología del parásito.
- Implicaciones patológicas.
- Hipobiosis.
- Metabolismo intermedio.
- Resistencia a los antihelmínticos.
1. CLASES DE PARASITISMO GASTROINTESTINAL
1.1. PRINCIPALES PARÁSITOS GASTROINTESTINALES DE LOS BOVINOS Y ENFERMEDADES ASOCIADAS
Debido a la variedad de especies de parásitos gastrointestinales que afectan a los bovinos, es amplia la diversidad de enfermedades parasitarias, las cuales, como se dijo antes, pueden tener forma subclínica, haciéndolas no perceptibles a los ganaderos (Sewe ll, 1984). El parasitismo gastrointestinal es causado por varias especies de parásitos, siendo muy importantes los que viven en el abomaso, el intestino, el hígado y los pulmones (Padilha, 1992). En 1993, Thullner et al., reportan que, por su importancia económica, los principales parásitos gastrointestinales de bovinos pertenecen a la familia Trichostrongylidae, dentro de la cual se encuentran los nematodos Haemonchus placei, Cooperia punctata y Cooperiapectinata, Oesophagostomun radiatum y Toxocara vitulorum. El mismo autor informa que en animales jóvenes los nematodos de importancia son Strongyloides papillosus y T. vitulorum. Fasciola hepatica también se ha reportado como un parásito de gran importancia económica en Colombia (Parra, 1990). La Tabla 1 muestra los helmintos más comunes en rumiantes y los sitios de localización.
Tabla 1. Órganos de localización de los helmintos más comunes de los rumiantes.
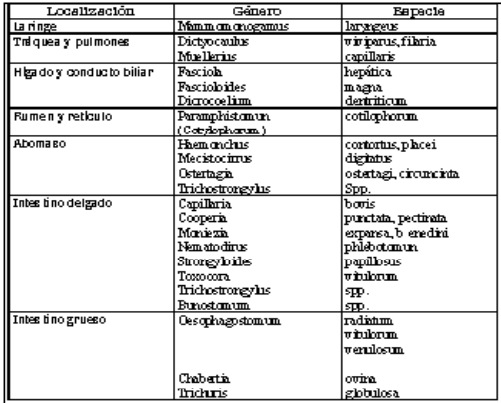
1.2. HELMINTOS MÁS COMUNES DE LOS RUMIANTES
Cooperia spp..Estos nematodos infectan el intestino delgado de los bovinos, exisitiendo varias especies, entre las que se destacan C. oncophora, C. punctata y C. pectinata, de las cuales las dos últimas son las que predominan en las zonas tropicales y subtropicales. Es normal hallarlas asociadas a la gastroenteritis parasítica en terneros, aunque la severidad de los signos clínicos y cambios patológicos están directamente relacionados con el nivel de infección.
Los daños patológicos ocasionados por Cooperia spp. se producen sobre todo en el intestino delgado con pérdida de las vellosidades intestinales, respuesta inflamatoria intensa y pérdida de proteína plasmática, lo cual conduce a disminución de la eficiencia digestiva intestinal, anemia, anorexia, hipoproteinemia y, a veces, a la muerte de los animales cuando las cargas parasitarias son altas, aunque la enfermedad subclínica es lo más común.
Las tres especies de Cooperia de mayor prevalencia en bovinos son C. oncophora, frecuente en zonas templadas y considerada no patógena; C. punctata y C. pectinata, de mayor presencia en regiones tropicales y subtropicales donde son asociadas a gastroenteritis en bovinos.
Haemonchus spp. Este nematodo es muy importante por su capacidad hematófaga, en especial en pequeños rumiantes. Debido a su alto potencial reproductivo grandes cargas parasitarias se pueden incrementar en las épocas secas y calurosas, pudiendo producir muerte de los animales (Alarcón, 1983). Haemonchus causa daños severos en la mucosa abomasal originando anemia, disturbios en la digestión, hipoproteinemia y diarrea (Sewell, 1984).
Los pequeños rumiantes, en particular las cabras, poseen escasa inmunidad contra estos endoparásitos, lo cual, aunado al alto potencial biótico de estos nematodos en corto tiempo (tres semanas) y a la frecuente exposición a los antihelmínticos, ha posibilitado el desarrollo de resistencia a la mayor parte de éstos, en particular a los benzimidazoles, la cual se encuentra bastante extendida en el mundo. Situación diferente ocurre en los bovinos, por cuanto esta problemática no reviste el cartácter dramático que tiene en los pequeños rumiantes, debido tal vez al mejor desarrollo inmunitario de éstos y al incipiente y tardío desarrollo de resistencia a los antihelmínticos.
Ostertagia spp. Es un parásito común en todas las regiones del mundo, de preferencia en aquellas en las cuales las condiciones de lluvias o irrigación son adecuadas para su transmisión y supervivencia. Es de los pocos parásitos que afecta tanto a los animales adultos como a los jóvenes. La resistencia adquirida por los animales a la infección por estos endoparásitos requiere de períodos de exposición más largos que para los otros parásitos.
La enfermedad causada por Ostertagia spp., la ostertagiosis, puede ser de dos tipos: ostertagiosis tipo I y la ostertagiosis tipo II (Sewell, 1984).
La ostertagiosis tipo I se presenta en animales jóvenes destetos y no destetos cuando son introducidos por primera vez en praderas altamente contaminadas con larvas infectantes L3. Esta enfermedad 13 se caracteriza por alta morbilidad y baja mortalidad. El proceso de la enfermedad se inicia cuando los animales ingieren larvas L3, que invaden las glándulas abomasales, se desarrollan hasta adultos y salen de éstas en tres semanas.
Durante la aparición, las células parietales del abomaso producen HCl, dañando las células principales que secretan pepsinógeno, de lo cual resulta una elevación del pH del abomaso, que impide la conversión del pepsinógeno en pepsina, y produce, por tanto, una disrupción en la digestión de proteínas. Estos parásitos destruyen asimismo las células epiteliales y el puente intercelular, permitiendo que las proteínas séricas y los glóbulos rojos salgan al lumen del abomaso y el pepsinógeno a la circulación. La determinación del pepsinógeno en plasma o suero es uno de los métodos para el diagnóstico de la ostertagiosis, en especial en ovinos.
La ostertagiosis tipo II se origina por la reanudación del desarrollo de las larvas L4 inhibidas (hipobiosis), como respuesta a condiciones ambientales favorables para su supervivencia, al final de los períodos secos y calientes y al inicio de las épocas de lluvias. En este caso, las larvas acumuladas en las glándulas abomasales salen en masa, ocasionando una patología mucho más severa que la de tipo I, cuyos principales signos son la anemia, el edema submandibular, la diarrea y la pérdida de peso, caracterizándose por escasa morbilidad y alta mortalidad. Los animales con ostertagiosis tipo II presentan elevados niveles de pepsinógeno sérico y recuentos de huevos en heces superiores a los 2000.
Trichostrongylus spp. Son parásitos pequeños que se localizan en el abomaso de los rumiantes, miden menos de 7 mm de largo, pudiendo ocasionar gastritis severa con diarrea intensa si es alto el nivel de infección, aunque las infecciones con estos parásitos son a menudo asintomáticas. Sin embargo, se pueden observar signos clínicos de ella cuando se detectan altas cargas parasitarias y los animales están estresados por transporte o por otras enfermedades. T. axei se encuentra normalmente en bovinos, mientras que T. colubriformis es común encontrarlo en ovinos y bovinos.
Oesophagostomum spp. Estos parásitos, luego de dos días de infección, se localizan en las paredes de la porción final del intestino delgado, y otros en el ciego y en el colon. Son causantes de nódulos en el intestino grueso de los rumiantes, los cuales se forman en torno de la larva que se desarrolla a L4 a los ochos días posinfección. Más adelante (diez días), las larvas dejan los nódulos y migran a la mucosa del ciego y del colon, en la cual se desarrollan hasta adultos a partir del día 19. Los huevos se pueden detectar en las heces a los 32-42 días posinfección.
Otros nematodos como Dictyocaulus, Strongyloides, Neoascaris y Bunostomum se pueden encontrar en pequeñas cantidades, dependiendo de la región, aunque estos helmintos no son causantes de mayores problemas sanitarios (Echevarria, 1996).
1. 3. BRONQUITIS VERMINOSA O PARASITISMO BRONCOPULMONAR
La bronquitis verminosa es producida por Dictyocaulus viviparus (Figura 1), ingerido por los bovinos a través de pastos o aguas contaminadas con larvas de este parásito. Aunque se puede manifestar en toda clase de climas, esta infección es más frecuente 14 en climas fríos y medios, y en los animales jóvenes que empiezan a pastorear (Mateus, 1990).
Figura 1. D. viviparus en heces de bovinos.
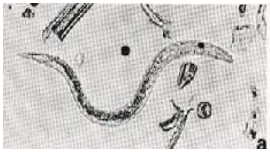
D. viviparus se localiza en los bronquios principales de los pulmones, y tapona y obstruye los bronquios y bronquíolos, lo cual interfiere los procesos respiratorios de los animales (Figura 2). Tiene un ciclo evolutivo directo que se caracteriza por que las hembras adultas, ubicadas en la tráquea y bronquios de mayor tamaño, ponen huevos que poseen una larva que se desarrolla en las vías respiratorias y ascienden por la tráquea para ser expulsados la mayoría por la boca y la nariz de los animales, siendo de glutida una mínima proporción.
Figura 2. D. viviparus en bronquiolos.
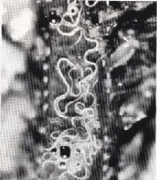
Las larvas (L1) se excretan con la materia fecal de los bovinos, y luego se trans for man en el pasto en larvas infectantes (L3) más o menos en un período de 3-5 días. Después de ser ingeridas por los animales y de situarse en el intestino delgado, pasan a los ganglios linfáticos mesentéricos y se transfor man en larvas L4 para llegar al corazón derecho y, por último, al sistema bronquiotraqueal donde se convierten en larvas L5, y en estado adulto, 22 días después de su ingestión (Mateus, 1990).
Desde el punto de vista de la epidemiología de la infección, ella está asociada a pasturas con suelos con humedad permanente, exagerada contaminación de los pastos y alta densidad animal en las praderas (Bor chert, 1981; Alarcón, 1983).
1.4. FASCIOLOSIS O PARASITISMO HEPÁTICO
Esta enfermedad la origina un gusano aplanado (Figura 3), comúnmente denominado mariposa del hígado (F. hepatica), y suprevalencia corresponde a los climas fríos (Pa rra, 1990), aunque es menor en los climas me dios y cálidos (Márquez et al., 2003). La adquisición de la infección depende de la presencia en los predios de caracoles del género Limnaea truncatula, porque en éstos se cumple una parte del ciclo de vida de este gusano (Borchert, 1981).
Figura 3. F. hepatica adulta.
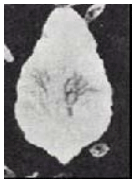
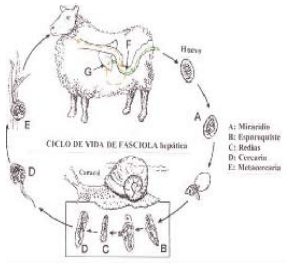
El ciclo de vida de estos parásitos (Figura 4) se inicia con la expulsión de sus huevos en la materia fecal de los bovinos, penetrando, si existen adecuadas condiciones de humedad, en los caracoles, en donde cumplen una parta de su ciclo de vida, para luego abandonarlo y adherirse a las superficies de las plantas cercanas a las fuentes de agua, infectándose los animales cuando ingieren estos pastos o las aguas contaminadas con este parásito. Las lluvias intensas y las inundaciones favorecen la eclosión de los huevos, lo mismo que su deposición directa en el agua (Borchert, 1981).
Figura 4. Ciclo de vida de Fasciola hepatica.
El control de F. hepatica debe ser preventivo, dirigido al control de los caracoles que sirven de hospederos intermediarios de estos parásitos, pues mediante la eliminación de los caracoles se interrumpe el ciclo de vida de la Fasciola y, por lo tanto, la continuidad de la infección en un hato. Entre las principales medidas de control (Pa rra F., 1996) se destacan las siguientes:
- Localizar los lugares que puedan ser criadores de caracoles para drenarlos o cercarlos.
- Mantener secos los alrededores de los bebederos e impedir la formación de charcos.
- Evitar que la materia fecal de bovinos llegue a aguas estancadas temporalmente, en las cuales pueda haber caracoles.
- Introducción de patos en fincas como alternativa de control biológico.
- Hacer uso de medicamentes específicos contra Fasciola ante la presencia de anaimales afectados por este parásito, para lo cual es indispensable la asesoría de un médico veterinario.
1.5. COCCIDIOSIS
La coccidiosis en bovinos es una enfermedad parasitaria generalmente aguda causada por protozoarios del género Eimeria en las células intestinales. Estos parásitos tienen la particularidad de afectar deforma aguda a los animales jóvenes y en forma crónica a los adultos. Se conocen 13 especies diferentes que afectan al ganado bovino, siendo las de mayor ocurrencia Eimeria zurnii, E. bovis, E. ellipsoidalis y E. auburnensis (Romero, 2002).
E. bovis y E. zurnii son las especies más patógenas de los bovinos, las cuales son las responsables de la mayoría de los casos clínicos, aunque la infección por lo general sucede en forma mixta, situación que hace variar la patogenicidad de las mismas. Son parásitos intracelulares muy específicos, por lo que los coccidios de bovinos no afectan a otras especies de animales. Tienen un ciclo de vida directo (monoxeno), o sea que necesitan un solo hospedero para completar su ciclo (Drugueri, 2002; Romero, 2002).
El ciclo biológico de las coccidiosis en rumian tes comprende dos etapas: Una fase asexual: esquizogonia y esporogonia. La primera se desarrolla fuera del hospedero y la segunda dentro del mismo. La fase sexual comprende la fase de gametogonia y se desarrolla también dentro del huésped.
Los bovinos más susceptibles son los terneros entre tres y ocho meses de edad, infectándose al consumir agua o alimentos con ta mi na dos de heces en los bebederos y comederos, haciendo de la coccidiosis una enfermedad típica de animales jóvenes cria dos en condiciones de elevada contaminación fecal de alimentos. El diagnóstico se hace mediante la detección de ooquis tes en heces, apoyado en la historia clínica de los animales.
El control de la coccidiosis debe ser preventivo. Hay que asegurarse que la infección de los terneros sea gradual y paulatina, los animales jóvenes no se deben introducir en lotes de animales adultos, por considerarse que éstos actúan como portadores clínicamente sanos, convirtiéndose en fuente de infección para los terneros. Asímismo, se recomienda prevenir la enfermedad reduciendo la contaminación del agua y alimentos con heces que puedan contener ooquistes de Eimeria (Drugueri, 2002).
1.6. NEOSPOROSIS
Desde su reconocimiento, en 1984, la neosporosis ha emergido como una seria enfermedad causante de abortos en vacas en muchas regiones del mundo. El agente causal de esta enfermedad es el parásito coccídio Neospora caninum, del cual los bovinos son huéspedes intermediarios, mientras que el perro, por excretar el parásito en heces y desarrollar signos de neosporosis, es huésped definitivo e intermediario. N. caninum es un protozoo de la clase esporozoa, perteneciente a la familia Sarcocystidae, re portado por primera vez en l984 en Noruega e identificado en 1988. Hasta ahora, este parásito es un patógeno importante en bovinos y caninos, que en ocasiones puede causar infecciones clínicas en ovejas, cabras, caballos y ciervos (Dubey, 2003).
La infección en los bovinos se inicia con la ingestión de alimentos contaminados con quistes microscópicos capsulados, provenientes de heces de perros. En el intestino de los bovinos los parásitos abandonan los quistes, los cuales, a través del sistema circulatorio, llegan y se multiplican en las células cerebrales, hepáticas, cardíacas, pulmonares y musculares. El perro se infecta por la ingestión de órganos de bovinos infectados (feto, placenta), en el cual se producen los quistes contaminantes de los pastos. Sin embargo, estudios epidemiológicos llevados a cabo sugieren que la principal vía de trasmisión en los bovinos es la transplacentaria (Dubey, 2003).
El único signo clínico en las vacas es el aborto, el cual puede ocurrir desde el tercer mes de gestación hasta el final de la misma, siendo más frecuente entre el 5º y 6º mes de gestación. Los abortos pueden ser esporádicos, endémicos o epidémicos. Cuando el síntoma no es el aborto, los terneros pueden nacer muertos, infectados, enfermos o infectados clínicamente sanos, siendo esta forma de presentación la más frecuente en rebaños donde la enfermedad es endémica (Dijkstra, 2003)
Los métodos de diagnóstico pueden ser directos e indirectos. El diagnóstico definitivo requiere del aislamiento de N. caninun, y el diagnóstico histopatológico en cerebros de fetos abortados se hace mediante inmunohistoquímica. Otra técnica para la detección de Neospora es la prueba de PCR, de poco uso en la rutina diagnóstica debido a su alto costo (Venturini, 2003). Las principales técnicas en los métodos serológicos son ELISA, Prueba de Aglutinación Directa e Inmunofluorescencia Indirecta (IFI) (Di- jks tra, 2003; Dubey, 2003).
Cuando no existen fetos abortados completos, el cerebro, el corazón y el hígado constituyen los órganos más importantes para el examen de lesiones histopatológicas y obtener así un diagnóstico histopatológico.
2. DISTRIBUCIÓN GEOGRÁFICA DEL PARASITISMO GASTROINTESTINAL
Los parásitos internos se encuentran distribuidos en todo el mundo, abarcando diversos climas y latitudes, lo cual conlleva a que todos los bovinos en pastoreo estén expuestos a las infecciones por éstos. Sin embargo, a pesar de que la verminosis ocurra en la mayoría de los animales, esto no significa que haya una gran incidencia de casos clínicos, debido a que por lo general su efecto mayor conduce a una reducción en la capacidad productiva de los animales, sin que los signos clínicos sean evidentes o notorios (Padilha, 1992).
No obstante describirse la importancia de los parásitos arriba mencionados en las verminosis, la prevalencia de cada uno de éstos es diferente según sea la zona agroeco lógica o el sistema de producción imperante (Márquez, 1996; Parra y Uribe, 1990; Parra, 1990; Rivera et al., 1983), los cuales ejercen su acción deletérea ma ni fes ta da en diarrea continua y en fla que ci mien to progresivo; así, por ejemplo, en un es tu dio realizado en el departamento de Córdoba, Colombia, dirigido al conocimiento de la epidemología de los helmintos en terneros, se encontró que los géneros que predominaron fueron Cooperia (C. pectinata y C. oncophora), Haemonchus (H. similis y H. placei) y Mecistocirrus (Thullner, 1993).
Por otra parte, resultados de un estudio efectuado por Márquez et al. (2003) entrepisos térmicos de Colombia (cálido, medio y frío) demostraron que los principales nematodos involucrados en el parasitismo gastrointestinal de bovinos son: Cooperia spp., Hamonchus spp., Ostertagia spp., Trichostrongylus spp., y Oesophagostomum spp.
En una investigación llevada a cabo en el oeste de Victoria, se detectó que el prin ci pal nematodo en el ganado era O. ostertagi (Ri ff kin y Callinam, 1987). En el Estado de Yu ca tán, México, Domínguez y col. (1990), establecieron que los nematodos prevalentes en bovinos jóvenes fueron los del orden Strongylidae, sobresaliendo Trichostrongylus sp, Cooperia sp y Haemonchus sp.
Couvillion et al. (1996) encontraron que las especies de nematodos gastrointestinales que prevalecían en terneros de la región del Mississipi (USA) fueron: Ostertagia spp. y Cooperia spp., mientras que en vacas prevalecieron Ostertagia spp. y Trichostron gylus spp., con un nivel de excreción 18 de huevos relativamente bajo durante el estudio, debido al desarrollo de inmunidad y algunos otros mecanismos que evitaron el establecimiento de grandes poblaciones de endoparásitos.
Resultados de estudios adelantados en los Llanos Orientales de Colombia por Rivera et al. (1983), revelaron que los endoparásitos de mayor prevalencia en terneros nacidos al inico de la estación de vernao y al final de la misma fueron Cooperia spp. y Haemonchus spp., siendo el nivel de infección mayor en los terneros nacidos al iniciar la época seca.
En Brasil, en el Estado de Minas Gerais, Guimaraes et al. (1990) reportaron que el género Cooperia (C. punctata, C. pectinata y C. oncophora) prevalecía en vacas en pastoreo; mientras que en otro estudio llevado a cabo por Bianchin et al. (1993), en Mato Grosso, Brasil Central, comprobaron durante 10 años que Cooperia sp, Haemonchus sp, Trinchostrongylus sp y O. ra dia tum eran los parásitos de mayor importancia en ganado de carne con manejo extensivo.
Se ha reportado que el género Haemonchus (H. placei, H.contortus y H. similis) constituye en las regiones tropicales y subtropicales uno de los principales problemas parasitarios internos de los bovinos, mientras que otras especies como C. punctata, c. pectinata, T. axei y O. radiatum están asociadas, en términos generales, a brotes de verminosis gastrointestinal (Grisi, 1993).
El ciclo de vida de los nematodos, y más concretamente la dinámica de sus poblaciones, está influenciada por muchos factores, los cuales se han agrupado en factores extrínsecos e intrínsecos. Los primeros, son todos aquellos relacionados con el cli ma, las variaciones atmosféricas y las condiciones de manejo zootécnico im pe ran tes en una zona o sistema de producción de ter mi na dos Stromberg et al., 1991). En re la ción con el clima, cuatro grandes zonas climáticas se han definido en el mundo, las cuales se conocen como zonas áridas, tropicales/ subtropicales y templadas.
En la zona árida es casi insignificante la verminosis por las condiciones ecológicas adversas o desfavorables para el de sa rro llo y supervivencia de las larvas; mientras que en las zonas tropicales, donde las condiciones ambientales son de todo favorables, la ocurrencia de verminosis es fre cuen te con predominio de Haemonchus sp, C., punctata y O. radiatum, al tiempo que en las regiones templadas sobresalen las infecciones causadas por O. ostertagi, T. axei y C. oncophora (Grisi, 1993)
Sewell (1984) describe cuatro zonas climáticas, en las cuales el comportamiento epidemiológico de los nematodos es diferente, así:
Climas con régimen de humedad permanente: son áreas tropicales con una corta estación de sequía, que se caracteriza por presencia constante de larvas infectantes en praderas con el dominio de Haemonchus y Mecistocirrus.
Climas de lluvias–sequía: regiones con estación seca prolongada, cuyas características epidemiológicas son la ruptura del desafío larvario, siendo la humedad el factor limitante.
Climas de estación fría–lluviosa: son áreas frías altas, donde el factor limitante es la humedad con predominio de Ostertagia, 19 existiendo un alto número de larvas hipóbióticas cuya importancia varía de acuer do con el régimen de lluvias.
Climas permanentemente áridos: regiones desérticas, en cuyas áreas de irrigación el principal riesgo lo constituye el Haemonchus.
Por otra parte, las prácticas de manejo zootécnico también influencian en el comportamniento epidemiológico de los parásitos en general, en especial los factores relacionados con la densidad animal en el hato.
Dentro de los factores intrínsecos se destacala edad y la inmunidad de los animales, sobre todo los jóvenes, toda vez que éstos son más susceptibles a los padecimien tos parasitarios (Grisi, 1993).
En Colombia, se han efectuado algunos es tu dios epidemiológicos con el objeto de ir sentando las bases para implantar sistemas racionales de control en los Llanos Orien ta les y en la Costa Atlántica. En un estudio realizado durante cuatro años y utilizando terneros destetos, Parra (1993) estableció que la presencia de larvas en los pastos fue más elevada de abril a junio y de agosto a septiembre, con un pico alrededor del mes de septiembre, correspondiendo estos in cre men tos a los meses de mayor precipitación pluvial en la zona.
Igualmente, en un trabajo desarrollado durante un año con terneros, en el departamento de Córdoba, se halló que la contaminación de los pastos con larvas infectantes de terneros fue más baja en la época seca (enero a marzo) que durante el resto del año (Thullner, 1993). Por último, según Gri si (1993) el parámetro principal para el es ta ble ci mien to de programas de control es- tra té gi co de parásitos gastrointestinales en las regiones tropicales está relacionado con las lluvias y la distribución de las mismas. El mismo autor reporta que los estudios epi de mio ló gi cos en distintas regiones de cli ma tropical indican que en los períodos de mayor distribución de lluvias, es más ele va do el número de larvas infectantes en los pastos y más o menos baja la carga pa ra si ta ria en los bovinos, mientras que en los períodos de escasez de lluvias ocurre el fe nó me no inverso.
3. CICLO DE VIDA DE LOS NEMA TODOS GASTROINTESTINALES
La supervivencia de los parásitos gastrointestinales depende de que superen múltiples barreras tanto en el hospedero como en el ambiente, de las cuales los factores climáticos, especialmente temperatura y humedad, son las que influyen en forma drástica en el desarrollo y la supervivencia de las larvas en el medio ambiente (Con nan, 1996). Ade más, un conjunto de factores concomitantes deben presentarse para el logro exitoso de su supervivencia, los cuales, según Gibbs (1982), son los siguientes:
1) Presencia de huéspedes susceptibles para la ingestión de larvas en estado infectivo en el momento apropiado de la transmisión, 2) Entrada, establecimiento y reproducción del parásito en el nuevo huésped. 3) Adaptación, aclimatación y superación de los principales factores de resistencia (celulares y moleculares) del nuevo huésped, y 4) Desarrollo de mecanismos por parte del parásito para abandonar el huésped y con ta mi nar las praderas.
Los animales adquieren la infección cuando ingieren pastos contaminados, y el gra do de infección depende del nivel de contaminación de los pastos, el cual, está relacionado, a su vez, con factores como la temperatura, el tipo de suelos, los pastos, las razas de los animales existentes en los predios, el número de animales por potrero, y la cantidad de lluvia caída en una época determinada (Stromberg, 1997).
El ciclo de vida de la mayoría de los ne- ma to dos gastrointestinales y pulmonares es directo y semejante, y, por lo tanto, no in vo lu cra huéspedes intermediarios; consta de una fase parasítica que se desarrolla en el huésped (relación parásito-animal) y otra de vida libre o preparasítica (relación pa rá si to-medio ambiente), las cuales son res pon sa bles de las tasas de contaminación e infección, respectivamente (Tho- mas, 1982).
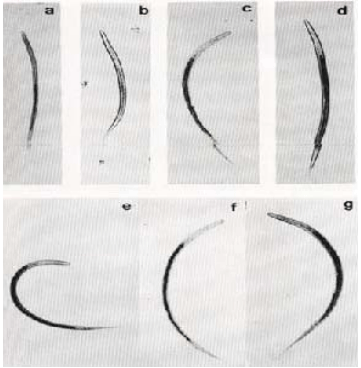
La fase de vida libre corresponde a formas no parasíticas que ocurren en la superficie del suelo, a partir de los huevos que son excretados en la materia fecal de los rumian tes, donde se desarrollan los huevos y eclosionan emergiendo las larvas. Éstas, mediante mudas sucesivas (L1 y L2), se tor- nan en larvas infectivas L3 (Figura 5) en el interior de los bolos fecales. Las larvas L3 abandonan el estiércol, quedando sujetas a influencias ambientales como tem pe ra tu ra, precipitación pluvial, humedad, pre sión ba-
Figura 5. Larvas infectantes (L3) más comunes de nemátodos gastrointestinales de rumiantes.
Las larvas, evolucionadas a partir de los huevos, resultan entonces del desarrollo de una serie de estados que van desde el hue vo has ta la larva infectiva, proceso que, bajo condiciones óptimas de temperatura y humedad, tiene que pasar por supervivencia, desarrollo y eclosión de los huevos, desarrollo, supervivencia y motilidad de las larvas, estados que dependen de re que ri mien tos am bien ta les específicos, de acuerdo con el ta ma ño final de la población del balance en tre las ta sas de producción y la mor ta li dad lar va ria.
Ahora bien, las larvas infectivas (L3) emer gen de los bolos fecales sólo cuando éstos están húmedos, y puedan trasladarse al fo rra je a través de películas de humedad, tor nán do se en larvas disponibles para los bovinos en las pasturas. Factores como la de se ca ción y los extremos climáticos de tem pe ra tu ra y humedad limitan en gran medida el desarrollo de los huevos y larvas en el medio ambiente, siendo los dos primeros estadios larvales (L1 y L2) los más vulnerables a estas situaciones climáticas, de tal manera que al secarse el bolo fecal con rapidez éstas no se desarrollarán o supervivirán. Las larvas L3 son más resistentes a las condiciones de sequía en los potreros (Ar mour, 1980; Bruns don, 1980; Stromberg, 1997).
Puesto que la larva L3 no puede alimentarse mientras permanece en el medio ambiente, ésta utiliza la energía que almacenan cuando se alimentan de las bacterias fecales, estando entonces condicionada la supervivencia a sus reservas energéticas, la cual es consumida en relación directa con la temperatura ambiental. Se ha demostrado que la vida de estos estadíos se corta durante las épocas de verano y, por el contrario, se prolonga durante las estaciones de lluvias (Waller, 1999).
Se considera que el tiempo de evolución des de el huevo hasta la larva infectiva es de cinco a siete días. En regiones tropicales, durante las épocas de lluvias las larvas se desarrollan y se acumulan en esta estación, mientras que en las épocas de verano el número de larvas disminuye poco a poco debido a la desecación, por lo que la mayor parte de la población de parásitos gastrointestinales se encuentra en los animales durante las épocas de verano (Grisi, 1993).
En general, el medio ambiente en el cual se desenvuelven los estados no parasíticos de los nematodos del ganado está constituido, en esencia por 1) Efectos estacionales del clima, 2) Fluctuaciones de las estaciones como la temperatura/precipitación pluvial, humedad, brillo solar y 3) Condiciones físicas o microhábitat de las larvas como el tipo de las pasturas, la estructura y los microorganismos del suelo y los propios de la materia fecal (Sievers, 1998).
De acuerdo con Gibbs (1982) y Craig et al. (1996) la temperatura y la precipitación pluvial son los factores de mayor influencia en el desarrollo y supervivencia de los estados libres de los trichostrongylidos, mientras que la temperatura determina la tasa de desarrollo de las larvas, la precipitación pluvial impide la desecación de éstas y favoreciendo, a la vez, la migración de las larvas a las pasturas.
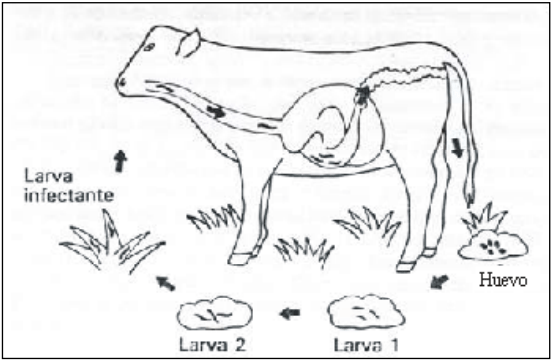
La fase parasítica, que ocurre al interior de los hospedadores, se inicia con la ingestión de las larvas infectivas por parte de los rumiantes. Éstas, luego de desprenderse de su cutícula externa, penetran en la mucosa del abomaso o intestino (dependiendo de su localización definitiva). Allí mudan a lar va L4 y a larva L5 (aumentado su tamaño de 8 a 10 veces), para luego abandonarla y Figura 6. Ciclo de vida de los nematodos gastrointestinales en rumiantes. Tomado de Padilha 1986. fijarse a ella por su extremidad anterior, en un período de 21 a 28 días en la mayoría de las especies. La Figura 6 ilustra el ciclo de los nemátodos gastrointestinales de los rumiantes.
Figura 6. Ciclo de vida de los nematodos gastrointestinales en rumiantes. Tomado de Padilha 1986.
La mayor parte de las larvas L3 evolucionan hasta machos y hembras adultos, alcanza después madurez sexual, produciéndose la cópula entre machos y hembras, las cuales inician la oviposicion. Cada una de ellas pondrá miles de huevos a lo largo de su vida (que puede ir de unas cuatro se ma nas hasta doce meses), los cuales se eva cúan con la materia fecal de los bovinos, recontaminando las praderas.
El número de huevos producidos por cada especie de nematodo varía de centenares a miles cada día, dependiendo de la especie de parásito. Luego, cada hembra origina una gran cantidad de huevos, cada uno de los cuales, si encuentra condiciones am bien ta les fa- vo ra bles, produce una larva infectante. Por tanto, en una población de bovinos mantenida en una determinada pra de ra, si se considera la población de vermes como un todo, la mayoría de esta población se en cuen tra en las praderas (huevos, larvas en desarrollo y larvas infectantes). Un estudio australiano reveló que el 97% de los nematodos se halla en los pastos y el 3% en los animales.
El tamaño de la población de parásitos adultos es regulado por el ambiente interno de los hospederos, el cual, mediante mecanismos fisiológicos, influye en el tamaño, la persistencia y fecundidad de los parásitos adultos, que, según Thomas (1982), pue den dividirse en factores que determinan el control de la población de adultos y la ex cre ción de huevos.
Una porción de larvas infectivas de al gu nas especies de parásitos detienen de ma ne ra temporal su desarrollo en el interior de los animales (larvas L4 o hipobióticas), fenómeno conocido como hipobiosis, constituyen do una de las más exitosas formas de adaptación para garantizar la supervivencia de los parásitos, que parece ocurrir en muchas especies de estos parásitos y cuya importancia epidemiológica es clave en la dinámica poblacional de los parásitos gastrointestinales, en la medida en que puede ser precursora de enfermedad clínica o de masiva contaminación de praderas (Thomas, 1982; Fabiyi y Copeman, 1989).
La hipobiosis se ha definido como una cesación temporal del desarrollo de los nematodos al inicio del estado parasitario. En ese estado parasítico temprano la larva detiene su desarrollo, no se alimenta y permanece inactiva en el hospedero en espera de condiciones favorables para re anu dar su desarrollo. Este fenómeno es un mecanismo evolutivo que le permite al parásito sobrevivir cuando las circunstancias le son adversas, es decir, cuando podría ser eliminado por la inmunidad del animal que ingirió la larva infectante, o cuando su pro ge nie pudiera ser destruida por las condiciones climáticas desfavorables. Este fenómeno se ha observado en regiones templadas y tropicales (Bianchin et al., 1993).
Existen varios factores que inducen o tienen ingerencia en la ocurrencia de la hipobiosis. Algunos de ellos están relacionados con el animal, como el estado inmunitario de los animales, cambios endocrinos y factores ambientales que actúan sobre el animal; otros, propios de los parásito, como la presencia de helmintos adultos de la misma especie, sitio del parasitismo o cantidad de larvas infectantes ingeridas; y otros con el medio ambiente como el frío, el calor excesivo, el foto período, etc. Sin embargo, aún no son muy claras las condiciones que determinan el reinicio del desarrollo de las larvas (Ar mour, 1980; Padilha, 1992; Thu ll ner, 1993).
La inmunidad adquirida y los estímulos ambientales son las causas potenciales más estudiadas. Las primeras observaciones sugirieron que la hipobiosis resultaba de la inmunidad adquirida. Sin embargo, algunos experimentos en los cuales se han utilizado animales sin experiencia previa con infecciones e inmunosuprimidos, mostraron que en este fenómeno pueden estar involucrados varios aspectos. Algunos de estos experimentos demostraron que ciertos cam bios ambientales interrumpían de manera temporal el desarrollo de las larvas, y que ellas podían reanudar de modo espontáneo su desarrollo, así esas condiciones permaneciesen constantes.
Dentro de los estímulos ambientales, la influencia de la temperatura y la humedad son los más conocidos. En ocasiones en que las temperaturas son extremas (altas o ba jas) y hay deficiencia de humedad, una proporción de las larvas es inducida a interrumpir su desarrollo luego de ser ingeridas por los animales (Craig, 1996).
Las implicaciones parasitológicas y patológicas de la hipobiosis en nematodos gastrointestina les se han observado desde hace muchas décadas, informándose que el fenómeno tiene implicaciones prácticas porque permite a los parásitos sobrevivir dentro del animal durante períodos adversos, tales como el ambiente inmunológicamente hostil (animal inmune) o el ambiente externo desfavorable (época seca, por ejemplo). Cuando la reanudación de una gran cantidad de larvas sucede al mismo tiempo, pueden resultar en helmintiosis clínicas en un período en que la infección de la pradera es baja y éstas no son esperadas (Armour, 1980).
A pesar de que la inhibición del desarrollo se presenta en varias especies de nematodos como Ostertagia spp., Haemonchus spp., Trichostrongylus spp. y Cooperia spp., ésta es importante en O. ostertagi. Su importancia se debe en especial a la patogenicidad de sus formas inmaduras y a las implicaciones de la ocurrencia de ellas en el control, pues para la remoción de estas formas se requieren, para algunas formulaciones antihelmínticas, dosis específicas, diferentes a las usadas para la remoción de los adultos.
Son escasas las informaciones sobre la hi po bio sis en regiones tropicales, a no ser en infecciones con Ostertagia spp., sugiriéndose que es posible que la hipobiosis no sea importante en regiones húmedas con in vier no moderado. Sin embargo, Fritsche (1993) reportó observaciones de larvas inhibidas de H. contortus en la mucosa del abomaso en Gambia.
4. EPIDEMIOLOGÍA DE LARVAS INFEC TAN TES EN LAS PRADERAS
La influencia de las condiciones atmosféricas es importante en la medida en que determinan la mayor o menor disponibilidad de larvas infectantes en las praderas, debido a que, en el trópico, la humedad es el factor preponderante para el desarrollo, su pervivencia y traslación de las larvas. Por un lado, el grado de humedad que nor mal men te se encuentra en las heces es suficiente para permitir la eclosión de los huevos y evolución de los primeros estadios larvarios de los parásitos gastrointestinales y, de otra parte, la mayor o menor disponibilidad de las larvas infectantes en los pastos está condicionada a la presencia de lluvias, de tal manera que es condición suficiente para permitir la migración de larvas de los bolos fecales a los pastos (Grisi, 1993)
Numerosos estudios se han llevado a cabo para establecer la influencia de la precipitación pluvial en la carga parasitaria de rumiantes en las regiones tropicales, mediante el examen de muestras de pastos (Thu ll ner, 1993).
Fabiyi et al. (1988), en un trabajo realizado en el norte de Queensland, para estudiar la supervivencia y abundancia de larvas infectivas de C. punctata, H. placei y O. radiatum, demostraron que las condiciones climáticas de la zona favorecían el desarrollo de las larvas, observando una relación entre la mayor incidencia de larvas y los meses de mayor precipitación pluvial.
Por otra parte, Barger et al. (1984), al analizar la supervivencia de larvas de nemátodos de vacas en una época seca de Australia, observaron los mayores picos de larvas infectivas en épocas de lluvia, épocas precedidas de intensa sequía, porque, según Rose (1961- 1962) y Durie (1961), citados por Barger et al. (1984), el estiércol seco sirve de reservorio de larvas en épocas secas, y la reanudación de las lluvias favorece su traslación a los pastos. La misma observación es reportada por Chiejina (1989) en una investigación llevada a cabo en Nigeria. De esta manera, ellos explicaron un extenso brote de gastroenteritis parasitaria ocurrido en Australia en 1.960, precedido de una época seca, donde el invierno desencadenó el incremen to de larvas infectivas en las praderas.
Durie (1961) y Smeal (1977), citados por Barger et al. (1984), también consideran de especial importancia a los períodos secos prolongados por ser claves en la epidemiología de la gastroenteritis parasitaria en ganado.
En otro estudio epidemiológico realizado en el sur de Inglaterra sobre la ecología de las formas libres de H. contortus, Gibson et al. (1976) establecieron que las ca rac te - rís ti cas climáticas de la zona no favorecían la supervivencia de larvas de este parásito, pero que, sin embargo, por la conjunción de temperatura y humedad se presentan los ran gos óptimos para su desarrollo. El trabajo también muestra la concordancia con los trabajos de Rose (1964), citado por Gibson et al. (1976), cuando afirman que la temperatura y la humedad controlan el desarrollo de huevos de H. contortus.
Los anteriores trabajos coinciden en que son las lluvias (precipitación) y su distribución las que determinan, en mayor medidad, la presencia de las larvas infectantes en los pastos, sobre todo en las regiones tropicales.
5. EPIDEMIOLOGÍA DE LAS ENFERMEDADES INFECCIOSAS POR HELMINTOS
Los sistemas de producción ganaderos de Colombia están ubicados en una región tropical, en la cual las condiciones am bien ta les son favorables la mayor parte del año para el desarrollo y supervivencia de los helmintos y que, por lo tanto, constituye una región endémica de parasitismo gastrointestinal. De acuerdo con Armour (l980), cuales quiera de las siguientes razones pueden desencadenar la aparición de infecciones por helmintos en los animales, sin perder de vista que los factores que hacen posible la incidencia de la helmintiosis eco nó mi ca men te importante son múltiples (Armour, 1980): 1.) Incremento de la masa infectante en el ambiente. Si bien son diversos los factores que determinan las fluctuaciones poblacionales de los estadios de vida libre, éstos se agrupan por lo general en a.) factores que afectan la contaminación de las praderas con huevos o larvas de helmintos, y b.) factores que inciden en el desarrollo, supervivencia, diseminación, disponibilidad y traslación de las larvas en las praderas.
De manera adicional, la migración de las larvas está influenciada por la temperatura y la precipitación pluvial de la región, siendo las lluvias, en especial, el factor de terminante en estas regiones. Factores importantes del incremento de esta masa infectante son el potencial biótico de los helmintos, el estado inmune de los animales, las prácticas de manejo en fincas, la densidad animal en los potreros y la hipobiosis. El potencial biótico se define como la capacidad de un organismo para tener éxito biológico, y se mide median te la fecundidad.
En relación con el incremento de la masa infectante de las praderas es necesario precisar dos términos: contaminación e infectividad (Morelly y Donald, 1980). El grado de infectividad de una pastura está relacionada con el número de larvas infectivas (L3) que pueden ser ingeridas por los animales que pastorean una pradera, mientras que la contaminación de una pastura hace referencia al número de estadios de vida libre via bles por unidad de área. Cuando to das las formas de vida libre existen como larvas infectivas y se encuentran en las porciones de las pasturas que puedan ser ingeridas por los bovinos, la contaminicación y la infectividad son similares.
Por el contrario, si una gran proporción de formas de vida libre se encuentran en las heces, en el suelo o en la base de los pastos, de tal manera que no puedan ser accesibles a los animales, o si esas formas de vida libre no se han desarrollado a estadios infectivos (L3), entonces esa pastura con alta contaminación puede ser no infectiva o poco infectiva. En esas condiciones, una pradera puede transformarse en a ta memte infectiva por un período de tiempo, que dependerá de las condiciones ambientales y la supervivencia de esas larvas en las praderas, en especial después de una caída de lluvias.
2.) Alteración del estado de susceptibilidad de los animales. Se ha demostrado que en la dinámica de la relación huésped-pa rá si to, la población total de parásitos adultos en los animales se mantiene mediante la expulsión de estos parásitos cuando se ad quie rennuevas infecciones, a una tasa en la cual el nivel de expulsión es proporcional al nivel de la nueva infección adquirida. El incremento de la susceptibilidad a la adquisición de nuevas infecciones puede provenir de los cambios en la dieta (dis mi nu ción del valor nutricional o en la de fi cien cia de minerales esenciales en la misma), en la fase final de la preñez y lactación (en especial en ovinos, no muy evidente en bovinos), por la aplicación de esteroides y, en ocasiones, de antihelmínticos.
Estudios realizados en ovinos en Nueva Zelanda han demostrado que los cambios en la dieta pueden provocar un incremento en los niveles de producción y excreción de huevos de helmintos en las heces, en particular cuando se suministran a los animales dietas ricas en carbohidratos, situación que se traduce en un aumento de la fecundidad parasitaria debido a un aumento del metabolismo energético de los parásitos hembras, sobre todo de los parásitos hematófagos. Resultados similares se han registrado en condiciones deficitarias de minerales y de ciertas trazas de elementos (fósforo, cobre, etc.).
Figura 7. Factores que afectan la epidemiología de infecciones por helmintos. Tomado de Armour, 1980
En relación con la terapia antihelmíntica, y basados en el principio de que la inmunidad a los helmintos depende de la continua presencia de un bajo umbral de infección de parásitos adultos, se ha demostrado que, el intervalo entre el tratamiento y la re-infección puede influenciar la ocurrencia de infecciones posteriores; por ejemplo, si el pe río do entre el tratamiento y la re-infección es corto (dos semanas), entonces el hués ped se tor na rá susceptible, mientras que en períodos más largos (4-8 semanas), los animales han elevado su capacidad de resistencia.
3.) Introducción de animales susceptibles a áreas endémicas (infectadas). Esta situación se caracteriza por alta mortalidad, la cual ocurre, por lo común, a las pocas semanas de exposición, y es importante en animales jóvenes carentes de un estado de inmunidad sólida, en los cuales ejercen influencia como la raza, el tipo de hemoglobina y el sexo, a lo cual se suma el hecho de que la mayor parte de la inmunidad a los helmintos es lenta.
4.) Sin embargo, la helmintiosis también pue de presentarse cuando se introducen animales infectados a zonas no endémicas (limpias), pero con situaciones ambientales favorables para el desarrollo y supervivencia de los endoparásitos. La Figura 7 muestra los factores involucrados en la epidemología de de las enfermedades causadas por helmintos.
6. SUSCEPTIBILIDAD ANIMAL A LOS PARÁSITOS GASTROINTESTINALES
El efecto o el impacto que los nematodos gastrointestinales ocasionan en el ganado dependen de la susceptibilidad de éstos a aquéllos, la cual está casi siempre aso cia da a factores extremadamente complejos como la edad, la nutrición animal, los tipos de parásitos, las infecciones in ter cu rren tes, exposición previa de los animnales a los parásitos y la capacidad de respuesta de los hospedadores:
a.) Edad del animal y tipos de parásitos. Se ha demostrado que debido al desarrollo gra dual de la inmunidad posterior al con- tac to con nematodos, la susceptibilidad de los animales se incrementa con su edad (Thu ll ner et al., 1993; Colditz et al., 1996). Así, por ejemplo, se ha reportado que las in fec cio nes con T. vitulorum y S. papillosus per sis ten en terneros hasta el quinto mes de edad. Márquez et al. (2000), reportaron que los niveles de excreción de huevos y de Ooquistes de Eimeria spp. y huevos de nematodos disminuían a medida que se au men ta ba la edad.
Así mismo, Thullner et al. (1993), ob ser va ron en tereneros infecciones por S. pa pi llo sis y Trichostrongylus spp. hasta el quinto y octavo mes de edad, a causa del de sa rro llo de la inmunidad. En el Estado de Yu ca tán (México) se ha detectado una mayor pre- va len cia de endoparásitos del orden Strongyli da en terneros de tres a nueves meses de edad, fenómeno que puede aso ciar se al ma yor consumo de forrajes con ta mi na dos en la época del destete (Do mín guez et al., 1993). Craig et al. (1996), re por ta que los nematodos gastrointestinales de mayor pre va len cia en terneros jóvenes en el sur de los estados Unidos de América son C.oncophora, C. punctata y C. pectinata.
En Colombia, Márquez et al. (2000), han señalado que la mayor prevalencia de Cooperia spp. se manifiesta hasta los 18 meses de edad de los animales, con un mayor porcentaje en bovinos de cuatro a siete meses de vida.
Nutrición. Es conocida la interacción que existe entre la nutrición y el parasitismo, la cual se abordó desde dos puntos de vista: el del efecto del parasitismo en el me ta bo lis mo del hospedero y el de la influencia de la nutrición sobre la regulación de la población parasitaria en los animales, habiéndose precisado el efecto adverso que los parásitos internos ocasionan en la digestión y absorción de los nutrientes en el huésped, en el metabolismo de bovinos, en el sistema in mu ne de éstos y en la habilidad para contrarrestar las infecciones (Coop et al., 1996; Coop et al.,1999; Ketzis, 2002).
Exposición previa del huésped a los endoparásitos. La exposición previa de los animales a los parásitos determiná más ade lan te el grado de inmunidad que éstos de sa rro llen, la cual está asociada, en lo fun- da men tal, al manejo de las praderas que se practique en un sistema de producción determinado. De esta manera, los bovinos que han sido expuestos de manera gradual a desafíos parasitarios desarrollarán, en la misma forma, inmunidad a los nematodos gastrointestinales, en especial a partir del primer año de edad (Armour, 1985).
Raza. En los últimos 20 años se ha estudiado y establecido la posibilidad de explotar la variación genética en la resistencia de los rumiantes a los nematodos, a través de procesos de selección con resultados con tun den tes, según los cuales algunas razas, sobre todo las cebuinas, han mostrado resistencia a las infecciones parasitarias, así como a ciertos individuos de una mis ma raza (Gray, 1997; Waller, 1997).
Capacidad de respuesta del hospedero. La mayor o menor capacidad de res pues ta de los rumiantes a los nematodos gas tro in - tes ti na les está relacionada con la inmunidad innata o adquirida que éstos de sa rro llen, la cual los capacita para enfrentar con éxito los desafíos parasitarios. Esta inmunidad, o la manifestación de resistencia, pue de ser con tra nematodos adultos o contra estadios lar va rios (Balic et al., 2000; Klei, 1997).
La inmunidad contra los estadios adultos de nematodos gastrointestinales en rumiantes se manifesta de la siguiente manera:
- Por la expulsión de la población de nematodos adultos. Existen evidencias de que la expulsión de nematodos adultos en infecciones primarias de rumiantes no es lo común, reportándose, por el contrario, que la manifestación de resistencia está en fun ción del desarrollo de la inmunidad adquirida, producto de las infecciones re pe ti das.
- Por los cambios en la morfología de los nematodos adultos. Se ha demostrado que la inmunidad adquirida de los rumiantes, especialmente en ovejas, contra los nematodos gastrointestinales se manifiesta también reduciendo el tamaño de los parásitos adultos y/o reduciendo los labios vulvares de los parásitos hembras.
- Por la reducción de la fecundidad de los parásitos hembras adultas. Se considera que la reducción de la fecundidad de los parásitos gastrointestinales es el prin ci pal mecanismo regulador de las poblaciones de estos endoparásitos, la cual puede ser re sul ta do de la inmunidad adquirida de los rumiantes y/o de la alta densidad de la población parasitaria.
Las manifestaciones de resistencia a larvas de nematodos parásitos pueden expresarse mediante el desarrollo de larvas hipobióticas, fracasos en el establecimiento de las larvas infectivas en el organismo del huésped y/o expresión múltiple de resistencia a los nematodos.
Sin embargo, debe tenerse en cuenta que algunos factores como el estrés, la aplicación de corticoides, hembras periparturientas y la administración de ciertos antihelmínticos, entre otros, pueden disminuir la resistencia adquirida de los animales adultos.
7. DIAGNÓSTICO DEL parasitismo GASTROINTESTINAL
7.1. DIAGNÓSTICO CLÍNICO
Un requisito importante para el diagnóstico de las infecciones por endoparásitos es la comprobación de la especie parasitaria objeto de ataque. Un diagnóstico oportuno es a menudo difícil, debido a la ausencia de síntomas característicos, dando como re sul ta do el que se aplacen los correctivos sanitarios necesarios y adecuados, in cre men tán do se así los perjuicios económicos.
Esto implica la necesidad de llevar a cabo de manera oportuna un abordaje clínico y otro coprológico, para evitar el descenso en la producción de los animales (Jonson y Behnke, 1996).
Para el diagnóstico de infecciones por nematodos gastrointestinales del ganado, se han desarrollado varias técnicas, entre las cuales el examen coprológico juega un papel confirmatorio del diagnóstico clínico, no obstante estar su importancia orientada al monitoreo de las infecciones por nematodos en los rebaños. Para un diagnóstico clínico, los signos clínicos, combinados con la historia del animal, deberían ser suficientes, haciendo caso omiso del diagnóstico de laboratorio.
El diagnóstico clínico de una enfermedad parasitaria es a menudo difícil en la prác ti ca, puesto que las enfermedades pa ra si ta rias gastrointestinales agudas son raras, aunque pueden presentarse algunos casos agudos (Borchert, 1981). Ante la presencia de signos clínicos, el diagnóstico puede es ta ble cer se mediante una adecuada anam ne sis, para lo cual la época del año, la historia de pastoreo del animal, el último antihelmíntico suministrado a los animales y el manejo practicado en las fincas son elementos importantes a tener en cuenta, lo mismo que otros signos clínicos como la pérdida del apetito, la diarrea, la disminución del peso y el pelo sin brillo (Padilha, 1992).
Un elemento también importante es la influencia epidemiológica en la dinámica de la relación entre la excreción de huevos en las heces y la población de parásitos adultos, para lo cual es conveniente, para el pro fe sio nal que enfrenta un diagnóstico, co noz ca los tipos de trichostrongyliasis que de manera general afectan el ganado de una región determinada (Sewell, 1984), ya que por lo general las infecciones por hel min tos son mixtas, causadas por diferentes géneros y especies de nematodos, hecho que hace del diagnóstico clínico algo re la ti vo en comparación con el diagnóstico de laboratorio.
7.2. EXAMEN FECAL
El número de huevos de nematodos en he ces de rumiantes ha sido usado para es ti mar la severidad o intensidad de una infección. Sin embargo, este criterio es in su fi cien te, en razón a que la mayoría de las veces el recuento de huevos en materia fecal, no refleja, la mayoría de las veces, el nivel de infección por nematodos y, por lo tanto, debe ser usado con precaución como indicador de enfermedad clínica, en especial en ovinos (Coyné et al., 1991; Gas ba rre, 1996; Eysker y Ploeger, 2000).
La variabilidad en la expresión de la carga parasitaria de un animal está relacionada con factores como la historia previa de la exposición del animal, la especie y fecundidad de los parásitos, estado inmunitario del huésped y la variación del número de hue vos excretados en las heces en diferentes horas del día (Mckenna, 1981). Otros factores pueden alterar los recuentos de huevos en las heces, entre los que se destacan el volumen y el contenido de agua en ellas, el número de parásitos en capacidad de ovipositar y las fluctuaciones estacionales.
Otras de las utilidades de los exámenes coprológicos, no obstante las limitaciones que se han reportado, son:
- Útil en los estudios de resistencia antihelmíntica, a pesar de no detectar niveles bajo de resistencia.
- Eficaz en los procesos de selección de rumiantes resistentes por naturaleza a los nematodos gastrointestinales.
- Es el parámetro más usado en los es tu dios de infecciones por nematodos gastrointestina les dada su fácil aplicabilidad.
En casos de dificultad para realizar la necropsia a los animales que mueren, el diagnóstico en el rebaño puede basarse en la técnica del conteo de huevos por gramo de heces, la cual, no obstante sus limitaciones, es una herramienta importante para contribuir a mejorar las condiciones sanitarias de los animales, en particular de los rumiantes.
Se puede afirmar que los exámenes coprológicos, aun con las limitaciones que se han reportado, son útiles en los estudios de resistencia antihelmíntica, a pesar de no permitir detectar bajos niveles de resistencia; son eficaces en los procesos de selección de rumiantes resistentes por naturaleza a los nematodos gastrointestinales y son el parámetro más usado para estudiar las infecciones por nematodos gastrointestinales, dada la relativa facilidad de su aplicación.
7.3. INTERPRETACIÓN DE LOS HPG DE NEMATODOS GASTROINTESTINALES
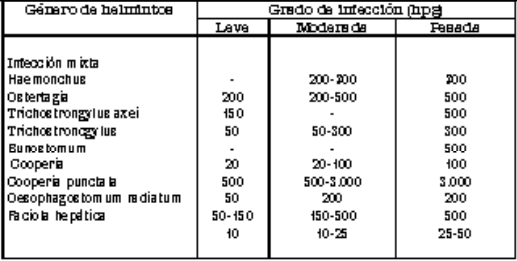
Si bien es difícil relacionar el significado de los recuentos de huevos por gramo de heces (hpg) con el número de nematodos que un animal alberga, es necesario des ta car que la correlación entre los recuentos y el grado de infección por helmintos (Ta bla 2), resultan apenas una guía para la toma de decisiones de los veterinarios, siem pre y cuando se tengan en cuenta las siguientes consideraciones (Ueno y Ca bral, 1998):
- El conteo de huevos no refleja el número de helmintos adultos presentes en los animales, en virtud de la reacción del huésped y las características propias de cada especie. Esta afirmación, es más aplicable en ovinos que en bovinos, en particular en los países templados, pues la situación no es del todo precisa en los bovinos de regiones tropicales. Además, los recuentos de hpg se traducen en una técnica valiosa en trabajos experimentales y “seguimientos de campo”, en los cuales una serie de recuentos de hpg de animales con hostoria clínica conocida provee información sobre la magnitud de la carga parasitaria, o sobre la reacción del hospedador frente a los endoparásitos (Mendoza de Gives, 2000).
- Los nematodos que parasitan animales adultos ponen menos huevos que los que parasitan animales jóvenes, en virtud de la consolidación del estado inmunitario de los primeros y de la mayor susceptibilidad de los segundos.
- Las formas inmaduras de los helmintos no producen huevos, razón por la cual no es posible detectarlos a través de los métodos coprológicos.
- Para una adecuada interpretación de la relación entre el hpg y los helmintos adultos, es necesario considerar las experiencias locales, las condiciones nutricionales de los animales, el manejo y las condiciones clínicas de los mismos.
- Los animales bien nutridos y portadores de un número grande de helmintos, por lo común no presentan síntomas clínicos, mientras que los animales mal nutridos, portadores del mismo grado de infección, presentan una exaltación de los síntomas clínicos.
- Un reducido número de helmintos no siempre es indicativo de síntomas leves en el animal. Así, por ejemplo, en casos de ostertagiosis y Oesopphagostomiosis la patogenicidad de éstos es superior al número de helmintos en los animales, pudiendo causarles la muer te antes de que estos nematodos alcancen su maduración completa.
Tabla. 2. Guía para la interpretación de huevos de helmintos de bovinos.
8. CONTROL DEL PARASITISMO GASTRO INTESTINAL
Puesto que la erradicación de los parásitos no es muy práctica, el objetivo del control de los nematodos gastrointestinales debe dirigirse a limitar el contacto hospederoparásito, desarrollando sistemas de producción en los cuales la población de parásitos no exceda los niveles compatibles con los niveles de producción económica en estos sistemas, esto es, que no afecten la salud o el óptimo desempeño productivo de los bovinos (Craig, 1996).
En este contexto, se ha propuesto un amplio menú de alternativas de control, unas implementadas y otras en desarrollo hasta ahora, basadas en la epidemiología y la dinámica poblacional de estos parásitos, entre las que se destacan el manejo racional de antihelmínticos, el manejo de pasturas, la selección de animales resistentes, el control biológico, el uso de pasturas con ta ni nos concentrados, etc. (Williams, 1997; Van Wyk et al. 1998; Veracruysse, 1999). Un aspecto esencial que debe señalarse es que cualquier medida de control recomendada debe ser un instrumento más a ser utilizado en el contexto epidemiológico de un particular sistema de producción (Barger, 1997), la cual debe estar sujeta a las metas de producción de los productores.
Hasta ahora, el método de control de mayor aplicación es el uso irracional de medicamentos antihelmínticos, situación que ha conducido al surgimiento de la resistencia a estas sustancias en las poblaciones de nematodos. Para compensar esto, los productores recurren a incrementar la frecuencia de los tratamientos, sobre todo con drogas de actividad persistente, situación que ha agravado el problema del parasitismo en las fincas a causa de la insostenibilidad económica y ambiental de esta práctica, y producido estos resultados:
a) Magnificación del problema parasitario en fincas.
b) Gasto innecesario de productos antiparasitarios.
c) Riesgo para la salud humana por la presencia de residuos químicos en productos de origen animal.
d) Alto riesgo de aparición de resistencia en los nematodos a los compuestos químicos de mayor frecuencia de uso.
e) Contaminación del medio ambiente debido al uso de lactonas macrocíclicas (aver mec ti nas).
Estas no despreciables consecuencias del uso irracional de los compuestos químicos, aunado al cada vez mayor interés de los consumidores por los problemas ambientales, por una producción más limpia y por la aparición de la resistencia a los anti parasitarios (Anziani et al., 2001; Sonstegard et al., 2001; Suárez, 2002; Waller, 1999), ha conducido a que algunos productores ini cien cambios en los enfoques para el control de las infecciones por endoparásitos en sus sistemas de producción ganaderos.
Situación que los inducirá a introducir elementos sostenibles, de tal manera que para los que no cambien de opciones o alternativas las infecciones parasitarias continuarán siendo una causa importante de pérdidas económicas en sus sistemas de producción, aparte de que sus prácticas insostenibles los hará no competitivos (Sons te gard et al., 2001; Salles, 2002) y, quizá, los lleve a abandonar la actividad ganadera (Waller, 1999).
En la actualidad, el consenso entre los parasitólogos es integrar la mayor cantidad posible de medidas de control (Waller, 1993; Uilenberg, 1996), pero el desarrollo de éstas es, por una parte, muy lenta en comparación con las necesidades de los productores y, por otra, muchas de las medidas de control propuestas se encuentran en fase de experimentación, no encontrándose entonces disponibles en su totalidad.
Al margen de las alternativas empleadas para el control de los parásitos gastrointestinales, un programa adecuado de control de helmintos requiere del conocimiento local o regional de los siguientes aspectos:
a) La fluctuación en el tiempo de la carga parasitaria en los animales, la prevalencia de los distintos géneros de parásitos en los predios y las épocas de mayor contaminación de las praderas.
b) El conocimiento de la bioecología de los parásitos, es decir, el conocimiento de los estados de vida libre en el estiércol y en las praderas.
c) Períodos en los cuales los animales se afectan por el incremento de los efectos de los parásitos internos.
d) La influencia de los sistemas de pastoreo sobre la dinámica de las enfermedades en los animales.
Por otra parte, puesto que cada especie de parásito debe considerarse como un sistema complejo de interacciones entre el huésped, el parásito y el medio ambiente de un sistema de producción determinado, el control de los parásitos internos depende también de:
- Sistema de producción (leche, carne, doble propósito).
- Clima: templado o tropical.
- Manejo practicado en fincas: sistemas de pastoreo.
- Especies de helmintos involucrados.
En los sistemas de producción ganaderos, el control de los nematodos gastrointestinales en rumiantes abarca dos niveles: el del hospedero y el del ambiente.
8. 1. CONTROL EN EL HOSPEDERO:
Este se efectúa con el uso de antihelmínticos, de vacunas, de animales resistentes, con el mejoramiento de la nutrición animal o suplementación alimenticia y la etnoveterinaria.
8.1.1. Control Mediante el Uso de Antihelmínticos
Para el control de los nematodos con antihelmínticos existen diferentes estrategias, destancándose las siguientes (Bianchin et al., 1993):
- Tratamiento preventivo extensivo: basado en la aplicación de tratamientos durante largos períodos, determinados en lo fundamental por la persistencia del antiparasitario empleado, como, por ejemplo, los antihelmínticos usados mediante el sistema de liberación lenta, que tienen la doble desventaja de seleccionar para resistencia por no remover el 100% de los parásitos adultos, y la presencia de residuos en los productos de origen animal.
- Tratamiento curativo, de salvamento o de emergencia: dirigido a la aplicación de tratamientos sólo a los animales clínicamente enfermos, y cuya desventaja es el riesgo de muerte de los animales o del incremento de las pérdidas indirectas.
- Tratamiento táctico: tiene como objeto tratar los animales cuando van a ser trasladados a otras áreas o praderas recién formadas, para evitar así el aumento de la contaminación ambiental. El tratamiento táctico requiere del conocimiento de los ciclos de los parásitos internos y de los factores que desencadenan los procesos de traslación de larvas infectivas en las pasturas, como ocurre cuando se presentan lluvias en épocas de verano.
- Tratamiento estratégico: en relación con este programa, es necesario precisar que el tratamiento estratégico es un concepto estadístico que se basa en la probabilidad de ocurrencia de ciertos eventos epidemiológicos en ciertas épocas del año en las condiciones normales de una región, por lo cual estos es que mas precisan del conocimiento de la dinámica de la traslación de las larvas y de la identificación de las épocas críticas de los tratamientos, con el objeto de interrumpir este proceso. Ade más, este tipo de control tiene en cuenta la menor cantidad de larvas de endoparásitos existentes en las pasturas durante las épocas secas del año (Willia ms, 1997).
Es probable que una de las fragilidades del esquema estratégico de control es el in ten to de hacer coincidir los tratamientos antihelmínticos con otras actividades en las fin cas, lo cual puede hacer depender este es que ma del resto de actividades propias del sistema de producción, perdiendo de vista que las épocas estratégicas no siempre son las mismas que pertenecen a otras la bo res. Esto no significa, sin embargo, que el control estratégico deba ser una actividad ais la da en un sistema de producción.
Por lo anterior, a diferencia del control tra di cio nal practicado por los productores, que es esencial curativo, el programa es tra té gi co debe realizarse en las épocas, edades y categoría de animales definidas con anterioridad.
En época reciente, este tipo de control se validó de manera satisfactoria en 13 fincas ganaderas de pequeños y medianos productores de tres pisos térmicos (frío, medio y cálido) de Cundinamarca y Boyacá (Már quez et al., 2003). Los resultados de este trabajo permitieron sacar las siguientes conclusiones para llevar a cabo controles de tipo estratégico:
a. Realizar un primer tratamiento al inicio del verano: El fundamento de éste consiste en bajar la carga parasitaria de los animales y, por consiguiente, reducir el nivel de contaminación de las praderas y la tasa de traslación de larvas infectivas en las pasturas en la época menos favorable (épocas secas) para la su per vivencia de estas larvas.
b. El segundo tratamiento debe efectuarse al final de la época seca, con el objeto de remover los parásitos adultos que sobrevivan al primer tratamiento y mantener la interrupción de la traslación de las larvas. Si se tuviera conocimiento de veranos prolongados, un tratamiento en la mitad de éste se recomendaría. Con este esquema se logra una reducción de la población de parásitos internos en los animales y un bajo nivel de contaminación de los pastos al inicio del próximo invierno.
c. Hacer tratamientos selectivos o limitados, en especial en los animales jóvenes hata el destete, es decir, no tratar animales adultos, pues éstos generalmente han desarrollado un adecuado nivel de inmunidad, hecho que se refleja en los bajos niveles de excreción de huevos (Márquez et al., 1999; Márquez et al., 2000; Márquez et al., 2003). Con esta práctica se mantiene en refugio un buen porcentaje de la población de parásitos, previniéndose la selección para resistencia.
La población de parásitos en refugio es el factor más importante a tener en cuenta en el momento de diseñar e implementar es que mas de control parasitario con miras a disminuir la velocidad de desarrollo de resistencia a los antiparasitarios. La población en refugio es la subpoblación de parásitos que no se expone a una particular medida de control (antihelmíntico), escapando, por lo tanto, para resistencia. Para el caso particular de los nematodos gastrointestinales, la población refugio la constituye la porción de población en estado de vida libre en las pasturas (Van Wyk, 2001).
El tratamiento selectivo debe ser practicado con rigor sobre todo antes o después de períodos de poco refugio, como ocurre cuando las condiciones ambientales son hostiles para la supervivencia de los estados de vida libre de los nematodos gastrointestinales (Van Wyk, 2003). Esta situación es la que sucede en las regiones tropicales.
d. Mediante pruebas de laboratorio, es necesaria la identificación de los parásitos internos que prevalecen en los predios, por que permite seleccionar en forma adecuada los antihelmínticos, en atención a que no todos estos medicamentos poseen el mismo nivel de efi ca cia contra todos los endoparásitos y a que no todos los nematodos del ganado presentan el mismo grado de patogenicidad.
e. Hacer rotaciones anuales de los antihelmínticos. Aunque esta recomendación no está dilucidada en su totalidad, es la más aceptada hoy en día por parte de los parasitólogos a nivel mundial.
f. Vermifugar los animales según el peso de éstos, ya que así se evita sub dosificar los o sobredosificarlos.
No obstante las bondades del control estratégico, éste presenta algunas limitaciones o desventajas que es necesario mencionar:
Variaciones climáticas: cuando ocurren variaciones en el clima de una región, en particular en el patrón del régimen de las lluvias, la dinámica de las poblaciones de larvas en las pasturas se modifica, con la consecuente modificación de las cargas de los helmintos en los animales, lo cual implica hacer ajustes o tratamientos adicionales, como se mencionó en el párrafo del tratamiento número dos.
Necesidad de conciliación con el manejo general de la finca: los tratamientos estratégicos no deben depender de otras actividaes de las fincas, puesto que aquéllos son definidos previamente.
Efectos a mediano plazo: los efectos de esta estrategia no son inmediatos, lo cual puede conducir al desánimo del productor. Por el contrario, sus efectos son visualizados a mediano plazo (dos a cuatro años), en la medida en que es una al ternativa de carácter preventivo, que busca disminuir los niveles de contaminación de las praderas y, por tanto, evitar altos niveles de infección de los huéspedes para no comprometer la productividad del sistema de producción.
Aparición de cepas resistentes: lo cual depende, en lo fundamental, del tamaño de la población en refugio. El uso de los antiparasitarios debe hacerse con dos objetivos:
a) Eliminación del parásito o, lo que debería ser ideal, mantener la carga parasitaria a niveles tolerables por el animal y compatibles con la productividad del sistema de producción, debido a que no existe ningún antiparasitario que actúe contra todos los tipos de parásitos y en todas las fases de su desarrollo.
b) Prevenir las reinfecciones, o reinfestaciones si se trata de parásitos externos.
Estos compuestos deben seguir ciertas condiciones o tener las siguientes propiedades deseables:
- Eficacia: debe tener un amplio espectro de actividad y ser capaz de destruir el mayor porcentaje posible de parásitos, actuando sobre todas las fases de su desarrollo. Generalmente, se dice que un antiparasitario es eficaz cuando el porcentaje de reducción es del 95%, mientras que reducciones inferiores al 75% catalogan al compuesto como ineficaz, siempre y cuando la dosificación se ajuste a la recomendada.
- Que no altere el desarrollo normal del animal: es decir, que no tenga efectos colaterales: algunos antiparasitarios pue den ser poco selectivos, actuando so bre las células del huésped.
- No dejar residuos en los tejidos y en los productos de origen animal.
- Posibilidad de administración por varias vías.
- Facilidad de administración.
- Tener un elevado margen terapéutico.
- Económicamente aceptable.
- Baja toxicidad para el huésped y el me dio ambiente. Estos compuestos re quie ren un período de supresión previo al sacrificio.
Los antihelmínticos se administran por diferentes vías, a saber:
- Parenteral: intramuscular (IM) o subcutánea (SC).
- Oral: indicada para equinos y animales de compañía. Puede usarse en bovinos aun que se dificulta su aplicación cuando se requiere tratar grandes lotes de animales.
- Transcutánea o percutánea: usada cuan do las formulaciones son de tipo spot-on o pour-on. Las preparaciones de estos compuestos contienen un vehículo especial que permite la absorción de la droga a través de la piel. A pesar de ser más caras, facilitan la administración de la droga a grandes rebaños.
- Bolos de liberación lenta: son preparaciones (comprimidos) que, mediante la acción de los microorganismos ruminales sobre los bolos, permite la liberación lenta de la droga.
Algunas consideraciones relacionadas con el hospedero y el animal deben tenerse en cuenta con el objeto de realizar un manejo prudente del antiparasitario y lograr una mejor eficacia:
- Hospedero:
- Especie y raza: tiene relación especialmente en las diferencias de las dosis terapéuticas requeridas entre especies, en particular en pequeños rumiantes.
- Edad: con el objeto de lograr una inmunidad gradual y sólida en los hos pe de ros se debe evitar el uso de anti parasitarios en animales que no hayan tenido experiencias previas con endoparásitos y, por lo tanto, hayan madurado su sistema enzimático.
- Carga parasitaria: animales debilitados por altos niveles de infección parasitaria requieren de adyuvantes (suplementos) cuando son objeto de tratamientos con antiparasitarios.
- Peso: el ajuste de la dosis de un medicamento con base en el peso de los animales es importante por cuanto se disminuye la velocidad de desarrollo de la resistencia a los antihelmínticos.
- Estado fisiopatológico del animal: se relaciona con el cuidado que debe te ner se con animales debilitados o en gestación.
- Parásito. El estado de susceptibilidad o de resistencia de los parásitos gastrointestinales a los antiparasitarios es factor clave en la eficacia de un antihelmíntico.
8.1.2. Uso de Vacunas
Éstas constituyen la alternativa más deseable para combatir las infecciones del ganado por helmintos, por su condición no química de control, esperándose que en el futuro el uso de ellas, basadas en antígenos recombinantes sea una realidad (Knox, 2000). Esfuerzos recientes se hacen en este campo, siguiendo el modelo de las vacunas contra Dictyocaulus viviparus y D. filaria. Sin embargo, los resultados en este campo no son nada satisfactorios dada la no viabilidad de producir vacunas comercialmente y el desuso en que han caído las vacunas irradiadas (Nari et al., 2000). A pesar de ello, con excepción de la vacuna contra D. viviparus, no existen vacunas disponibles en el comercio. Son pocos los progresos existentes en este aspecto para bovinos, en contraste con lo que ocurre en el campo de los ovinos. Varias razones se esgrimen para explicar esta situación:
1a.) los principales laboratorios que trabajan vacunas contra helmintos orientan su trabajo hacia los ovinos; 2a.) hasta ahora, la resistencia antihelmíntica ha sido un problema en ovinos, más no en bovinos; 3a.) los nematodos de los ovinos, en especial Haemonchus, son un problema mayor que los nematodos de los bovinos; 4a.) los bovinos son animales experimentales costosos y 5a.) se necesita acumular mayor in for ma ción de los hospederos y los parásitos (Ver cruys se y Dorny, 1999).
8.1.3. Uso de Animales Resistentes
Algunas razas de rumiantes han demostrado poseer la característica deseable de ser resistentes por naturaleza a los nematodos gastrointestinales. Por resistencia se en tien de la habilidad de algunos animales para prevenir o limitar el establecimiento o el subsecuente desarrollo de infección por helmintos. Tolerancia es la capacidad de ciertos bovinos para man te ner una bue na productividad no obs tan te la presencia de infección.
Al respecto, se ha realizado algunos es tu dios en bovinos como en pequeños rumiantes, en Australia y Nueva Zelanda, cen tra dos en la correlación directa que existe en tre el conteo de huevos en heces y la carga parasitaria de los animales jóvenes. El ni vel de excreción de huevos fecales ha demostrado ser heredable, sugiriéndose la práctica de selección de animales resistentes en fincas como una de las alternativas para el control de endoparásitos (Barger, 1996; Waller, 1999).
8.1.4 Mejoramiento nutricional o suplementación alimenticia.
Este aspecto debe ser de con si de ra ble importancia por la relación si nér gi ca entre el nivel de infección por hel min tos y la mal nu tri ción, reportándose que animales que reciben suplementación ali men ti cia re du cen el número de huevos de hel min tos por gramo de heces, situación que podría interactuar con el genotipo del animal, lo cual indica que las pérdidas de pro duc ción y las tasas de mortalidad debidas al parasitismo gastrointestinal disminuyen en los sis te mas de producción de bovinos ali men ta dos en forma adecuada (Ketzis, 2002).
8.1.5. Etnoveterinaria
Los medicamentos antihelmínticos provienen del uso de extractos y productos de plantas, como los aceites de castor y el que no po dio, a partir de un sinnúmero de plan tas que poseen propiedades antihelmínticas, las cuales cayeron después en desuso con el advenimiento de los más seguros y eficaces antihelmínticos sintéticos. Sin embargo, ha surgido un renovado interés en el campo de la salud animal tradicional tan- to en países en vías de desarrollo como en los industrializados, debido al ago ta mien to del recurso antihelmíntico sintético y a los problemas ambientales ocasionados por su uso irracional (Waller, 1999).
En este sentido, existen reportes sobre las propiedades antihelmínticas de algunas plantas como las leguminosas por las altas concentraciones de taninos condensados en estas dicotiledoneas, los cuales pueden afec tar a los nematodos gastrointestinales y mejorar la productividad de los bovinos.
8.2. CONTROL AMBIENTAL
8.2.1. Manejo de Praderas o del Pastoreo
Puesto que los pastos constituyen un puen te de unión entre los estados de vida libre de los endoparásitos y los huéspedes, el eje central del manejo de praderas es diseñar esquemas que reduzcan las posibilidades de contacto entre las larvas infectivas de los parásitos en los pastos y el hospedero. Debe ser una práctica ideal en los es que mas de control de parásitos siempre que las situaciones particulares de los predios lo permitan. Con esto se logra reducir los estados de vida libre de los nemátodos por falta de alimento al no haber hospederos disponibles, disminuyéndose las po si bi li da des de contacto entre los animales y las larvas infectivas, obteniéndose, al final, pas tu ras seguras con bajos niveles de contaminación parasitaria (Morelly et al. 1980).
Desde el punto de vista del manejo, pra de ras “libres de parásitos”, “des con ta mi na das” o parasitológicamente “controladas” pueden obtenerse mediante sistemas de pastoreo rotacional y/o pastoreo alterno.
Pastoreo rotacional. Consiste en la división de las praderas en un número variable de potreros que permitan el movimiento periódico y secuencial de los animales con períodos de ocupación y descanso; la división de potreros puede hacerse mediante cercas eléc tri cas movibles o con el sistema tradicional. Este sistema aventaja al pastoreo continuo, en cuanto permite las posibilades para que los ciclos parasitarios se desarrollen y se re in fec ten los animales de manera periódica.
Los beneficios del control parasitario a través del pastoreo rotacional pueden lograra se a través de dos alternativas: del tiem po de permanencia en los potreros o del tiem po de descanso, la elección de las cua les dependerá de la mayor o menor capacidad de reinfección que pueda ocurrir en los bovinos, fenómeno que se relaciona, a su vez, con el tipo de clima. Así, por ejemplo, tiempos de permanencia inferiores a siete días impiden la reinfección de los hospederos provenientes de la contaminanción de las praderas por los propios animales, pues to que la disponibilidad de las larvas será posible cuando los bovinos hayan aban do na do los potreros.
Lo anterior se debe a que a pesar de ser más rápido y exitoso el desarrollo de los es- ta díos de vida libre de los nematodos en las regiones templadas que en las tropicales, su lon ge vi dad es mucho más corta en los climas tropicales (Waller, 1999), lo cual permitiría un mayor éxito en la rotación de potreros, basada en el tiempo de permanencia, en es tas regiones, dada la mortalidad importante de larvas L3 que ocurren entre la cuar ta y sexta semana de edad en estas zonas.
Pastoreo alterno. Este tipo de pastoreo es una alternativa eficaz para el control de los nematodos gastrointestinales, toda vez que se obtienen pasturas seguras utilizando diferentes especies de rumiantes (bovinoovino) o distintas categorías dentro de una misma especie.
El fundamento del pastoreo alterno radica en (Nari et al., 2000):
- La tendencia a desarrollar nematodos en bovinos y ovinos es diferente o que, si exis te transmisión cruzada ésta sea de poca importancia. Esto hace que durante el tiempo en que los bovinos estén pastoreando no se está produciendo contaminación para los ovinos y las larvas L3 pre- sen tes disminuyen sus poblaciones por la acción de los factores climáticos.
- Se mantiene libre la pradera del hospedero o categoría animal objeto de control, impidiéndose el ciclo de las especies parasitarias específicas.
- Los bovinos mayores de 18 meses po seen un buen estado inmunitario con tra nematodos gastrointestinales, los cuales actúan como “aspiradoras” de larvas que, luego de ser ingeridas, no podrán desarrollarse y contaminar los pastos.
Las principales bondades del manejo de praderas son (Salles, 2002):
- El manejo de pasturas permite la racionalización del control químico.
- Existe información adecuada acerca de cómo diferentes sistemas de pastoreo pue den dterminar pasturas seguras y cómo ellas benefician desde el punto de vista del control parasitario.
- Las pasturas seguras pueden ser utilizadas como una herramienta dentro del Control Integrado de Parásitos, para el control de la resistencia antihelmíntica.
- Los sistemas a aplicar dependen de algunas variables, para lo cual la información epidemiológica es esencial.
- La mayor limitante puede ser la dificultad o imposibilidad del ganadero para integrar estas alternativas en el ma ne jo de su finca.
El manejo adecuado de praderas debe estar basado en la epidemiología de los helmintos, en el cual es indispensable el conocimiento de las variaciones ambientales (temperatura y humedad) y de la supervivencia de las fases no parasíticas para poder estimar los intervalos de descanso de las pasturas; situación que dificulta la implementación de esta alternativa en Colombia por la escasa o casi nula información epidemiológica de estos parásitos en las diferentes áreas agroecológicas de nuestro país.
8.2.2. Control Biológico
El control biológico ha sido definido como un medio ecológico desarrollado por el hom bre con el objeto no de eliminar las poblaciones parasitarias, sino para reducir las a densidades subclínicas aceptables, o para conservar esta población en niveles no per ju di cia les para los animales, usando an ta go nis tas naturales vivos, dirigido, particularmente, al control de los estadios de vida libre en las praderas (Larsen, 2000).
El control biológico de los nematodos pa- ra sí ti cos está orientado al control de los estados de vida libre de los endoparásitos (Waller, 1997), en contraste con los quimio-terapéuticos que atacan la fase parasítica en los hospederos. Hasta ahora, es Dudding- to nia flagrans, el hongo que ha demostrado tener mayor habilidad para reducir las larvas de parásitos tri chos tron gyli dos en heces de animales (Larsen, 1999; Padilha, 1999; Vercruysse y Dorny, 1999).
Este hongo pasa a través del tracto gas tro - in tes ti nal de los hospederos como esporas sin sufrir alteración alguna, las cuales ger mi nan después y se extienden por toda la materia fecal fresca para atrapar larvas en movimiento antes de que migren a los pas tos (Waller, 1999). Aparte de D. flagrans, existen otras especies de hongos que tie nen esta habilidad (Nari, 2000), los cuales pueden actuar en los huevos, en las larvas en desarrollo o en las larvas infectantes, por medio de diferentes estructuras (anillos constrictores, hifas, redes, etc.) que de sa - rro llan en presencia de nematodos (Pa dil ha y Mendoza-de Gives, 1996; Ketzis, 2002).
8.2.3. Silvopastoreo
Una nueva alternativa surge en el escenario de los endoparásitos de bovinos como propuesta para el control de los nematodos gastrointestinales de rumiantes, sobre todo en regiones tropicales/subtropicales: el silvopastoreo. Un sistema silvopastoril (SSP) es una opción de producción en el cual árboles y arbustos interactúan con pastos y animales bajo un sistema de manejo integral (Babbar, 2003).
Los sitemas silvopastoriles pueden mitigar el impacto de los endoparásitos en el ganado directa e indirectamente por el estado de confort y mejoramiento nutricional de los animales, en particular por Soca et al., 2001:
- El mayor volumen de biomasa comestible producido, lo cual le permite a los animales hacer una mejor selección de los alimentos.
- La alimentación de los animales con las partes más altas de las plantas (ramoneo) disminuye los consumos cercanos al suelo y, por tanto, los niveles de infección con endoparásitos, pues es conocido que la mayor cantidad de larvas L3 selocalizan entre 0 – 25 cm de altura de los pastos.
- La altura de la biomasa debajo de estos sitemas es superior a los 35 cm, dificultando la traslación de estas larvas a los ápices de estas plantas, lo cual disminuye las posibilidades de infección de los huéspedes.
- El mayor desarrollo de una fauna coprófaga contribuye a la descomposición rá pi da de las excretas, impidiendo, por lo tanto, el desarrollo de las larvas a estados infectivos.
Debido a la no sostenibilidad del principal esquema de control parasitario tradicional men te empleado (compuestos químicos), la tendencia actual es la combinación ade cua da de diferentes alternativas de control (quí mi cas y no químicas), la cual ha demostrado ser más eficaz y sostenible que la dependencia a un solo método de control Esta estrategia es conocida como Control Integrado de Parásitos (CIP). El CIP es definido como el uso racional de medidas de control biológicas, biotecnológicas y no quí mi cas con prácticas de manejo o estrategias de selección de razas, con el propósito de reducir el uso de agentes químicos a un mínimo absoluto (Thamsborg et al., 1999). O, lo que es lo mismo, es la integración planeada de una serie de alternativas que apun te a la minimización del uso de pesticidas (antihelmínticos) y la maximización de los beneficios de la producción.
Uno de los problemas serios que tiene la aplicación del CIP, en especial en países no desarrollados, es que éste es más complejo y exigente que los métodos con ven cio na les de control, por cuanto requiere mayor planificación e inversión por parte de los productores, además de las renuencias pro pias de los productores por aquello de per ci bir que los métodos fáciles y simples de control empleados por ellos todavía les funcionan “bien”. Ante esta realidad, un fuerte componente de transferencia de tecnología se requerirá en estos países, lo cual es poco probable que ocurra dado el cada vez menor esfuerzo estatal destinado a esta actividad.
Van Wyk (2003) puntualiza lo siguiente so bre la necesidad de hacer una evaluación urgente sobre lo hecho hasta ahora en re la ción con el control parasitario, y decidir sobre las acciones para lograr un control sostenible de endoparásitos:
- Concentrarse en lo más importante, esto es, desestimular todo aquello que vaya en contra de la protección de la población de parásitos en refugio, lo mismo que de las actividades que tengan poco o ningún efecto en mejorar la sostenibilidad del control de los nematodos gastrointestinales.
- El imperativo de realizar sólo tratamientos selectivos o limitados.
- Condenar todo método no sostenible en el marco del CIP.
- Propender por la producción óptima y sostenible en los sistemas de producción, en vez de la próducción máxima de los animales.
- Estar atento a las ayudas disponibles como el manejo de praderas, el control racional de antihelm|ínticos, el uso de animales resistentes, etc., además de la medición de la condición corporal de los animales con el fin de identificar y tratar selectivalemente solo a los animales más rezagados.
Según Karlsson et al. (2002), los principales componentes del Control Integrado de Parásitos son:
1. Incremento o mejoramiento de la resistencia del hospedador.
1.1 Resistencia innata mejorada.
1.2 Respuesta innmune adquirida incrementada.
1.2.1 No genética (Nutrición, estimulación del sistema inmune).
1.2.2 Genética (Selección de razas, se lección de animales resistentes).
2. Mejoramiento de Manejo
2.1 Monitoreo de la carga parasitaria (recuento de hpg).
2.2 Evaluación del umbral de desafío para diferentes clases de ganado.
2.3 Índice del nivel de desafío de las parcelas.
2.4 Adecuado conocimiento ecológico de la relación huésped-parásito.
3. Control biológico/ambiental
3.1 Reducción del desafío larvario en las praderas.
3.2 Optimizar los aspectos no genéticos de la respuesta inmune. Nutrición óptima, etc.
3.3 Utilización de plantas naturales con factores antiparasíticos, con altos contenidos de taninos, por ejemplo.
4. Uso selectivo de compuestos químicos
4.1 Vermifugación selectiva.
4.2 Reducción de la presión de selección sobre los parásitos, basada en el mantenimiento de una alta proporción de la población refugio, etc.
REFERENCIAS BIBLIOGRÁFICAS
Alarcón, J.A., Aldemar, O., Cardona, H.R. 1983. Estudio epidemiológico del parasitismo gastrointestinal, he pá ti co y pulmonar del ganado lechero del de par ta men to del Cesar. Acovez. Vol. 7, No. 4, 21-27.
Anziani, O.S.; Zimmermann, G.; Guglielmone, A.A.; Suárez, V.H.; Vásquez, A.R. 2001. Avermectin resistance in Cooperia pectinata in cattle in Argentina. Veterinary Record. Vol. 149. p. 58-59.
Armour, J. 1980. The epidemiology of helminth disease in farm animals. Vet er i nary Parasitology. Vol. 6, 7-46.
Babbar, L. 2003. Sistemas silvopastoriles. En: Curso Sistemas Agroforestales Tropicales. Memorias. Corpoica – CATIE. Mosquera, Cundinamarca, Co lom bia.
Balic, A.; Bowles, V.M.; Meeusen, E. 2000. The inmunobiology of Gastrointestinal Nematode Infections in Ru mi nants. Advances in Parasitology. Vol. 45. p. 183-241.
Barger, I.A.; Lewis, R.J.; Brown, G.F. 1984. Survival of infective larvae of nematode parasites of cattle during drought. Veterinary Parasitology. Vol. 14. p. 143-152.
Barger, I.A. 1996. Prospects for Integration of Novel Parasite Control Options into Grazing Systems. In ter na tion al Journal for Parasitology. Vol. 26, No. 8/9. p. 1001-1007.
Barger, I.A. 1997. Control by management. Veterinary Parasitology. Vol. 72, No. 3-4, 493-506.
Bianchin, I.; Honer, M.R. Nunes, S.G., Nascimento, Y.A., Curvo, J.B.E; Costa, F.P. 1993. Epidemiologia dos nematodeos gastrintestinais em bovinos de corte nos cerrados e o controle estratégico no Brasil. Campo grande. EMBRAPA-CNPGC, 120 P.
Borchert, A. 1981. Parasitología veterinaria. Ed. Acribia. Zaragoza, España.
Brunsdon, R. 1980. Principles of helminth control. Veterinary Parasitology. Vol. 6, 186-215.
Chiejina, S.N. and Fakae, B.B. 1989. The ecology of infective larvae of bovine gas trointes ti nal trichostrongylids in dry season contamined pastures in the Nigerian savanna. Journal of Helmintology. Vol. 63. p. 127-139.
Colditz, I.G.; Watson, D.L.; Gray, G.D.; Eady, S.J. 1996. Some relationships between age, immune re spon sive ness and resistance to parasites in ruminants. In ter na tion al Journal for parasitology. Vol. 26 N0. 8-9, 869-877.
Connan, R.M. 1996. Observations on the epidemiology of gastrointestinal nem a todes of farmer red deer in central southern England. Veterinary record. Vol. 139, 228-232.
Couvillon, C.E.; Sieker, C. ; Evans, R.R. 1996. Epidemiological study of nematode infections in a grazin beef cow-calf herd in Missisippi. Veterinary parasitology. Vol. 64, 207-218.
Coop, R.L.; Holmes, P.H. 1996. Nutrition and parasite interaction. International Journal for Parasitology. Vol. 26, No.8-9, 951-962.
Coop, R.L.; Kyriazakis, I. 1999. Nutrition-parasite interaction. Veterinary Parasitology. Vol. 84. p. 187-204.
Coyne, M.; Smith, G.; Hohnstre, C. 1991. Fecundity of gastrointestinal Trichostrongylid nematodes of sheep in the field. American Journal Veterinary Research. Vol. 52, No.7, 1182-1187.
Craig, T.M.; Wikse, S.E. 1996. Control programs for internal parasites of beef cattle in the southern United States. Department of Veterinary pathobiology, Texas. 1-6
Dijkstra, Th.; Barkema, H.W.; Eysker, M.; Beiboer, M.L.; Wouda, W. 2003. Evaluation of a single se ro log i cal screening of dairy herds for Neospora caninum antibodies. Veterinary Parasitology. Vol. 110. p. 161-169.
Domínguez, J.L.; Rodríguez, R.I.; Honhold, N. 1993. Epizootiología de los parásitos gastrointestinales en bovinos del Estado de Yucatán. Vet. Mex. Vol. 24, No. 3, 189-193.
Drugueri, L.; Modern, D. 2002. Coccidiosis en bovinos. http://www.zoetecnocampo.com/Do cu men to/eimeria/ .
Dubey, J.P. 2003. Review of Neospora caninum and neosporosis in animals. The Korean Journal of Par a si tol o gy. Vol. 41, No. 1, 1-16.
Eysker, M.; Ploeger, 2000. H.W. Value of present diagnostic methods for gastrointestinal nematode in fec tions in ruminants. Parasitology. No. 120, 109-119.
Echevarria, F. 1996. Epidemiología das helmintiasis em rumiantes em pastoreio en condiçôes de trópico. En: Memorias Curso-Taller Internacional de Epidemiología y Diagnóstico de Endoparásitos en rumiantes. Cor po - ra ción Colombiana de Investigación Agropecuaria, Programa Nacional de Epidemiología Veterinaria. Santafé de Bogotá. 220 p. (Biblioteca Agropecuaria de Co lom bia).
Fabiyi, J.P. and Copeman. D.B. 1989. Inhibited development of trichostrongylid worms in grazing cattle. Australian Veterinary Journal. Vol. 6, No. 66, 240-243.
Fritsche, T.; Kaufmann, J.; Pfister, K. 1993. Parasite spectrum and seasonal epidemiology of gastrointestinal nematodes of small ruminants in Gambia. Veterinary Parasitology. Vol. 49. p. 271-283.
Gasbarre, L.C.; Leighton, E.A.; Bryan, D. 1996. Reability of a single fecal egg per gram determination as a measure of individual and herd values for trichostrongyle nematodes of cattle. AJVR. Vol. 57, No. 2. p. 168-171.
Gibbs, H.C. 1982. Mechanisms of survival of nematodes parasites with emphasis on hypobiosis. Veterinary Parasitology. Vol. 11, 25-48.
Gibson, T.E.; Everett, G. 1976.The ecology of the free living stages of Haemonchus contortus. British Veterinary Journal. Vol. 132. p. 50-59.
Gray, G.D. 1997. The use of genetically resistant sheep to control nematode parasitism. Veterinary Parasitology. Vol. 72. p.345-366.
Grisi, L. 1993. O problema do parasitismo interno dos bovinos nos tropicoos. En Seminario Internacional “Manejo y Control de de Ecto y Endoparásitos en Ganado Bovino. Memorias. Convenio ICA-GTZ-UNISALLE. Cartagena de Indias, Colombia.
Gruner, L. and Cabaret, J. 1985. Current methods for estimating parasite populations: potential and limits to control gastrointestinal and pulmonary strongyles of sheep on pasture. Livestpck production Science, Vol. 13, 53-70.
Johnson, M.J.; Behnke, J.M.; Coles, G.C. 1996. Detection of gastrointestinal nematodes by a coproantigen cap ture ELISA. Veterinary Science. Vol. 60, 7-12.
Karlsson, J.; Palmer, D.; Greeff, J. Components of IPM. 2002. En: Sustainable worm management: an electronic conference. http://www.worms.org.za. p. 39
Ketzis, J.K. 2002. New parasite control methods. How will they affect livestock nutrition and diet? www.ansci.cornell.edu/tmplobs/baagzAD7b.pdf.
Klei, T.R. 1997. Immunological control of gas trointes ti nal nematode infections. Veterinary Parasitology. Vol. 72, 507-523.
Knox, D.P. 2000. Development of vaccines against gas trointes ti nal nematodes. Parasitology. Vol. 120. p. 43-61.
Larsen, M. 1999. Biological control of helminths. International Journal for Parasitology. Vol. 29. p. 139-146.
Larsen, M. 2000. Prospects for controlling animal parasitic nematodes by predacious micro fungi. Parasitology. Vol. 120. p. 121-131.
Márquez, D. 1996. Determinación de pepsinógeno en plasma o suero. En: Curso-taller internacional: epidemiología y diagnóstico de parásitos internos de los rumiantes. Bogotá, Colombia. 12-1, 12-6.
Márquez, D.; Romero, A. 1996. Prueba de digestión de tejidos para el examen de formas evolutivas de helmintos. 1996 .En: Curso-taller internacional: epidemiología y diagnóstico de parásitos internos de los rumiantes. Bo go tá, Colombia. 12-1, 12-6.
Márquez, D.; Jaramillo, F. y Romero, A. 2000. Di ná mi ca del parasitismo gastrointestinal en bovinos del hato de Tibaitatá, Colombia. Revista de Medicina Ve te ri na ria y Zootecnia. Universidad Nacional de Co lom bia. Vol. 47. No. 2. p. 49-56.
Márquez, D.; García, F.; Jiménez, G.; Garzón, C.; Alarcón, R.; Basto, G.;Albarracín, L. 2003. Diseño de es tra te gias para el control de ecto y endoparásitos del ganado en trópicos medio, bajo y de altura, de Cundinamarca y Boyacá. Informe Técnico Final Pronatta.
Mateus, G. 1990. Bronconeumonía verminosa. En: Curso nacional sobre medicina de la pro duc ción de ganado de leche. Subgerencia de investigación. Cen tro de Investigación en Salud y Pro duc ción Animal-CEISA. Bo go tá, D.C. Colombia. P. 123-125.
Mckenna, P.B. 1981. The diagnostic value and in ter pre ta tion of faecal egg counts in shhep. New Zeland Vet er i nary Journal. No. 29, 129-132. Mendoza de Gives, P. 2000. Control alternativo de las helmintosis en rumiantes. http//:www1.inta.gov.ar/ producto/helminto/conferencia.htm.
Morelly, F.H.; Donald, A.D. 1980. Farm management and systems of helminth control. Veterinary Par a si tol o gy. Vol. 6, 105-134.
Nari, A.; Hansen, J.; Eddi, C.; y Martins, J. 2000. Control de la resistencia a los antiparasitarios a la luz de los conocimientos actuales. Red de helmintología Veterinaria de América Latina y El Caribe. Html. 16 p.
Padilha, T.C. 1992. Verminosis dos bovinos de leite. En: Doencas parasitarias dos bovinos de leite. Coronel Pachecho. EMBRAPA-CNPGL. 134 p.
Padilha, T. y Mendoza-de Gives, P. 1996. Controle microbiano das formas de vida livre dos nematódeos trichostrongilídeos: uma alternativa para higienizaçao das pastagens. En: Controle dos nematódeos gastrointestinaisem ruminantes. EMBRAPA. Coronel Pacheco, Brasil. 258 p.
Padilha, T. 1999. Biological control. International Journal for parasitology. Vol. 29. P. 153-154.
Parra, D. y Uribe, L. F. 1990. Epidemiología de nemátodos del bovino en el pie de monte de los Ll anos Orientales de Colombia. Revista ACOVEZ. Vol. 14. No. 4. p. 16-25.
Parra, D. 1990. Los parásitos de los bovinos de clima frío en el país. En: Curso nacional sobre medicina de la producción de ganado de leche. Subgerencia de investigación. Centro de Investigación en Salud y Producción Animal-CEISA. Bogotá, D.C. Colombia. P. 121-122.
Parra, D. 1993. Comportamiento de los parásitos gastrointestinales en las ganaderías de los Lannos orientales y en la Costa Atlántica. En: Seminario Internacional “Manejo y control de ecto y endoparásitos en ganado bovino”. Cartagena de Indias, Colombia. Convenio ICA-GTZ-UNISALLE.
Parra F., D. 1996. Epidemiología y diagnóstico de Fasciola hepática. En: Curso-taller in ter na cio nal: epidemiología y diagnóstico de parásitos internos de los rumiantes. Bogotá, Colombia. 11-1, 11-6.
Riffkin, G.G.; Callinan, A.A.L. 1.987. A comparison of nematode control programs for cattle in south west ern Victoria. Australian Veterinary Journal, Vol. 64, No. 6.
Rivera, B.; Parra, D.; García, O. y Aycardi, E. 1983. Gastrointestinal parasites in calves in Colombia. Trop i cal Animal Health and Production. Vol. 15. p. 107-114.
Rodríguez, J. 1996. Identificación de las formas adul tas de los principales helmintos de rumiantes. En: Me mo - rias. Curso-Taller Internacional de Epidemiología y Diagnóstico de Endoparásitos en rumiantes. Cor po ra ción Colombiana de Investigación Agropecuaria, Programa Nacional de Epidemiología Veterinaria. Santafé de Bo go tá. 220 p. (Biblioteca Agropecuaria de Co lom bia 2).
Romero, J.R. 2002. Impacto productivo de coccidiosis en rumiantes. www.inta.gov.ar/producto/helminto.
Rossanigo, C.E.; Gruner, L. 1995. Moisture and tem per a ture requirements in faeces for the development of free-living stages of gastrointestinal nematodes of sheep, cattle and deer. Journal of Helmintology, Vol. 69, 357-362.
Salles, J. 2002. Métodos alternativos para el control de endoparásitos. Pastoreo alterno bovino-ovino. www.inta.gov.ar/producto/helminto.
Sewell, M.M. 1984. Estrongiliasis gastroentérica de rumiantes. Traducción (Benavides, E). Rev. ACOVEZ. Vol.12, No.3. p 31-34.
Sievers, G.; Quintana, I.; Cortese, F. y Ernst, F. 1998. Variación anual de la ubicación de las larvas infectantes de tricostrongilidos del bovino sobre el pasto de un potrero en Valdivia, Chile. Arch. Med. Vet. Vol. 30, No.1. p.47-54.
Soca, M.; Simón, L.; Roche,Y.; Sánchez, S.; Aguilar, A.; Gómez, E. 2001. Parasitological dinamics of bovine dropping Ander silvopasatoral system conditions. En: Internacional Symposium on Silvopastoril Sys tems. Sec ond Congress on Agroforestry and Livestock Production. Compilador: Ibrahim, M. San José de Costa Rica. Abril de 2001. p. 122-126.
Sonstegard, T. S.; Gasbarre, L. C. 2001. Genomic tools to improve parasite resitance. Veteronary Par a si tol o gy. Vol. 101. p. 387-403. Soulsby, E.J. 1987. Parasitología y enfermedades parasitarias en los animales doemésticos. XII Edición. Edit. Interamericana. México. 823p.
Stromberg, B.E; Schlotthauer, J.C.; Haggard, D.L.; Vatthauer, R.J.; Hanke, H. And Myers, G.H. 1991. Epi zooti ol o gy of helminth parasitism in a beef cow/calf herd in Minnesota. Am J Vet Res, Vol. 52, No. 10, 1712-1716.
Stromberg, B. E. 1997. Environmental factors influencing transmission. Veterinary Parasitology. Vol. 72, No. 3-4. p. 247-264.
Stromberg, B. E.; Averbeck, G.A. 1999. The role of parasite epidemiology in the management of grazing cattle. International Journal for Parasitology. Vol. 29. p. 33-39.
Suárez, V. H. 2002. Helminthic control on grazing ruminants and environmental risks in South America. Vet er i nary Research. Vol. 33, No. 65. p. 563-573.
Thamsborg, S.M.; Roepstorff, A; Larsen, M. 1999. Integrated and biological control of parasites in organic and conventional production systems. Veterinary Parasitology. Vol. 84. p. 169-186.
Thomas, R.J. The ecological basis of parasite control: nematodes. 1982. Veterinary Parasitology. Vol. 11. p. 9-24.
Tullner, F.; Roqueme, L. y Otte, J. 1993. Investigaciones sobre la ocurrencia, epidemiología e importancia eco- nó mi ca de los helmintos en terneros en el departamento de Córdoba, Colombia. Proyecto ICA-GTZ. In for me Técnico No. 10., 58 p.
Ueno, H.; Cabral, P. 1998. Diagnóstico das helmintoses. En: Manual para diagnóstico das helmintoses de rumiantes.Japan International Cooperation Agency. Cuarta Edición. Tokio, japan. 142p.
Uilenberg, G. 1996. Integrated control of tropical animal patasitoses. Tropical Animal Health and Production. Vol. 28. p. 257-265.
Van Wyk, J.A.; Bath, G. and Malan, F. 1998. The need for alternative methods to control nematode parasites of ruminant livestock in South Africa. World Animal Review. Vol. 91, No.2. p. 30-33.
Van Wyk, J.A. 2001. Refugio – overlooked as perhaps the most potent factor concerning the development of anthelmintic resistance. Onderstepoort Journal of Veterinary Research. Vol. 68. p. 47-57.
Van Wyk, J.A. 2003. FAO 2nd Electronic Conference; “Sustainable parasite Management – Where to now?. Html. Venturini, M.C. 2002. Neosporosis: epidemiología y diagnóstico. www.inta.gov.ar/producto/helminto.
Vercruysse, J. And Dorny, P. 1999. Integrated control of nematode infections in cattle: A reality? A need? A future?. International Journal for Parasitology. Vol. 29. p. 165-175.
Waller, P.J. 1993. Towards sustainable nematode parasite control of livestock. Veterinary Par a si tol o gy. Vol. 48. p. 295-309.
Waller, P. J. 1997. Sustainable helminth control of ruminants in developing countries. Veterinary Par a si tol o gy. Vol. 71. p. 195-207.
Waller, P. J. 1999. International approaches to the concept of integrated control of namatode parasites of live stock. International Journal for Parasitology. Vol. 29. p. 155-164.
Williams, J. 1997. Anthelmintic treatment strategies. Current status and future. Veterinary Parasitology. Vol.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación17 de junio de 2017
En el punto donde menciona que las vacunas para disminuir o anular la carga parasitaria en los vacunos, el hecho que sea costoso su estudio no me conforma pues es mas caro la enfermedad que acarrea gastos innecesarios en los productores...deberia de salir si o si ya las vacunas solo que no lo quieren sacar... cuando laboraba hace años me di cuenta que cada productor de ganado criollo (QUINTIL 1 Y QUINTIL 2) extrema pobreza y muy pobre--- tenian que costear minimamente 4 veces al año gastos para control parasitario (Cada poblador tenia en promedio 8 vacas 20 ovejas 2 cerdos , y otros quizas menos y otros mas, PREGUNTO hasta cuando esa pobre gente tendra que gastar eso? ...es por eso que deben salir las vacunas ya que esta gente por la escasa area de terreno que es microparcializado no puede realizar un control por manejo...entonces no cabe la menor duda de que se deben tomar medidas politicas tecnicamente aceptables.
9 de mayo de 2017
Sugiero que antes de publicar artículos debe el autor o autores revisar muy bien las palabras y términos a usar ya que hay muchas entrecortadas y algunos números que no corresponden a lo que quiero decir especialmente a los estados larvarios el el desarrollo y ciclo de vida de los parásitos enumerados
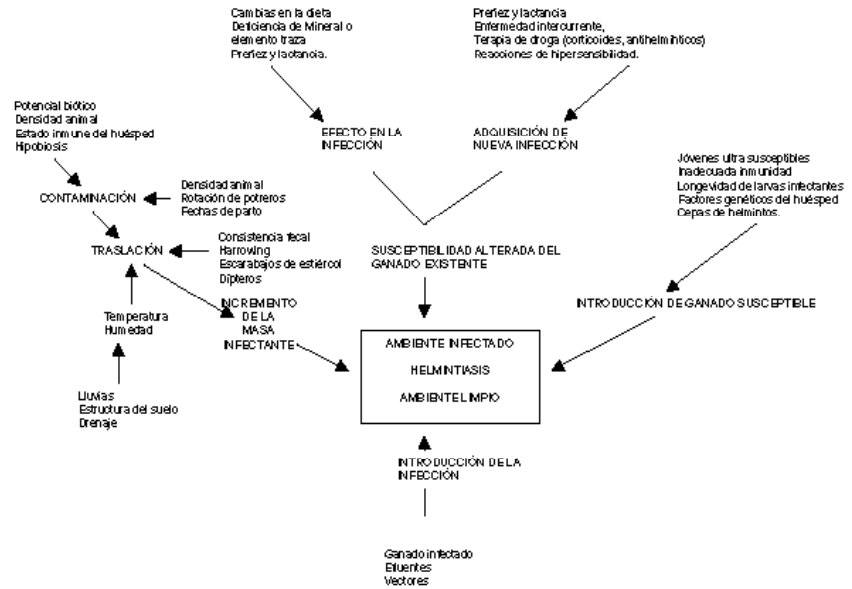







.jpg&w=3840&q=75)