Introducción
Considerando que Fasciola hepatica y Cotylophoron cotylophorum pueden estar presentes en el hospedador definitivo en forma simultanea (Genchi y Giugni,1981 ; Pino y Morales,1982), además de utilizar el mismo hospedador intermediario, hemos considerado importante el suministro de información que permita el adecuado diagnostico tanto a nivel del molusco gasterópodo hospedador intermediario como mediante el examen de heces del hospedador definitivo, señalando también los signos clínicos que caracterizan a cada una de las afecciones parasitarias debidas a estos trematodos. En vista de que existe la posibilidad de diagnósticos erróneos debido a la facilidad de confusión entre los huevos de Paramphistomum spp con los de Cotylophorum spp. por su morfología similar , se incluyen las medidas respectivas que se utilizan clásicamente para su diferenciación .
Para la denominación de las afecciones parasitarias se utilizo la Nomenclatura estandarizada para enfermedades parasitarias de la W.A.A.V.P (Kassai y cols,1988)
Fasciola hepatica
La clasificación taxonómica de Fasciola hepatica es la siguiente:
- Phylum : Platyhelminthes
- Clase : Trematoda
- Sub- clase: Digenea
- Familia: Fasciolidae
- Genero: Fasciola
- Especie: Fasciola hepatica
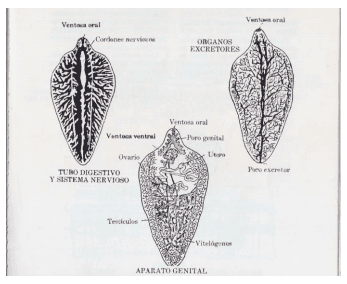
Figura 1. Dibujo de Fasciola hepatica
Descripción
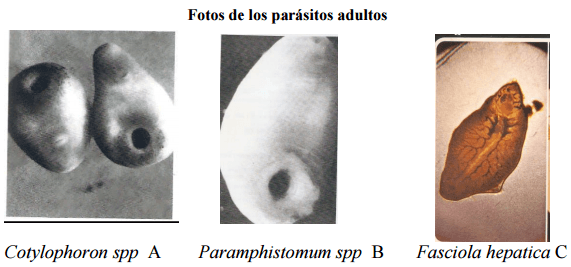
Mide de 20 a 30 mm de largo por 10 a 13 mm de ancho. Tiene aspecto de hoja ,siendo mas ancha en su parte anterior , de donde parte una prolongación que le es característica denominada cono cefálico. Posee dos ventosas muy próximas entre si, una oral ubicada en el cono cefálico y la ventral situada posteriormente a dicho cono. La cutícula externa del parasito es espinosa. Los ciegos, al igual que los testículos son ramificados y en posición anterior a estos se encuentra el ovario y el útero (Figura 1; Figura 3 C)
Signos clínicos
En los bovinos los signos clínicos de la Fasciolosis hepática se desarrollan lentamente, observándose en los animales afectados y con elevadas cargas : anemia, ascitis, inapetencia, membranas mucosas de ojos y boca pálidas, edema en botella sub-mandibular, que llevan al animal a un estado de emaciación, debilidad general y baja productividad (Troncy ,1981 ) e incluso la muerte, sin embargo cuando las cargas son bajas los efectos clinicos son minimos y la disminución de la productividad es difícil de diferenciar de la malnutrición(Urquhart y cols,1999). La diarrea no es un hecho frecuente en la Fasciolosis bovina al menos que se asocie con Ostertagia spp , de ahí que a la infección combinada se la llame complejo Fasciolosis-Ostertagiosis (Urquhart y cols,1999)
Desde el punto de vista reproductivo, F. hepatica tiene un efecto depresivo sobre la fertilidad y actividad sexual de los animales afectados; además de ocasionar abortos y partos de mortinatos y de animales de bajo peso al nacer (Euzeby, 1971). Asimismo, el nacimiento de animales infectados (infección prenatal), tiene importancia epidemiológica, debido a su contribución con el mantenimiento de los focos endémicos por el elevado número de huevos que excretan estos animales en sus heces (Pino y cols, 1992).
Cotylophoron spp y Paramphistomum spp
Los trematodos Cotylophoron spp y Paramphistomum spp , como ocurre con todos los Paramphistomidae , son muy similares entre si , de ahí que consideramos de interés la inclusión de claves que faciliten su diferenciación. Su clasificación taxonómica es:
- Phylum : Platyhelminthes
- Clase : Trematoda
- Sub clase: Digenea
- Familia : Paramphistomidae
- Generos : Cotylophoron
Paramphistomum
Los Paramphistomidae (figura 2 ; Figura 3 A y B ) parásitos de rumiantes viven en el rumen y el retículo sobretodo al estado adulto (12 mm x 4 mm) , sin embargo es posible encontrarlos en el cuajo y en el duodeno pero al estado juvenil , de pequeño tamaño (5mm x 2 mm) y de coloración blanco rosada.
A) Una ventosa genital…………………………..Cotylophoron
B) Ausencia de ventosa genital…………………Paramphistomum
Figura 2.Cotylophoron spp y Paramphistomum spp
Para la identificación de las diferentes especies del genero Cotylophoron , recomendamos consultar a Eduardo (1985)
Signos clínicos
Este parásito en su forma adulta se ubica en el rumen y el retículo y no se consideran patógenas cuando la carga parasitaria no es elevada; sin embargo, los estadios inmaduros al migrar en el duodeno y el íleon causan enteritis grave, produciendo necrosis y hemorragia (Sanchez y cols,2009; Alarcon y Velasquez,2009). , acompañada de anorexia y de una intensa sed.(Urquhart y cols,1999).Debemos destacar que al estado adulto cuando son numerosos ocasionan trastornos digestivos tales como timpanismo, indigestión, detención de la rumia y anorexia (Troncy,1981)
La severidad de la enfermedad depende del grado de contaminación y condiciones ambientales que garanticen una significativa presencia de metacercarias , los animales jóvenes parecen ser mucho más susceptibles que los adultos.
Cuando los niveles de infestación son elevados los animales padecen una diarrea abundante, persistente, frecuentemente sanguinolenta y fétida, que constituye un síntoma típico de la paramfistomidosis intestinal aguda La temperatura corporal permanece normal. Los animales presentan anemia, y edema en zonas corporales en declive, enflaquecimiento, debilidad y postración con alto índice de mortalidad. Las perdidas de apetito y sed intensa son síntomas que aparecen a las dos semanas post infección y en los animales que sobreviven, los síntomas clínicos pueden persistir por varias semanas. La infección con gusanos adultos en el rumen es menos severa, causando solo indigestión. Pequeñas infecciones sucesivas en animales jóvenes generan inmunidad. El diagnostico de esta parasitosis puede hacerse mediante el hallazgo de formas juveniles en las heces o por la observación de sus característicos huevos en el examen coproscópico.
Figura 3. Fotos de Cotylophoron spp A ; Paramphistomum spp B y Fasciola hepatica C
Identificación y examen del molusco hospedador intermediario
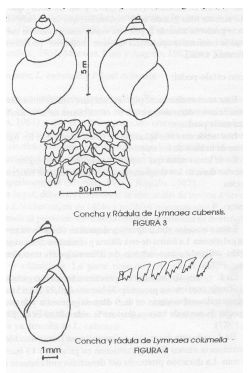
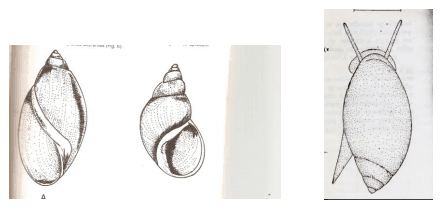
Los moluscos hospedadores intermediarios de Cotylophoron spp y de Fasciola hepatica reportados en Venezuela (Pino y Morales,1982; Morales y Pino,1982))., pertenecen a la clase Gastropoda, Subclase Pulmonata (carecen de operculo) y al orden Bassomatophora (poseen un par de tentáculos contráctiles con los ojos en la base de los mismos). Estos tentáculos, en el caso de la Familia Lymnaeidae son aplanados, pequeños y de forma triangular (Figura 3) y constituye un carácter morfológico de enorme interés. El Genero Lymnaea ha sido reportado en Venezuela (Martinez y Miranda,1968) y las especies señaladas son L. cubensis y L(Pseudosuccinea) columella (Figuras 4 y 5 ) Se trata de caracoles anfibios, que se localizan en los bordes de las acequias, con vegetación baja lo cual permite una adecuada penetración de los rayos solares que favorecen el desarrollo de microalgas utilizadas en su nutrición . En los hábitats en los cuales se localizan los limneidos , es también frecuente la presencia de moluscos de la Familia Physidae , también Basomatophoros y pulmonados (Malek y Cheng,1974) , pero estos son acuáticos y levógiros con los tentáculos cilíndricos y filiformes y cuando se desplazan se observa fácilmente el pie que termina en forma aguda (Figura 6)
Figura 4.Conchas y radulas de Lymnaea cubensis y L (Pseodosuccinea) columella
Figura 5. Lymnaea cubensis (se ven los tentáculos pequeños, aplanados, triangulares y los ojos en la base de los mismos).
Figura 6. Molusco Physidae (levógiro) y Lymnaeidae (dextrógiro) y a la derecha Molusco Physidae en el que se observan los tentáculos filiformes y el pie agudo.
En vista de la especificidad de los trematodos por el molusco que le sirve de hospedador intermediario y conociendo que en ellos ocurre la multiplicación de las formas larvarias, su identificación y disección tiene un valor predictivo para la contaminación con las formas pre-infectantes (cercarías) que al enquistarse como metacercarías serán la forma infectante para el ganado, además de su importancia para la identificación de las zonas en donde se encuentran las fuentes de infección.
Recolecta de los moluscos en el hábitat
Los moluscos son recogidos con la ayuda de pinzas y colocados en recipientes plásticos provistos de tapa, dentro del cual se coloca previamente una pequeña cantidad de agua del hábitat, de tal forma de trasladarlos vivos al laboratorio para su identificación, medición y disección (Pino y Morales, 1982; Morales y pino, 1982). En el laboratorio y considerando los criterios antes señalados para su identificación, se procede a la selección de los moluscos del genero Lymnaea spp para su medición y disección en búsqueda de las formas larvarias de los trematodos objeto de nuestro interés.
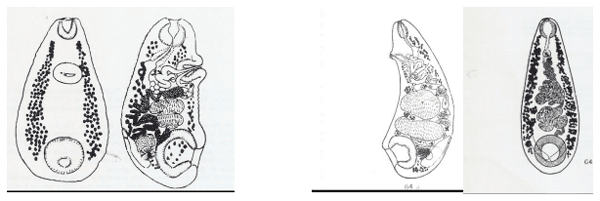
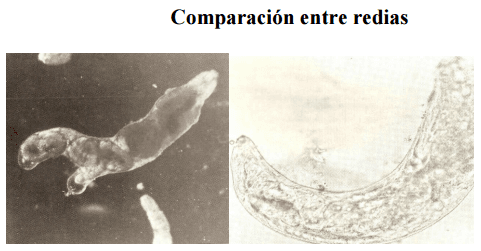
Comparación entre redias
Figura 7. Redias de Fasciola hepatica (izquierda) y de Cotylophoron spp (derecha)
La redia de F.hepatica presenta apéndices ambulacrales, los cuales están ausentes en las redias de Cotylophoron(Figura 7) además esta última es incurvada en forma de banana (Pino y Morales, 1982; Alarcon y Velasquez,2009)
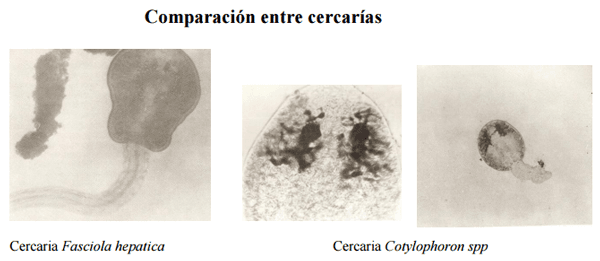
Comparación entre cercarías
Figura 8. Cercarias de Fasciola hepatica (izquierda) y de Cotylophoron spp (derecha)
Como se observa en la Figura 8 ,la cercaria de Fasciola hepatica corresponde al tipo dístoma, tiene forma de renacuajo, cuerpo discoideo y larga cola posterior, mientras que la cercaria de Cotylophoron spp. es de tipo anfistoma , forma rechoncha , cola corta y presenta manchas oculares (eyes spot) ramificadas que le son características (Pino y Morales, 1982
Técnica diagnóstico coproscopico
Procedimiento
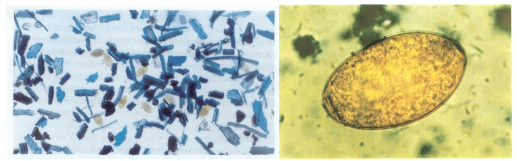
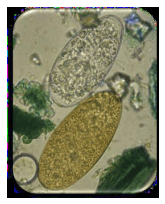
Se pesan 5 gramos de heces, se le agregan 22 ml de agua, se tamiza, la suspensión con la ayuda de un colador de te a otro recipiente, se lava bien el primer recipiente y el colador con 8 ml adicionales de agua, luego se llenan 2 tubos de centrífuga de 15 ml cada uno y se centrifuga a 800 r.p.m. por 10 minutos, después de este procedimiento se descarta el sobrenadante y se le agrega al sedimento una o dos gotas de azul de metileno al 2% o verde malaquita .Se homogeniza dicho sedimento y se toma con pipeta Pasteur la cantidad requerida para examinar entre cubre y portaobjeto al microscopio, comenzando por 10x. Como los huevos de Fasciola hepatica , están en contacto con la bilis su color será amarillento y resaltara entre el sedimento coloreado (Figura 9 y 10), mientras que los de Cotylophoron spp. son incoloros (Figura 10)
Figura 9. Huevos de Fasciola hepatica en el sedimento coloreado y aislado.
Figura 10. Huevos de Cotylophoron spp (arriba) y de Fasciola hepatica (abajo) Fotos tomadas de Velasteguilara,2012)
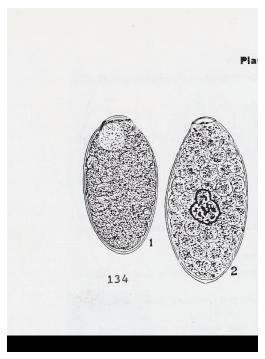
Criterios morfológicos y morfométricos para diferenciar entre huevos de Fasciola hepatica , Cotylophoron spp y Paramphistomum spp. (Euzeby,1982)
Huevos > de 80 micras completamente llenos por una mórula o masa moruliforme, con 1 opérculo.
Polos sub-iguales, cáscara amarilla oscura; con un núcleo embrionario situado cerca del polo operculado.: Fasciola hepatica (130 a 150 micras x 75 – 90 micras)
Polos desiguales, cáscara incolora o verde pálido, núcleo de desarrollo embrionario bien visible y situado en el centro del huevo: Cotylophoron spp (120 – 135 micras x 65-68 micras) y Paramphistomum spp (150 – 180 micras x 75 – 100 micras).
Cuando al microscopio se observan simultáneamente los huevos de F.hepatica y de un Paramphistomidae, además del color su, medición es de gran importancia, considerando lo antes señalado.
La observación del núcleo de desarrollo embrionario requiere de su enfoque con el micrométrico.
Con el fin de mostrar esquemáticamente el núcleo de desarrollo embrionario, presente tanto en huevos de Cotylophoron spp. como de Parampistomum spp y su comparación con uno de F.hepatica utilizamos la figura suministrada por Euzeby (1981), que corresponde a un huevo de Paramphistomum spp.(Figura 11)
Figura 11. Huevos de Fasciola hepatica (izquierda) y de Paramphistomum spp (derecha), mostrando el núcleo de desarrollo embrionario
Los huevos de Paramphistomum spp. pueden ser fácilmente confundidos con los de Cotylophoron spp, pero la diferencia nos la aporta el tamaño, ya que los de Paramphistomum spp son mas grandes ( y oscilan desde145 – 160 micras x 75 – 99 micras hasta 150- 180 micras x 75- 100 micras), mientras que los de Cotylophoron spp. alcanzan entre 120 – 135 micras x 65 – 68 micras), siendo por consiguiente de tamaño inferior no solo a los huevos de Paramphistomum spp . sino que también lo son a los de Fasciola hepatica. De acuerdo a estos criterios identificamos como Cotylophoron spp. al huevo que aparece en la parte superior de la figura 8.
Tratamiento
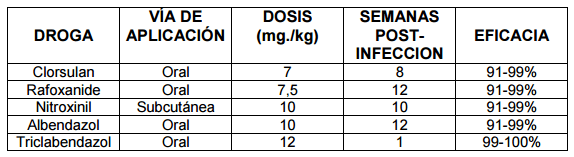
La realización de un correcto diagnostico es la base para efectuar un tratamiento adecuado, sobre todo si consideramos la posibilidad de infestaciones por Fasciola hepatica o por Cotylophoron spp en forma separada o por ambos parásitos simultáneamente. En el caso de Fasciola hepatica los quimioterapicos más usados son los siguientes (Cuadro 1):
Cuadro 1.Tratamiento de la Fasciolosis hepática
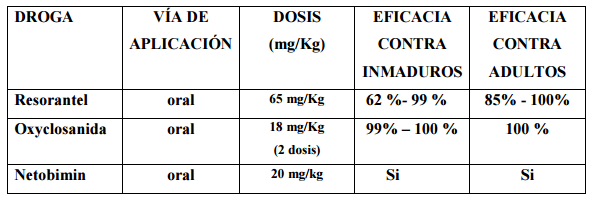
En el caso de la Paramfistomidosis (Cuadro 2) los principios activos mas recomendados son el Resorantel , la oxyclozanida y el Nectobimin. por actuar simultáneamente contra parásitos inmaduros y adultos, aunque en el Resorantel hay evidencias que demuestran mala tolerancia en los bovinos.
Cuadro 2.Tratamiento de la Paramfistomosis
CONTROL
Como en nuestro pais el hospedador intermediario reportado para F.hepatica y Cotylophoron spp es la Lymnaea cubensis (Pino y Morales, 1982) y considerando la similaridad del ciclo biologico de ambos parasitos en el hospedador intermediario (Urquhart y cols,1999 ; Graber y Perrotin , 1983) , así como la existencia de drogas que actuan sobre las formas juveniles como adultas en ambas parasitosis, posibilita el desarrollo de estrategias de control basadas en principios de acción comunes, como lo expondremos a continuación,
El control de la fasciolosis hepática y de la paramfistomosis debe reposar sobre una estrategia combinada con miras a destruir las infrapoblaciones de dichos trematodos presentes en el hospedador definitivo, lo que requiere el uso de antihelmínticos, así como de la implementación de medidas ecológicas, químicas o de biocontrol, tendientes a la reducción de las poblaciones del hospedador intermediario; y consecuentemente, de las infrapoblaciones de las larvas de F.hepatica y /o paramfistomidos que lo parasitan y la reducción de las posibilidades de infestación de los rumiantes mediante la implementación de medidas que impidan el acceso de los animales a las zonas en donde los moluscos hospedadores intermediarios tienen su habitat.(Morales y Pino ,1992, Hansen y Perry , 1994, Urquhart et al ,1999)
Todo programa de lucha contra estos trematodos debe contemplar algunas medidas básicas como las siguientes:
- Impedir el acceso del ganado a las zonas identificadas como infectadas, fundamentalmente a nivel de los puntos críticos.
- Destrucción de las metacercarias enquistadas en el pasto, mediante procesos como el corte y henificación del mismo.
- No alimentar al ganado con pasto de corte fresco procedente de localidades identificadas como localidades problema..
- Quimioprofilaxia: consiste en la eliminación de los distomas mediante el tratamiento sistemático con drogas fasciolicidas/paramfistomicidas, con lo cual, además de liberar al hospedador de la infección parasitaria se evita la infección de los hospedadores intermediarios. La quimioprofilaxia reposa en el empleo regular de drogas que sean altamente eficaces tanto contra las formas larvarias como adultas de F.hepática y de Paramfistomidos , lo cual es actualmente posible debido a la existencia en el mercado de drogas que actúan sobre dichos trematodos tanto en su fase juvenil (migratoria a nivel del parénquima hepático como en F.hepatica o en su recorrido retrogrado del duodeno hacia los pre-estomagos como en Cotylophoron spp, así como sobre las adultas en los canales biliares y en el rumen-reticulo respectivamente. Se basa en las siguientes consideraciones:
a. La droga debe ser usada en animales infestados antes de que los parásitos alcancen el estado adulto y comiencen la producción de huevos; y así, impedir la infección del hospedador intermediario, lo que aunado a programas de lucha antimolusco y de rotación de potreros se presenta como la mejor alternativa para el control de este parásito.
b. La quimioprofilaxia requiere del conocimiento de la acción de la droga sobre formas juveniles y adultas del parásito, para establecer la frecuencia de los tratamientos y su integración con otras medidas como la rotación de potreros.
c. Los animales procedentes de potreros infestados deben ser tratados antes de introducirlos a potreros libres o a otras explotaciones ganaderas.
El tiempo de pastoreo en los potreros no infestados debe ser al menos de 12 semanas y el tratamiento antihelmíntico, se aplica 4 semanas antes del traslado a los potreros infestados. En estos últimos, el periodo de pastoreo no será jamás superior a las 8 semanas, que es el tiempo promedio de evolución de las fases larvarias del parásito antes de alcanzar el estado de cercaria en el interior del molusco .Este tipo de estrategia de control requiere del empleo de drogas como el Triclabendazole , el cual es un quimioterápico sintético que actúa contra todos los estados de desarrollo de F.hepatica en el hospedador definitivo (Smeall y Hall,1983) o de Oxyclosanida considerada droga de elección en el caso de la paramfistomosis.
Bibliografía
- Alarcon, E ; Velasquez , L (2009).Descripción morfológica de Cotylophoron cotylophorum (Digenea: Paramphistomidae) hallado en bovinos de Rio Negro , Antioquia, Colombia. Revista Colombiana de Ciencias Pecuarias; 22(2):168-177
- Eduardo, S (1985)The taxonomy of the family Paramphistomidae Fischoeder , 1901 with special reference to the morphology of species occurring in ruminants.V. Revision of the genus Cotylophoron Stiles and Goldberger,1910.Syst Parasitol; 7:3-26
- Euzeby , J (1971). Les maladies vermineuses des animaux domestiques et leurs incidences sur la pathologie humaine. Tome II .Maladies dues aux plathelminthes. Vigot Freres Editeurs , Paris , p.350 – 358
- Euzeby , J (1981).Diagnostic experimental des helmintoses animales.Tome 1 Informations Techniques des Services Vétérinaires , Ministére de l ´Agriculture , Paris, p. 91--124.
- Euzeby, J (1982).Diagnostic experimental des helminthoses animals.Tome 2. Informations Techniques des Services Vétérinaires, Ministére de l ´Agriculture , Paris, p. 74 - 79.
- Genchi , C ; Giugni , M.F (1981). La distomatosi epatica (Fasciola hepatica) e la paramfistomiasi ( Cotylophoron cotylophorum ) nei bovini Della provincia di Sondrio. Riv.Zoot.Vet 9(1):15-19
- Graber , M ; Perrotin , C (1983).Helminthes et helminthoses des ruminants domestiques D Afrique Tropicale.Editions du Point Veterinaire; Maisons Alfort, Francia, p.86 – 101
- Hansen, J ; Perry, B (1994). The Epidemiology Diagnosis and Control of Helminth Parasites of Ruminants F.A.O – ILRAD, Nairobi, Kenya, pp.66-73.
- Kassai, T ; Cordero Del Campillo, M ; Euzeby , J ; Gaafar , S ; Hiepe , Th ; Himonas , C.A (1988). Standardized nomenclature of animal parasitic diseases (SNOAPAD). Veterinary Parasitology, 29 :299 – 326.
- Malek ,E ; Cheng , T (1974).Medical and economic malacology. Academic Press , New York.
- Martinez,R ; Miranda , R (1968). Aspectos de la reproducción en moluscos pulmonados del área metropolitana de Caracas. Estudio de Caracas. VI Ecología. Universidad Central de Venezuela, p 122- 165
- Morales , G ; Pino ,L.A (1982). Infection de Lymnaea cubensis par Fasciola hepatica dans une region d´altitude , au Venezuela. Ann. Parasitol. Hum: comp. ,58 (1):27-30.
- Morales, G y Pino, L.A (1992) Fasciola hepática. Aspectos Ecoepidemiológicos de Interés para el Desarrollo de Estrategias de Control. Ganaderìa mestiza de Doble propósito en Venezuela, editado por Gonzalez,C, Universidad del Zulia , Maracaibo, Venezuela p.301-324
- Pino, L .A ; Morales , G ; Perdomo , L (1992). Infestación prenatal de becerros por Fasciola hepática. Revista Científica, 2(1):59-60.
- PIno, L .A ; Morales , (1982). Lymnaea cubensis Pfeiffer,1839 hospedador intermediario de Cotylophoron cotylophorum (Fischoeder,1901)Stiles y Goldberger,1910 en condiciones naturales.Acta Cientif, Venezolana 33:57-60.
- Sanchez , N ; Tantalean ,M ; Chavez , A ; Soto , A (2009). Presencia de Cotylophoron cotylophorum (Trematoda , Paramphistomidae) en bovinos de Loreto , Perú. Rev.Peru. Biol ; 16(1):141-142.
- Smeal , M ; Hall , C (1983). The activity of triclabendazole against immature and adults Fasciola hepatica infections in sheep. Australian Veterinary Journal ;60 :329 – 331.
- Troncy, P (1981). Prècis de Parasitologie Vètèrinaire Tropicale. T.I Helminthes du Betail et des oiseaux de Basse-cour en Afrique tropicale, Institut D´Elevage et de Medicine Veterinaire des Pays Tropicaux , Maisons Alfort ,Francia ,p.113-126
- Urquhart,G ; Armour , J ; Duncan , J,L ; Jennings , F.W (1999). Veterinary Parasitology. Blackwell Science, Londres p. 110-116
- Velasteguilara, F (2012). Prevalencia de parasitosis por Paramphistomum spp. en ganado bovino del Cantón del Chaco, Provincia del Napo, Ecuador. Universidad Central del Ecuador, 100 pags.