Comparación de diferentes diluyentes en las características cualitativas del semen de conejo durante su conservación
Publicado: 31 de octubre de 2006
Por: Rosato M. P. y Laffaldano (Department of Animal, Vegetable and Environmental Sciences, University of Molise, Italia) y N. Rebollar P.G. Depto. de Producción Animal, E.T.S.I. Agrónomos, Univ. Politécnica de Madrid, Epaña
Resumen
El objetivo de este estudio fue comparar el empleo de MIII©, un diluyente económico empleado para conservar semen de verraco, con respecto a dos diluyentes de semen de conejo, Lepus© y Tris-ácido cítrico (TCG), respectivamente, sobre las características cualitativas in vitro de los espermatozoides de conejo almacenados hasta 72 horas a 15º C. Para este estudio se emplearon seis pooles de semen (n= 5-6 eyaculados/pool) recogidos con vagina artificial de 30 machos adultos.
La concentración espermática fue evaluada con la cámara de Thomas-Zeiss y cada pool se dividió en 3 alícuotas, lascuáles se diluyeron con Lepus © y TCG respectivamente, a una concentración de 30 x 106 espermatozoides / ml de diluyente. La motilidad espermática total, la motilidad progresiva rectilínea, la viabilidad (procedimiento de SYBR-14 / Propidium Ioduro) y la integridad del acrosoma (procedimiento PSA-FITC) se determinaron a las 3, 24, 48 y 72 h de conservación. El semen conservado durante 72 horas presentó peores características cualitativas en todos los diluyentes empleados, aunque con los diluyentes TGC y MIII© el deterioro fue menor. Después de 3 horas de almacenamiento, todoscomparados con el diluyente Lepus© los parámetros fueron mejores con los diluyentes TGC y MIII pero no se detectaron diferencias significativas. Pasadas 24 horas, la motilidad espermática total (TSM) (P© mientras que no existieron diferencias significativas en la viabilidad entre los tres diluyentes. Además, después de 48 y 72 horas, la TSM (P©.
Nuestros resultados muestran que la calidad del semen conservado con TGC y MIII® fue similar. No obstante, el diluyente de semen de verraco, de precio más bajo, se puede emplear para conservar semen de conejo ya que mantiene la calidad del mismo durante su almacenamiento in vitro. Aunque se necesitan más estudios que confirmen su eficacia in vivo.
Abstract
The aim of this study was to compare the effect of MIII©, a cheap boar semen diluent, respect to two extenders used for the dilution of rabbit semen, Lepus® and Tris-citric acid (TCG) diluent respectively, on in vitro qualitative characterisics of rabbit spermatozoa stored for up 72 h at 15° C. 6 pools of semen (n 5-6 ejaculates/pool) collected via artificial vagina from 30 hybrid mature males were used. Sperm concentration was evaluated with a Thoma-Zeiss chamber and each pool was divided into 3 aliquots which were diluted with Lepus®, M III® and TCG diluents, respectively, to a concentration of 30 x 106 spermatozoa/ml diluent. Total sperm motility, forward progressive motility, viability (SYBR-14/Propidium Iodide procedure) and acrosome integrity (PSA-FITC procedure) were recorded at 3, 24, 48 and 72 h of storage The storage of rabbit semen for 72 h worsened the quality characteristics of semen with the different extenders although the semen with TGC and M III diluents was less deteriorated during storage. After 3 h of storage, all the parameters were better with TGC and M III® compared to Lepus® extender, but not significant differences emerged. After 24 h significantly higher were the TSM (P® diluents compare to Lepus® one, while not significant differences for viability were observed between extenders. Also after 48 and 72 h better values of TSM (P® respect to Lepus® one. Our results suggest clearly that the quality of the semen stored with TCG and MIII was comparable. Therefore, a commercial boar semen extender of reduced cost and of practical use, seems to be effective to preserve the rabbit semen quality during in vitro storage, although studies are necessary to confirm in vivo its efficacy.
Introducción
La inseminación artificial (IA) de conejas está ampliamente extendida en los países europeos, obteniéndose resultados de fertilidad comparables a los de monta natural, cuando se utiliza semen fresco diluido 6-12 horas después de la recogida (Alabiso et al., 1996).
En condiciones normales, en las explotaciones de conejos, la inseminación artificial se realiza a las pocas horas de la recogida del semen y se limita a las hembras de la misma granja donde se encuentran los machos. Aunque, en los últimos años se han realizado progresos significativos en las técnicas de conservación (Roca et al., 2000; Nagy et al., 2002; López-Gautius et al., 2005) y en los protocolos de congelación (Mocé et al., 2002; 2003; 2005; Si et al., 2006) para el semen de conejo, la calidad del semen almacenado y por consiguiente, la fertilidad y prolificidad obtenidas, son inferiores a las que se obtienen con semen fresco y no son adecuadas en los actuales sistemas de producción. Las investigaciones que se han realizado se han centrado en definir diluyentes de características óptimas. La elección de un diluyente no sólo se realiza por sus implicaciones productivas sino también por las implicaciones económicas de su uso: disponer de un diluyente barato capaz de conservar las cualidades del semende conejo durante la conservación podría ser un objetivo de la industria productora de conejos, reduciendo los costes de inseminación sin afectar a los parámetros productivos.
El objetivo de este estudio fue comparar el empleo de MIII©, un económico diluyente de semen de verraco, y dos diluyentes de semen de conejo, Lepus® y Tris-ácido cítrico (TCG), valorando la calidad in vitro de espermatozoides de conejo almacenados durante 72 horas a 15ºC.
Material y Métodos
Dos eyaculados consecutivos se recogieron mediante vagina artificial de 30 conejos híbridos adultos alojados en una granja comercial. Después de la recogida del semen se eliminó la fase gelatinosa del mismo. Los eyaculados individuales de mezclaron en 6 pooles de semen, cada uno de 5-6 machos. Estos pooles se dividieron más tarde en tres alícuotas y cada una de ellas se prediluyó 1:1 en uno de los siguientes diluyentes: MIII® (Minitüb Abfüll, Germany), un diluyente comercial de verraco que contiene gentamicina como antibiótico, Lepus®, un diluyente comercial de semen de conejo (Medi Chimica, RE, Italy) y TCG, elaborado según Viudes-de Castro et al., (1999), respectivamente. El diluyente TCG estaba compuesto de 0,25 M de Tris[hydroxymetill]aminometano, 88 mM de ácido cítrico, 47 mM de D (+) glucosa y 80 mg/l de kanamicina, pH 7,1, con una presión osmótica de 300 mOsm/l. Todos los componentes empleados para preparar este diluyente fueron obtenidos en Sigma. La composición cuantitativa de los medios MIII® y Lepus® es desconocida debido a intereses comerciales y su pH fue de 7,2 y 7,3 , respectivamente.
La concentración espermática se determinó con la cámara de recuento celular Thoma-Zeiss (Marienfield, Germany), y la concentración final de cada muestra se ajustó a 30 x 106 espermatozoides/mL con el diluyente empleado en la predilución. Las muestras se introdujeron en un refrigerador a 15º C y se almacenaron allí durante 72 horas.
La motilidad espermática total (TSM), la motilidad progresiva rectilínea (FPM), la viabilidad y la integridad acrosómica de los espermatozoides se analizaron a las 3, 24, 48 y 72 horas del almacenamiento. La TSM y la FPM se determinaron según Roca et al. (2000). La viabilidad espermática se analizó mediante una técnica de doble tinción que emplea Sperm SYBR-14 y Propidium Ioduro (PI) como colorantes, según describen Garner and Johnson (1995). La viabilidad espermática se determinó con un kit (Molecular Probe, Eugene, OR, USA). Brevemente, 0,5 ml de semen diluido (30 x 106 espermatozoides / ml) se incubaron con 0,50 µl 5fl de SYBR-14 (0,1 mg/ml DMSO) durante 10 minutos y después con 2 µl 5fl de PI (4 mg/ml PBS) durante 5 minutos a 36°C. Se contaron al menos 200 espermatozoides con el microscopio de fluorescencia, usando el objetivo de inmersión (x100).
Las células vivas emiten un brillo fluorescente de color verde y las muertas, de color rojo. El porcentaje de espermatozoides viables se calculó según la siguiente ecuación: células verdes / (células verdes + células rojas) x 100. La integridad del acrosoma se determinó según el método de Mendoza et al. (1992): 10 µl 5fl de semen diluido se extendieron sobre un porta-objetos; después de secarse, las extensiones espermáticas se introdujeron en metanol (Sigma) durante 15 minutos y luego se incubaron durante 30 minutos a temperatura ambiente en una cámara oscura con una solución de FITC-conjugado PSA (Sigma; 50 µl 5fg/ml PBS). Los portaobjetos se lavaron después con agua destilada para eliminar el exceso de producto no unido. Después de secarse, las preparaciones se examinaron inmediatamente con un microscopio de epifluorescencia y con el objetivo de inmersión (x 100).
Los espermatozoides con el acrosoma intacto, cuyo color era verde brillante, se contaron en un total de al menos 200 células espermáticas y el porcentaje de integridad acrosómica se calculó según la ecuación: células con acrosoma intacto/(células con acrosoma intacto + células con acrosoma no intacto) x 100.
Los resultados de motilidad, viabilidad e integridad del acrosoma, transformados mediante el arcoseno, se analizaron mediante un ANOVA usando el procedimiento de mínimos cuadrados y el modelo general lineal del SPSS (SPSS Inc., Chicago, IL, US, 2003).
Resultados y Discusión
Los resultados de la motilidad espermática total, la motilidad progresiva espermática, la viabilidad y la integridad del acrosoma se muestran en las Figuras 1, 2, 3 y 4, respectivamente.
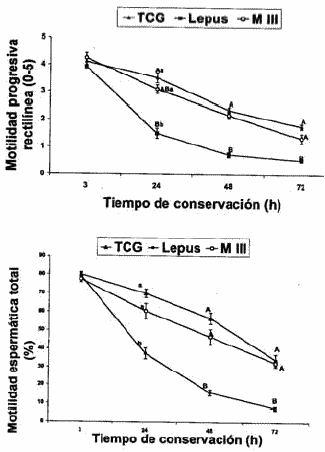 La calidad del semen de conejo conservado durante 72 horas fue empeorando con los tres diluyentes estudiados, aunque el semen diluido con TGC y MIII® se deterioró menos durante este periodo de conservación.
La calidad del semen de conejo conservado durante 72 horas fue empeorando con los tres diluyentes estudiados, aunque el semen diluido con TGC y MIII® se deterioró menos durante este periodo de conservación.
Después de 3 horas de conservación, no se observaron diferencias significativas entre los tres diluyentes.
A las 24 h, la TSM (P® comparado con el diluido en Lepus®, mientras que no se observaron diferencias significativas para la viabilidad.
A las 48 y 72 horas TSM (P®, con respecto a Lepus®.
Nuestros resultados sugieren claramente que el semen diluido en TGC y MIII® presenta mejores características cualitativas después de un tiempo de conservación, que el diluido en Lepus®.
Estudios previos han mostrado que con TGC las cualidades del semen se mantenían en mejores condiciones que con otros diluyentes con Tris (Roca et al., 2000). La calidad del semen conservado con TGC y MIII® fue similar.
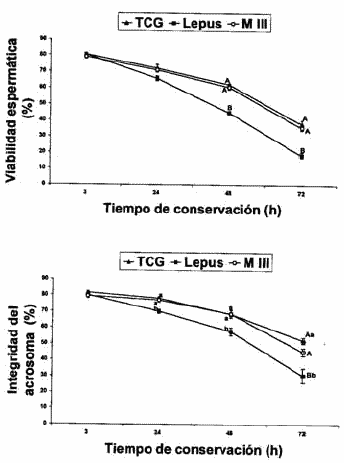 Esto podría ser debido al hecho de que MIII®, aunque es un diluyente disponible para semen de verraco, además es también capaz, como el TGC, de aportar nutrientes que los espermatozoides necesitan para sus necesidades metabólicas, aportando protección frente a las variaciones de pH y asegurando una presión osmótica adecuada para que el espermatozoide pueda sobrevivir durante una conservación de 72 horas. Nagy et al. (2002), demostraron que un diluyente de verraco comercial (Piglet Bt., Hungary), era igual de eficaz en la preservación de la viabilidad y de la integridad acrosómica del semen de conejo almacenado durante 72 h a 5º C, cuando se añadía gelatina a este diluyente.
Esto podría ser debido al hecho de que MIII®, aunque es un diluyente disponible para semen de verraco, además es también capaz, como el TGC, de aportar nutrientes que los espermatozoides necesitan para sus necesidades metabólicas, aportando protección frente a las variaciones de pH y asegurando una presión osmótica adecuada para que el espermatozoide pueda sobrevivir durante una conservación de 72 horas. Nagy et al. (2002), demostraron que un diluyente de verraco comercial (Piglet Bt., Hungary), era igual de eficaz en la preservación de la viabilidad y de la integridad acrosómica del semen de conejo almacenado durante 72 h a 5º C, cuando se añadía gelatina a este diluyente.
Estos resultados, por un lado confirman la capacidad de los diluyentes del tipo Tris-acetato para conservar la calidad del semen durante su almacenamiento, y por otra, que el MIII®, un diluyente comercial de coste reducido y de uso práctico, parece ser eficaz para el mismo fin. Sin embargo, se necesitan más estudios para confirmar la eficacia de este diluyente de verraco in vivo, con el objeto de introducirlo en las granjas comerciales para reducir los costes de la inseminación.
Referencias
ALABISO M., BONANNO A., ALICATA M.L., Leto G., Todaro M. 1996. Productivity of rabbit does subjected to artificial insemination and natural mating. En: Proceedings of the 6thWorld Rabbit Toulouse Congress act.1996. 2: 29-32.
GARNER D.L., JOHNSON L.A. 1995. Viability assessment of mammalian sperm using SYBR-14 and propidium iodide. Biol Reprod. 53: 276-84.
LÓPEZ-GATIUS F., SANCES G., SANCHO M., YÁNIZ J., SANTOLARIA P., GUTIÉRREZ R., NÚÑEZ M., NÚÑEZ J., SOLER C. 2005. Effect of solid storage at 15°C on the subsequent motility and fertility of rabbit semen. Theriogenology 64: 252-260.
MENDOZA C, CARRERAS A, MOOS J, Tesarik J. 1992. Distinction between true acrosome reaction and degenerative acrosome loss by a one-step staining method using Pisum sativum agglutinin. J Reprod Fertil. MOCÉ E., VICENTE J.S. 2002. Effect of cooling and freezing, the two first steps of a freezing protocol, on the fertilizing ability of the rabbit sperm. Reprod Nutr Dev. 42: 189-96.
MOCÉ E., VICENTE J.S., LAVARA R. 2003. Effect of freezing-thawing protocols on the performance of semen from three rabbit lines after artificial insemination. Theriogenology. 60: 115-23.
MOCÉ E., LAVARA R., VICENTE J.S. 2005. Influence of the donor male on the fertility of frozen-thawed rabbit sperm after artificial insemination of females of different genotypes. Reprod Domest Anim. 40: 516-21.
NAGY S.Z., SINKOVICS G.Y., KOVÁCS A. 2002. Viability and acrosome integrity of rabbit spermatozoa processed in a gelatin-supplemented extender. Anim Reprod Sci. 70: 283-286.
ROCA J., MARTÍNEZ S., VÁZQUEZ J.M., LUCAS X., PARRILLA I., MARTÍNEZ E.A., 2000. Viability and fertility of rabbit spermatozoa diluted in tris-buffer extenders and stored at 15 °C. Anim Reprod Sci. 64: 103-112. SI W.,
HILDEBRANDT T.B., REID C., KRIEG R., JI W., FASSBENDER M., HERMES R. 2006. The successful double cryopreservation of rabbit (Oryctolagus cuniculus) semen in large volume using the directional freezing technique with reduced concentration of cryoprotectant. Theriogenology 65: 788-98. SPSS/PC + Statistics 12. SPSS, Inc., Chicago, IL
VIUDES-DE-CASTRO M.P., VICENTE J.S., LAVARA R. 1999. Effet du nombre de spermatozoides sur la fertilité de la semence conservée 24 heures chez le lapin. Ann. Zootech. 48: 407–412.
El objetivo de este estudio fue comparar el empleo de MIII©, un diluyente económico empleado para conservar semen de verraco, con respecto a dos diluyentes de semen de conejo, Lepus© y Tris-ácido cítrico (TCG), respectivamente, sobre las características cualitativas in vitro de los espermatozoides de conejo almacenados hasta 72 horas a 15º C. Para este estudio se emplearon seis pooles de semen (n= 5-6 eyaculados/pool) recogidos con vagina artificial de 30 machos adultos.
La concentración espermática fue evaluada con la cámara de Thomas-Zeiss y cada pool se dividió en 3 alícuotas, lascuáles se diluyeron con Lepus © y TCG respectivamente, a una concentración de 30 x 106 espermatozoides / ml de diluyente. La motilidad espermática total, la motilidad progresiva rectilínea, la viabilidad (procedimiento de SYBR-14 / Propidium Ioduro) y la integridad del acrosoma (procedimiento PSA-FITC) se determinaron a las 3, 24, 48 y 72 h de conservación. El semen conservado durante 72 horas presentó peores características cualitativas en todos los diluyentes empleados, aunque con los diluyentes TGC y MIII© el deterioro fue menor. Después de 3 horas de almacenamiento, todoscomparados con el diluyente Lepus© los parámetros fueron mejores con los diluyentes TGC y MIII pero no se detectaron diferencias significativas. Pasadas 24 horas, la motilidad espermática total (TSM) (P© mientras que no existieron diferencias significativas en la viabilidad entre los tres diluyentes. Además, después de 48 y 72 horas, la TSM (P©.
Nuestros resultados muestran que la calidad del semen conservado con TGC y MIII® fue similar. No obstante, el diluyente de semen de verraco, de precio más bajo, se puede emplear para conservar semen de conejo ya que mantiene la calidad del mismo durante su almacenamiento in vitro. Aunque se necesitan más estudios que confirmen su eficacia in vivo.
Abstract
The aim of this study was to compare the effect of MIII©, a cheap boar semen diluent, respect to two extenders used for the dilution of rabbit semen, Lepus® and Tris-citric acid (TCG) diluent respectively, on in vitro qualitative characterisics of rabbit spermatozoa stored for up 72 h at 15° C. 6 pools of semen (n 5-6 ejaculates/pool) collected via artificial vagina from 30 hybrid mature males were used. Sperm concentration was evaluated with a Thoma-Zeiss chamber and each pool was divided into 3 aliquots which were diluted with Lepus®, M III® and TCG diluents, respectively, to a concentration of 30 x 106 spermatozoa/ml diluent. Total sperm motility, forward progressive motility, viability (SYBR-14/Propidium Iodide procedure) and acrosome integrity (PSA-FITC procedure) were recorded at 3, 24, 48 and 72 h of storage The storage of rabbit semen for 72 h worsened the quality characteristics of semen with the different extenders although the semen with TGC and M III diluents was less deteriorated during storage. After 3 h of storage, all the parameters were better with TGC and M III® compared to Lepus® extender, but not significant differences emerged. After 24 h significantly higher were the TSM (P® diluents compare to Lepus® one, while not significant differences for viability were observed between extenders. Also after 48 and 72 h better values of TSM (P® respect to Lepus® one. Our results suggest clearly that the quality of the semen stored with TCG and MIII was comparable. Therefore, a commercial boar semen extender of reduced cost and of practical use, seems to be effective to preserve the rabbit semen quality during in vitro storage, although studies are necessary to confirm in vivo its efficacy.
Introducción
La inseminación artificial (IA) de conejas está ampliamente extendida en los países europeos, obteniéndose resultados de fertilidad comparables a los de monta natural, cuando se utiliza semen fresco diluido 6-12 horas después de la recogida (Alabiso et al., 1996).
En condiciones normales, en las explotaciones de conejos, la inseminación artificial se realiza a las pocas horas de la recogida del semen y se limita a las hembras de la misma granja donde se encuentran los machos. Aunque, en los últimos años se han realizado progresos significativos en las técnicas de conservación (Roca et al., 2000; Nagy et al., 2002; López-Gautius et al., 2005) y en los protocolos de congelación (Mocé et al., 2002; 2003; 2005; Si et al., 2006) para el semen de conejo, la calidad del semen almacenado y por consiguiente, la fertilidad y prolificidad obtenidas, son inferiores a las que se obtienen con semen fresco y no son adecuadas en los actuales sistemas de producción. Las investigaciones que se han realizado se han centrado en definir diluyentes de características óptimas. La elección de un diluyente no sólo se realiza por sus implicaciones productivas sino también por las implicaciones económicas de su uso: disponer de un diluyente barato capaz de conservar las cualidades del semende conejo durante la conservación podría ser un objetivo de la industria productora de conejos, reduciendo los costes de inseminación sin afectar a los parámetros productivos.
El objetivo de este estudio fue comparar el empleo de MIII©, un económico diluyente de semen de verraco, y dos diluyentes de semen de conejo, Lepus® y Tris-ácido cítrico (TCG), valorando la calidad in vitro de espermatozoides de conejo almacenados durante 72 horas a 15ºC.
Material y Métodos
Dos eyaculados consecutivos se recogieron mediante vagina artificial de 30 conejos híbridos adultos alojados en una granja comercial. Después de la recogida del semen se eliminó la fase gelatinosa del mismo. Los eyaculados individuales de mezclaron en 6 pooles de semen, cada uno de 5-6 machos. Estos pooles se dividieron más tarde en tres alícuotas y cada una de ellas se prediluyó 1:1 en uno de los siguientes diluyentes: MIII® (Minitüb Abfüll, Germany), un diluyente comercial de verraco que contiene gentamicina como antibiótico, Lepus®, un diluyente comercial de semen de conejo (Medi Chimica, RE, Italy) y TCG, elaborado según Viudes-de Castro et al., (1999), respectivamente. El diluyente TCG estaba compuesto de 0,25 M de Tris[hydroxymetill]aminometano, 88 mM de ácido cítrico, 47 mM de D (+) glucosa y 80 mg/l de kanamicina, pH 7,1, con una presión osmótica de 300 mOsm/l. Todos los componentes empleados para preparar este diluyente fueron obtenidos en Sigma. La composición cuantitativa de los medios MIII® y Lepus® es desconocida debido a intereses comerciales y su pH fue de 7,2 y 7,3 , respectivamente.
La concentración espermática se determinó con la cámara de recuento celular Thoma-Zeiss (Marienfield, Germany), y la concentración final de cada muestra se ajustó a 30 x 106 espermatozoides/mL con el diluyente empleado en la predilución. Las muestras se introdujeron en un refrigerador a 15º C y se almacenaron allí durante 72 horas.
La motilidad espermática total (TSM), la motilidad progresiva rectilínea (FPM), la viabilidad y la integridad acrosómica de los espermatozoides se analizaron a las 3, 24, 48 y 72 horas del almacenamiento. La TSM y la FPM se determinaron según Roca et al. (2000). La viabilidad espermática se analizó mediante una técnica de doble tinción que emplea Sperm SYBR-14 y Propidium Ioduro (PI) como colorantes, según describen Garner and Johnson (1995). La viabilidad espermática se determinó con un kit (Molecular Probe, Eugene, OR, USA). Brevemente, 0,5 ml de semen diluido (30 x 106 espermatozoides / ml) se incubaron con 0,50 µl 5fl de SYBR-14 (0,1 mg/ml DMSO) durante 10 minutos y después con 2 µl 5fl de PI (4 mg/ml PBS) durante 5 minutos a 36°C. Se contaron al menos 200 espermatozoides con el microscopio de fluorescencia, usando el objetivo de inmersión (x100).
Las células vivas emiten un brillo fluorescente de color verde y las muertas, de color rojo. El porcentaje de espermatozoides viables se calculó según la siguiente ecuación: células verdes / (células verdes + células rojas) x 100. La integridad del acrosoma se determinó según el método de Mendoza et al. (1992): 10 µl 5fl de semen diluido se extendieron sobre un porta-objetos; después de secarse, las extensiones espermáticas se introdujeron en metanol (Sigma) durante 15 minutos y luego se incubaron durante 30 minutos a temperatura ambiente en una cámara oscura con una solución de FITC-conjugado PSA (Sigma; 50 µl 5fg/ml PBS). Los portaobjetos se lavaron después con agua destilada para eliminar el exceso de producto no unido. Después de secarse, las preparaciones se examinaron inmediatamente con un microscopio de epifluorescencia y con el objetivo de inmersión (x 100).
Los espermatozoides con el acrosoma intacto, cuyo color era verde brillante, se contaron en un total de al menos 200 células espermáticas y el porcentaje de integridad acrosómica se calculó según la ecuación: células con acrosoma intacto/(células con acrosoma intacto + células con acrosoma no intacto) x 100.
Los resultados de motilidad, viabilidad e integridad del acrosoma, transformados mediante el arcoseno, se analizaron mediante un ANOVA usando el procedimiento de mínimos cuadrados y el modelo general lineal del SPSS (SPSS Inc., Chicago, IL, US, 2003).
Resultados y Discusión
Los resultados de la motilidad espermática total, la motilidad progresiva espermática, la viabilidad y la integridad del acrosoma se muestran en las Figuras 1, 2, 3 y 4, respectivamente.
 La calidad del semen de conejo conservado durante 72 horas fue empeorando con los tres diluyentes estudiados, aunque el semen diluido con TGC y MIII® se deterioró menos durante este periodo de conservación.
La calidad del semen de conejo conservado durante 72 horas fue empeorando con los tres diluyentes estudiados, aunque el semen diluido con TGC y MIII® se deterioró menos durante este periodo de conservación.Después de 3 horas de conservación, no se observaron diferencias significativas entre los tres diluyentes.
A las 24 h, la TSM (P® comparado con el diluido en Lepus®, mientras que no se observaron diferencias significativas para la viabilidad.
A las 48 y 72 horas TSM (P®, con respecto a Lepus®.
Nuestros resultados sugieren claramente que el semen diluido en TGC y MIII® presenta mejores características cualitativas después de un tiempo de conservación, que el diluido en Lepus®.
Estudios previos han mostrado que con TGC las cualidades del semen se mantenían en mejores condiciones que con otros diluyentes con Tris (Roca et al., 2000). La calidad del semen conservado con TGC y MIII® fue similar.
 Esto podría ser debido al hecho de que MIII®, aunque es un diluyente disponible para semen de verraco, además es también capaz, como el TGC, de aportar nutrientes que los espermatozoides necesitan para sus necesidades metabólicas, aportando protección frente a las variaciones de pH y asegurando una presión osmótica adecuada para que el espermatozoide pueda sobrevivir durante una conservación de 72 horas. Nagy et al. (2002), demostraron que un diluyente de verraco comercial (Piglet Bt., Hungary), era igual de eficaz en la preservación de la viabilidad y de la integridad acrosómica del semen de conejo almacenado durante 72 h a 5º C, cuando se añadía gelatina a este diluyente.
Esto podría ser debido al hecho de que MIII®, aunque es un diluyente disponible para semen de verraco, además es también capaz, como el TGC, de aportar nutrientes que los espermatozoides necesitan para sus necesidades metabólicas, aportando protección frente a las variaciones de pH y asegurando una presión osmótica adecuada para que el espermatozoide pueda sobrevivir durante una conservación de 72 horas. Nagy et al. (2002), demostraron que un diluyente de verraco comercial (Piglet Bt., Hungary), era igual de eficaz en la preservación de la viabilidad y de la integridad acrosómica del semen de conejo almacenado durante 72 h a 5º C, cuando se añadía gelatina a este diluyente.Estos resultados, por un lado confirman la capacidad de los diluyentes del tipo Tris-acetato para conservar la calidad del semen durante su almacenamiento, y por otra, que el MIII®, un diluyente comercial de coste reducido y de uso práctico, parece ser eficaz para el mismo fin. Sin embargo, se necesitan más estudios para confirmar la eficacia de este diluyente de verraco in vivo, con el objeto de introducirlo en las granjas comerciales para reducir los costes de la inseminación.
Referencias
ALABISO M., BONANNO A., ALICATA M.L., Leto G., Todaro M. 1996. Productivity of rabbit does subjected to artificial insemination and natural mating. En: Proceedings of the 6thWorld Rabbit Toulouse Congress act.1996. 2: 29-32.
GARNER D.L., JOHNSON L.A. 1995. Viability assessment of mammalian sperm using SYBR-14 and propidium iodide. Biol Reprod. 53: 276-84.
LÓPEZ-GATIUS F., SANCES G., SANCHO M., YÁNIZ J., SANTOLARIA P., GUTIÉRREZ R., NÚÑEZ M., NÚÑEZ J., SOLER C. 2005. Effect of solid storage at 15°C on the subsequent motility and fertility of rabbit semen. Theriogenology 64: 252-260.
MENDOZA C, CARRERAS A, MOOS J, Tesarik J. 1992. Distinction between true acrosome reaction and degenerative acrosome loss by a one-step staining method using Pisum sativum agglutinin. J Reprod Fertil. MOCÉ E., VICENTE J.S. 2002. Effect of cooling and freezing, the two first steps of a freezing protocol, on the fertilizing ability of the rabbit sperm. Reprod Nutr Dev. 42: 189-96.
MOCÉ E., VICENTE J.S., LAVARA R. 2003. Effect of freezing-thawing protocols on the performance of semen from three rabbit lines after artificial insemination. Theriogenology. 60: 115-23.
MOCÉ E., LAVARA R., VICENTE J.S. 2005. Influence of the donor male on the fertility of frozen-thawed rabbit sperm after artificial insemination of females of different genotypes. Reprod Domest Anim. 40: 516-21.
NAGY S.Z., SINKOVICS G.Y., KOVÁCS A. 2002. Viability and acrosome integrity of rabbit spermatozoa processed in a gelatin-supplemented extender. Anim Reprod Sci. 70: 283-286.
ROCA J., MARTÍNEZ S., VÁZQUEZ J.M., LUCAS X., PARRILLA I., MARTÍNEZ E.A., 2000. Viability and fertility of rabbit spermatozoa diluted in tris-buffer extenders and stored at 15 °C. Anim Reprod Sci. 64: 103-112. SI W.,
HILDEBRANDT T.B., REID C., KRIEG R., JI W., FASSBENDER M., HERMES R. 2006. The successful double cryopreservation of rabbit (Oryctolagus cuniculus) semen in large volume using the directional freezing technique with reduced concentration of cryoprotectant. Theriogenology 65: 788-98. SPSS/PC + Statistics 12. SPSS, Inc., Chicago, IL
VIUDES-DE-CASTRO M.P., VICENTE J.S., LAVARA R. 1999. Effet du nombre de spermatozoides sur la fertilité de la semence conservée 24 heures chez le lapin. Ann. Zootech. 48: 407–412.
Temas relacionados
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación26 de octubre de 2012
hola, soy productor e inseminador de conejos en uruguay y estoy en Guatemala por este momento y me gustaria hacer contacto para poder ayudar un poco mas en este tema ya que lo hicimos con bastante éxito en nuestro pais y creo se puede desarrollar ahora por aca tambien ,gracias.

12 de julio de 2009
Como se hace el TRIS?
12 de septiembre de 2007
Mis agradecimientos por socializar tan importante artículo.
La biotecnología de la inseminación cunícola nos obligará a invertir más tiempo de estudio y dedicación a la producción cunícola, pues esa actividad tiende a crecer a nivel mundial sobe todo en Latinoamérica.
Las técnicas de sobre diluyentes seguirán jugando primordial papel dentro de esta técnica por lo que el artículo de la referencia es un valioso aporte digno de seguir analizándolo y socializándolo.
Saludos a todo el FORO
11 de noviembre de 2006
Trabajos de investigación como éste deberían hacerse siempre, ayuda a decidir en términos económicos y de tiempo, el momento exacto para realizar la inseminación con semen diluido.

6 de noviembre de 2006
quisiera agradecer este tema que es muy importante para la expancion de nuestra granja, ¿ como introducimos o cuando podemos o debemos introducir este sistema a nuestra granja?


