INTRODUCCIÓN
En la avicultura moderna las aves son criadas bajo condiciones intensivas tal motivo puede causar cualquier problema infecto-contagioso que se disemina rápidamente y reduce el margen de ganancia, conversión alimenticia y pérdidas económicas.1
Uno de los problemas que afectan comúnmente a las aves de postura es la peritonitis11 pues a pesar de los avances en el control y terapia antimicrobiana estas infecciones causan una elevada morbilidad y mortalidad en parvadas de aves de postura12. Aunque no existen datos que lo prueben, es aceptado que desde la mitad de los años 90 la incidencia de este padecimiento se ha incrementado de manera substancial en muchos países europeos13. De manera similar, en los Estados Unidos de América durante los últimos cinco años, algunos segmentos de la producción de huevos se han visto afectados por la elevada mortalidad de las parvadas de ponedoras causada por peritonitis14,15. En el caso México, a pesar de que no existen datos publicados sobre la incidencia de este problema, se estima que más del 90% de la mortalidad que se presenta comúnmente en parvadas de postura comercial son consecuencia de infecciones bacterianas que producen peritonitis. Desafortunadamente, a pesar de que las gallinas son afectadas severamente por este tipo de infecciones, los reportes científicos al respecto son escasos16.
Aunado a esto, la rápida difusión de resistencia a antibióticos entre las cepas de Escherichia coli es un problema en la industria avícola. Existen diversos factores que pueden contribuir a este aumento ya que el alto uso de antimicrobianos implica una presión selectiva para bacterias resistentes.2 Adicionalmente, se han identificado varios elementos genéticos móviles que participan en la transferencia de genes de resistencia, de los cuales los más conocidos son los plásmidos, los transposones y los cassettes genéticos de resistencia.3 En la actualidad es bien conocido el papel de los plásmidos y transposones en la multiresistencia de las bacterias a los antibióticos, aunque recientemente se ha descubierto que los integrones desempeñan un papel primordial en la evolución de los genomas bacterianos, pues son los responsables de la captura y difusión de los determinantes de resistencia a los antibióticos entre diversos microorganismos Gram-negativos.4
Dada la velocidad de los eventos que puede suceder en la producción avícola, en ocasiones no se medica en función de un diagnóstico preciso, sino como respuesta a una percepción empírica. Así, la combinación de la presión comercial por hacer de la avicultura un negocio cada vez más rentable, y la amplia disponibilidad de los antibióticos han hecho que se utilice este recurso de manera excesiva, con posibles consecuencias negativas en salud pública.
MATERIAL Y METODOS
Aves a muestrear. Las muestras fueron obtenidas en una granja de crianza de 83,000 pollitas Hy-line W36. Durante tomó 10 días, de la mortalidad fueron seleccionadas 20 aves por día, para obtener las muestras de órganos y llevar a cabo el aislamiento bacteriano.
Toma de muestras. Los órganos que se obtuvieron fueron hígado, pulmón, saco vitelino y médula ósea, los cuales estos fueron remitidos al área de bacteriología de un laboratorio de diagnóstico de la región. Aislamiento bacteriano. Los primeros 5 días las muestras se sembraron en caldo nutritivo y posteriormente en medios sólidos TSA y McC (DIFCO). A partir del sexto día sólo se sembraron en medios sólidos, se incubaron a 37°C durante 24 hr, con base en la morfología de las colonias éstas fueron seleccionadas para su posterior identificación.
Pruebas bioquímicas. La identificación de E. coli se realizó en el laboratorio de bacteriología del DMZA (FMVZ, UNAM) mediante el empleo de pruebas bioquímicas como TSI, Citrato, Urea, LIA y SIM.
Antibiograma. Una vez que ya se tenían las cepas aisladas e identificadas, se procedió a realizar la prueba de sensibilidad antimicrobiana mediante la técnica de antibiograma; para lo cual se utilizaron 11 antibióticos: Tilosina 30μg (TL), Enrofloxacina 5μg (ENR), Florfenicol 30μg (FLC), Fosfomicina 200μg (FSM), Oxitetracilina 30μg (OXT), Amoxicilina 20μg (AMX), Doxiciclina 30μg (DXT), Sulfaclopirimidacina 25μg (SLF), Clortetracilina/Tiamulina 30μg (CLT), Gentamicina 30μg (GMT) y Ceftiofur 30μg (CFT).
Cada cepa fue sembrada en caldo nutritivo (CN), este se incubo a 37°C por 15 min hasta obtener una turbidez equivalente al tubo 0.5 de McFarland (1.5x108 UFC/ml); posteriormente se sembraron en Müeller Hinton por estría cerrada, y se utilizaron discos de papel filtro impregnados con concentraciones conocidas de los diferentes antibióticos. Estos discos se colocaron sobre la superficie del agar y se incubaron a 37°C durante 24 horas.
Para determinar el grado de susceptibilidad de la bacteria se toma en cuenta el tamaño de la zona de inhibición de crecimiento, y se determina si una cepa es resistente, intermedia o sensible. La lectura se basó en los estándares que existen para cada antibiótico.7
RESULTADOS
Aislamiento de Escherichia coli
Los microorganismos aislados pertenecieron a diversos géneros. En total se obtuvieron 217 colonias, de las cuales el 79.2% (n=172) fueron identificadas bioquímicamente como E. coli y el 20.7% (n=45) fueron identificadas como Enterobacter sp., Klebsiella sp., Pseudomonas aureginosa y Proteus miriabilis. El órgano del que se obtuvo el mayor porcentaje de aislamiento de Escherichia coli fue médula ósea que representó el 29.6% (n=51), seguido de saco vitelino, 25.6% (n=44), pulmón 22.6% (39) e hígado 22% (38).
Resistencia antimicrobiana de Escherichia coli
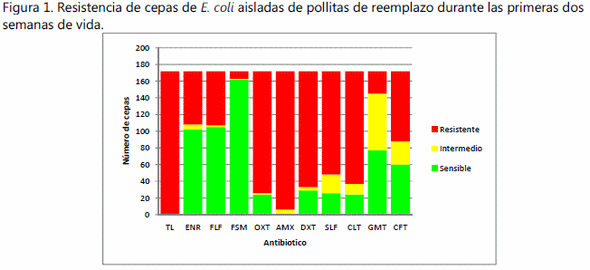
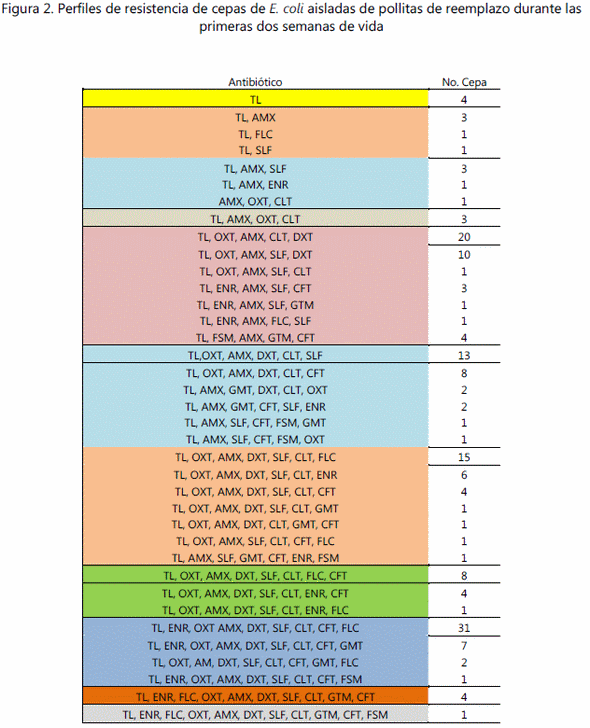
Los resultados de la prueba de sensibilidad antimicrobiana mostraron un alto porcentaje de cepas resistentes a diversos antibióticos, en particular a la tilosina (99.4%), seguido por amoxicilina con el 96.5%, oxitetraciclina y doxiciclina con el 80%, sulfacloropirimidacina y clortetraciclina con el 70% de resistencia. Por otra parte, también se encontró una elevada sensibilidad hacia algunos antibióticos, por ejemplo, el 94.2% fueron sensibles a fosfomicina, seguido de florflenicol 61%, enrofloxacina 59.3%, gentamicina 44.7% y ceftiofur 34.9% (figura1). Se observó que todas las cepas mostraron algún grado de multirresistencia, la cepa más sensible fue resistente a un antibiótico, mientras que 31 cepas fueron resistentes a nueve antibióticos (figura 2).
DISCUSIÓN
Actualmente la manera de controlar las infecciones es mediante el empleo de antimicrobianos como ampicilina, tetraciclina, sulfonamidas y enrofloxacina; esta última es unas de las quinolonas más usada en la industria avícola.
En el presente estudio el antibiótico que mostró una mayor resistencia fue la tilosina 99.4% seguido de la amoxicilina 96.5% y doxiciclina 80.8%. La resistencia a los macrólidos, como la tilosina, generalmente está mediada por plásmidos.8 En este estudio se encontró una baja resistencia antimicrobiana a fosfomicina, florfenicol, enrofloxacina, lo cual es similar a lo reportado por Rosario et al.9 quienes encontraron que el ceftiofur y la fosfomicina tenían bajos niveles de resistencia en cepas de E. coli aviares.
Actualmente se observa de manera rutinaria el aislamiento de microorganismos resistentes a dos o más antibióticos. Además se sabe que los genes que codifican para la resistencia están ligados a elementos móviles8, lo que podría explicar el incremento en el número de cepas resistentes a los antimicrobianos analizados en el presente estudio.
El alto nivel de resistencia a los antibióticos en los patógenos aviares es preocupante e indica que el uso generalizado de antibióticos como aditivos en la alimentación, y la prevención de enfermedad podría tener implicaciones negativas para la salud humana, animal y ambiente.10
REFERENCIAS
1. Sumano SH, Gutierrez OL. Problemática del uso de enrofloxacina en la avicultura en México. Vet. Mex., 2000; 31:137-145
2. Soufi L, Sáenz Y, Vinué L, et al. Escherichia coli of poultry food origin as reservoir of sulphonamide resistance genes and integrons. International Journal of Food Microbiology, 2011; 144:497–502
3. González RG, Mella MS, Zemelman ZR, et al. Integrons and resistance gene cassettes: structure and role against antimicrobials. Rev Med Chile, 2004; 132:619-626
4. Dean A. Rowe-Magnus, Mazel D. The role of integrons in antibiotic resistance gene capture. International Journal of Medical Microbiology, 2002; 292:115-125
5. Cona TE. Condiciones para un buen estudio de susceptibilidad mediante test de difusión en agar. Rev Chil Infect (2002); 19 (Supl. 2): S 77-81
6. Bauer AW, Kirby WM, et al. Antibiotic susceptibility testing by standardized single disk method. Am J Clin Pathol 1966; 45: 493-6
7. Clinical and Laboratory Standars Institute. M2-Disk-Diffusion. Enterobacteriaceae. Vol. 27, January 2007
8. Sumano SH, Ocampo CL. Farmacología veterinaria. 3ra ed. McGrawHill. 2006
9. Rosario CC. Resistencia antimicrobiana en cepas respiratorias de Escherichia coli. Avícultores y su entorno. 66:100-104. 2009
10. Hasan B, Faruque R, Drobni M, et al. High prevalence of antibiotic resistance in pathogenic Escherichia coli from large- and small-scale poultry farms in Bangladesh. Avian Dis., 2011; 55(4):689-92.
11. Monroy MAR, Knöbl T, Bottino JA, Astolfi Ferreira CS, Piantino Ferreira AJ. Virulence characteristics of Escherichia coli isolates obtained from broiler breeders with salpingitis Comp Immun Microbiol Infect Dis; 2005; 28: 1-15.
12. Vandekerchove D, De Herdt P, Laevens H, Pasmans F. Risk factors associated with colibacillosis outbreaks in caged layer flocks. Avian Pathol 2004-1; 33:337-342.
13. Vandekerchove D, De Herdt P, Laevens H, Butaye P, Meulemans G, Pasmans F. Significance of interactions between Escherichia coli and respiratory pathogens in layer hen flocks suffering from colibacillosis-associated mortality. Avian Pathol 2004; 33:298 -302.
14. Shane S. Impacto de la E. coli sobre la producción redituable de huevos. Industria Avícola 2009; 56: 22-25.
15. Raviv Z, Ferguson-Noel N, Laibinis V, Wooten R, Kleven SH. Role of Mycoplasma synoviae in commercial layer Escherichia coli peritonitis syndrome Avian Dis 2007; 51:685– 690.
16. Vandekerchove D, De Herdt P, Laevens H, Pasmans F. Colibacillosis in caged layer hens: characteristics of the disease and the aetiological agent. Avian Pathol 2004, 33:117–125
AGRADECIMIENTO
Al Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT) de la DGAPA de la UNAM por el apoyo al proyecto PAPIIT IN230811 “Caracterización de cepas de Escherichia coli aisladas durante la etapa de crianza y su importancia en la mortalidad causada por peritonitis en aves de postura”