Planta de incubacion - Factores que afectan a su productividad
Factores que afectan la productividad en la planta de incubación
1. Calidad del huevo.
2. Sanidad de la planta.
3. Condiciones de incubación.
4. Mantenimiento preventivo.
5. Uso eficiente de la energía.
Aunque existe un gran número de factores, se trataran únicamente los mencionados anteriormente, debido a que se considera que éstos son los de mayor importancia y al mejorarlos se producen efectos notables en la productividad de las plantas de incubación; no obstante en la planta misma todos estos factores deben tratarse simultáneamente y los efectos son acumulativos, en el presente documento se evaluarán individualmente para facilitar su comprensión.
1. Calidad del huevo
Las plantas de incubación avícola dependen en gran medida de la calidad de huevo que reciben, la planta de incubación no puede mejorar la calidad que recibe sino solo conservarla, por lo tanto, se debe prestar atención y hacer esfuerzos para que siempre se reciba la mejor calidad, con el fin de mantener una buena productividad.
Algunos de los factores que afectan la calidad de le los huevos fértiles, según Valle (2001) son:
- Manejo, nutrición y alimentación de las reproductoras.
- Manejo del ambiente y nivel de higiene, en el galpón, almacén y transporte.
- Manejo de las aves y nidos.
- proceso de recolección.
- temperatura y humedad relativa de almacenamiento.
- Proceso de sanitización.
Estos factores están fuera del control de la planta, por lo que no puede tomar acciones para corregir estas deficiencias, entonces, la planta debe mantener una constante evaluación de la materia prima que está recibiendo y retroalimentar a sus proveedores, así como a exigir una buena calidad de huevo, con el fin de procurar una buena incubabilidad y por lo tanto buena productividad.
Las plantas de incubación que pertenecen a un sistema integrado de producción, pueden hasta cierto punto, exigir y manejar la calidad, ya que al pertenecer la misma empresa, ésta tratará de maximizar la eficiencia.
Cuando la planta compra el huevo se enfrenta a una situación complicada, máxime si se abastece de proveedores del exterior, ya que en este ultimo caso ni el proveedor ni la planta incubadora tienen un control del manejo que se le de a este huevo durante el transporte.
Los puntos más importantes a considerar en la evaluación de la calidad del huevo fértil son los siguientes:
1.1 Manejo.
1.2 Sanidad del huevo.
1.3 Fertilidad.
1.4 Calidad del cascarón.
Todos estos factores tienen una influencia directa sobre la incubabilidad, por lo que es necesario mantener una estricta vigilancia sobre estos aspectos.
1.1 Manejo
Los huevos fértiles son embriones, por lo tanto deben manejarse como tal, ya que el manejo brusco y las fluctuaciones de temperatura los afectan. El maneo del huevo inicia desde la postura hasta que nace el pollito, para efecto de este tema, se enfocará desde la postura hasta que ingresa a la planta de incubación, haciendo énfasis en: temperatura, manipulación y tiempo de almacenamiento; que son los factores del manejo que tienen mayor impacto en la incubabilidad.
1.1.1 Temperatura
Para que los embriones permanezcan viables deben mantenerse en condiciones óptimas (Temperatura y humedad), el patrón de temperatura que deben seguir los huevos es una temperatura descendente desde la postura hasta el cuarto de almacenamiento, que debe estar entre 18-20 °C (65 – 68 °F) con una humedad entre 75 a 80 % (North y Bell, 1993), cuando se incuba debe proporcionárseles un incremento rápido de la temperatura hasta llegar a la temperatura de incubación (Martín, 2003). Lo importante en este proceso es que los embriones no sufran incrementos y descensos de temperatura, un incremento por arriba de los 24 °C activa el desarr ollo embrionario (North y Bell, 1993) si después desciende se produce mortalidad, la magnitud de esta muerte embrionaria varía según la magnitud de los aumentos y descensos así como el tiempo que duren.
Para realizar esta monitoreo de este proceso debe coordinarse con el proveedor de huevo fértil, para ello puede valerse de termómetros con almacenamiento de datos (data logger), acompañado de análisis de embriodiagnosis, cuando se detecten inconformidades y efectos dañinos a los embriones, ambas partes deben realizar esfuerzos para corregir esta inconformidad. Esto se hace más fácil cuando se tienen proveedores permanentes y existe una buena comunicación entre ambos, cuando el proveedor es eventual es difícil realizar estos monitoreos y correcciones.
En la grafica mostrada a continuación (Figura N. 1) se observa un efecto no deseado, de incremento de temperatura.
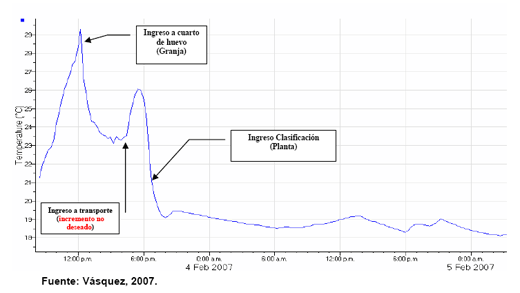
Figura N. 1: Gráfica de Temperatura de manejo, con problemas en el transporte.
Como se observa en esta grafica cuando los huevos inician su transporte a la planta de incubación estos sufren un incremento de temperatura que llega hasta los 26 °C y luego sufren un descens o de la misma hasta llegar a aproximadamente 19 °C, esto puede corregirse acon dicionando el transporte y/o transportándolo en horas más benignas.
En la siguiente grafica (Figura N. 2) se muestra un patrón de temperatura aceptable, donde se tiene un buen manejo de la temperatura hasta la planta de incubación.
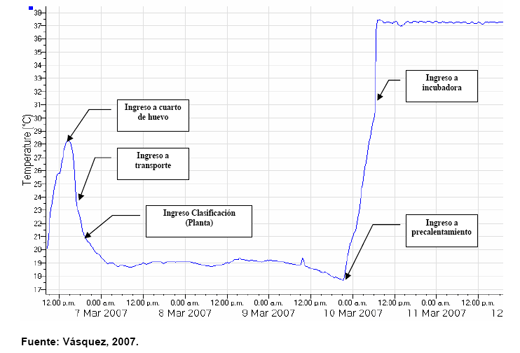
Figura N. 2: Gráfica de temperatura de manejo aceptable.
1.1.2 Manipulación
La manipulación brusca de los huevos durante su recolección, almacenamiento y transporte puede provocar fisuras en la cáscara, esto afecta directamente en la productividad, ya que todo huevo fisurado que es colocado en la incubadora no nace, por lo tanto, mantener un manejo cuidadoso del huevo es muy importante, y el cual debe hacerse desde el nido hasta la colocación en la incubadora.
Para monitorear este factor pueden realizarse muestreos semanales en la incubadora, determinando así el porcentaje de huevos fisurados. Debe establecerse un mínimo aceptable de este tipo de huevos, el cual dependerá de la edad de la reproductora, el monitoreo semanal permite determinar su tendencia, cuando se presenten aumentos significativos en el porcentaje de huevo fisurado y rotos se debe investigar la causa y una de esas causas puede ser el manejo brusco y el transporte; por lo que debe instruirse al personal para que realicen un manejo cuidadoso del mismo. En cuanto al transporte en vehículos, el uso de camiones con suspensión neumática puede ayudar a disminuir el número de huevos fisurados.
1.1.3 Tiempo de almacenamiento
“Cuando los huevos incubables se conservan a temperatura de 18.3 °C (65 °F), se detiene por completo el desarrollo embr ionario. Sin embargo, disminuye la incubabilidad por cada día que los huevos están detenidos” (North y Bell, 1993)
Según North y Bell (1993) si los huevos se almacenan menos de 5 días no se afecta el porcentaje de nacimiento, al almacenarlos por más tiempo ocasiona disminución considerable la incubabilidad, aproximadamente un 2% por cada día adicional de almacenamiento. Cuanto más tiempo se desee almacenar, más se debe bajar la temperatura y aumentar la humedad relativa.
Según Vásquez (2000) , el tiempo de almacenamiento óptimo depende de la edad de la parvada reproductora; a continuación se detalla el tiempoóptimo de almacenamiento recomendado:
Huevos de fase I: Los huevos de reproductoras de primera fase, (25 a 33 semanas de edad) se deben almacenar por 5 días para mejorar la calidad de la albúmina.
Huevos de fase II: Los huevos de reproductoras de segunda fase, (34 a 50 semanas) se deben almacenar por un máximo de 5 días.
Huevos de fase III: Los huevos de tercera fase, (de 51 semanas en adelante) se deben incubar con el menor tiempo de almacenaje posible (máximo 3 días de almacenamiento).
1.2 Sanidad del huevo
Cuando la planta de incubación recibe huevos contaminados, poco puede hacerse para eliminar esta contaminación, y representan un gran riesgo, ya que dentro de la incubadora se dan las condiciones ideales para el crecimiento de los microorganismos (alta temperatura y humedad), y pueden contaminar el resto de los huevos dentro de la incubadora.
Los huevos tienen un buen sistema de defensa para impedir su contaminación, para ello cuentan con cuatro cubiertas, (14 y 9). “La primera en prevenir la penetración es la cutícula, pero como no es muy constante el grosor, es muy variable en su capacidad para prevenir que las bacterias entren por lo poros de cascaron. La segunda mejor cubierta de las cuatro para resistir la penetración de las bacterias es el cascarón. Aunque un huevo de 56.7 g (2 oz.) contiene alrededor de 8,000 poros, la mayor parte de estos son muy pequeños para que penetren las bacterias. Pero hay un pequeño porcentaje de poros malformados que son varias veces el diámetro de gran parte de las bacterias” (North y Bell, 1993). Según North y Bell (1993) muchas bacterias no logran penetrar las membranas pero pueden vivir en los poros por más de tres semanas antes de entrar.
Las dos membranas de la cáscara (interna y externa) son la siguiente barrera que tienen que penetrar los microorganismos, dichas membranas están formadas por fibras que actúan como filtros, sin embargo son vulnerables cuando el nivel de contaminación es alto (Valle, 2001).
La albúmina también tiene propiedades fisicoquímicas que ayudan a contener los microorganismos que logren penetrar las membranas.
Aunque el huevo tiene este sistema efectivo de defensa, puede ser vencido cuando la carga es demasiado alta, según Gentry (1973) , un huevo limpio tiene en promedio 10,000 colonias de bacterias y un huevo sucio puede tener hasta 200,000 colonias, por lo tanto la única manera de reducir esta carga bacteriana es realizando una desinfección inmediatamente después de la oviposición (North y Bell, 1993). La desinfección debe efectuarse en la granja, lo más pronto posible después de ser puesto el huevo, pues la alta temperatura del huevo al ser puesto hace que por un momento los poros estén más abiertos, y al enfriarse estos se cierran quedando los microorganismos en su interior y haciendo difícil si no imposible su desinfección posterior.
Generalmente los huevos que presentan mayor contaminación son los huevos provenientes de reproductoras muy jóvenes y las de aves viejas, esto por razones diferentes, las primeras porque es común que al inicio de la postura una gran cantidad de aves ovipositen en el piso y se envíe este huevo a la planta, y las segundas porque la cáscara de las aves viejas es más delgado. Es normal que se acepte algún grado de contaminación, que va de un 0.5 % hasta un 1% para huevos de reproductoras de fase III, sin embargo un mayor numero de huevos contaminados es inaceptable porque afecta directamente en la productividad. La determinación de este porcentaje de contaminado se determina con un análisis semanal de residuos y de laboratorio.
Los microorganismos más comunes que suelen contaminar los huevos y que tienen efecto negativo sobre la incubabilidad son: Proteus mirabilis, Staphyloccus aureus, Streptococcus spp., Escherichia coli, Enterobacter aerognes y Pseudomona spp. (Valle, 2001).
También es importante tener en cuenta que microorganismos de transmisión vertical como micoplasmas también pueden afectar la incubabilidad porque ocasionan mortalidad tardía de los embriones por efecto de deficiencia respiratoria, afectando negativamente la productividad, para este tipo de patógenos debe realizarse prevención y/o control en las granjas reproductoras.
Ante esta amenaza biológica, la planta de incubación debe mantener un monitoreo microbiológico de los huevos que recibe, cuando se detecten incrementos en la carga microbiana deberá retro alimentar a su proveedor, para que se investiguen cuales con las causas de estos incrementos y se tomen medidas para disminuir esta contaminación, la frecuencia de estos monitoreos dependerá del conocimiento que se tenga de la condición sanitaria de los huevos que se reciben pero es normal que se realice un muestro quincenal o mensual cuando se tiene un buen historial.
La capacidad de las hembras de producir huevos fértiles depende de los factores de manejo en la granja reproductora, y dentro de éstos factores la fertilidad y capacidad de cópula de macho juega un papel muy importante (North y Bell, 1993). El proceso de incubación no afecta la fertilidad, y aunque generalmente a las planta de incubación se les mide por el porcentaje de nacimiento sobre el total de huevos incubados, el verdadero rendimiento debe medirse por el nacimiento sobre fértiles, porque cuando se reciben huevos de baja fertilidad éstos producirán un porcentaje bajo de nacimiento, aunque el proceso de incubación sea óptimo. Lo más recomendable para medir la eficiencia es el porcentaje de nacimiento sobre fértiles, este porcentaje indica cual fue el porcentaje de pollitos que nacieron de los huevos fértiles y elimina el efecto de los infértiles, la formula para calcularlo es:

Aplicando esta formula por ejemplo: si se obtiene un porcentaje de nacimiento sobre huevos totales de 66.5 pero los huevos que se incubaron tenían solo 70 de fertilidad, el % de nacimiento sobre fértiles es 95.
Se considera que un porcentaje mayor a 88% de nacimiento sobre fértiles es aceptable, y un 95% es ideal, en general una buena planta debe estar en este rango, con un promedio de 92%.
Otra forma de medir la eficiencia de la incubadora es por la diferencia entre la fertilidad y el % de nacimientos, el ideal es que se acerca del 5% (Nilipour, 1998), esto significa que si la fertilidad es de 85% un % de nacimiento ideal sería de 80%, aplicando la formula del NSF esto es 94% de nacimiento sobre fértiles.
1.3.1 Determinación de la fertilidad
El método más práctico para determinar la fertilidad es por medio de ovoscopía (North y Bell, 1993), para evitar errores lo mejor es realizarla después del día 12 de incubados, los huevos claros que se obtienen de la ovoscopía deben abrirse para determinar que porcentaje corresponde a infértiles y a mortalidad embrionaria.
1.4 Calidad del cascarón
La calidad del cascarón (cáscara) es uno de los factores que tiene mayor incidencia sobre la incubabilidad (North y Bell, 1993). Generalmente la calidad del cascarón se deteriora a medida que la reproductora aumenta de edad, esto se debe básicamente a que con la edad, el tamaño del huevo aumenta, se reducen las reversas de este calcio y el metabolismo de las aves para procesarlo. Para coadyuvar en esta situación las reproductoras deben ser alimentadas una ración balanceada.
Se deben realizar monitoreos periódicos de la calidad del cascarón, este monitoreo se puede realizar por medio de la determinación de la densidad especifica de los huevos, porque está directamente relacionada con la calidad de la cáscara, se considera que una densidad promedio mayor o igual a 1.080 es indicativo de una buena calidad (North y Bell, 1993).
La calidad del cascarón es importante porque está directamente relacionada con el intercambio gaseoso del embrión, protección contra la invasión de patógenos, así como la protección contra las fracturas. Además es la fuente de calcio para el sistema óseo del embrión (Miles, 1993).
1.4.1 Intercambio gaseoso y de calcio
A medida que el cascarón es más delgado, la humedad se mueve más libremente a través de él, resultando en un aumento en la evaporación del contenido del huevo, con lo que se producen pollitos pequeños (North y Bell, 1993) y más propensos a la deshidratación, además disminuye la cantidad de calcio disponible para la formación del sistema óseo del pollito, resultando un pollito de mala calidad.
1.4.2 Protección contra patógenos El cascarón es la segunda barrera contra de los patógenos, en la medida que ésta sea de mejor calidad protegerá más al embrión de los patógenos invasores.
1.4.3 Protección contra roturas
Según datos de North y Bell (1993) , hasta un 2% de los huevos puede romperse durante el proceso antes de la eclosión. La cantidad de huevos fisurados y rotos se disminuye cuando los huevos poseen cáscara de buena calidad.
2. Sanidad de la planta
En muchas ocasiones los programas de sanidad están focalizados en el uso de desinfectantes, pero la sanidad es deficiente en otras áreas como; manejo de huevo, flujo, limpieza, entre otros (Mauldin y Wilson, 1991). Se debe tomar en cuenta que para que los desinfectantes tengan un buen efecto sobre los patógenos debe tenerse un programa integral de sanidad. Los componentes de un buen programa de sanidad son:
2.1 Iniciar con un huevo sano.
2.2 Aislamiento.
2.3 Flujo.
2.4 Limpieza y desinfección.
2.1 Iniciar con un huevo sano
Como se menciona en el capitulo anterior de Calidad del Huevo, en la planta de incubación no se puede hacer nada por los huevos que llegan contaminados, por lo tanto la planta de incubación debe realizar monitoreos microbiológicos para determinar el nivel de contaminantes que tienen los huevos con los que esta iniciando el proceso, y debe retro alimentar a su proveedor cuando los niveles de contaminación se eleven. En las reproductoras los factores que influyen en el nivel de sanidad del huevo incubable son: manejo de la cama y nidos, recolección y selección, procedimiento de sanitización, manejo, almacenamiento y transporte.
2.2 Aislamiento
Tanto la planta de incubación como las granjas de reproductoras deben estar lo más aislado posible de otras instalaciones avícolas para evitar la introducción de patógenos (Mauldin y Wilson, 1991), sin embargo esto no siempre es posible porque aunque las reproductoras e incubadora se instalen en ubicaciones relativamente aisladas de otras instalaciones avícolas, no se puede tener control de las instalaciones que se construyan en los alrededores, es importante diseñar un programa de Bioseguridad estricto y funcional en el que se tomen en cuenta todos los detalles del proceso según las características de la planta.
2.3 Flujo
El flujo de la incubadora debe estar diseñado de tal forma que el flujo de trabajo, personal y aire siga la misma ruta de los huevos (Mauldin y Wilson, 1991), para poder realizar esto todo el flujo debe ser en una sola vía. De lasáreas más limpias hacia las menos limpias, deben establecerse restricciones de paso de personal por áreas y con personal específico para cada área, preferiblemente con ropa de diferente color. Con esto se ayuda a evitar la contaminación cruzada.
La ventilación debe recibir especial atención, preferiblemente cada sala debe tener su propio sistema de ventilación (Mauldin y Wilson, 1991). En general las salas más limpias como; cuarto de huevo y salas de incubadoras deben tener una presión ligeramente positiva (0.1 a 0.2 pulgadas de agua) y las áreas sucias como salas de nacedoras, salas de pollito y sala de lavado una presión ligeramente negativa (-0.1 a -0.2 pulgadas de agua), lo ideal es que estas presiones se controlen utilizando ventiladores de velocidad variable comandados por un sistema digital de control de presión, pero si no se cuenta con este equipo, las salas que requieren de presión positiva se les coloca ventiladores de mayor capacidad de inyección y ventiladores de menor capacidad de extracción y las salas que requieren presión negativa al contrario (extractores de mayor capacidad que los inyectores) , todo esto cumpliendo con los volúmenes de aire necesarios para el huevo o pollito que se tenga en cada área.
Según North y Bell (1993) , los requerimientos de aire por sala para una planta de incubación que tenga una temperatura ambiente promedio de 21.1°C deberían ser: Cuarto de conservación 0.06, sala de incubación 0.28, sala de nacedoras 0.57, cuarto de pollitos 1.42 mts. Cúbicos por minuto por cada 1,000 huevos o 1,000 pollitos.
2.4 Limpieza y desinfección
La limpieza y desinfección son dos factores muy importantes en el mantenimiento de la sanidad dentro de la planta de incubación, siempre existirán microorganismos no deseados dentro de la planta por las características de esta operación, el objetivo de un programa de sanidad es mantener los microorganismos controlados a niveles aceptables, y en esto el proceso de limpieza y desinfección juega un papel importante.
Todos los desinfectantes son más efectivos en un ambiente limpio, ya que los residuos de materia orgánica los neutralizan, por lo tanto un buen trabajo de limpieza es bien recompensado por el buen efecto que tendrán los desinfectantes (Mauldin y Wilson, 1991).
2.4.1 Limpieza
La planta posee una diversidad de procesos y algunos de éstos requieren frecuencias y niveles diferentes de limpieza; básicamente todo el proceso de incubación se puede dividir en 2 etapas, la primera etapa son los 18.5 (18-19) días que pasan los huevos en las máquinas incubadoras y la segunda etapa los últimos 2.5 (2-3) días en las nacedoras.
La primera fase de 18.5 días es la que se considera la más limpia del proceso y por esta razón puede caerse en el error de no limpiar con suficiente frecuencia, como cada planta es diferente no se puede establecer una frecuencia estándar, sino que cada planta debe diseñar un procedimiento a medida, es importante poner especial atención a las zonas que son más difíciles de limpiar y a las que por su funcionamiento facilitan la diseminación de los microorganismos como: ductos, aspas, serpentines, admisión de aire y sistema de humidificación, tanto de las máquinas incubadoras como de las salas y del edificio en general.
La segunda fase del proceso de incubación en las nacedoras es más difícil pasar desapercibida, debido a que después del nacimiento las nacedoras quedan totalmente impregnadas con plumón de los pollitos que nacieron, por lo que es lógico e imperativo que se debe realizar una limpieza profunda, en esta parte es importante hacer énfasis que debido a la gran cantidad de materia orgánica que se acumula se facilita la formación bio-películas (Briosentry, 1999) que son capas de materia orgánica que pueden esconder y proteger microorganismos patógenos. Para evitar la formación de estas bio-películas es recomendable establecer un programa de limpieza que alterne el uso de jabones alcalinos y ácidos (neutros) en ciclos 3 a 4 semanas con un jabón alcalino por 1 a 2 semanas con un jabón ácido.
2.4.2 Desinfección
El objetivo de la desinfección es mantener los niveles de los microorganismos nocivos a niveles aceptables y para esto se aplican desinfectantes utilizando diversas técnicas y equipos. Las técnicas más comunes de desinfección de una planta de incubación son: aspersión, nebulización y termonebulización. La técnica a aplicar depende de la disponibilidad de recursos, nivel de automatización y del área que se este
desinfectando.
En cuanto a que desinfectantes utilizar, North y Bell (1993) dan algunas características de un buen desinfectante: altamente germicida, no tóxico para los humanos y animales, efectivo bajo la presencia de niveles moderados de materia orgánica, no corrosivos, buena solubilidad en el agua, alta capacidad de penetración, buen precio y fáciles de adquirir, otras características deseables son: que no induzcan resistencia en los gérmenes, que no provoquen mortalidad embrionaria, alta residualidad, de amplio espectro y que no pierdan su efectividad con las aguas duras, sin embargo todas estas características son muy difíciles de encontrar en un solo desinfectante por lo que es necesario validar los desinfectantes que se utilizan por medio de análisis de laboratorio, realizar combinaciones de desinfectantes así como el mantenimiento de un programa de rotación con por lo menos tres tipos de desinfectantes. Cuando se hacen mezclas, lo más efectivo es realizar una combinación de un bactericida con un fungicida, ya que las bacterias y los hongos son los gérmenes más comunes en una planta de incubación y aunque muchos de los desinfectantes tienen acción contra ambos, lo mejor es la aplicación de un fungicida específico combinado con un buen bactericida.
2.4.2.1 Desinfectantes más comunes.
Fenoles: Éstos actúan por medio de la desnaturalización y precipitación de la proteína celular, tienen principalmente acción bactericida y algo de acción viricida y fungicida, tiene moderada tolerancia a la presencia de materia orgánica, pierden su efectividad cuando se aplican con aguas duras y su mayor efectividad se logra con pH alto. Son compatibles con aniones (North y Bell, 1993), éstos se pueden utilizar en todas las áreas de de la planta.
Amonios: Es uno de los desinfectantes más utilizados en las plantas de incubación debido a sus características de precios, disponibilidad, baja toxicidad y efectividad bactericida.
Son compuestos catiónicos (carga positiva), que actúan por desnaturalización de la proteína celular, pierden su efectividad con la presencia de materia orgánica, baja efectividad en aguas duras, aunque los amonios de doble cadenas son más resistentes a las aguas duras, son más efectivos si en vehículos ligeramente ácidos (North y Bell, 1993). Se pueden utilizar en todas las áreas de la planta de incubación.
Cloro: En las plantas de incubación su uso más frecuente es la potabilización del agua, ya que para ser usada como desinfectante se necesitan entre 200 a 300 ppm. a esta concentración es una solución altamente irritante y corrosiva. Su mecanismo de acción es la desnaturalización de la proteína y ácidos nucleicos de los virus, tiene acción bactericida, fungicida y alguna acción viricida. Tiene alta reactividad con la materia orgánica, es más efectivo a mayor temperatura y pH ligeramente ácido (North y Bell, 1993).
Yodóforos: Son compuestos de acción no iónica, su mecanismo de acción es por la reacción con el ácido nucleico celular, son efectivos contra bacterias, hogos y virus sin cobertura. Su efectividad disminuye rápidamente en presencia de materia orgánica y pH alto, el pH ideal del vehículo es 2 a 4 y este es un pH muy difícil de lograr.
Ácidos orgánicos (cítrico): Son productos relativamente nuevos en el campo de la incubación avícola, su mecanismo de acción es por cambios en la permeabilidad de la pared celular y desnaturalización de la proteína (cita pendiente), son efectivos contra bacterias y tienen baja efectividad para hongos. Son una buena alternativa de rotación cuando se tiene resistencias a los desinfectantes tradicionales. No son corrosivos y son inocuos para las personas.
Agentes oxidantes: actúan por oxidación de la materia orgánica, tienen acción bactericida y alguna acción fungicida y viricida. Aunque se pueden aplicar en todas las áreas de incubación, debe ponerse mucha atención a su aplicación ya que son altamente corrosivos y pueden ocasionar daños a todos los equipos susceptibles de corrosión.
Formaldehído: Históricamente es uno de los desinfectantes más utilizados en las plantas de incubación por su comprobada acción bactericida, fungicida, viricida y esporicida y por su facilidad para gasificarse. Actúa por medio de desnaturalización proteica y con los compuestos de los ácidos nucleicos. No reacciona con la materia orgánica (North y Bell, 1993). Actualmente su uso esta siendo cuestionado por los efectos nocivos a la salud humana y ambiental, pero por su alta efectividad aun es ampliamente utilizado. Su utilización debe ser bien controlada ya que puede ocasionar serios daños tanto a la salud humana como a los embriones y pollitos. En incubadoras no se debe utilizar cuando los embriones tienen entre 24 y 96 hrs. de incubados.
La gasificación del formol se realiza con permanganato de potasio (KMnO4). Se utiliza generalmente a concentraciones de 1X (dosis simple) (1X corresponde a 7 g. de permanganato de potasio y 14 cc de formol por m3), pero puede utilizarse a 2X, 3X y hasta 5X. En presencia de embriones se puede utilizar hasta un máximo de 2X siempre que no estén entre 24 y 96 de incubados.
El formol es utilizado para desinfectar nacedoras esto también da un color más amarillo a los pollitos, pollitos bien amarillos por efectos del formol se han asociado a pollitos libres de contaminación (North y Bell, 1993). Sin embargo la aplicación de formol a pollitos en la nacedora causa daños en el epitelio del sistema respiratorio, y puede comprometer la salud de éstos.
Cuando se tiene un sistema integral de limpieza y desinfección generalmente ya no es necesario desinfectar las nacedoras con pollitos para que éstos estén libres de contaminación.
2.4.2.2 Áreas a desinfectar
Por las condiciones de la planta de incubación es un lugar muy susceptible a crecimiento de patógenos, por lo tanto todas las áreas deben tener una atención particular y adaptar un sistema de desinfección idóneo.
2.4.2.2.1 Sistema de admisión de aire
Cualquiera que sea el sistema de admisión de utilice la planta de incubación, debe tener algún tratamiento para prevenir que ingresen contaminantes a través de este, cuando se utilizan paneles evaporativos, éstos sirven también para filtrar el aire que ingresa ya que al pasar a través de éstos, el polvo y otras partículas son atrapadas en las paredes húmedas de éstos paneles, a esta agua también se le puede agregar un desinfectante que ayude a eliminar algunos gérmenes que puedan ir en el aire que esta ingresando a la planta. Cuando no se utiliza este sistema es necesario poner algún tipo de filtro para minimizar el ingresos de contaminantes a la planta, los sistemas de acondicionamiento para salas de incubadoras actuales ya traen un sistema de filtrado muy eficiente que evita el ingreso de material no deseado a las áreas de la planta de incubación.
2.4.2.2.2 Cuarto de huevo
La desinfección del cuarto de huevo es crítica para minimizar la contaminación en la planta. Antes de ingresar a la planta los huevos han pasado por gran exposición a contaminantes. Por lo que es necesaria su desinfección para reducir el riesgo de contaminación cruzada, además en el cuarto de huevo debe realizarse una desinfección periódica (Thaxton, 1995).
En el cuarto de huevo debe ponerse mucha atención a la eliminación de los huevos rotos, piso y porta huevos sucios, esto no debe permitirse en esta área.
2.4.2.2.3 Salas
Las salas de incubadoras deben limpiarse y desinfectarse por lo menos 1 vez por semana, esto se debe realizar cuando no se encuentren huevos, debe hacerse énfasis en los humidificadores y en las aspas de los ventiladores, éstos deben limpiarse y desinfectarse por lo menos una vez por mes (Thaxton, 1995). Las salas de nacedoras se deben lavar y desinfectar depuse de cada nacimiento.
2.4.2.2.4 Máquinas (Incubadoras y nacedoras)
La periodicidad de la limpieza y desinfección de las incubadoras varía dependiendo de las condiciones de cada incubadora, lo más común es que se realice 1 ó 2 veces por semana junto con las cargas que se le realicen a la incubadora, pero existen sistemas que permiten realizar aplicaciones de desinfectante cada hora, las nacedoras se deben desinfectar después de cada nacimiento.
Los puntos importantes a poner intención son: boquillas humidificadoras, aspas de los ventiladores, los ductos y los huevos explotados y/o derramados (Thaxton, 1995). Es importante que la desinfección de las incubadoras sea dosificada por metro cúbico, ya que aquí más que desinfectar la superficie nos interesa desinfectar todo el ambiente en el que encuentran los embriones, por lo que debe establecerse una dosis por metro cúbico, y esta dosis debe aplicarse si importar la cantidad total de huevos que tenga la máquina.
2.4.2.3 Validación del programa de limpieza y desinfección
Cada planta de incubación tiene condiciones muy particulares según la intensidad de su producción, condiciones ambientales, tipo de patógenos presentes y nivel de resistencia de los mismos, por lo que establecer un programa estándar de limpieza y desinfección es prácticamente imposible. Por lo que cada planta debe establecer la frecuencia y tipo de productos que se adecuen a esa situación en particular. Para realizar esto se debe apoyar con análisis de laboratorio, con ello se podrá; validar el desinfectante, la dosis y la frecuencia. Para los ambientes como salas, incubadoras y nacedoras generalmente se utilizan placas con agar de crecimiento selectivo tanto para hongos como bacterias, los niveles generalmente aceptados como buenos son de 5 o menos unidades formadoras de colonias. Para las superficies se utilizan hisopos u otro tipo de método que este disponible.
3. Condiciones de incubación.
Las variables ambientales de incubación más importantes son:
Temperatura, humedad relativa y volteo. El mantenimiento óptimo de estas variables esta directamente relacionado con la cantidad y calidad de pollito que produce la incubadora, otra variable que esta tomando importancia es el CO2, principalmente con incubadoras de etapa única, en incubadoras de etapa múltiple aunque se puede monitorear y controlar levemente no se logran los beneficios que con incubadoras de etapa única.
3.1 Temperatura
La temperatura toma importancia desde la postura hasta el nacimiento del pollito, antes de incubarse los huevos deben mantenerse por debajo del cero fisiológico, según North y Bell (1993) el cero fisiológico es 23.9 °C (75 °F).
La temperatura más recomendada para el almacenamiento de los huevos es 18.3 °C (65 °F) cuando el tiempo de almacenamiento no sobre pasa los 6 días, este es el tiempo máximo recomendado para obtener la mayor productividad.
3.1.1 Temperatura de Incubación
Los embriones tiene una temperatura óptima para su crecimiento ideal, cuando la temperatura se desvía de esta temperatura el crecimiento de los embriones se ve afectado (North y Bell, 1993).
La temperatura de incubación debe estar entre 98.5 a 100.3 °F, la temperatura óptima esta dentro de este rango, esta dependerá del tipo de incubadora que se este utilizando, cada tipo de incubadora tiene una recomendación de temperatura óptima que debe usarse como guía. En general para las incubadoras de etapa múltiple la temperatura óptima es muy cerca a los 99.2 °F. ( ± 0.5 °F). Para las incubadoras de carga única esto e s totalmente diferente ya que en estas máquinas lo normal es que se maneje un perfil y no un punto fijo, el perfil consiste en variar la temperatura con la edad del embrión, iniciando con una temperatura de aproximadamente 100.5 °F y finalizando a los 18.5 días con aproximadamente 98.5 °F.
Después de la transferencia (18.5 días) debe mantenerse una temperatura ligeramente inferior a los primeros 18.5 días, que para las nacedoras de etapa múltiple es aproximadamente 98.5 °F, y para las nacedoras de etapa única va desde 98.5 en las primeras horas después de la transferencia hasta 97.5 en las ultimas horas antes de ser retirado el pollito de la nacedora.
Temperaturas arriba del lo ideal adelantaran el nacimiento y temperaturas por debajo lo retrasaran, el tiempo de adelanto o retrazo depender de cuanto se incremente o disminuya la temperatura y el tiempo que permanezca fuera del óptimo, las 504 horas (21 días) que debe durar el periodo de incubación deben ser la guía del incubador, más de 4 horas de desajuste en este período requieren que se corrijan las condiciones de incubación, y la temperatura es el factor que más influye sobre tiempo de nacimiento.
A pesar que cada tipo de incubadora tiene una recomendación de temperatura óptima, esta varía según algunos factores como: tamaño del huevo, calidad del cascarón, genética, edad de las reproductoras, tiempo de almacenamiento y humedad relativa de incubación (North y Bell, 1993).
3.1.2 Efecto de variaciones significativas de la temperatura sobre la incubabilidad
Sin duda la temperatura es uno de los factores ambientales más importantes durante todo el proceso de incubación, los embriones soportan leves variaciones (± 0.4 °F) sin efectos nocivos notables sobre la incub abilidad, sin embargo desviaciones mayores a 0.6 tendrán efectos dañinos notables sobre la incubabilidad, estas desviaciones asociadas con el tiempo de exposición pueden causan grandes perdidas en la planta de incubación.
Las altas temperaturas son las que ocasionan los mayores daños, según North y Bell (1993) , exposición de los embriones por 6 hrs. a 110 °F provocan disminución notable en la incubabilidad y 115 °F po r 3 hrs. ocasionara la muerte de todos los embriones.
Las bajas temperaturas son menos letales y menos frecuentes durante el proceso de incubación pero no por eso menos importantes, exposiciones a bajas temperaturas alargan el periodo de nacimiento y provocan un decremento significativo en el calidad del pollito, debidas básicamente a mal posiciones embrionarias (North y Bell, 1993). Cuando un nacimiento se retrasa los pollitos que no nacen durante el periodo previsto generalmente no pueden ser aprovechados ya que es anti-económico e impractico mantener los embriones retrasados hasta su nacimiento total, a menos que las condiciones de manejo de la planta lo permitan. Lo más común es que se eliminen los embriones que no nacen en el tiempo previsto (21 días ± 4 hrs).
Cuando los huevos que se incuban son expuestos a temperaturas que sobrepasan en cero fisiológico ocasiona que el periodo de nacimiento (spread) se alargue, esto también puede porque la incubadora no este manteniendo uniformidad de la temperatura en toda la masa de huevos, en incubadoras de etapa múltiple es normal que el periodo de nacimiento sea de hasta 36 hrs en incubadoras de etapa única esto se reduce a 26 hrs, periodos de nacimiento mayores deben ser motivo de acciones correctivas del manejo de la temperatura previa determinación del origen del problema.
3.1.3 Temperatura de los embriones
El uso de la temperatura del los embriones es una herramienta que ha tomado importancia en el control de la temperatura, esta temperatura se mide indirectamente midiendo la temperatura de la cáscara de los huevos con un termómetro láser de alta confiabilidad.
La temperatura del embrión depende de la temperatura del aire y de la habilidad del embrión en realizar el intercambio, por lo que existe una diferencia entre la temperatura del aire y la temperatura del embrión debida al calor metabólico del embrión, su temperatura se incrementa a medida que acerca al día del nacimiento, esta temperatura es un reflejo del grado y ritmo metabólico del embrión (Meijerhof, 2003).
Monitorear la temperatura del embrión es tan importante como monitorear las condiciones ambientales de la incubadora, la temperatura embrional, es frecuente encontrarse con condiciones ambientales aceptables pero temperaturas embrionales perjudiciales, hacer ajustes oportunos basadonse en el desarrollo embrional puede mantener un porcentaje de óptimo de nacimiento.
Las temperaturas embrionarias varían según el tiempo de incubación y el tipo de máquinas, se considera que la temperatura óptima debe estar entre 100.0 y 100.5 °F. Los primeros días de incubación l a temperatura embrionaria debe estar entre 99.5 y 100.0 °F. y al finalizar el período de incubación entre 100.0 y 101.0 (Meijerhof, 2003).
Las incubadoras presentan variaciones de temperatura por zonas, según su sistema de ventilación, las áreas donde la velocidad del aire el menor la temperatura tiende a ser más alta, lo importante es conocer que áreas de la incubadora presentan las temperaturas más elevadas y tener un punto de toma de lecturas de tal forma que ese punto represente la temperatura promedio embrional de toda la máquina, también es importante hacer énfasis en que temperaturas embrionarias superiores a 102.5 son perjudiciales, por lo que se debe tratar de que las zonas más calientes de la máquina no sobre pasen dicha temperatura cuando los embriones estén entre 16 y 18 días de incubados.
3.2 Humedad
Proporcionar a los huevos una humedad óptima es tan importante como la temperatura (Nilipour, 1998). Durante el periodo de incubación el contenido del huevo debe perder cierta cantidad de agua, esta perdida de humedad es un importante ya que tiene gran influencia en la calidad del pollito. La pérdidaóptima de humedad influirá mucho en la calidad y en el porcentaje de nacimiento.
La pérdida debe ser suficiente para que la cámara de aire alcance el tamaño adecuado para que el embrión pueda realizar la transición respiratoria córioalantoidea a respiración pulmonar (Salazar, 2000).
La mayoría de máquinas incubadoras controlan la humedad por medio de una medición indirecta de la humedad relativa, esto se hace por medio de la temperatura de bulbo húmedo, pero también existen máquinas que tienen censores para leer porcentaje de humedad.
Los porcentajes de humedad recomendados van de 45 a 60 % dependiendo del tipo de máquina y tipo de huevo que se este utilizando, los huevos de menor tamaño y con cáscara de menor calidad pierden humedad con más facilidad por la mayor relación área volumen y por la mayor permeabilidad de la cáscara respectivamente, por lo que es aconsejable hacer ciertos ajustes en la humedad según el tipo de huevo que se este incubando, generalmente se acostumbra a dar un poco más de humedad a los huevos provenientes de reproductoras jóvenes.
3.2.1 Manejo de la humedad en las incubadoras
La forma más efectiva de determinar cual el porcentaje de humedad óptima en la incubadora es por medio de la medición periódica de la perdida de peso durante el periodo de incubación (18.5 días), el rango más aceptado como ideal está de 11 a 14 %, los huevos de reproductoras jóvenes (pequeños) perderán más y lo huevos de reproductoras de fase III perderán menos. Para realizar esta medición se pesan los huevos (alrededor de 324 en 3 posiciones de la máquina) al momento de ingresar a la incubadora y luego al momento de transferirlos a la nacedora, la diferencia de peso será la pérdida de humedad. Si se determina que la pérdida de peso esta fuera del rango recomendado se deberá subir o bajar la humedad según se a el caso, generalmente se recomienda realiza cambios de 0.5 °F o 2% cuando la diferencia con lo ideal no es muy alta (1-2%), y siempre teniendo en cuenta que la temperatura de bulbo húmedo de las incubadoras debe estar entre 80 a 86 °F, o 45 a 60 % de humedad relativa dependiendo de la temperatura de bulbo húmedo que se este utilizando.
Debe tenerse en cuenta que si las condiciones de la sala no favorecen a la máquina incubadora a mantener la humedad que se le programó poco o ningún efecto tendrá este cambio sobre la perdida de humedad de los huevos (Salazar, 2000).
3.2.2 Manejo de la humedad en las nacedoras
Para la humedad de la nacedoras se sigue un criterio un poco diferente, el objetivo en esta etapa del proceso es que exista suficiente humedad para que el pollito pueda nacer sin dificultades y no se deshidrate, la humedad también ayuda a mantener una temperatura adecuada cuando no se cuenta con salas o plenums de ingreso acondicionados. La humead tampoco debe ser tan alta que ocasione un jadeo continuo de los pollitos en el intento de refrescarse, cuando la humedad es muy alta después del nacimiento puede ocasionar este jadeo continuo, y puede provocar debilitamiento y deshidratación.
Los rangos de humedad generalmente manejados en las nacedoras van desde 82 hasta 90 °F, algunas recomendaciones que s e dan es manejar baja humedad (82 a 84 °F bulbo húmedo) en el primer día y alta humedad (86 a 90°F) después que el 10% de los pollitos hayan roto e l cascarón, y luego baja humedad en las ultimas 8 horas antes de retirar los pollitos de la nacedora, sin embargo el incremento de la humedad durante el proceso de picado se produce en forma natural por la humedad que liberan los pollitos al salir del cascarón, por lo que probablemente la nacedora no requerirá activación del sistema de humedad.
3.3 Volteo
El objetivo de voltear los huevos es exponer a los embriones a los nutrientes y oxigeno, así como para evitar que éstos toquen la cáscara y se queden pegados ocasionándoles la muerte (Nilipour, 1998).
El ángulo de volteo debe ser de 45 grados respecto de la vertical, de tal forma que en cada volteo los huevos giren 90 grados (North y Bell, 1993). La falta de volteo puede ocasionar que una perdida de un 50 % del nacimiento (Nilipour, 1998), a continuación se presenta el cuadro N. 1 propuesto por North y Bell (1993) donde se muestran los efectos en el porcentaje de nacimiento ocasionado por un mal ángulo de volteo.
Cuadro No. 1. Efecto del ángulo de volteo de los huevos durante la incubación.
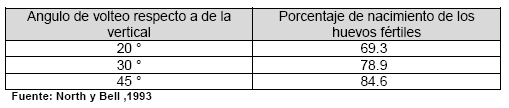
El intervalo de volteo tiene efecto en el porcentaje de nacimiento, a medida que se incrementa la cantidad de volteos diarios, el porcentaje de nacimiento sube, pero no se ha encontrado ningún efecto beneficiosos con más de 24 volteos diarios (Nilipour, 1998), por esta razón la mayoría de incubadoras poseen intervalos de una hora. Este intervalo de volteo es requerido durante los primero 15 días de incubación después el volteo no es necesario, a menos que la ausencia provoque incrementos no deseados de temperatura, en la incubadoras de ventilación por túnel es oportuno desconectar y colocar en posición horizontal los carros de los huevos que ya cumplieron 15 días para mejorar la ventilación.
3.4 Ventilación y CO2
El suministro de aire fresco a las incubadoras es muy importante para el buen desarrollo de los embriones, según Nilipour (1998) un embrión requiere de aproximadamente 6 litros de oxigeno, por cada 1 % de disminución en la concentración de oxigeno a partir de 21 % (concentración a nivel del mar) el porcentaje de nacimiento baja en un 5 %.
A medida que los embriones crecen requieren de mayor cantidad de oxigeno, en las incubadoras de etapa múltiple que tienen embriones en diferente edad de incubación se debe mantener menos de 0.3 % de C02 (Nilipour, 1998), la mayoría de máquinas regulan el ingreso de aire fresco abriendo o cerrando la compuerta de ingreso de aire, para que las máquinas no restrinjan el aire que les ingresa deben tratarse de mantener las condiciones de la sala de máquinas en las condiciones recomendadas de temperatura, si la sala se mantiene más fría de lo recomendado las incubadoras restringirán el ingreso de aire y por lo tanto se incrementara el nivel de C02 dentro de la máquina, a los requerimientos de las sala recomendados se muestran en el cuadro N. 2.
Para cumplir con los requerimientos de oxigeno de los embriones, el suministro de aire a la incubadora debe ser de por lo menos 5 pies cúbicos por minuto (pcm) por cada 1000 huevos (Cobb-Vantres inc. 2002).
Cuadro No. 2: Condiciones ambientales recomendadas para salas en la planta de incubación.
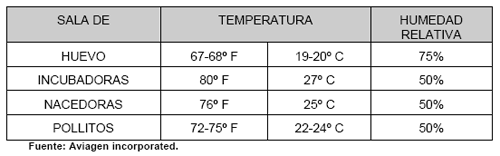
Anteriormente se creía que los embriones jóvenes tenían menor tolerancia al CO2 (Nilipour, 1998), sin embargo estudios más recientes realizados con incubadoras de etapa única han mostrado que en los primeros 7 días concentraciones de cercanas al 1 % tiene efecto beneficiosos sobre la calidad de los pollitos, ya que esto estimula un buen desarrollo del sistema circulatorio de los pollitos así como se produce un mejor aprovechamiento del calcio de la cáscara (Salazar, 2006).
Aprovechando este descubrimiento en incubadoras de etapa única se recomienda mantener cerrada la compuerta de ingreso de aire en los primeros 6 a 10 días dependiendo del tipo de incubadora, para realizar esto es necesario que la máquina cuente con un sistema de monitoreo y control de CO2, algunas incubadoras han experimentado con la inyección de CO2 durante este periodo, obteniendo resultados favorables pero con costos que no compensan. En incubadoras de etapa múltiple que poseen enfriamiento por agua y aire se recomienda mantener un control de la compuerta de ingreso de aire por nivel de CO2, programando la máquina para una concentración de 0.3 % (3000 ppm), para esto se requiere un sistema de monitoreo que consiste de un censor que comanda esta compuerta.
3.4 Importancia de la estabilidad de las condiciones de incubación y como lograrlas
Es indiscutible que el proporcionar las condiciones adecuadas de incubación proporciona la mejor productividad en una planta de incubación, además una mejor estabilidad de estas condiciones contribuye a obtener los mejores beneficios, mantener condiciones de incubación estables produce menor mortalidad embrionaria y por lo tanto mejor nacimiento, mantener un monitoreo permanente de las condiciones ambientales de la incubadoras y realizar las correcciones necesarias en importante para lograr esta estabilidad, actualmente se cuenta con sistemas digitales de control ambiental que son mucho más precisos que los sistemas que de control con termostatos de mercurio, éstos sistemas electrónicos son una herramienta muy valiosa para lograr estas condiciones.
4. Mantenimiento preventivo.
El mantenimiento preventivo consiste en todas las acciones realizas a la maquinaria y equipo tendientes a mantenerlos en un funcionamiento continuo y perfecto. Este mantenimiento ofrece; menor índice de fallas, elimina factores de riesgo, permite llevar orden en la verificación de los equipos y mantiene resultados estables (Torres, 2005).
Cada fabricante establece recomendaciones de mantenimiento preventivo para sus equipos, es importante seguir esas recomendaciones, el cumplimento del mantenimiento preventivo evitara que se tenga que apagar máquinas para realizar mantenimiento correctivo, el cual trae como consecuencia perdidas en la productividad debidas al costo y porque cuanto se hace este ya ha ocasionado mal funcionamiento de la máquina y por lo tanto afectara la producción (Cobb-Vantres inc. 2002).
Un buen programa de mantenimiento preventivo debe poseer lo siguiente: elaboración de reportes de verificación para mantenimiento interno y externo de las incubadoras y nacedoras, inventario de repuestos necesarios para la buena conservación de los equipos, contar con las herramientas y utensilios necesarios, definir la frecuencia de las verificaciones y mantenimientos a realizar (esta frecuencia es recomendada por el fabricante), programar fechas y tiempos, así como el apoyo del personal necesario para dichas operaciones (Torres, 2005).
Aunque cada fabricante posee recomendaciones específicas de mantenimiento, es importante hacer énfasis en los puntos que afectan más drásticamente la productividad de la planta de incubación, éstos son: mecha del bulbo húmedo, Boquillas de humedad, motores, aspas de los motores, resistencias y calibración.
4.1 Mecha del bulbo húmedo
Para que la máquina mantenga la humedad que se requiere, es necesario que la lectura que tome el censor sea la real, la mecha del censor o termostato debe estar en buenas condiciones, es necesario reemplazarla cada 7 días, también ayuda dándole vuelta a los 3 días después de haberla cambiado, este procedimiento de voltearla consiste en colocar la punta que esta dentro del recipiente de agua en el censor o termostato.
4.2 Boquillas de humedad
Debe verificarse su buen funcionamiento por lo menos 1 vez por semana e idealmente 2 veces por semana, el patrón de aspersión y la descarga son importantes para mantener la humedad programada a la máquina, deben limpiarse las que no estén cumpliendo con el patrón requerido y reemplazarse las que no se puedan reparar.
4.3 Motores y aspas
Las revoluciones de los motores son importantes para que exista una buena ventilación dentro de la máquina, se debe verificar esto por lo menos 1 vez cada 3 meses, los motores deben cumplir con las revoluciones especificadas por el fabricante y debe reemplazarse los que estén un 15 % por debajo de esta especificación esta verificación se puede realizar con un tacómetro o estroboscopio. Las aspas que vibran disminuyen su efectividad para mover el aire, al mismo tiempo que se revisan los motores debe revisarse también el estado de las aspas, estas deben reemplazarse cuando se detecte que tienen vibración, aunque esta vibración puede detectarse por observación directa es de mucha ayuda contar con un estroboscopio para realizar esta tarea.
4.4 Resistencias
El consumo de las resistencias debe revisarse al menos cada mes, las resistencias que no estén consumiendo el amperaje de la especificación deben reemplazarse, ya que de lo contrario la máquina tomara más tiempo en alcanzara la temperatura programada ocasionando disminución del porcentaje de nacimiento.
4.5 Calibración
Cada fabricante recomienda calibración de los censores de las máquinas a diferentes intervalos, pero en general una calibración de las máquinas cada 3 a 6 meses es razonable. Cuando los censores o termostatos estén defectuosos, éstos deben reemplazarse.
5. Uso eficiente de la energía.
Uno de los costos más altos en el proceso de incubación es la energía eléctrica, esto se debe a que todas la máquinas incubadoras utilizan motores eléctricos para su funcionamiento, una gran mayoría de las incubadoras utiliza resistencias para calentamiento y en general todo el sistema de la incubadoras opera con energía eléctrica, también se necesitan una serie de equipos de apoyo como; enfriadores, compresores, ventiladores, humidificadores entre otros. Esto hace que la factura de la energía eléctrica probablemente sea superada solo por el costo de la mano de obra.
Existen algunas acciones que se pueden tomar para hacer más eficiente el uso de la energía eléctrica:
5.1 Uso de lámparas Fluorescentes
Las lámparas fluorescentes son más eficientes en el uso de la energía eléctrica y pueden utilizarse para la iluminación tanto del edificio como dentro de las incubadoras y nacedoras.
5.2 Motores en buenas condiciones
Motores viejos y con los cojinetes en mal estado consumen más energía, los motores con cojinetes defectuosos deben repararse y los que tengan un consumo de energía mayor a su especificación deben ser reemplazados y rebobinados o utilizados en áreas donde su uso no sea continuo como en las incubadoras.
5.3 Sistemas eficientes
Las máquinas con sistemas digitales de control son mucho más eficientes en el uso de la energía, debido a que los censores son más exactos y por lo tanto la máquina utiliza menos ciclos de calentamiento, además las tarjetas electrónicas consumen menos energía que los contactores. Estas característica de de control más exacto de las condiciones además de reducir el consumo eléctrico también mejora el porcentaje de nacimiento, contribuyendo grandemente a aumentar la productividad.
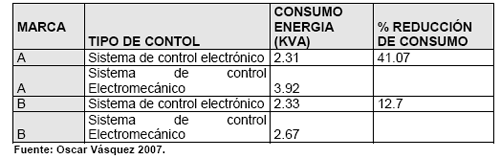
La mayoría de proveedores actuales de máquinas incubadoras proveen también los sistemas de transformación a sistema digital, esta es una inversión que se recupera muy rápidamente, pues como se menciona disminuye el consumo eléctrico, mejora los nacimientos y en algunos casos también disminuye el costo de mantenimiento. Los beneficios en ahorro de energía pueden verse en el siguiente cuadro (cuadro N. 3), en el cual se comparan 2 incubadoras iguales pero con diferente sistema de control, es este caso la incubadora marca “A” con el sistema de control digital consume un 41 % menos de energía que su homologa con control electromecánico, en la marca “B” el efecto es menor produciéndose un ahorro de casi un 13 %.
Cuadro No. 3. Comparación de consumo eléctrico de incubadoras con controles digitales y electromecánicos.
5.4 Buscar proveedores con precios más competitivos
Actualmente existen productores privados de energía eléctrica que proveen este servicio a precios más competitivos, el procedimiento consiste en buscar el distribuidor que tenga el precio más favorable y luego instalar la infraestructura del tendido que sea necesaria. Con este sistema es posible ahorrar hasta un 30 % del costo en energía con relación al proveedor tradicional de este servicio.
BIBLIOGRAFIA
1. Biosentry. 1999. Manual de sanidad para plantas de incubación. Biosentry, Inc. Georgia USA. 34p.
2. Cobb-Vantres Inc. 2002. Guía de manejo de la planta incubadoras. USA, 33p.
3. Gentry F. 1973. Higiene y manejo del huevo para incubar. Wiley laboratory. Pensylvania, U.S.A. p (40-51)
4. Martín S. 2003. Informe de Auditoria a Planta de incubación ARECA, Guatemala, Guatemala. 7p.
5. Mauldin J. y Wilson J. 1991. Doce componentes de un buen programa de sanidad en la incubadora. Avicultura profesional, Vol. 9, n. 2, Georgia, USA. p. 64-66.
6. Meijerhof, R. 2003. Embryo temperature – the new tool?. Hybro BV, Boxmerr. 3p.
7. Miles, R. 1993. Gravedad específica del huevo - establecimiento de un programa de verificación. Asociación americana de la soya. México. 6p.
8. Nilipour, A. 1998. El arte de incubación. Grupo MELO, S.A. Panamá, 16p.
9. North M., Bell D. 1993. Manual de producción Avícola. Trad. Por Martínez H. 3era. Edición. México, D.F. Ed. El Manual Moderno. 829 p.
10. Salazar, A. 2000. Embriones de alta conformación y pequeños ajustes de incubación. Chick Master internacional, USA, 7p.
11. Salazar, A. 2006. Manejo del CO2 en incubadoras multi-etapas. Chick Master internacional. Congreso Latino Americano de Avicultura. El Salvador. Presentación.
12. Thaxton, J. 1995. Hatchery manual, Misssissippi State University, Departament of Poultry Science, USA. 20p.
13. Torres, B. 2005. Mantenimiento preventivo, clave exitosa, Chick Master Internacional. Presentación.
14. Valle R. 2001. Manejo de huevos fértiles. in Seminario tecnológico de incubación. Guatemala, Guatemala. Chick Master International Inc. p. s.n.
15. Vásquez O. 2000. Procedimientos de la planta de incubación, ARECA. Guatemala. 28 p.
16. Vásquez O. 2007. Experiencia personal.
Buen dia : Felicidades por el articulo, muy bien descrito..
En lo referente a desechos de incubacion Nosotros en Mexico estamos haciendo composta de todos los desechos de incubacion con muy buenos resultados, el proceso es algo complejo, sin embargo el problema de que hacer con los desechos se disminuye al maximo
Saludos!!!!
Felicitaciones Oscar.
me parece muy oportuna tu apreciación y muy completa.Quisiera preguntarte que consideras tu cual debe ser la mejor forma de eliminar los desperdicios de la planta de incubación. Enterrando o talvez en un horno crematorio.
Atentamente.
Erik Macay Mero














.jpg&w=3840&q=75)