Efecto del producto de fermentación de Saccharomyces cerevisiae en funciones inmunes de pollos parrilleros atacados con Eimeria tenella
Publicado: 10 de septiembre de 2014
Por: J. Gao, H. J. Zhang, S. G. Wu, H. J. Yan, y G. H. Qi (Instituto de Investigación Alimentaria, Academia china de Ciencias de la Agricultura y Laboratorio Clave de Tecnología alimentaria, Secretaría de Agricultura de China) I. Yoon (Diamond V Mills Inc) D.Moore, S. H. Yu, Y.P. Gao (Colegio de Ciencias Animales y Tecnología del Noroeste, Universidad A&F).
Resumen
EXTRACTO
Trescientos sesenta pollos parrilleros machos Arbor Acres de 1 día de nacidos se distribuyeron al azar en 6 grupos con un a arreglo factorial de tratamientos de 2 x 3. Se dio como alimento tres niveles suplementarios (0, 0.25 y 0.50%) del producto de fermentación (XP) de of Saccharomyces cerevisiae para controlar pollos parrilleros infectados de Eimeria tenella.
Trescientos sesenta pollos parrilleros machos Arbor Acres de 1 día de nacidos se distribuyeron al azar en 6 grupos con un a arreglo factorial de tratamientos de 2 x 3. Se dio como alimento tres niveles suplementarios (0, 0.25 y 0.50%) del producto de fermentación (XP) de of Saccharomyces cerevisiae para controlar pollos parrilleros infectados de Eimeria tenella.
Los criterios de respuesta inmune y del rendimiento del crecimiento se midieron después de la infección de coccidia. El ADG de los pollos parrilleros bajó (P < 0.01) por la infección de coccidia y mejoró por el suplemento de XP (P = 0.04). El suplemento de XP incrementó el conteo de CD3+, CD4+ y CD8+ T-linfocito (P < 0.05) y la proporción CD4+:CD8+ en sangre (P = 0.06) y bazo (P = 0.04) así como el conteo de linfocitos intraepiteliales de íleo, conteos de IgA secretorias de amígdalas cecales, contenido de lisozimas en suero (P < 0.01) y relación albúmina/globulina (P = 0.02). Estos resultados sugieren que la suplementación de XP dietética podría mejorar la función inmune y el rendimiento del crecimiento en pollos parrilleros infectados de coccidia.
Palabras clave : cultivo de levadura, pollo parrillero, función inmune, infección de coccidia
INTRODUCCIÓN
La coccidiosis es una de las protozoiasis endémicas más dañinas que causa protozoiasis generando un rango bajo de crecimiento, conversión alimentaria ineficiente, desnutrición de aves y a reducción de ganancias de la industria de aves de corral.
El efecto anual de coccidiosis para la industrial mundial de aves de corral se estima que es de $1 a 2 billones (Talebi y Mulcahy, 1995; Yun et al., 2000). Actualmente, la prevención y tratamiento de coccidiosis descansa en vacunas y medicamentos.
Sin embargo, la inmunización es costosa y la efectividad de los medicamentos se puede ver comprometida por cepas resistentes de coccidia. Además, debido a los intereses del consumidor y a las estrictas normas sobre residuos de medicamentos, nuevos métodos de operación con coccidiosis que son seguros y eficientes son motivadas para reemplazar a los tradicionales. Se ha informado que las respuestas inmunes de la mucosa intestinal están altamente relacionadas con la habilidad del ave a resistir la infección de coccidia (Dalloul y Lillehoj, 2005); así, las estrategias para mejorar las funciones inmunes se podrían aplicar en la prevención de coccidiosis. Una investigación previa en nuestro laboratorio utilizando un producto de fermentación de Saccharomyces cerevisiae mostró un incremento en la función inmune de pollos parrilleros al ser alimentados durante 42 días (Gao et al., 2008). Otros estudios han mostrado resultados similares en el sistema inmune del pollo parrillero cuando son alimentados con productos de fermentación de S. cerevisiae (Al-Homidan y Fahmy, 2007; El-Husseiny et al., 2008). Se hizo la hipótesis de que un producto de fermentación derivado de S. cerevisiae podría modular el sistema inmune para permitir que el ave manejara mejor el estrés con una infección de coccidia patogénica intestinal. El objetivo de este estudio fue el de investigar el efecto de un producto de fermentación dietético de S. cerevisiae en las funciones de inmunidad humoral y celular así como el rendimiento del crecimiento de pollos parrilleros con o sin la infección Eimeria tenella.
MATERIALES Y MÉTODOS
Diseño experimental y tratamientos
Un total de 360 pollos parrilleros Arbor Acres con un día de nacidos se distribuyeron al azar en 1 de 6 grupos de tratamiento.
Cada tratamiento consistió en 6 réplicas de 10 aves cada una. Un diseño factorial de 2 x 3 se aplicó en este estudio (3 tratamientos dietéticos y la infección de coccidia).
Tabla 1. Composición y contenido nutriente de dietas basales para pollos parrilleros de 0 a 3 sem y de 4 a 6 sem
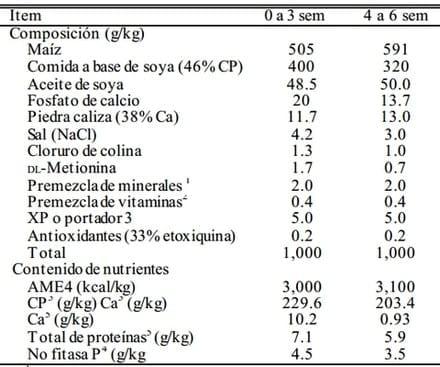
1 Premezcla de minerales proporcionados por kilogramo de dieta: Fe, 80 g; Cu, 8 mg; Mn, 60 mg; Zn, 40 mg; I, 0.4 mg; Se, 0.2 mg.
2 Premezcla de vitaminas proporcionados por kilogramo de dieta: vitamina A, 1,100 IU; vitamina D3, 240 IU; vitamina E, 6 IU; bisulfato de sodio de menadiona, 0.6 mg; vitamina B12, 0.004 μg; biotina, 0.15 mg; ácido fólico, 0.2 mg; ácido nicotínico, 50 mg; ácido pantoténico d, 5 mg; hidrocloruro de piridoxina, 1.2 mg; riboflavina, 2.2 mg; mononitrato de tiamina, 1.6 mg.
3La dieta de cada tratamiento contenida en XP de Diamond V (Diamond V Mills Inc., Cedar Rapids, IA) 0, 2.5 y 5.0 g/kg y portador (polvo de zeolita) 5, 2.5 y 0 g/kg.
4Calculado de acuerdo al Centro Web de Base de Datos Alimentarios de China (2005).
5Valor determinado.
En el día 21, a la mitad de los pollos se les inoculó oralmente con 6 × 104 de oocistos esporulados de E. tenella por ave. Los Oocistos los proporcionó el Instituto de Shanghai de Medicina Veterinaria de la Academia China de Ciencias de la Agricultura y se rejuveneció con pollos no infectados por coccidia antes de la inoculación oral. Los tratamientos dietéticos consistieron en 0, 0.25 y 0.50% de un producto de fermentación de S. cerevisiae (XP, Diamond V Mills Inc., Cedar Rapids, IA). Se formularon dos dietas básicas en maíz y soya (0 a 3 semanas y 4 a 6 sem, Tabla 1) para cumplir con los requerimientos de pollos parrilleros recomendados por NRC (1994) excepto ME. Todas las dietas se dieron como alimento en forma de puré. El manejo de las aves fue de acuerdo con las recomendaciones de la Guía de Manejo Comercial de Pollos Parrilleros.
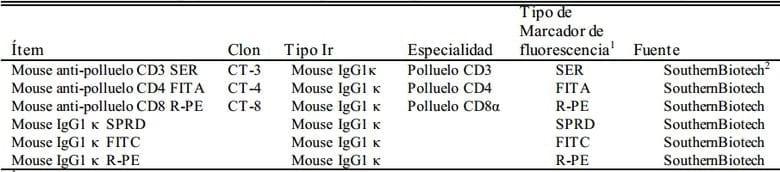
Tabla 2. Control de isotipo y anticuerpo monoclonal utilizado para medir las subpoblaciones de linfocitos mediante el citómetro de flujo
1R-PE = R-conjugado de ficoeritrina; FITC = conjugado de fluoresceína; SPRD = conjugado espectral rojo.
2Birmingham, AL.
Mediciones, Muestreo y Análisis
El rendimiento del crecimiento. El peso del cuerpo y el consume alimentario se midieron en el día 21, 35 y 42. Se registró la mortalidad durante todo el periodo alimentario. La ganancia diaria promedio, ADFI y la conversión alimentaria (G:F) se calcularon en periodos de iniciadores (d 1 a 21), infección (d 21 a 35) y postinfección (d 35 a 42).
Muestreo y análisis de Sangre y Tejido. En el d 28 (d 7 postinfección), 1 ave de cada jaula de réplica se eligió al azar para recolectar sangre de la periferia del corazón. La mitad de la sangre se utilizó inmediatamente después de la recolección para determinar subgrupos de linfocitos mediante citometría de flujo y la sangre restante se utilizó para la recolección de suero mediante centrifugación en 1,920 × g. Las muestras de suero se recolectaron y se almacenaron (−20°C) antes del análisis. Después de la recolección de la sangre, se mató las aves inmediatamente mediante dislocación cervical para recolectar el bazo, amígdalas cecales y muestras de íleo (porción media). En el d 35 (d 14 postinfección), se hizo nuevamente un muestreo con la sangre periférica según se describió previamente.
Los linfocitos de las muestras de sangre periférica y del bazo se separaron y purificaron mediante la centrifugación en gradiente de densidad utilizando el medio de separación de linfocitos de Ficoll linfocito (Pharmacia, Piscataway, NJ). Los subgrupos de CD4+, CD8+ y CD3+ dentro de las células purificadas de la población de linfocitos se determinaron mediante una citometría de flujo EPICS ELITE (Beckman Coulter Inc., Fullerton, CA). El control de anticuerpos monoclonales e isotipos se utilizó en la determinación de la subpoblación de linfocitos mediante la citometría de flujo según se muestra en la Tabla 2.
Las amígdalas cecales y las muestras de tejido ileal se fijaron en 2.5% del fijador de glutaraldehido-polioximetileno. Se midió el contenido de IgA secretorio (sIgA) utilizando el ensayo inmunohistoquémico descrito por Gao et al. (2008). El conteo de linfocitos intraepiteliales (IEL) en el íleo se midió mediante el método de rutina de secado de hematoxilina eosina.
Se midió la actividad de la lisozima en suero de acuerdo al método de Keukniet et al. (1994) utilizando células ococcus lisodeicticus como sustrato. La albúmina y la proteína total en suero se determinaron mediante el analizador automático de sangre Sysmex XE-2100 (Sysmex Medica Co. Ltd., Kobe, Japón). El contenido de globulina en suero se calculó al sustraer albúmina de la proteína total.
Análisis estadístico
Se analizaron los datos utilizando procesos GLM (SAS Institute, 2001). Los datos del rendimiento del crecimiento del día 1 a 21 (antes de la infección de coccidia) se analizaron utilizando ANOVA de 1 vía y los medios se separaron mediante pruebas de rango múltiple de Fisher. Los datos después del d 21 se sometieron ANOVA de 2 vías con tratamiento dietético de XP y tratamiento contra la infección de coccidia como efectos principales y sus interacciones. Se determinó el efecto de los niveles suplementarios de XP en aves normales y aves infectadas con coccidia, respectivamente, utilizando procesos polinomios ortogonales para efectos lineales y cuadráticos (SAS Institute, 2001).
RESULTADOS
El rendimiento del crecimiento
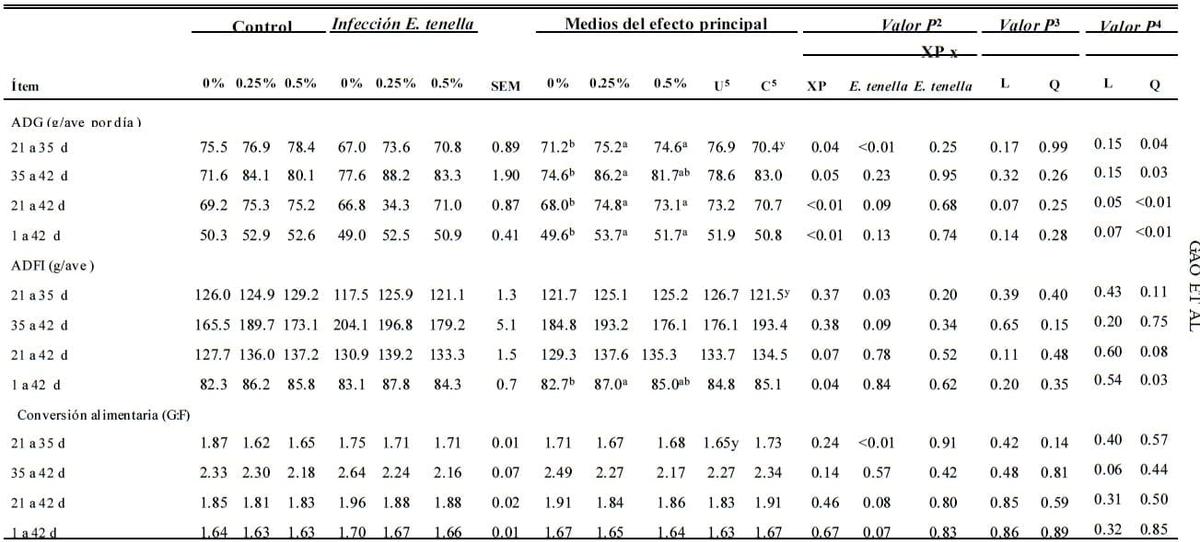
Tomando como base el efecto principal del ataque de la coccidia (E. tenella), ADG, ADFI y la conversión alimentaria se vieron afectados de manera adversa (P<0.01, P = 0.03, P < 0.01, respectivamente) durante el periodo de infección del d 21 al 35 (Tabla 3) comparado con los controles no infectados. No se observe ninguna otra evidencia (P > 0.05) entre las aves atacados y las no atacadas.
El XP dietético no tuvo efecto importante (P > 0.05) en el rendimiento del crecimiento de pollos parrilleros del d 1 al 21 excepto que las aves alimentadas con 0.5% de XP en dietas tuvieron un menor ADG comparado con el grupo de control (P ≤ 0.05, no se muestran datos). El suplemento de XP incrementó ADG durante los periodos del d 21 al 35 (P = 0.04), d 35 al 42 (P = 0.05), d 21 al 42 (P < 0.01) y d 1 al 42 (P < 0.01) basados en el efecto principal de XP (XP, Tabla 3) al compararse con el de control. El suplemento de XP también incrementó la ingesta alimentaria de los pollos parrilleros del d 1 al 42 (P = 0.04).
No se observaron efectos importantes en la conversión alimentaria (P > 0.05) con el suplemento XP. Ninguna interacción (P > 0.05) en el rendimiento del crecimiento entre el XP dietético XP y la infección de coccidia se observaron. Sin embargo, cuando el nivel dietético de XP incrementó durante el ataque de coccidia, ADG incrementó cuadráticamente del d 21 al 35 (P = 0.04), d 35 al 42 (P = 0.03), d 21 al 42 (P < 0.01) y d 1 al 42 (P < 0.01) para aves infectadas con E. tenella. Las aves atacadas con coccidia también mostraron un incremento cuadrático (P = 0.03) en la ingesta alimentaria incrementó los niveles de XP del d 1 al 42. Sin embargo, no se observó ningún efecto importante en la conversión alimentaria (P > 0.05).
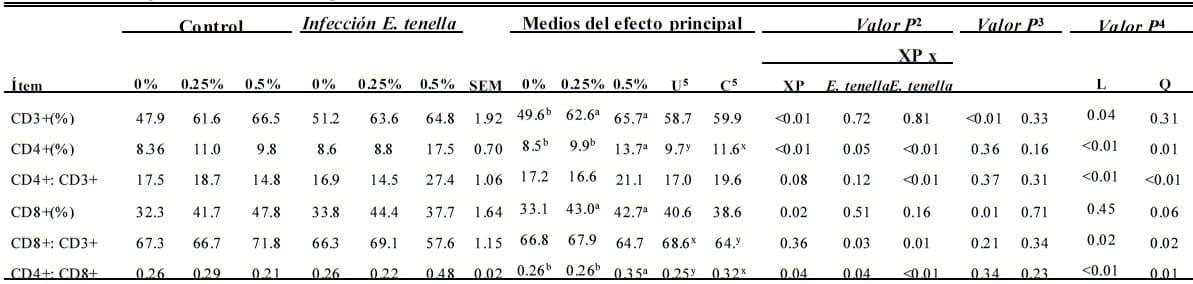
Subpoblación de linfocito monocito de sangre periférica
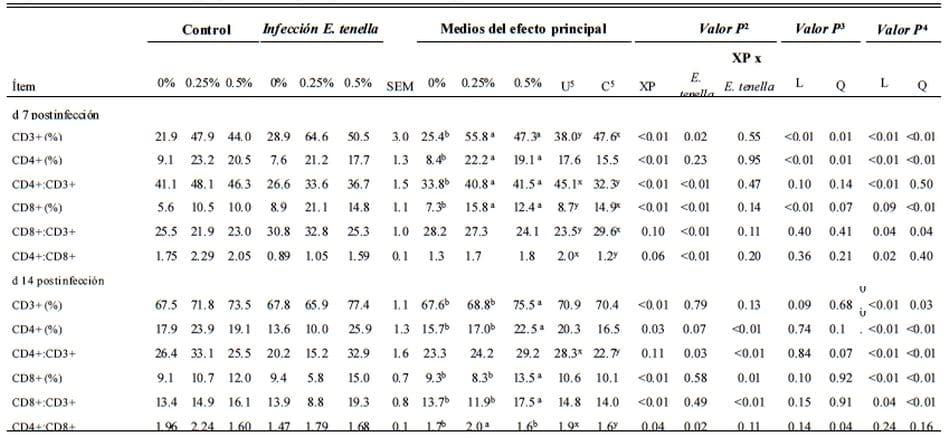
d 7 Postinfección. Infección Eimeria tenella de manera importante (P<0.05) incrementó la proporción de CD3+ y CD8+ T linfocitos y la relación de CD8+:CD3+ y bajó (P < 0.05) CD4+:CD3+ y la relación de CD4+:CD8+ (E. tenella, Tabla 4).
Suplemento de XP en dietas de pollos parrilleros incrementó (P < 0.05) los conteos de CD3+, CD4+ y CD8+ T linfocitos y la relación CD4+:CD3+ (XP, Tabla 4). No se observaron interacciones entre el suplemento de XP y la infección de coccidia en subgrupos de linfocitos d (P > 0.05). Sin embargo, XP tuvo un efecto en la respuesta de dosis en subgrupos de linfocitos en sangre periférica de aves independientemente de la infección de coccidia. Para aves non atacadas, el porcentaje de CD3+ and CD4+ T linfocitos incrementó lineal y cuadráticamente (P ≤ 0.01) y el porcentaje de CD8+ T linfocitos incrementó linealmente (P < 0.01) sin incrementar los niveles de XP. Para las aves atacadas con coccidia, los conteos de CD3+ y CD4+ T linfocitos y la relación de CD8+:CD3+ células se incrementó lineal y cuadráticamente (P < 0.05). Las aves atacadas también mostraron un incremento cuadrático (P < 0.01) in CD8+ T linfocitos y and un incremento lineal (P < 0.05) en CD4+:CD3+ y CD4+:CD8+ relaciones con niveles de incremento de XP.
d 14 Postinfección. La infección de coccidia bajó (P < 0.05) las relaciones de CD4+:CD3+ y CD4+:CD8+ (E. tenella, Tabla 4).
Ninguna otra diferencia se observe (P > 0.05). La suplementación de XP dietética incrementó de manera importante los conteos de CD3+, CD4+ y CD8+ T-linfocito y la relación de CD8+:CD3+ y CD4+:CD8+ T linfocitos (P < 0.05; XP, Tabla 4). Hubo interacciones en los conteos de CD4+ y CD8+ T linfocitos y la relación de CD4+:CD3+ y CD8+:CD3+ T linfocitos entre XP dietético y la infección de coccidia (P ≤ 0.01). La relación de CD4+:CD8+ linfocitos incrementó cuadráticamente (P < 0.05) con el incremento de XP dietético en aves no infectadas. Cuando las aves se infectaban de coccidia, lo los efectos de respuesta de la dosis XP dietética fueron más notorios. Con el incremento de XP dietético, los conteos de CD3+, CD4+ y CD8+ T linfocitos y las relaciones de CD4+:CD3+ y CD8+:CD3+ incrementaron lineal y cuadráticamente (P < 0.05).
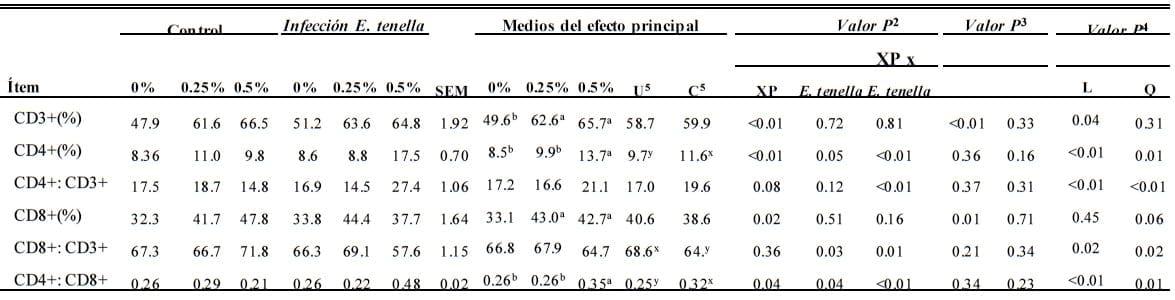
Subgrupos de células de linfocitos en Bazo (d 7 Postinfección)
La infección de coccidia afectó variablemente (P ≤ 0.05) los conteos de CD4+ y CD8+:CD3+ y las relaciones CD4+:CD8+ en el bazo (Tabla 5). EL XP dietético incrementó (P < 0.05) CD3+, CD4+, una proporción de CD8+ T-linfocito. Hubo interacciones (P < 0.01) en las proporciones de CD4+ T linfocitos y las relaciones de CD4+:CD3+, CD8+:CD3+ y CD4+:CD8+ entre la infección de coccidia y la suplementación de XP dietético. La infección de coccidia redujo CD4+, CD4+:CD3+, CD8+:CD3+ y CD4+:CD8+ de aves alimentados con 0 y 2.5% de XP. Cuando el nivel de XP incrementó a 5%, estos índices mejoraron. La suplementación de XP dietética tuvo un efecto en la respuesta de la dosis en los subgrupos de linfocitos. Cuando XP dietético incrementaba, las proporciones CD3+ y CD8+ T-linfocito en pollos parrilleros no infectados incrementaba linealmente (P ≤ 0.01). Para las aves atacadas, hubo una importante respuesta a XP para CD3+ (lineal, P = 0.04), proporciones de CD8+ T-linfocito (cuadrático, P = 0.06) y para conteos de CD4+ T-linfocitos y relaciones de CD4+:CD3+, CD8+:CD3+ y CD4+:CD8+ (lineal y cuadrático, P< 0.05).
Tabla 3. Efecto del producto de fermentación dietético de Saccharomyces cerevisiae (XP; en 0, 0.25, o 0.50%; Diamond V Mills Inc., Cedar Rapids, IA) suplementación en el rendimiento del crecimiento 1 de pollos parrilleros infectados por Eimeria tenella.
a,b; x,y Medios dentro de una fila sin superíndices comunes (a,b y x,y, respectivamente, para la comparación del efecto de XP y E. tenella) difiere de manera importante (P ≤ 0.05).
1n = 6, jaulas de réplicas de 10 aves por jaula.
2Análisis factorial.
3Contrastes ortogonales para polluelos no atacados. L = efecto lineal de XP suplemental ; Q = efecto cuadrático de XP suplemental .
4Contrastes ortogonales para polluelos infectados con E. tenella.
5U = no atacado; C = atacado.
Tabla 4. Efecto del producto de fermentación dietético de Saccharomyces cerevisiae (XP; en 0, 0.25, o 0.50%; Diamond V Mills Inc. , Cedar Rapids, IA) en subpoblaciones de linfocitos de sangre periférica1 en pollos parrilleros infectados por Eimeria tenella
a,b; x,y Medios dentro de una fila sin superíndices comunes (a,b y x,y, respectivamente, para la comparación del efecto de XP y E. tenella) difiere de manera importante (P ≤ 0.05).
1n = 6, jaulas de réplica de 10 aves por jaula.
2Análisis factorial.
3Contrastes ortogonales para polluelos no atacados. L = efecto lineal de XP suplemental ; Q = efecto cuadrático de XP suplemental .
4Contrastes ortogonales para polluelos infectados con E. tenella.
5U = no atacado; C = atacado.
Tabla 5. Efecto del producto de fermentación dietético de Saccharomyces cerevisiae (XP; en 0, 0.25, o 0.50%; Diamond V Mills Inc., Cedar Rapids, IA) en subgrupos de linfocitos en el bazo de pollos parrilleros en el día 7 después de la infección de Eimeria tenella
a,b; x,y Medios dentro de una fila sin superíndices comunes (a,b y x,y, respectivamente, para la comparación del efecto de XP y E. tenella) difiere de manera importante (P ≤ 0.05).
1n= 6.
2Análisis factorial.
3Contrastes ortogonales para polluelos no atacados. L = efecto lineal de XP suplemental ; Q = efecto cuadrático de XP suplemental .
4Contrastes ortogonales para polluelos infectados con E. tenella.
5U = no atacado; C = atacado.
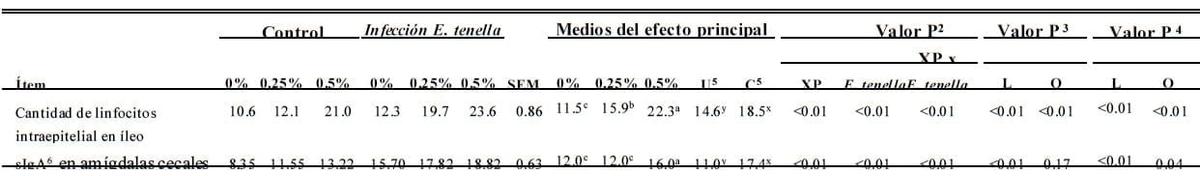
IEL y sIgA (d 7 Postinfección)
La infección de coccidia incrementó (P < 0.01) la cantidad de IEL en íleo y el contenido de sIgA en las amígdalas cecales (Tabla 6). XP dietético también incrementó de manera importante (P < 0.01) el conteo IEL en el íleo y en el contenido de sIgA en las amígdalas cecales. El efecto de interacción entre la infección de coccidia y XP en la cantidad de IEL en íleo y e contenido de sIgA en las amígdalas cecales se observó (P <
0.05). El mismo nivel de XP dietético promovió que las aves produjeran más IEL y sIgA en aves atacadas que en aves de control. Se encontró que XP mostró un efecto de respuesta de dosis en IEL y sIgA tanto en aves no infectadas como infectadas. Cuando la dosis suplementario de XP incrementó para las aves sin la infección de infección de coccidia, la cantidad de IEL en íleo incrementó (P < 0.01) lineal y cuadráticamente y sIgA en las amígdalas cecales incrementó (P < 0.01) linealmente. Para las aves Para las aves infectadas, la cantidad de IEL en íleo y el contenido de sIgA en las amígdalas cecales incrementó lineal y cuadráticamente (P < 0.05) incrementando la suplementación dietética de XP.
Contenido de Ig en Suero (IgG, IgM)
d 7 Postinfección. La infección de coccidia incrementó (P < 0.01) el contenido de IgM pero no influyó en (P > 0.05) el contenido de IgG (Tabla 7). El XP dietético dado como alimento a los parrilleros incrementó (P ≤ 0.01) IgM en suero pero no incrementó el contenido (P > 0.05) de IgG. Las interacciones entre XP dietético y la infección de coccidia se observaron para ambos IgG en suero (P < 0.01) y el contenido de IgM (P = 0.02). El contenido de IgM en suero en las aves infectadas fue mayor que en las aves de control. Hubo una relación de respuesta a la dosis entre la dosis de XP dietético y el contenido de IgM tanto en aves infectadas como no infectadas. Cuando XP dietético incrementó, IgM (linear, P = 0.01; cuadrático, P < 0.01) incrementó en aves no infectadas, en donde el contenido de IgM (linear, P = 0.1) incrementó en aves infectadas.
d 14 Postinfección. La infección de coccidia no afectó (P > 0.05) el contenido de IgG e IgM en sangre (Tabla 7). Sin embargo, XP dietético afectó variablemente el contenido de IgM en suero (P < 0.01). No se observaron interacciones (P > 0.05) en el contenido de IgG o IgM en sangre entre la infección de coccidia y XP dietético.
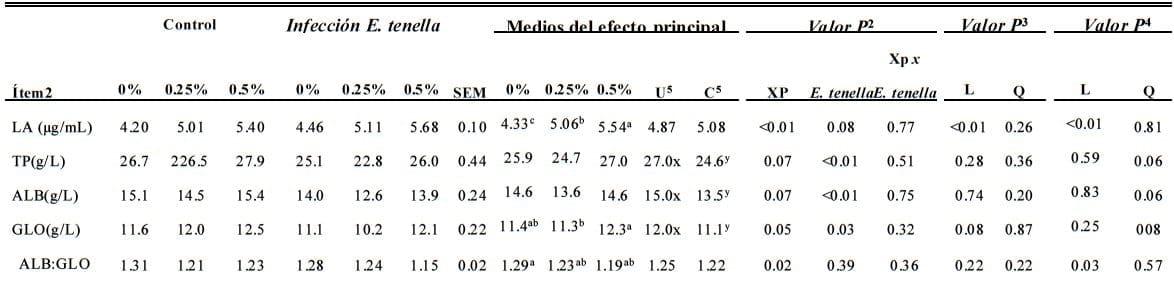
Actividad de Lisozima en Suero e índices bioquímicos (d 7 Postinfección)
La infección de coccidia disminuyó la proteína total del suero y el contenido de la albúmina (P < 0.01, Tabla 8). XP dietético incremento (P < 0.01) contenido de lisozimas en suero y el contenido de globulina en suero (P = 0.05) pero disminuyó (P = 0.02) la relación albúmina:globulina.
No se observó ninguna interacción (P >0.05) entre la infección de coccidia y XP dietético en el contenido de lisozima en suero. Se observó una respuesta de la dosis lineal de XP en el contenido de lisozimas en suero se observó (P < 0.01) para todos los tratamientos.
Bajo la infección de coccidia, la relación albúmina:globulina disminuyó (P = 0.03) linealmente cuando el nivel de XP suplemental incrementó.
Tabla 6. Efecto del producto de fermentación dietético de Saccharomyces cerevisiae (XP; en 0, 0.25, o 0.50%; Diamond V Mills Inc., Cedar Rapids, IA) en el conteo de linfocitos intraepiteliales1 en íleo y contenido de IgA (sIgA) secretoria en amígdalas cecales en pollos parrilleros infectados por Eimeria tenella en el día 7 de la infección de E. tenella
a-c; x,y Medios dentro de una fila sin superíndices comunes (a-c; y x,y, respectivamente, para la comparación del efecto de XP y E. tenella) difiere de manera importante (P ≤ 0.05).
Se calculó 1n = 6 cantidad de linfocitos intraepiteliales en 100 epitelios.
2 Análisis factorial.
3 Contrastes ortogonales para polluelos no atacados. L = efecto lineal de XP suplemental ; Q = efecto cuadrático de XP suplemental .
4 Contrastes ortogonales para polluelos infectados con E. tenella.
5 U = no atacado; C = atacado.
6 El valor se expresó por la relación de area de areas positivas cubiertas con sIgA para el complete campo de vision.
DISCUSIÓN
En el presente estudio, la inoculación oral de oocistos esporulados de E. tenella para pollos parrilleros a los 21 días de edad afecto de manera adversa a ADG, ADFI y a la conversión alimentaria, sugiriendo una exitosa infección de coccidia. Hay pocos estudios sobre efectos de Productos de fermentación de S. cerevisiae en aves atacadas por coccidia, Por lo general, XP dietético no tuvo ningún efecto importante en el rendimiento del crecimiento de pollos parrilleros en el d 1 al 21. Este resultado va de acuerdo con la investigación previa (Gao et al., 2008), indicando que se necesita un periodo de tiempo para que XP afecte el rendimiento del crecimiento of un pollo parrillero.
Se observó que XP suplemental mejoró el rendimiento del crecimiento de pollos parrilleros en engorda (después de 21 d de nacimiento) con o sin infección de coccidia en el estudio actual. La infección de coccidia si disminuyó el rendimiento del crecimiento, mientras que el suplemento de XP facilitó el estrés de la infección de coccidia hasta cierto grado. Efectos similares de productos de S. cerevisiae dieron a conocer Stanley et al. (2004) y Lensing et al. (2008) en pollos parrilleros infectados por coccidia y ponedores, respectivamente. Sin embargo, Stanley et al. (2004) y Lensing et al. (2008) emplearon un método diferente de infección de coccidia utilizando aves de corral con puerta posterior contra aves en jaulas en el presente estudio Bajo 2 formas de infección (duración corta vs exposición continua), la suplementación de un producto de fermentación de S. cerevisiae se mostró el efecto de facilitar el estrés de la infección de coccidia. Huff et al. (2007) y Osweiler et al. (2008) también informaron que la inclusión del producto de S. cerevisiae mejoró el rendimiento del crecimiento of pollos parrilleros expuesto a la aflatoxina. Estos resultados sugieren que los productos de fermentación de S. cerevisiae puedan incrementar la habilidad del ave de manejar el estrés.
La proporción de CD4+ y CD8+ Linfocitos T se podría utilizar para evaluar el estatus inmune de aves debido a su importante papel en la inmunidad celular (Lillehoj y Trout, 1994). La inoculación oral de oocistos esporulados de E. tenella afectó de manera importante la población del monocito de sangre periférica, indicando vitalidad de occidia y efectividad de dosis. En el d 7 de la postinfección en el estudio actual, la proporción de CD3+ T linfocitos (P = 0.02) en pollos parrilleros infectados por E. tenella incrementó en CD8+ Linfocitos T (P < 0.01). Sin embargo, la proporción de CD4+ Linfocitos T, no incrementó comparado con las aves de control (P = 0.23). Estos resultados sugieren que en el d 7 de postinfección, CD8+ Linfocitos T jueguen un papel importante en el proceso de inmunidad celular. La relación de CD4+:CD8+ Linfocitos T bajó debido al incremento de CD8+ Linfocitos T, en donde los conteos de CD4+ linfocito permanecen sin cambiar. Cuando los oocistos maduran y se lo comen las aves, los esporozoites se liberan en el tracto gastrointestinal.
Tabla 7. Efecto del producto de fermentación dietético de Saccharomyces cerevisiae (XP; en 0, 0.25, o 0.50%; Diamond V Mills Inc., Cedar Rapids, IA) en subgrupos de linfocitos en el bazo de pollos parrilleros en el día 7 después de la infección de Eimeria tenella
a,b; x,y Medios dentro de una fila sin superíndices comunes (a,b and x,y, respectivamente, para la comparación del efecto de XP y E. tenella) difiere de manera importante (P ≤ 0.05).
1 n = 6.
2 Análisis factorial.
3 Contrastes ortogonales para polluelos no atacados. L = efecto lineal de XP suplemental ; Q = efecto cuadrático de XP suplemental .
4 Contrastes ortogonales para polluelos infectados con E. tenella.
5 U = no atacado; C = atacado
Tabla 8. Efecto del producto de fermentación dietético de Saccharomyces cerevisiae (XP; en 0, 0.25, o 0.50%; Diamond V Mills Inc., Cedar Rapids, IA) en subgrupos de linfocitos en el bazo de pollos parrilleros en el día 7 después de la infección de Eimeria tenella
a - c;,x,,y Medios dentro de una fila sin superíndices comunes (a,-c y x,y, respectivamente, para la comparación del efecto de XP y E. tenella) difiere de manera importante (P ≤ 0.05).
1 n = 6.
2 LA=actividad de lisozimas ; TP = total de proteína; ALB = albúmina ; GLO = globulina ; ALB:GLO = albúmina :globulina ratio.
3 Análisis factorial.
4 Contrastes ortogonales para polluelos no atacados. L = efecto lineal de XP suplemental; Q = efecto cuadrático de XP suplemental .
5 Contrastes ortogonales para polluelos infectados con E. tenella.
6 U = no atacado; C = atacado.
Los esporozoites pueden alcanzar el epitelio de la cripta e iniciar a reproducirse. Luego, los tejidos linfoides asociados al intestino pueden procesar y presentar antígenos e inmunidad activada y mediada por células (Dalloul y Lillehoj, 2005). La esporozoite y merozoite coccidio puede estimular la activación y proliferación de linfocitos T y luego diferenciar en CD4+ y CD 8+ Linfocitos T. Por lo tanto, CD8+ Linfocitos T puede inhibir el desarrollo de esporozoites durante el inicio de la infección de coccidia y matar las células infectadas durante la infección en etapa tardía (Liu et al., 2006). Esta acción juega un papel importante en limpieza de patógenos (Zou et al., 2006).
La inclusión de XP en dietas de pollos parrilleros incrementó los conteos de CD3+, CD4+ y CD8+ T-linfocitos en aves infectadas con coccidia así como en aves de control (P < 0.01).
Estos resultados sugieren que XP suplemental estimule la respuesta de inmunidad celular del ave. Las aves infectadas con coccidia principalmente dependen del sistema de inmunidad celular para limpiar la coccidia en el animal, principalmente incrementando el contenido de CTL (fundamentalmente CD8+ Linfocitos T) por medio del efecto citotóxico y la habilidad de matar CD8+ Linfocitos T. En el presente estudio, XP suplemental también activó CD4+ Linfocitos T (fundamentalmente Células T ayudantes). CD4+ Linfocitos T secretan citoquinas tales como IFN2γ y IL22 para activar a los macrófagos y modular la respuesta de inmunidad (Arstila et al., 1994). Los linfocitos del ayudante T 2 ayudan a los linfocitos B a producir anticuerpos (Arstila et al., 1994). El contenido de IgM (en el d 7 de postinfección) en sangre periférica de aves tratadas con XP fue mayor que el de las aves de control en nuestro estudio. Estos resultados van de acuerdo con la proporción mayor de CD4+ Linfocitos T, que podría impulsar a los linfocitos B a producir anticuerpos. CD4+ y CD8+ Linfocitos T todos juegan papeles claves en el proceso de limpieza de coccidia (Liu et al., 2006).
La relación de CD4+:CD8+ Linfocitos T revela la actividad de Linfocitos T. En el estudio actual, la relación de CD4+:CD3+ y CD4+:CD8+ Linfocitos T en in aves infectadas con coccidia fue menor que el de las aves de control (P < 0.01) en el d 7 posterior a la infección, mostrando que la infección de coccidia parcialmente inhibe la respuesta de inmunidad en etapas tempranas de infección. Li (2000) y Liu et al. (2006) también informaron resultados similares en la inhibición de la inmunidad frete a la infección de coccidia. El XP suplemental en dietas de pollos parrilleros incrementó la relación CD4+:CD8+ T-linfocito comparada con las de control, demostrando una mejorada recuperación del sistema inmune. Estos resultados sugieren que XP dietético podría mejorar la función inmune y ayudar a las aves durante el tiempo en que la coccidia las ataque.
En el d 14 después de la infección, basada en los subgrupos de linfocitos en sangre periférica disminuyó el efecto de infección de coccidia. Únicamente las relaciones CD4+:CD3+ y CD4+:CD8+ ratios en aves atacadas continuaron siendo menores que las de las aves de control (P < 0.05). Otros índices tales como los conteos de CD3+, CD4+ y CD8+ linfocito T y la relación CD8+:CD3+ no afectaron de manera importante (P > 0.05). Estos resultados sugieren que por el d 14 en la postinfección el sistema inmune empezaba a recuperarse. La inclusión de XP en dietas incrementó los conteos de CD4+, CD8+ y CD3+ Linfocitos T y la relación CD4+:CD8+ en aves independientemente de la coccidia (P < 0.05), la cual es similar a los datos del d 7 de la postinfección y muestra la habilidad de XP para mejorar la función inmune en el proceso de coccidiosis.
En el d 7 de la postinfección, la infección de coccidia afectó variablemente los subgrupos de linfocitos en el bazo, que diferían del efecto en sangre periférica. Liu et al. (2006) informó que CD4+ y CD8+ Linfocitos T en el bazo de aves infectadas por Eimeria necatrix disminuyó cuantitativamente, del d 2 al 7 de la postinfección.
En nuestro estudio CD8+ Linfocitos T fueron mayores que CD4+ Linfocito T, lo cual fue diferente con los niveles encontrados en sangre periférica, pero de acuerdo con el estudio de Wang et al. (2005). El suplemento de XP en las dietas incrementó los conteos CD3+, CD4+ y CD8+ Linfocito T (P < 0.05), que fue el mismo que el efecto de XP en los subgrupos de linfocitos en sangre periférica. Estos resultados también sugieren que XP podría mejorar la diferenciación y proliferación de Linfocitos T en bazo. Hubo interacciones entre XP dietético y el ataque de la coccidia en subgrupos de linfocitos esplénicos. El ataque de la coccidia redujo las relaciones y los conteos de CD4+ de CD4+:CD3+ y CD8+:CD3+; la suplementación de XP puede mejorar la reducción, especialmente cuando a los polluelos se les alimenta con 0.5% de XP. E cuanto a la infección de coccidia, los polluelos alimentados con 0.50% de dieta de XP mostraron un incremento distintivo y esplénico de los conteos de CD4+ y el incremento correspondiente de las relaciones de CD4+:CD3+ y CD4+:CD8+ y enfermedades notables de la relación CD8+:CD3+.
El efecto de XP dietético en subgrupos de monocitos de sangre periférica exhibe una respuesta de dosis, especialmente para las aves infectadas con coccidia. Para ambas aves no infectadas y si infectadas CD3+, CD4+ y CD8+ Linfocitos T incrementaron linealmente o cuadráticamente cuando el nivel dietético de XP suplemental ha incrementado. Cuando el nivel de inclusión de XP para las aves infectadas con coccidia incrementa, CD3+ Linfocitos T (d 7 y 14 de la postinfección), las relaciones de CD4+:CD3+ y CD8+:CD3+ Linfocitos T (d 7 y 14 de la postinfección) y la relación de CD4+:CD8+ (d 7 de la postinfección) linealmente haya incrementado (P < 0.05). Estos resultados muestran que bajo condiciones de estrés, los efectos del XP en cuanto a la inmunidad, son obvios. Tal vez una dosis mayor de la suplementación dietética de XP sería mejor para proteger las aves de la infección de coccidia, mientras que ninguna respuesta excesiva de inmunidad y compromiso de crecimiento tenga lugar. La inmunidad mucosal juega un papel clave en la protección inmune del intestino (MacDonald, 2003). Las amígdalas cecales y el IEL son parte de la mucosa agregada asociada al tejido linfoide y la mucosa difusa asociada al tejido linfoide, respectivamente. El IEL del ave consiste en células B, células T y linfocitos naturales grandes con CD8+ Linfocitos T como las principales células efectoras. Por lo tanto, IEL juega un papel mayor en la protección del cuerpo en contra de la invasión de patógenos (Neutra, 1998). En este estudio, la infección de coccidia incrementó el conteo del IEL ileal y el contenido de sIgA secretado por las amígdalas cecales (P < 0.01).
Estos resultados sugieren que los pollos parrilleros podrían estimular la inmunidad mucosal para luchar en contra de la infección de la coccidia.
La inclusión de XP también incrementó linealmente el conteo de IEL ileal y el contenido de sIgA secretada por las amígdalas cecales (P < 0.01). Esto muestra que XP podría mejorar la respuesta para fortalecer la inmunidad de la mucosa para luchar contra la coccidiosis. La interacción entre XP dietético y el ataque de coccidia se observó por la cantidad de IEL y sIgA en las amígdalas cecales. Para las aves atacadas, comparadas con la aves de control, la suplementación del mismo nivel de XP permitió que las aves produjeran más IEL y sIgA, que se necesita para que las aves luchen contra la infección de coccidia.
La producción de anticuerpos comparada con la inmunidad celular tiene menos efecto en la coccidiosis. Sin embargo, estudios previos han demostrado que la inmunidad humoral es una parte viable del sistema inmune (Scott, 2004). Las células B en la mucosa asociadas a los tejidos linfoides secretan sIgA que juega un papel crucial en la inmunidad local después de la exposición a los antígenos. IgA secretorio es la molecular efectora dela inmunidad mucosal y es un componente mayor de la inmunidad humoral. Nuestro estudio previo demuestra que la inclusión de XP en dietas de pollos parrilleros podría incrementar linealmente (P = 0.01) el contenido de sIgA en el duodeno (Gao et al., 2008). El presente estudio demostró que XP podría incrementar linealmente el contenido de sIgA en las aves de control y en las infectadas por coccidia (P < 0.01). Sin embargo, un mayor contenido de sIgA se observó en aves infectadas con coccidia. Bajo condiciones de estrés, tales como la infección de coccidia, la habilidad de XP para incrementar sIgA es más importante que bajo ninguna condición de estrés.
El ceco es la principal ubicación de lesiones de E. tenella. Por lo tanto, sIgA encontró que las amígdalas cecales son críticas cuando tienen que ver con una infección de coccidia. Davis y Porter (1979) informaron que cuando la aves se infectaron con E. tenella, células productoras de sIgA en el ceco incrementaron, así el contenido de sIgA en el intestino. Sus experimentos in vitro mostraron que sIgA podría inhibir el esporozoite al invadir las células cultivadas e inhibe los esporozoites maduros. Se correlacionaron concentraciones más altos de sIgA con relaciones más bajas delos esporozoites para revivir.
En el estudio actual, XP dietético no solamente incrementó la inmunidad mucosal (sIgA) sino que también incrementó los anticuerpos circulantes. Un estudio previo (Gao et al., 2008) mostró que XP podría promover la producción de IgM en aves no atacadas. Este es un acuerdo con el presente estudio que mostró un contenido mayor de IgM de aves no infectadas con la adición de XP a la dieta. Este estudio también mostró que la infección de coccidia promovió la producción de IgM (P < 0.01). El suplemento de XP en las dietas también mejoró la producción de IgM. Sin embargo, para las aves atacadas con coccidia, la suplementación del mismo nivel de XP permitió que las aves produjeran más IgM en comparación con las aves de control, lo cual fue benéfico para las aves en el proceso de anti infección. Se observe rápidamente IgM en la primera exposición de aves a la infección de coccidia. Al contrario, en este estudio, ningún XP dietético ni infección de coccidia mostró una respuesta de acuerdo a ello en el contenido de suero en IgG en sangre periférica.
En el estudio actual, XP dietético no solamente incrementó la inmunidad mucosal (sIgA) sino que también incrementó los anticuerpos circulantes. Un estudio previo (Gao et al., 2008) mostró que XP podría promover la producción de IgM en aves no atacadas. Este es un acuerdo con el presente estudio que mostró un contenido mayor de IgM de aves no infectadas con la adición de XP a la dieta. Este estudio también mostró que la infección de coccidia promovió la producción de IgM (P < 0.01). El suplemento de XP en las dietas también mejoró la producción de IgM. Sin embargo, para las aves atacadas con coccidia, la suplementación del mismo nivel de XP permitió que las aves produjeran más IgM en comparación con las aves de control, lo cual fue benéfico para las aves en el proceso de anti infección. Se observe rápidamente IgM en la primera exposición de aves a la infección de coccidia. Al contrario, en este estudio, ningún XP dietético ni infección de coccidia mostró una respuesta de acuerdo a ello en el contenido de suero en IgG en sangre periférica.
IgG no aparece durante la exposición inicial a patógenos y es parte del sistema inmune de adaptación. El contenido mayor de IgG se puede observar en pollos parrilleros con una prolongada exposición a la coccidia. Debido a que las aves en este estudio se criaron en jaulas de red y no podían entrar en contacto con excrementos, las aves no podían volverse a infectar. Esto podría explicar la respuesta inconsistente de IgG en este estudio. Para la aves no atacadas, XP dietético incrementó la actividad de lisozimas en suero, lo cual va de acuerdo con nuestro estudio previo (Gao et al., 2008). Este estudio también mostró que la inclusión de XP en dietas incrementara la actividad de lisozima en suero en aves infectadas con coccidia. Un efecto positivo de XP en la actividad de la lisozima en suero mostró una respuesta lineal en las aves independientemente de la infección. La lisozima principalmente se secreta a través de los fagocitos y es un efector de inmunidad no específica. Los niveles incrementados de lisozima en aves tratadas con XP sugieren que más fagocitos se activen con la inclusión de XP. Por lo tanto, XP pueden mejorar la inmunidad no específica de las aves en algunos niveles.
La infección de coccidia bajó el contenido total de la proteína en suero (P < 0.01), que fue un acuerdo con el estudio de Wei et al. (2003). Sin embargo, XP dietético incrementó el contenido de la globulina en suero (P = 0.048) y bajó la relación de albúmina:globulina (P = 0.02). Bajo estrés producido por la coccidia, el efecto de XP en la relación de albúmina:globulina fue una respuesta de dosis. La relación bajó al incrementa los niveles de XP. El efecto de XP en los niveles de IgM en sangre también mostró una respuesta de dosis. Esto sugiere que la disminución de la relación albúmina:globulina con los niveles de incremento de XP podría atribuirse al incremento de Ig en suero.
Nuestro estudio previo (Gao et al., 2008) mostró que bajo condiciones normas, los efectos de XP en dietas de pollos parrilleros sobre inmunidad mostraron una respuesta de dosis. La inmunidad incrementó con niveles de incremento de XP. Durante el presente estudio, la inmunidad celular (subgrupo de linfocitos, IEL), inmunidad humoral (sIgA en amígdalas cecales, IgM) e inmunidad no específica (lisozima) se mejoraron con niveles de incremento de XP en dietas de pollos parrilleros, mostrando una respuesta consecuente de dosis. Para lidiar con el estrés, como infección de coccidia, las aves necesitan tener un sistema inmune eficiente. Debido a que XP dietético puede mejorar el sistema inmune, el nivel óptimo suplementario de XP en dietas de pollos parrilleros depende de la condición en la que vivan las aves. Bajo condiciones de estrés, un nivel óptimo suplemental de XP debería estar basado en la fuente de estrés y en el grado de estrés. En el presente estudio, a las aves alimentadas con dietas suplementadas con 0.25% de XP tuvieron el mejor rendimiento de crecimiento.
Hubo algunas interacciones de XP dietético y de la infección de coccidia en el trabajo actual. En el día 7 de la infección, el conteo IEL ileal en polluelos alimentados con 0.25% de XP dietético incrementaron de manera importante al 62.8% comparado con 16.0 y 12.4% de elevación en polluelos alimentados con 0 y 0.50% de dietas con XP. La pronunciada mejora del conteo de IEL ileal sería benéfico para los polluelos para antagonizar la invasión de patógenos extraños. Además, la elevación del contenido de IgM en suero en polluelos alimentados con 0.25% de XP dietético se comparó con 36.7 y 22.7% en polluelos alimentado de 0 a 0.5% de XP en dietas, respectivamente.
Fue posible que el IgG de suero disminuido se pudiera movilizar para defender el ataque externo sistémico y la mejoría de IgM de suero también beneficiara a los polluelos para superar el estrés. Estos resultados también demostraron que incluir 0.25% de XP en la dieta fue a favor de la resistencia de los polluelos infectados con coccidia. Sin embargo, estudios posteriores deberán realizarse para elucidar las interacciones importantes entre la inclusión de XP y la infección de la coccidia.
Se observó en este estudio que XP dietético promovió el rendimiento del crecimiento y la función inmune, sugiriendo una reducción del daño causado por una infección de coccidia. El efecto de XP en la función inmune incluyendo la inmunidad mucosal, inmunidad celular e inmunidad humoral dependió de la dosis. A pesar de que la función inmune incrementó linealmente con el incremento de XP, el rendimiento del crecimiento fue mejor en polluelos alimentados con dieta de 0.25% de XP. EL nivel suplementario óptimo de XP e la dieta de pollos parrillero de este estudio fue de 0.25%.
RECONOCIMIENTOS
El apoyo financiero proporcionado por Diamond V Mills Inc. y el Programa R&D de Tecnología del 11o. Plan de Cinco Años (2006BAD12B06) se aprecia enormemente.
REFERENCIAS
- Al-Homidan, A., and M. O. Fahmy. 2007. The effect of dried yeast (Saccharomyces cerevisiae) supplementation on growth, performance, carcass chemical analysis, immunity, ileum villi heights and bacterial counts of broiler chickens. Egypt. Poult. Sci. J. 27:613–623.
- Arstila, T. P., O. Vainio, and O. Lassila. 1994. Central role of CD4+ T cells in avian immune response. Poult. Sci. 73:1019–1026.
- China Feed Database Web Center. 2005. Tables of Feed Composition and Nutritive Value in China, 2005. 16th ed. China Feed 15:25–33. (In Chinese)
- Dalloul, R. A., and H. S. Lillehoj. 2005. Recent advances in immunomodulation and vaccination strategies agaist coccidiosis. Avian Dis. 49:1–8.
- Davis, P. J., and P. A. Porter. 1979. Mechanism for secretory IgA mediated inhibition of the cell penetration and intracellular development of Eimeria tenella. Immunology 36:471–477.
- El-Husseiny, O. M., A. G. Abdallah, and K. O. Abdel-Latif. 2008. The influence of biological feed additives on broiler performance. Int. J. Poult. Sci. 7:862–871.
- Gao, J., H. J. Zhang, S. H. Yu, S. G. Wu, I. Yoon, J. Quigley, Y. P.
- Gao, and G. H. Qi. 2008. Effects of yeast culture in broiler diets on performance and immunomodulatory functions. Poult. Sci. 87:1377–1384.
- Huff, G. R., W. E. Huff, N. C. Rath, F. Solis de los Santos, M. B. Farnell, and A. M. Donoghue. 2007. Influence of hen age on the response of turkey poults to cold stress, Escherichia coli challenge, and treatment with a yeast extract antibiotic alternative. Poult. Sci. 86:636–642
- Kreukniet, M. B., M. G. B. Nieuwl, and A. J. van der Zijpp. 1994. Phagocytic activity of two lines of chickens divergently selected for antibody production. Vet. Immunol. Immunopathol. 44:371– 387.
- Lensing, M., J. D. Van der Klis, L. Castillejos, and I. Yoon. 2008.
- Effects of Diamond V XPCls on intestinal health and productivity of coccidian challenged laying hens. Poult. Sci. 87(Suppl. 1):93. (Abstr.)
- Li, H. M. 2000. Study on recombinant chicken interleukin-2 used as immunopotentiator. MS Thesis. Nanjing Agricultural University, Nanjing, China.
- Lillehoj, H. S., and J. M. Trout. 1994. CD8+ T cell-coccidia interactions. Parasitol. Today 10:10–14.
- Liu, J., S. M. Zheng, and J. Y. Hu. 2006. Dynamic changes of T lymphocyte subpopulations in immune organs of chicks infected with Eimeria necatrix. Acta Vet. Zootech. Sin. 37:168–172.
- MacDonald, T. T. 2003. The mucosal immune system. Parasite Immunol. 25:235–246.
- Neutra, M. R. 1998. Current concepts in mucosal immunity.V. Role of M cells in transepithelial transport of antigens and pathogens to the mucosal immune system. Am. J. Physiol. 274:G785– G791.
- NRC. 1994. Nutrient Requirements of Poultry. 9th rev. ed. National Academies Press, Washington, DC.
- Osweiler, G. D., S. M. Ensley, S. Jagannatha, D. W. Trampel, P.
- Imerman, I. Yoon, and D. T. Moore. 2008. Evaluation of XPTM and prototypes on aflatoxin challenged broilers. Poult. Sci. 87(Suppl. 1):97–98. SAS Institute. 2001. SAS User’s Guide. Version 8.02 ed. SAS Institute Inc., Cary, NC.
- Scott, T. R. 2004. Our current understanding of humoral immunity of poultry. Poult. Sci. 83:574–579.
- Stanley, V. G., C. Gray, M. Daley, W. F. Krueger, and A. E. Sefton.
- 2004. An alternative to antibiotic-based drugs in feed for enhancing performance of broilers grown on Eimeria spp.-infected litter. Poult. Sci. 83:39–44.
- Talebi, A., and G. Mulcahy. 1995. Correlation between immune responses and oocyst production in chickens monospecifically infected with Eimeria maxima. Avian Pathol. 24:485–495.
- Wang, C. J., R. Si, D. G. Jia, H. Q. Yao, C. Y. Wang, and H. P. Zhao.
- 2005. Study on dynamic changes of lymphocytes in chickens by flow cytometry. Acta Vet. Zootech. Sin. 36:828–831.
- Wei, J. Z., X. G. Wu, and H. H. Lin. 2003. Studies on some serum biochemical values of Arbor Acres infected with Eimeria tenella. Chin. J. Vet. Med. 39:8–11.
- Yun, C. H., H. S. Lillehoj, and E. P. Lillehoj. 2000. Intestinal immune responses to coccidiosis. Dev. Comp. Immunol. 24:303–324.
- Zou, F. C., Y. P. Jiang, K. Nie, Y. X. Shang, and H. L. Li. 2006.
- Dynamic changes of CD4+ and CD8 T lymphocyte subpopulations in blood of chicks infected with Eimeria tenella. Poult. Husbandry Dis. Control. 1:4–7.
TRADUCCIÓN realizada por María Elena García Jiménez, Lic. En Traducción - Perito Traductor. Cédula Profesional de Lic. en Traducción: 2628979 (Querétaro, Qro., México)
Temas relacionados
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación