INTRODUCCIÓN
La crianza de las codornices (Coturnix coturnix japonica) en México se ha enfocado a la producción de huevo y carne por parte de pequeños y medianos productores. Constituye una alternativa al consumo de carne de pollo y huevo. La mejora en los procedimientos de incubación en esta especie son imprescindibles para lograr mejoras en la producción. Uno de los puntos críticos de la incubación es la ventilación, dentro de la cual la tasa de remoción de aire fresco varía a lo largo del proceso de incubación de acuerdo a los requerimientos del embrión, en el último lustro se ha hecho investigación puntual en cuanto a los requerimientos de las concentraciones de CO2 en cada una de las etapas de la incubación, se ha observado que un incremento de CO2 durante la primera mitad de la incubación mejora los parámetros de incubación al disminuir la mortalidad embrionaria y aumentar el porcentaje de pollitos de excelente calidad. Sin embargo, de acuerdo a De Smit et al (2006)6 para permitir el incremento natural de CO2 producido por los embriones durante la primer mitad del desarrollo embrionario (DE) es necesario implementar una metodología de noventilación o restricción en el acceso de aire fresco y salida de aire de la máquina incubadora, esta condición de ventilación provoca alteraciones en el balance de las variables más importantes de la incubación; es posible que la temperatura no se vea afectada tanto por este sistema de ventilación, como si lo es la humedad en el interior de la incubadora (De Smit et al, 2006).6 Uno de los puntos clave para lograr una óptima incubación es el control de la humedad dentro de las máquinas incubadoras.
El mantener la humedad relativa en los parámetros apropiados de acuerdo a los requerimientos del desarrollo embrionario en aves se dificulta debido a que la tasa de remoción de aire se disminuye notablemente en una metodología de ventilación restringida. Durante la incubación se requiere cierta cantidad de humedad alrededor del huevo, esto con la finalidad de evitar que el embrión se seque en la etapa temprana de la incubación, mientras que en la etapa tardía del DE, se requiere menor cantidad de humedad que facilite al embrión iniciar la respiración pulmonar. El contenido total de agua en un huevo previo a la incubación es de aproximadamente 68.2%, la cantidad de agua que se pierde durante la incubación puede afectar la tasa de incubabilidad y el peso del pollito al nacimiento (Burton y Tullett, 1985).2 Usualmente los huevos de la gallina y la pava pierden de 12 al 14% de agua durante el primer 88% del proceso de incubación (Rahn et al, 1991).1 Una baja o alta pérdida de peso en forma de vapor de agua del huevo durante este periodo modifica la trayectoria en el DE y consecuentemente afecta la incubabilidad (Meir et al, 1984).11 La tasa de pérdida de agua a partir del huevo se puede controlar al modificar la humedad relativa de la máquina incubadora (Bruzual et al, 2000).4
La temperatura influye directamente a la humedad relativa, ambas variables interaccionan en la pérdida de agua del huevo incubado, por lo cual estas variables deben seleccionarse y vigilarse cuidadosamente durante todo el proceso de incubación, esto debido a que el embrión no tiene la capacidad per se para controlar apropiadamente la pérdida de agua durante su desarrollo (Ar, 1991).1 La relación entre temperatura, humedad relativa y concentración de CO2 durante la primera mitad del proceso incubatorio se ha estudiado principalmente en la gallina doméstica, sin embargo, la interacción de estas variables durante el proceso de incubación en codornices no ha sido ampliamente estudiado.
El objetivo de la presente investigación fue verificar el efecto de la humedad relativa implementado en dos diferentes regímenes de ventilación durante la primer mitad del proceso de incubación que tuvo la finalidad de incrementar el CO2 naturalmente en uno de ellos, sobre los parámetros de incubación, pérdida de peso del huevo, peso y longitud de los guarnigones a la eclosión y viabilidad embrionaria.
MATERIAL Y MÉTODOS
Huevos fértiles.- Los huevos fértiles se obtuvieron a partir de un pie de cría de codorniz japonesa (Coturnix coturnix japonica) alojada en una granja comercial que se encuentra a una altitud de 540 m.s.n.m. Las codornices reproductoras de 12 semanas de edad se mantuvieron en jaulas comunales en una proporción de 12 hembras con 4 machos, la ovospostura promedio al momento del estudio fue de 85%. Recibían 14 horas de luz al día y una ración alimenticia balanceada de 30 g/codorniz y agua ad libitum.
Alimento.- Alimento comercial para postura con 21% de proteína cruda, 2% de grasa, 5% de fibra cruda, 12% de humedad, 15% de cenizas, 3.4% de calcio, 0.60% de fósforo y 41.30% de ELNP/DIF. Durante la reproducción se suplementa en forma de cafetería una fuente adicional de Ca++ en forma de calcita mineral (carbonato de calcio, CaCO3) a través de piedra marmolina.
Recolección, almacenaje y transporte del huevo.- Los huevos se ovopositaron en la tarde y al día siguiente 1,080 huevos fueron recolectados a las 10:00 am. El transporte del huevo hacia el sitio de incubación ubicado a una altura de 2,230 m.s.n.m., se efectuó en un vehículo con suspensión especial durante un lapso de 5 horas durante las cuales se proporcionaron condiciones ambientales de almacenaje temporal idóneas del huevo fértil (Temperatura de 21ºC y 60% de humedad realtiva (HR)).
Selección y pesaje del huevo.- En el sitio de incubación se seleccionaron 960 huevos, estos se pesaron, identificaron y fueron asignados de forma aleatoria a cada tratamiento. El almacenaje se efectuó durante 2 días a una temperatura de 21ºC y 65% de humedad relativa, no se realizó ningún tipo de volteo durante el almacenaje.
Acondicionamiento en la etapa de preincubación.- Previo a la incubación se permitió que los huevos adquirieran pasivamente una temperatura ambiental más alta con la finalidad de evitar choques térmicos al embrión o bien posibles condensaciones de H2O sobre la superficie del huevo. El periodo fue de 8 a 12 horas, a una temperatura inicial de 22ºC y 60% de H.R con una temperatura a término de 26ºC y 60% de HR (Petek y Dikmen, 2004).12
Diseño experimental.- Se formaron dos grupos cada uno con cuatro incubadoras (Hova-Bator® mod. 1183 n=120 huevos de codorniz por máquina). En el primer grupo (Tratamiento I) se diseño un tipo específico de ventilación limitada o de no-ventilación (NV), esto se logró al sellar por completo los exhaucios (Dos en la tapa superior de la incubadora Hova-Bator®), se dejaron abiertos solo cuatro de los doce Damper ubicados en la parte inferior de la máquina, el resto se cerro al 100%; el ventilador interno se mantuvo funcionando con la finalidad de que al homogeneizar el ambiente todos los huevos fértiles recibieran las mismas condiciones físicas (temperatura, humedad, O2 y CO2), esto se efectúo durante los primeros 8 días de DE lo cual permitió que al término de esta fecha las concentraciones de CO2 aumentaran a 0.97 % (9,660 ± 369 ppm) (De Smit et al, 2006),6 el O2 disminuyo a 19.8%. El Tratamiento II recibió condiciones ambientales de incubación estándar o ventilada (V) (Al día 8 DE= 0.25% de CO2 y 20.3% de O2). Las cuatro incubadoras de cada tratamiento se colocaron en un anaquel de tipo horizontal con la finalidad de que todas estuvieran sujetas al mismo ambiente. Una vez que finalizó la primera mitad del periodo de incubación (8 DE), el tratamiento NV recibió el mismo flujo de aire del V y ambos tratamientos continuaron el resto del periodo de incubación (15 días) bajo condiciones de incubación estándar.
Incubación y eclosión.- Los huevos se incubaron durante 15 días a una temperatura de 37.64 ºC en el bulbo seco y de 28.9 a 30.0ºC en el bulbo húmedo; la humedad relativa en el grupo NV durante los primeros 8 días de incubación se limito por medio del cálculo del índice de evaporación en mL por hora por máquina, la cantidad de agua determinada se colocó en la charola de evaporación al arranque de la incubación, se proporcionaron movimientos laterales de 45º con respecto al eje vertical mayor de cada huevo cada hora; los dos últimos días de incubación posteriores al día 15 no tuvieron movimiento, el mismo tipo de máquina se implementó como nacedora, a una temperatura de 37.2ºC en bulbo seco y de 32.2 a 34.4ºC en bulbo húmedo (Bruzual et al, 2000; Petek y Dikmen, 2004).4,12
Medición de variables físicas.- La temperatura y humedad relativa del medio ambiente de la sala de incubación y de cada máquina incubadora se verificó 4 veces al día, la temperatura se registró (Cº) con un termómetro de columna mercuarial (Brannan®), la HR (%) se verificó por medio de un higrómetro de tensión gradual (Taylor®); las mediciones de oxígeno (%) se realizaron por medio de una celda galvánica (Analox®), el CO2 (ppm) se determinó por medio de un sensor infrarrojo (Analox®); las lecturas ambientales y en las máquinas de incubación estándar o ventiladas de estos dos gases se efectuaron diariamente desde el día 1, mientras que las máquinas del tratamiento experimental y debido a la variable explicativa de ventilación limitada o no ventilación (airtight) que considera un sellado parcial del gabinete de incubación, sólo se pudo evaluar al día 8 de DE a partir del cambio de
condiciones de incubación NV a estándar.
Análisis de la mortalidad embrionaria.- Al día 18 de la incubación y una vez finalizada esta, las mortalidades embrionarias por etapa de DE, se registraron en cada uno de los dos grupos de incubación (V y NV). Las etapas se determinaron de acuerdo a la cronología del desarrollo embrionario específico de las codornices, para efecto de análisis en el presente estudio se determinaron las siguientes etapas: I (día 1 al 4 DE) II (día 5 al 14 DE), III (día 15 al 17 DE) y IV (Picados no nacidos). En ambos tratamientos se efectuó el registro de la mortalidad, así como el grado de desarrollo embrionario macroscópico alcanzado (Prado y Juárez 2002; Petek y Dikmen, 2004).12,13 Después de la transferencia del huevo fértil a las nacedoras la ventana de nacimientos se evaluó cada dos horas a través del registro del picaje externo y eclosión del primer hasta el último guarnigón eclosionado.
Pérdida de peso del huevo.- Con base al peso de cada huevo al arranque de la incubación, con la finalidad de obtener el porcentaje promedio de pérdida de peso se tomo una muestra de peso individual de 15 huevos por máquina al día 8, 10, 12, 14, 15 y 16 días de incubación.
Evaluación de parámetros de incubación.- Al cierre de la ventana de nacimientos se evaluó el porcentaje de fertilidad aparente (Con ayuda del embriodiagnóstico se determinó el número total de huevos que contenían un embrión o bien un blastodisco en el caso de huevos infértiles). El porcentaje de incubabilidad por máquina se determinó a partir del total de guarnigones nacidos a partir del total de huevos diagnosticados como fértiles; el porcentaje de natalidad incluyo al total de guarnigones nacidos a partir del total de huevos incubados. Conforme eclosionaban los guarnigones se obtuvo el peso promedio al nacimiento, el coeficiente de variación en el peso de los guarnigones y la talla del guarnigón (longitud en centímetros) que se tomó desde el pico hasta el dedo medio usando una escala de medición cuantitativa (Willemsen et al, 2008 a; López et al, 2009).9,16
Escala de calidad a la eclosión.- La calidad del guarnigón al nacimiento fue evaluada de forma cualitativa mediante una escala de medición no invasiva que fue determinada por el aspecto del guarnigón al nacimiento (vivacidad del guarnigón, estado ocular, tamaño del guarnigón, presencia o ausencia de ombligos mal cicatrizados, rastros de membranas, tarsos enrojecidos, grado de hidratación, peso, longitud corporal y guarnigones sucios), de acuerdo a los resultados obtenidos para estos parámetros los guarnigones se clasificaron en excelente, bueno, regular, deficiente e inaceptable de acuerdo a modificaciones mínimas hechas a la escala utilizada por López et al (2009)9 con la finalidad de adaptarla a codornices.
Análisis estadístico.- Las variables explicativas fueron la condición de ventilación limitada y la ventilación estándar durante los primeros 8 días de incubación, mientras que las variables de respuesta fueron los parámetros de incubación, la pérdida de peso del huevo, la viabilidad y la calidad del guarnigón. En los dos diferentes grupos las variables con comportamiento paramétrico se analizaron a través de la descomposición cuadrática de la varianza (GLM), cuando se determinó una diferencia significativa entre medias, se procedió a su discernimiento por medio de la prueba de Tukey (P<0.05) (Gill, 1978).7 Los datos porcentuales de pérdida de peso en cada grupo de incubación, fertilidad, incubabilidad y natalidad, previo a su análisis estadístico se transformaron al arcoseno de la raíz cuadrada de la proporción. Para determinar las probables diferencias entre estos datos se sometieron a un análisis de varianza de un sólo factor (GLM); las diferencias entre tratamientos se analizaron con la prueba de comparación múltiple de medias de Tukey (P<0.05) (Gill, 1978).7 Los datos porcentuales de la mortalidad embrionaria por etapas se evaluaron por medio de la técnica Xi2, a una significancia de P<0.05 (Gill, 1978).7
RESULTADOS
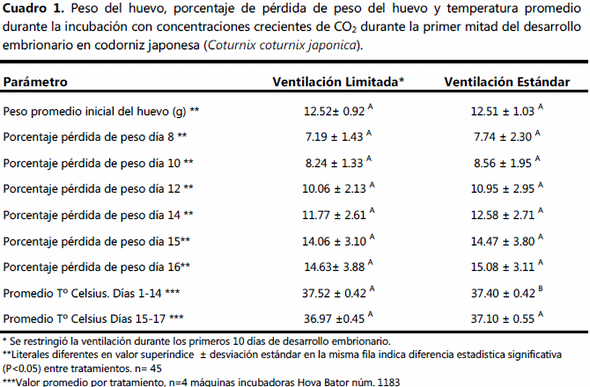
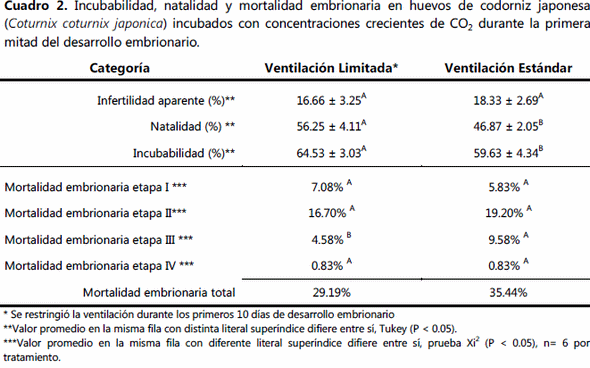
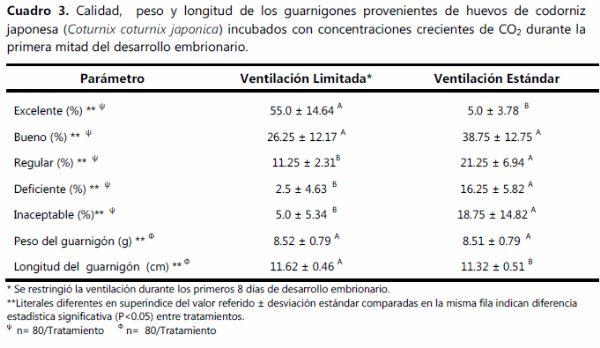
La pérdida de peso al día 8 fue similar en ambos tratamientos, a partir de esta fecha y hasta después de la transferencia no hubo diferencia entre los dos protocolos de ventilación (Cuadro 1). La temperatura promedio durante la incubación fue menor (p<0.05) en el grupo ventilado, el promedio del grupo NV fue de 37.52ºC (Cuadro 1). La temperatura en la etapa de nacedora no difirió entre grupos. La incubabilidad y natalidad fueron mayores (p<0.05) en el grupo NV que en el estándar (Cuadro 2). La mortalidad embrionaria solo fue diferente en la tercer etapa, donde el grupo NV mostró cinco por ciento menos (p<0.05) de embriones muertos que el grupo V. La calidad del pollito en el grupo NV fue 50% mayor (p<0.05) que en el grupo estándar, el cuál mostró a su vez mayor (p<0.05) cantidad de pollitos con calidad regular, deficiente e inaceptable que el grupo de ventilación limitada o NV (Cuadro 3). Los guarnigones del grupo NV fueron más largos (p<0.05) que los del grupo de ventilación estándar (Cuadro 3).
DISCUSIÓN
El peso promedio del huevo registrado aquí es mucho mayor al que se ha descrito para la codorniz japonesa, esto posiblemente podría ocasionar una alteración en el cascarón en cuanto a una mayor magnitud en la constante de conductancia a vapor de agua del cascarón, lo cual en parte puede ayudar a explicar una posible mayor tasa de evaporación a partir de los huevos incubados y por lo tanto una mayor pérdida de peso registrada al día 8 DE, día que corresponde a la mitad del periodo de incubación en codorniz japonesa, ésta pérdida de peso es mayor a la que correspondería observar en la mayor parte de las especies de gallináceas de las cuales forma parte la codorniz japonesa, esta pérdida de peso en forma de vapor de agua debería oscilar alrededor del 6.5%; sin embargo, la pérdida observada aquí no comprometió en ninguno de los grupos el proceso de incubación, toda vez que favoreció la formación de la cámara de aire de forma adecuada.
Adicionalmente se observó que no hubo diferencia de pérdida de peso entre los dos grupos que recibieron diferentes protocolos de ventilación, esto debido a la eficiencia en el cálculo de evaporación efectuado para el grupo NV, grupo donde de acuerdo De Smit et al (2006)6 y debido a lo limitado en el recambio de aire con el exterior durante la primera mitad del proceso incubatorio se vuelve muy difícil el control en la pérdida de peso a partir del huevo incubado; aquí el sistema depérdida de peso de cada huevo se calculo con base a la cantidad de agua metabólica que pierde cada embrión misma que a su vez se supeditada a la constante de conductancia del cascarón de cada huevo de codorniz incubado y a la cantidad de vapor de agua presente en el ambiente externo del huevo, además de la presión atmosférica ambiental, que en este caso posiblemente también contribuye a explicar el aumento en la tasa de evaporación observado, ya que de acuerdo a Amos Ar (1993)2 la cantidad de evaporación de los huevos incubados a gran altura aumenta en comparación al mismo tipo de huevos incubados a nivel del mar.
El porcentaje de pérdida entre grupos no difirió en ninguna fecha de evaluación, incluso después de la transferencia (día 16 DE), lo cual indica que a pesar de que el protocolo de incubación que considera la no-ventilación permitió al principio de la incubación una HR interna cercana al punto de rocío (saturación de vapor de agua), después del día 3 de incubación esta humedad comenzó a disminuir de tal forma que para el día 8, fecha en que se cambiaron las constantes de ventilación no mostró diferencia con relación al grupo control e incluso fue más cercano al promedio de pérdida de peso que se busca en esta fecha (6.5%) y aunque no mostro diferencia estadística con el grupo control (estándar), se mantuvo númericamente por debajo de este grupo hasta la fecha de tranferencia e incluso después.
El grupo NV tuvo un 14% de pérdida de peso al momento de la tranferencia, el cual se encuentra dentro de los parámetros apropiados para gallináceas (12-14%); Bruzual et al (2000)4 al evaluar diferentes humedades durante la incuabción determinó que la humedad relativa ambiental más apropiada para lograr el máximo porcentaje de incubabilidad es de 53%, parámetro que se conservó en el grupo control, sin embargo, el grupo NV a pesar de no diferir con relación a este grupo obtuvó mejor incubabilidad y natalidad al finalizar la incubación, por lo cual el balance hídrico dentro de este protocolo de incubación fue el adecuado. Romao et al (2009)14 al verificar el efecto de una baja (36%), media (52.2%) y alta (76.5%) humedad relativa dentro de la incubadora durante el proceso de incubación (0-360 hrs) y los dos últimos días en nacedora, determinó que la pérdida de humedad al día 10 DE en el grupo de baja HR fue de 7.89% similar al registrado aquí al día 8 DE, mientras que la pérdida de peso al día 10 DE en el grupo de HR media fue de 6.48% y en el de alta de 4.89%; al día de transferencia el grupo de baja HR de Romao et al (2009)14 perdió 11.96%, el de media 8.94% y el de alta HR 4.9%; Romao et al (2009)14 además determinaron que la natalidad que obtuvieron en el grupo de baja HR (79%) fue la más alta, mayor a la del mejor grupo del presente estudio que fue el NV, Romao et al (2009)14 obtuvo posiblemente una mejor incubabilidad en este grupo posiblemente debido a que incubaron en Brasil en un sitio de menor altitud al lugar donde se efectúo el presente estudio (2,230 m.s.n.m.) lo que determina que además de la tasa de perfusión de CO2 y O2, el vapor de agua muestra un comportamiento diferente sobre la incubabilidad de acuerdo a la altura del sitio de incubación, ya que a pesar de que la HR que utilizan ellos de 52% es similar a la recomendada por Bruzual et al (2000)4 o a la registrada aquí en el grupo NV (52% al día 8 DE) o la del grupo estándar (60% de HR al día 8 DE) Romao et al (2009)14 con 52% de HR obtuvo una natalidad de 70%, porcentaje mucho mayor a cualquiera de los obtenidos aquí (diferencia de 13% con el grupo NV y de 23% con el V). Bruzual et al (2000)4 determino una menor mortalidad embrionaria tardía (2-3%) cuando la incubación se efectúa a 53% de humedad relativa ambiental independiente a la edad de las aves reproductoras. Mientras que Romao et al (2009)14 obtuvo un 5% de mortalidad embrionaria tardía cuando incubo con baja humedad, 6% con la análoga a la del presente estudio y de 15% cuando utilizo alta humedad, lo cual significa que a pesar de que el grupo estándar del presente estudio mostró una mortalidad tardía de 10% esta no se puede atribuir únicamente al efecto de la HR per se, ya que los dos grupos del presente estudio perdieron la misma proporción de peso, además de que el porcentaje del pollito con relación al peso del huevo fue de 68%, porcentaje menor al reportado por Romao et al (2009)14 quién indico un porcentaje de 71.9% para los guranigones de HR intermedia y de 70% para los de HR baja, mientras que los de HR alta mostraron una proporción de 74%.
Es posible entonces que un indicador de la calidad del guarnigón y del proceso mismo de la incubación sea esta proporción, indicando que entre más baja es esta, los parámetros registrados son mejores. Si bien en el presente estudio los dos grupos mostraron esta proporción, es evidente que la HR mostró poco efecto sobre el mejor comportamiento productivo del grupo NV con relación al grupo estándar, por lo cual es más factible que el incremento de CO2 durante los primeros 8 días de DE sea la causa de esta diferencia, este efecto positivo de la restricción en la ventilación durante la primera mitad de la incubación ya ha sido puntualizada por diferentes investigadores, entre ellos Willemsen et al (2008,b)17 indican que este protocolo de ventilación favorece la viabilidad del embrión desde una etapa temprana del desarrollo embrionario, logrando contar con embriones más robustos que presentan menos problemas de eclosión y de mayor calidad como la observada en el presente estudio en el grupo NV; lo cual permite tener una mejor tasa de incubabilidad al final del proceso incubatorio como efectivamente se pudo observar en el presente estudio. Dentro de las condiciones de incubación NV, además de alcanzar los perfiles óptimos de CO2 y O2, también se logra una mejor estabilidad de la temperatura a nivel del cascarón de los huevos fértiles, situación básica para obtener un desarrollo embrionario óptimo de acuerdo a lo indicado ya previamente por Lourens et al (2005),10 por lo cual al restringir el sistema de ventilación las posibles oscilaciones de temperatura generadas por el obligado recambio de aire fresco del exterior (regularmente más frío y en la época de invierno es mayor este efecto) disminuyen, con lo cual se favorece el DE, ya que precisamente este mecanismo de restricción de la ventilación se aplica durante la fase endotérmica del embrión (1-8 DE), etapa crítica del DE donde se requiere un suministro constante y estable de calor a nivel del cascarón; de acuerdo a Lourens et al (2005),14 si no se logra una temperatura estable en este periodo, la incubabilidad y el rendimiento posterior pueden verse muy afectados.
El aire húmedo dentro de la incubadora transfiere el calor de mejor manera que el aire seco, de esta forma al limitar la ventilación durante los primeros 8 días del DE de los guarnigones se crea un ambiente más uniforme y confortable desde el inicio de la incubación, al no haber un recambio continuo de aire a través de la ventilación la temperatura se controla más eficientemente durante este periodo crítico del DE (1-8 DE), lo cual es crucial, sobre todo si la incubación se efectúa a grandes altitudes sobre el nivel del mar o en época de invierno (diciembre), como es el caso del presente estudio. Cuando se cierran los Dampers y exhaucios cómo en el grupo NV, el CO2 incrementa gradualmente a la par que lo hace la humedad relativa ambiental (~85%), la cual proviene de la pérdida de agua metabólica de los huevos incubados. Debido a que la transferencia de calor es mucho más alta y eficiente a través del aire húmedo que del aire seco, existe menor variación de la temperatura a nivel del cascarón en esta etapa crítica del DE (1-8 DE), por lo tanto se evitan variaciones y al final se obtiene un mejor promedio, como el observado en el grupo NV del presente estudio. Es evidente que la modificación de la humedad relativa de la incubadora no solo afecta la pérdida de peso del huevo como ya lo ha indicado muy bien Romao et al (2009),14 sino que también afecta la capacidad de transferencia calórica del aire, la temperatura a nivel del cascarón y por lo tanto el metabolismo del embrión.
Los efectos de un incremento gradual en la concentración de CO2 sobre el DE, la incubabilidad, la tasa de mortalidad embrionaria y la calidad de los guarnigones eclosionados ha sido diferente en cada estudio que ha abordado esta hipótesis; aparentemente el incremento en la concentración de CO2 actúa como un interruptor (apagado/encendido) con efectos específicos sobre algunos sistemas fisiológicos relacionados con el DE temprano, estos efectos persisten a lo largo de todo el proceso de DE; sin embargo, aún se desconocen las razones de por qué un incremento en las concentraciones de CO2 no siempre mejora de forma consistente la incubabilidad. Se ha propuesto que la alta concentración de CO2 durante la primera mitad del DE, tiene acción directa sobre el pH de la albúmina (Bruggeman et al, 2007)5 acompañado con un aumento temprano en la expresión de enzimas pH-dependientes como la anhidrasa carbónica, la cual se encuentra involucrada en los primeros estadíos del DE; se ha indicado además que favorece la aceleración de la ruptura de las membranas chalacíferas, con rápida pérdida de dureza de la albúmina densa y acuosa (Sadler et al, 1954),15 se menciona también que existe formación de una mayor proporción de fluido sub-embrionario durante el DE temprano (Latter y Baggot, 2002),8 sin embargo, es posible que el genotipo de la aves, la edad de éstas, la duración y las condiciones del almacenaje estén afectando directamente este pH albuminario, la ruptura de las membranas chalacíferas y la óptima formación de fluido sub-embrionario, lo cual explica posiblemente la variabilidad observada. Con base a los resultados, es posible concluir que la modificación del medio ambiente al limitar la ventilación de la incubadora favorece el incremento natural y paulatino en la concentración de CO2, lo cual contribuye directamente a mejorar el DE; el cual a grandes altitudes (~2,230 m.s.n.m.) se ve favorecido. Con la finalidad de efectuar una adecuada incubación en codornices es recomendable utilizar un sistema de ventilación limitada durante los primeros 8 días de incubación, lo cual debe permitir un incremento en la concentración de CO2 en el interior de la incubadora hasta un nivel de ~0.97% y 19.8% de O2; lo cual repercute en una mejora significativa de los parámetros de incubabilidad, una adecuada pérdida de peso del huevo, mejor calidad del guarnigón eclosionado, mayor longitud del mismo y una disminución en la mortalidad embrionaria tardía.
AGRADECIMIENTOS
Los autores agradecen a la D.G.A.P.A.- U.N.A.M. por el apoyo económico otorgado a través del proyecto PAPIIT IN 220909-3, lo cual ha contribuido a la realización del presente estudio.
REFERENCIAS
1.- AR A. Egg water movements during incubation. In: S G Tullet (editor). Avian Incubation. London, (Ed. Buterworth- Heinemann) 1991, 157-173 pp.
2.- AR A. Gas exchange of the avian embryo at altitude - The half-empty glass. Funktionsanalyse biologischer Systeme 1993; 23: 339-350.
3.- BURTON FG, TULLET S G. The effect of egg weight and shell porosity on the growth and water balance of the chicken embryo; Comparative Biochemistry and Physiology 1985; 81:377-85
4.- BRUZUAL JJ, PEAK SD, BRAKE J,PEEBLES ED. Effects of relative humidity during incubation on hatchability and body weight of broiler chicks from young breeder flocks. Poult Sci 2000; 79:827-30
5.- BRUGGEMAN V, WITTERS A, DE SMIT L, DEBONNE M, EVERAERT N, KAMERS B, et al. Acid–base balance in chicken embryos (Gallus domesticus) incubated under high CO2 concentrations during the first 10 days of incubation. Resp Physiol & Neurobiol 2007; 159:147-154.
6.- DE SMIT L, BRUGGEMAN V, TONA JK, DEBONNE M, ONAGBESAN O, ARCKENS L. Embryonic developmental plasticity of the chick: Increased CO2 during early stages of incubation changes the developmental trajectories during prenatal growth. Comp Bioch and Physiol: Part A 2006;145:166-175.
7.- GILL JL. Design and analysis of experimets in the animal and sciences. Vol. 1 Ames (Io): The Iowa State University Press, 1978.
8.- LATTER GV, BAGGOT GK. Role of carbon dioxide and ion transport in the formation of sub-embryonic fluid by the blastoderm of the Japanese quail. British Poultry Science 2002;43:104-16.
9.- LÓPEZ CS, JUÁREZ EMA, PRADO RO. Una escala no invasiva para clasificación de la calidad en pollitos recién nacidos permite valorar el proceso de incubación. Memorias en CD de la XXXIV Convención anual ANECA; 2009 agosto 13-16; Acapulco (Guerrero) México. México (DF): A.N.E.C.A., AC, 2009: 8 pp.
10.- LOURENS A, VAN DEN BRAND H, MEIJERHOF R, KEMP B. Effect of eggshell temperature during incubation on embryo development, hatchability and posthatch development. Poult. Sci 2005; 84:914-20.
11.- MEIR M, NIR A, AR A. Increasing hatchability of turkey eggs by matching incubator humidity to shell conductance of individual eggs. Poult Sci 1984; 63:1489-96 376
12.- PETEK M, DIKMEN S. The effects of prestorage incubation of quail breeder eggs on hatchability and subsequent growth performance of progeny. Anim Res 2004; 53:527-34
13.- PRADO ROF, JUÁREZ EMA. Efecto de diferentes humedades durante la incubación, sobre mortalidad embrionaria e incubabilidad. Memorias de las VIII Jornadas Médico Avícolas. 2002 febrero 20-22; Ciudad Universitaria (DF). México (DF): División de Educación Continua y Departamento de Producción Animal: Aves. Facultad de Medicina Veterinaria y Zootecnia. UNAM., 2002:209-211.
14.- ROMAO JM, MORAES TGV, TEIXEIRA RSC, BUXADE C, CARDOSO WM. Effect of relative humidity on incubation of Japanese quail eggs. Livestock Research for Rural Developmen 2009; 21:3-11.
15.-SADLER WW, WILGUS HS, BUSS EG. Incubation factors affecting hatchability of poultry eggs. Poult. Sci 1954; 33, 1108-15.
16.- WILLEMSEN H, TONA K, BRUGGEMAN V, ONAGBESAN O, DECUYPERE E. Effects of high CO2 level during early incubation and late incubation in ovo dexamethasone injection on perinatal embryonic parameters and post-hatch growth of broilers. British Poult Sci 2008; 49:22-231. (a)
17.- WILLEMSEN H, EVERAERT N, WITTERS A, DE SMIT L, DEBONNE M, VERSCHUERE F, et al. Critical Assessment of chick quality measurements as an indicator of post hatch performance. Poult Sci 2008; 87:2358-2366. (b)