Introducción
El inóculo transmitido por las semillas y el suelo es fuente de infección en el campo, puede favorecer el desarrollo progresivo de la enfermedad en los cultivos y reducir el valor comercial de la cosecha. Por otra parte, lotes de semillas y material de trasplante infectados pueden ser causa de la diseminación de enfermedades en nuevas regiones.
Los cultivos de melón (Cucumis melo L.), melón de agua (Citrullus lanatus Thunb.), pepino (Cucumis sativus L.), y calabaza (Cucurbita spp.) son afectados por bacterias y hongos fitopatógenos. Entre los principales microorganismos fitopatógenos transmisibles por semillas de cucurbitáceas se incluyen las bacterias Xanthomonas cucurbitae y Acidovorax avenae subsp. citrulli. La marchitez provocada por Fusarium oxysporum es la principal enfermedad fungosa transmisible por el suelo.
Las infecciones severas por Xanthomonas cucurbitae en calabaza pueden provocar pérdidas que exceden el 50% de la cosecha (Babadoost, 2002). La bacteria Acidovorax avenae subsp. citrulli se considera un patógeno con alto potencial de destrucción, capaz de causar pérdidas de hasta el 100% en plántulas o plantas (Schaad y col., 2001, Mora-Umaña y Araya, 2002).
La pudrición de las plántulas es el síntoma de infecciones tempranas por Fusarium oxysporum. La marchitez provocado por este patógeno se considera uno de los problemas que más afecta al melón en todo el mundo, en regiones cálidas y templadas (Zitter, 1999).
Se han realizado ensayos de forma experimental mediante el tratamiento químico de semillas de calabaza para el control de la Mancha bacteriana de las cucurbitáceas causada por Xanthomonas cucurbitae (Moffett y Wood, 1979; Lyon y Riedel, 2003; Özdemir y Zitter, 2003) y de semillas de melón de agua para el control de la Mancha bacteriana del fruto provocada por Acidovorax avenae subsp. citrulli (Larson y col., 1999). Se recomienda como el más efectivo método de manejo de estas enfermedades la siembra de semillas libres de las bacterias fitopatógenas.
El resultado limitado del tratamiento químico de las semillas de cucurbitáceas para el control de ambas enfermedades bacterianas y la baja efectividad de fungicidas y fumigantes para el control de Fusarium oxysporum debido a la rápida recolonización del suelo por el hongo (Egel y Martyn, 2007), han dirigido la investigación hacia la búsqueda de una alternativa al tratamiento químico para proteger semillas y plántulas de infecciones durante las etapas de germinación y brotación.
La bacterización de semillas con rizobacterias promotoras del crecimiento vegetal (PGPR por sus siglas en inglés), que además de promover el crecimiento de las plantas las protegen contra agentes tales como bacterias y hongos fitopatógenos por su efecto antagónico frente a estos microorganismos (Kloepper y Schroth, 1978; McSpadden y Fravel, 2002), es una alternativa que despierta interés, ya que los agentes de control biológico se seleccionan a partir de su interacción con los agentes nocivos en el medio ambiente y despliegan diversos mecanismos de acción en comparación con los pesticidas (Fravel, 2005).
La selección de rizobacterias como potenciales gentes de control biológico constituye un campo de investigación y desarrollo en expansión (Yadegari y col., 2008) por sus perspectivas de aplicación en agroecosistemas sustentables. Se han llevado a cabo investigaciones sobre el tratamiento de semillas de cucurbitáceas con PGPR para el control de patógenos fungosos (Ongena y col., 1999; Benhamou y col., 2000) y bacterianos (Liu y col., 1995; Santos y col., 2006).
El objetivo de esta investigación fue aislar, seleccionar, caracterizar e identificar rizobacterias por su actividad antagónica in vitro frente a Xanthomonas cucurbitae, Acidovorax avenae subsp. citrulli y Fusarium oxysporum, como potenciales agentes de control biológico de la Mancha bacteriana de las cucurbitáceas, la Mancha bacteriana del fruto y la marchitez por Fusarium.
Materiales y métodos
Origen de los aislamientos
Las muestras analizadas se colectaron en áreas de producción de la provincia de Camagüey. Se tomaron muestras de tubérculos de papa (Solanum tuberosum L.) procedentes de plantas en las cuales se observó desarrollo del síntoma de pudrición blanda bacteriana en el tallo, mientras los tubérculos estaban aparentemente sanos. Se seleccionaron semillas de frijol (Phaseolus vulgaris L.) que no presentaban síntomas del Tizón común del frijol, en contraste con la mayoría de los granos en la muestra. Las muestras de raíces de maíz (Zea mays L.) se tomaron de plantas seleccionadas por la ausencia del síntoma del tizón de la hoja provocado por Bipolaris turcicum a diferencia de las restantes.
Aislamiento de rizobacterias
Las rizobacterias se aislaron a partir de la preparación de diluciones decimales seriadas del agua de lavado de tubérculos de papa, suspensión de semillas de frijol molidas en agua destilada estéril y segmentos de 1cm de las raíces de plantas de maíz colocados en 1 ml de solución de MgSO4 0.1M (Burr y col., 1978). Se sembraron 100 μl de la dilución 10-7 de cada muestra sobre los medios Agar Nutritivo (AN) y Agar B de King (KB) en placas de Petri mediante diseminación con espátula de Drigalski. Los cultivos se incubaron a 28 ºC durante 48 horas. La producción de pigmento fluorescente en KB se comprobó bajo luz ultravioleta.
Selección inicial de rizobacterias antagonistas. Las placas de los aislamientos donde crecieron colonias separadas y de bordes delimitados se asperjaron con una suspensión de la bacteria fitopatógena Xanthomonas cucurbitae cepa 1408/00 a una concentración de 108 ufc/ml (Burr y col., 1978) y se incubaron a 28 ºC por un período adicional de 24 horas. Las colonias que mostraron zona de inhibición de la bacteria fitopatógena se recuperaron en medio AN y se incubaron a 28 ºC durante 24 a 48 horas hasta que se observó crecimiento.
Conservación. Determinación de la pureza y conteo de células viables
Las rizobacterias seleccionadas se conservaron por congelación a –70 ºC en medio Caldo Triptona Soya (TSB) con glicerol al 20 % como crioprotector. El control de la pureza se realizó mediante la siembra de rizobacterias por agotamiento en medio Agar Triptona Soya (TSA) y se crecieron en el medio TSB durante 24 horas con agitación a 250 rpm, ambos cultivos se incubaron a 28 ºC.
Se realizó tinción de Gram según el método modificado por Hucker y se observó al microscopio óptico la morfología de las células y reacción al colorante de Gram. La morfología de las colonias se observó al microscopio estereoscópico.
La viabilidad se determinó a partir de las diluciones decimales seriadas en solución salina (NaCl 0,9%) hasta llegar a 10-7. De cada dilución se tomaron 100 ?l, qu medio AN. Los cultivos se incubaron a una temperatura de 28 ºC. Se contaron las unidades formadoras de colonias (ufc) en la dilución que tenía entre 30 y 300 colonias y se realizó la determinación de la concentración utilizando la siguiente ecuación:
C= X. D. 100 ufc/ml
Donde X: media del conteo de las placas; D: factor de dilución =1/dilución; 100: conversión de μl-ml. Se determinó el coeficiente de variación, considerándose el ensayo válido cuando este fue menor del 20%.
Ensayo de interacción in vitro.
Interacción rizobacterias-bacterias fitopatógenas
Las rizobacterias purificadas se diluyeron hasta concentración de 108 ufc/ml, para cada uno de los aislamientos se depositó una gota de 10 μl, a razón de tres manchas por placa, en cada una de tres placas en medio AN para los cultivos Gram positivos y medio KB para los Gram negativos, las cuales fueron incubadas a 28ºC por 48 horas. Transcurrido este tiempo se sometieron a tratamiento con vapores de cloroformo durante tres minutos para que perdieran su viabilidad. Las cepas de bacterias fitopatógenas Xanthomonas cucurbitae 1408/00, Acidovorax avenae subsp. citrulli 672/01, cultivadas en AN se diluyeron aproximadamente a una concentración de 108 ufc/ml y se añadieron a tres mililitros de Agar Agua 0,5%. La mezcla se dispersó sobre las placas que contenían las cepas tratadas con cloroformo, posteriormente se incubaron a 28°C durante 48 horas, Transcurrido este periodo se comprobó la actividad antagónica de las rizobacterias por la presencia de halos de inhibición del crecimiento de las bacterias fitopatógenas alrededor de las manchas (Kloepper y Schroth, 1981; Liao, 1989).
Interacción rizobacterias-hongos fitopatógenos
Las rizobacterias se sembraron por manchas como se describió anteriormente, en placas en medio Agar Papa Dextrosa (PDA) y se incubaron a 28°C durante 48 horas, pasado este periodo se colocó en el centro de la placa un disco de 5 mm de diámetro de las diferentes cepas de hongos cultivados en PDA. Se realizaron tres réplicas para cada hongo a estudiar y se incubaron por 5 días a 28°C. Transcurrido este periodo se evaluó la actividad antagónica de las rizobacterias, observando la inhibición del crecimiento del micelio en el límitehacia la zona de crecimiento de las rizobacterias (Digat y Gardan, 1987).
Caracterización de las rizobacterias
Entre las cepas de rizobacterias que demostraron actividad antagónica se escogieron dos cepas correspondientes a bacilos Gram positivos y una cepa debacilos Gram negativos, las cuales se caracterizaron mediante los métodos microbiológicos descritos por Harrigan y McCance (1968).
Evaluación de la actividad hemolítica, pectolítica y reacción de hipersensibilidad en tabaco.
Se sembraron las rizobacterias antagonistas en medio Agar Sangre y se evaluó la actividad hemolítica por la aparición de zonas claras alrededor de crecimiento.
La actividad pectolítica se determinó en tubérculos de papa mediante la técnica de Stanier y col. (1966). La prueba de hipersensibilidad en hojas de tabaco se realizó según la técnica descrita por Klement y col. (1964). El control negativo fue agua estéril y el control positivo la bacteria fitopatógena Pseudomonas cichorii cepa143/01. Se observó por un periodo de hasta 24 hora.
.
Características bioquímicas y fisiológicas
Se determinó la producción de la enzima catalasa; reducción de nitrato; hidrólisis de gelatina, almidón y caseína; producción de indol y acetoína; utilización de citrato; producción de ácido a partir de carbohidratos; crecimiento en concentraciones 2 , 5, 7 y 10% de cloruro de sodio; rango de temperatura de crecimiento de las cepas esporuladas que se incubaron a 4, 20, 25, 30, 35, 40, 45, 50, 55, y 60º C y de las cepas no esporuladas, que se incubaron a 4, 20, 25, 30, 35 y 40º C.
Las bacterias caracterizadas preliminarmente como bacilos Gram positivos esporulados se identificaron según la clave de Claus y Berkeley (1986) para el género Bacillus. Las cepas antagonistas Gram negativas que produjeron pigmentos fluorescentes en medio KB se identificaron mediante la clave dicotómica propuesta por Bossis y col. (2000).
Pruebas de producción de antibiocinas por rizobacterias
La interacción rizobacterias-bacterias fitopatógenas para la determinación de la producción de antibiocinas se realizó en tres medios de cultivo según la prueba presuntiva descrita por Liao (1989). Se inocularon placas de los medios B de King, AN y B de King suplementado con FeCl3 0.01M, depositando tres gotas de 10 μl de las suspensiones de rizobacterias a la concentración de 108 ufc/ml en cada una de tres placas de cada medio y se incubaron a 28 ºC por 48 horas. Transcurrido este tiempo se sometieron a tratamiento con vapores de cloroformo durante tres minutos. Las cepas de las bacterias fitopatógenas Xanthomonas cucurbitae y Acidovorax avenae subsp. citrulli a una concentración de 108 ufc/mL se añadieron a tres mililitros de agar acuoso 0,5%. La mezcla se dispersó sobre las placas que contenían las cepas retadas, posteriormente se incubaron a 28 °C durante 48 horas, transcurrido este periodo se analizó la actividad antagónica de las rizobacterias según los presuntos metabolitos producidos en cada uno de los medios probados de acuerdo con la presencia de halos de inhibición del crecimiento de las bacterias fitopatógenas. .
Para determinar la producción de antibiocinas por las rizobacterias en la interacción frente a hongos fitopatógenos sobre el medio PDA, se evaluó la inhibición del crecimiento radial del micelio fungoso comparado con un control en ausencia de antagonistas (Buysens y col., 1996). El parasitismo y la producción de enzima extracelulares se determinó mediante la observación de la degradación del micelio al microscopio estereoscopio y lisis de las hifas mediante el microscopio óptico (Pleban y col., 1997).
Resultados y discusión
Aislamiento y selección de rizobacterias antagonistas
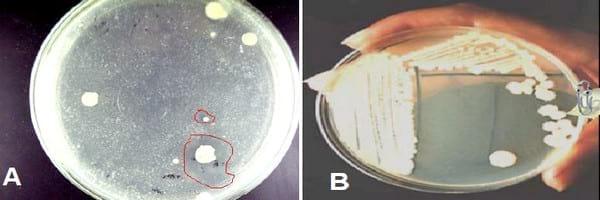
Los aislamientos obtenidos a partir de las rizosferas de papa y maíz y de la espermosfera de frijol mostraron halos de inhibición del crecimiento de la bacteria fitopatógena Xanthomonas cucurbitae cepa 1408/00 (fig.1A) alrededor de siete colonias, las cuales fueron seleccionadas (fig. 1B) como potenciales antagonistas. Las colonias rotuladas como 14A y 14B mostraron fluorescencia bajo luz ultravioleta en el medio KB.
Fig. 1. A: Aislamiento de rizobacterias potenciales antagonistas de Xanthomonas cucurbitae 1408/00. Se observan halos de inhibición de la bacteria fitopatógena alrededor de las antagonistas. B: Selección y purificación de rizobacterias antagonistas.
Las muestras de rizosfera y espermosfera analizadas en esta investigación se seleccionaron porque presentaban una notable reducción en el desarrollo de los síntomas de las enfermedades provocadas por patógenos conocidos, hecho que se ha atribuido al control biológico ejercido por organismos antagonistas de fitopatógenos, de forma natural (Cook y Baker, 1983), presentes en la rizosfera (Burr y col., 1978; Whipps, 2001) y en la espermosfera (Da Luz, 1993; Walker y col., 1998).
Las cepas aisladas en esta investigación se consideran dentro del grupo de las rizobacterias, un grupo particular de bacterias diversas filogenéticamente, que se denominan así porque se encuentran en las raíces y son aisladas a partir de la superficie radical y del suelo que la rodea inmediatamente; pueden presentar interacciones con las plantas que promueven o inhiben el crecimiento de éstas (Kloepper y col., 1980).
Los exudados radicales tales como aminoácidos, azúcares y ácidos orgánicos son una importante fuente nutricional para las bacterias que colonizan las raíces.Diferentes investigadores (Kloepper y Schroth, 1981; Jiménez y col., 2001) han obtenido aislamientos de rizobacterias antagonistas a partir de la rizosfera de papa (Solanum tuberosum L.); Hebbard y col. (1992) han aislado de la rizosfera de maíz (Zea mays L.). La espermosfera de varias especies de la familia Leguminosae ha sido el origen de aislamientos de rizobacterias antagonistas (Walker y col., 1998).
Conservación. Determinación de pureza y viabilidad de las cepas
Las cepas seleccionadas como potenciales antagonistas y conservadas en los bancos de células a -70oC alcanzaron una viabilidad de aproximadamente 108 a 109 ufc ml –1. La mayoría de las cepas purificadas correspondió a bacilos Gram positivos y solo dos cepas resultaron bacilos Gram negativos.
Interacción in vitro rizobacterias - microorganismos fitopatógenos
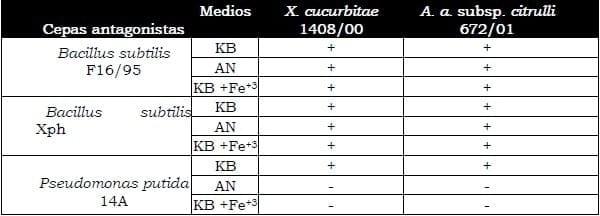
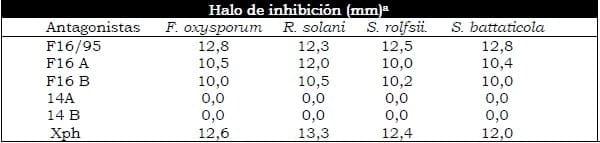
Las cepas de rizobacterias seleccionadas como potenciales antagonistas de Xanthomonas cucurbitae cepa 1408/00, una vez purificadas mostraron efecto inhibitorio in vitro sobre el crecimiento de las bacterias fitopatógenas ensayadas, entre ellas Xanthomonas cucurbitae cepa 1408/00 y A. avenae subsp. citrulli cepa 672/01, patogénicas en cucurbitáceas (Tabla 1A). Excepto las cepas 14A y 14B, las restantes suprimieron el crecimiento radial del micelio de los hongos fitopatógenos probados, habitantes del suelo (Tabla 1B).
Tabla 1A. Resultado de la interacción in vitro entre cepas de rizobacterias antagonistas potenciales y cepas de bacterias fitopatógenas.
 a
a Promedio de tres réplicas
Tabla 1B. Resultado de la interacción in vitro entre cepas de rizobacterias antagonistas potenciales y cepas de hongos fitopatógenos.
 a
a Promedio de tres réplicas
La aplicación del procedimiento de selección de rizobacterias antagonistas in vitro posibilitó la obtención de siete cepas potenciales antagonistas de fitopatógenos, de acuerdo con los resultados del ensayo. Este constituye el procedimiento usual para seleccionar agentes bacterianos de control biológico de enfermedades (Krauss, 1999).
Por otra parte, todas las cepas mostraron al menos capacidad para inhibir el crecimiento de bacterias fitopatógenas. Se considera que cuando se prueban aislamientos de hongos y bacterias del ambiente como candidatos para el control biológico, muestran al menos alguna capacidad para inhibir el crecimiento de fitopatógenos in vitro (McSpadden y Fravel, 2002).
Las cepas 14A y 14B sobre medio KB solo inhibieron el crecimiento de bacterias fitopatógenas, lo que puede estar relacionado con los inconvenientes de la selección in vitro. Se ha señalado que la inhibición en estas condiciones tiene lugar mediante la producción de metabolitos que dependen fuertemente del sustrato utilizado y, además, la diferencia existente entre los sustratos artificiales ricos en nutrientes en comparación con los sustratos naturales, por lo general limitados, representa una variación de las condiciones en que ocurre la interacción antagonista-patógeno (Whipps, 1997).
Ambas cepas 14A y 14B se conservaron teniendo en cuenta estos inconvenientes de la selección in vitro, que no hacen posible predecir el efecto de la interacción in vivo y, por esta razón no es recomendable descartar ninguna cepa antagonista en esta fase de la selección (Krauss, 1999; McSpadden y Fravel, 2002).
Caracterización e identificación de las rizobacterias antagonistas
La caracterización e identificación de las rizobacterias antagonistas hasta el nivel de especie se llevó a cabo con las cepas de bacilos esporulados Gram positivos F16/95 y Xph, y la cepa 14A de bacilos Gram negativos.
Evaluación de la actividad hemolítica, pectolítica y reacción de hipersensibilidad en tabaco
Las cepas de bacilos esporulados Gram positivos no mostraron actividad hemolítica en el medio Agar sangre. Las tres cepas antagonistas no produjeronreblandecimiento en las rodajas de papa a las 72 horas de incubación. La cepa 14A fluorescente no indujo necrosis en los espacios internerviales de hojas de tabaco en comparación con el control positivo Pseudomonas cichorii cepa 143/01.
Se conoce que la actividad β hemolítica de algunos bacilos esporulados Gram positivos está relacionada con la patogenicidad a animales de sangre caliente (Brock y Madigan, 1991), en tanto varias especies bacterianas provocan la pudrición blanda en tubérculos de papa debido a la actividad de enzimas pectolíticas (Stanier y col.,1966). Por otra parte, la reacción de hipersensibilidad ante la infiltración de una cepa bacteriana en hojas de tabaco es un mecanismo de defensa que despliegan las plantas para contrarrestar el efecto de los fitopatógenos, esta respuesta permite determinar la patogenicidad de dicha cepa (Klement y col., 1964).
Los resultados negativos mostrados por las cepas antagonistas en relación con la actividad de enzimas hemolíticas y pectolíticas, así como de la reacción de hipersensibilidad en hojas de tabaco, permitió continuar la caracterización e identificación de las rizobacterias al determinar su inocuidad para las plantas, animales y humanos.
Características morfológicas, culturales, fisiológicas y bioquímicas
Las cepas antagonistas F16/95 y Xph mostraron células en forma de bacilos con endosporas, Gram positivos, mótiles, produjeron catalasa y utilizaron la glucosa en condiciones aerobias. Estas características permitieron su identificación como miembros del género Bacillus (Claus y Berkeley, 1986). Los resultados de las pruebas fisiológicas y bioquímicas demostraron que las cepas F16/95 y Xph están estrechamente relacionadas con Bacillus subtilis (Ehrenberg) Cohn y se identificaron con esta especie mediante la comparación con la cepa de referencia Bacillus subtilis ATCC 6633 y la clave determinativa de las especies del género Bacillus (Claus y Berkeley, 1986).
Muchos representantes de este género viven en los suelos, o de forma epifítica y endofítica en la rizosfera (Kajimura y col., 1995) y en la espermosfera (Walker y col., 1998).
La cepa 14A mostró células en forma de bacilos Gram negativos, mótiles, produjo pigmento fluorescente en el medio KB y el metabolismo de la glucosa fue estrictamente aerobio. A partir de estas características se identificó dentro del grupo fluorescente del género Pseudomonas; de acuerdo con el esquema determinativo de Lelliott y col. (1966) se ubicó en el grupo de especies del género Pseudomonas que no son fitopatogénicas ni necrogénicas.
La identificación hasta el nivel de especie se basó en la ausencia de hidrólisis de la gelatina y de la actividad de la enzima desaminasa de triptófano según la clave dicotómica de Bossis (2000). Además, se comparó la utilización de diversos sustratos nutricionales de acuerdo con el perfil del kit API 20 NE (bioMérieux) para la cepa de referencia Pseudomonas putida ATCC 27853. A partir de los resultados de estas pruebas se identificó la cepa 14A como Pseudomonas putida.
Pseudomonas putida es una bacteria presente frecuentemente en el agua, los suelos y especialmente en la rizosfera de las plantas. Se han aislado cepas de esta especie que favorecen el crecimiento de las plantas y que están implicadas en la supresión natural de varias enfermedades mostrada por ciertos suelos (Weller, 2007).
Se observó que la temperatura óptima de crecimiento osciló entre 25° C - 35° C para la mayoría de los microorganismos en estudio. Este rango se considera óptimo para la mayoría de las bacterias de vida libre y permite su clasificación como mesófilos.
Las cepas Bacillus subtilis F16/95 y Xph y Pseudomonas putida 14A crecieron adecuadamente a 30° C, valor muy cercano a la temperatura utilizada para el aislamiento, por lo cual se seleccionó esta temperatura para el crecimiento de las rizobacterias en las pruebas.
Prueba de producción de antibiocinas por rizobacterias
Las cepas F16/95 y Xph de Bacillus subtilis mostraron halos de inhibición de ambas cepas de bacterias fitopatógenas en los tres medios de cultivo ensayados, mientras la cepa Pseudomonas putida 14A solo inhibió el crecimiento de las bacterias fitopatógenas en el medio KB (Tabla II).
Tabla 2. Inhibición de Xanthomonas cucurbitae y Acidovorax avenae subsp. citrulli por las cepas antagonistas en diferentes medios de cultivos.
La actividad antibacteriana in vitro de Bacillus subtilis cepas F16/95 y Xph, y de Pseudomonas putida 14A en el medio KB limitado en hierro, sugiere que su modo de acción está basado en la producción de sideróforos, compuestos capaces de formar quelatos con el hierro y transportarlo así al interior de la célula (Duijff y col., 1993; Leong y col., 1996). De esta manera los microorganismos antagonistas fijan el hierro y lo tornan menos disponible a otros incapaces de producir agentes similares de transporte del mineral (Neilands, 1986; Buysens y col., 1996).
La producción de sideróforos por cepas de Pseudomonas putida y P. fluorescens ha sido ampliamente estudiada (Kloepper y col., 1980; Barton y Hemming, 1993; Xie y col., 2006). También se ha informado acerca de cepas de Bacillus subtilis que muestran esta capacidad (Grossman y col., 1993).
Las cepas Bacillus subtilis F16/95 y Xph inhibieron el crecimiento de las bacterias fitopatógenas también en los medios AN y KB + Fe+3, lo cual sugiere otro modo de acción diferente a la competencia por el hierro. En el caso de la inhibición en el medio KB suplementado con hierro, se ha demostrado que el incremento de la concentración de hierro en el medio incrementa a su vez la producción de metabolitos secundarios o antibióticos (Dunne y col., 1996).
La observación de la interacción in vitro entre B. subtilis cepas F16/95 y Xph y los hongos fitopatógenos ensayados, no evidenció la degradación del micelio al microscopio estereoscopio, ni la lisis de las hifas mediante el microscopio óptico. Este resultado descarta el parasitismo como modo de acción, ya que éste se refiere a la capacidad de las bacterias para degradar la pared celular de las esporas fungosas, pasando así los nutrientes del hongo fitopatógeno a la bacteria, lo cual provoca la inhibición del crecimiento fungoso (Pleban y col., 1997).
La antibiosis puede explicar el efecto inhibitorio de ambas cepas antagonistas sobre bacterias y hongos fitopatógenos en los medios de cultivo que se ensayaron, s i se toma en consideración que Bacillus subtilis es uno de los mayores productores de antibióticos del género, entre los cuales se incluyen compuestos lipopolipéptidos cíclicos tales como las iturinas que permiten la competencia de B. subtilis frente a otros organismos, bien matándolos o reduciendo su tasa de crecimiento (Romero y col., 2007).
La cepa Pseudomonas putida 14A no desplegó in vitro el mecanismo de antibiosis, aunque fenazinas, floroglucinol, pirrolnitrina y pioluterina son los cuatro antibióticos más comunes producidos por especies de Pseudomonas como agentes de biocontrol (Weller, 2007).
El proceso aplicado en esta investigación para la selección de rizobacterias antagonistas se ajusta a las contribuciones iniciales en el desarrollo de agentes de control biológico; sin embargo, las tendencias actuales comprenden el mayor uso de procesos biorracionales de selección para identificar microorganismos con potencial para ejercer el control biológico, el desarrollo de sistemas de ensayo y bioensayo de alto rendimiento que facilite la selección de cepas superiores, así como la aplicación de técnicas de biología molecular para la identificación.
Como continuidad de la selección de potenciales antagonistas in vitro, resulta pertinente la realización de experimentos in vivo con las cepas antagonistas Bacillus subtilis F16/95 y Xph y Pseudomonas putida 14A, de manera que se permita el despliegue de los mecanismos de control biológico mediante los cuales las rizobacterias pueden promover indirectamente el crecimiento de las plantas (Lugtenberg y Kamilova, 2009).
Conclusiones
Se aislaron siete colonias bacterianas que mostraron halos de inhibición in vitro frente a cepas de Xanthomonas cucurbitae cepa 1408/00 y se seleccionaron como potenciales antagonistas.
Las cepas de rizobacterias caracterizadas como bacilos Gram positivos esporulados mostraron antagonismo in vitro frente a las cepas de hongos y bacterias fitopatógenos ensayados, mientras las cepas de rizobacterias Gram negativas no esporuladas mostraron efecto antagónico solo frente a bacterias fitopatógenas.
Se identificaron las cepas F16/95 y Xph como Bacillus subtilis y la cepa 14A se identificó como Pseudomonas putida..
Las cepas de F16/95 y Xph de Bacillus subtilis inhibieron el crecimiento de X. cucurbitae 1408/00, A. a. subsp. citrulli 672/01 y F. oxysporum en los tres medios ensayados y presuntamente despliegan modos de acción in vitro combinados por antibiosis y competencia por el hierro mediante la producción de sideróforos.
La cepa Pseudomonas putida 14A inhibió el crecimiento de las bacterias fitopatógenas en el medio limitado en hierro y presuntamente despliega in vitro la competencia por el hierro mediante la producción de sideróforos.
Recomendaciones
- Desarrollar experimentos in vivo mediante la bacterización de semillas de cucurbitáceas con las cepas antagonistas Bacillus subtilis F16/95 y Xph y Pseudomonas putida 14A que permitan el despliegue de los mecanismos de control biológico de las enfermedades Mancha bacteriana de las cucurbitáceas causada por Xanthomonas cucurbitae, Mancha bacteriana del fruto provocada por Acidovorax avenae subsp. citrulli y Marchitez provocada por Fusarium oxysporum.
- Incrementar la selección de cepas antagonistas como potenciales agentes de control biológico de enfermedades de las cucurbitáceas.
Bibliografía
1. Barton, L. L., Hemming, B. C. (1993). Iron Chelation in Plants and Soil Microorganisms. San Diego, CA: Academic Press.
2. Benhamou, N., Gagné, S., Le Quéré, D. & Dehbi, L. (2000). Bacterial-mediated induced resistance in cucumber: beneficial effect of the endophytic bacterium Serratia plymuthica on the protection against infection by Pythium ultimum. Phytopathology 90, 45–56.
3. Bossis, E., Lemanceau, P., Latour, X., Gardan, L. (2000).The taxonomy of Pseudomonas fluorescens and Pseudomonas putida: Current status and need for revision. Agronomie 20:51-63.
4. Brock, T., Madigan, M. (1991). Principles of Microbial Ecology. In: Biology of Microorganisms p.659. 6th Ed. Prentice Hall: Englewood Cliffs, NJ.
5. Burr, T. J., Schroth, M.N. & Suslow, T. (1978). Increased potato yields by treatment of seed pieces with specific strains of Pseudomonas. Phytopathology 72:199-206.
6. Buysens, S., Heungens, K., Poppe J. & Höfte M. (1996). Involvement of pyochelin and pyoverdin in suppression of Pythium-induced damping-off of tomato by Pseudomonas aeruginosa 7NSK2 Applied and Environmental Microbiology 62, 865– 871
7. Claus, D., Berkeley, R.C.W. (1986).Genus Bacillus [A] In Bergey's Manual of Systematic Bacteriology, Vol.2 [C], p. 1105-1139. Williams and Wilkins: Baltimore, MD.
8. Cook, R. J., Baker, K. J. (1983). The Nature and Practice of Biological Control of Plant Pathogens. APS Press: St. Paul, MN
9. Da Luz, W. C. (1993). Controle microbiológico do mal-do-pé do trigo pelo tratamento de sementes. Fitopatol. Bras 18:82-85.
10. Digat, B. & Gardan, L. (1987). Caracterización, variabilidad y selección de las cepas benéficas de Pseudomonas fluorescens y P. putida. Bulletin OEPP/EPPO Bulletin 17:559-568.
11. Duijff, B. J., Bakker, P. A. H. M. & Schipper, B. (1993). Siderophore-mediated competition for iron and induced resistance in the suppression of Fusarium wilt of carnation by fluorescent Pseudomonas spp. Netherlands Journal of Plant Pathology 99, 277–289.
12. Duijff, B. J., (1998). Implication of systemic induced resistance in the suppression of Fusarium wilt of tomato by Pseudomonas fluorescens WCS417r and by nonpathogenic Fusarium oxysporum Fo47. European Journal of Plant Pathology 104, 903–910.
13. Dunne, C., Delanny, I.; Fenton; A., O´Gara, F. (1996). Mechanisms involved in biocontrol by microbial inoculants. Agronomie 16:721-729.
14. Egel, D.S., Martyn, R.D. (2007). Fusarium wilt of watermelon and other cucurbits. The Plant Health Instructor DOI: 10.1094/PHI-I-2007-0122-01. Disponible en http://www.apsnet.org/edcenter/intropp/lessons/fungi/ascomycetes/Pages/Fusar iumWatermelon.aspx [Consulta 3 de diciembre 2011].
15. Fravel, D.R. (2005). Commercialization and implementation of biocontrol. Annual Review of Phytopathology 43: 337-359
16. Grossman, T. H., Tuckman, M., Ellestad, S. & Osburne, M. S. (1993). Isolation and characterization of Bacillus subtilis genes involved in siderophore biosynthesis: Relationship between B.subtilis sfp and Escherichia coli entD genes. J. Bacteriol. 175:6203-6211.
17. Harrigan, W. F. y McCance, M. (1968). Métodos de laboratorio de Microbiología. Academia: León, España.
18. Hebbard, K.P., Davey, A.G., Merrin, J., McLaughlin, T.J. & Dart, J.P. (1992). Rhizobacteria of maize antagonistic to Fusarium moniliforme, a soil-borne fungal pathogen: colonization of rhizosphere and roots. Soil Biol. Biochem. 24:989-97.
19. Jiménez-Díaz, R. M., Navas, J. A., Hervás, A., Vargas, B. B., Landa, M. M., Jiménez, J., Bejarano, D., Rodríguez, Y. E. y Pérez, A. (2000). Implicaciones del control de enfermedades en la agricultura sostenible. Phytoma 116: 26-38.
20. Kajimura, Y., Sugiyama, M. & Kaneda, M. (1995). Bacillopeptins, new cyclic lipopeptide antibiotics from Bacillus subtilis FR-2 Journal of Antibiotics 48:1095-1103.
21. Klement, Z., Farkas, G.L. & Lovrekovich, L. (1964). Hypersensitive reaction induced by phytopathogenic bacteria in the tobacco leaf. Phytopathology 54: 474-477.
22. Kloepper, J.W., Schroth, M.N. (1978). Plant growth promoting rhizobacteria on radish. In: Proc. 4th Int. Conf. Plant Pathogenic Bacteria, vol. 2 p.879-882. (Ed). Station de Pathologie Végétale y Phytobacteriologie INRA. France.
23. Kloepper, J.W., Leong, J., Teintze, M., Schroth, M.N. (1980). Pseudomonas siderophores: a mechanism explaining disease-suppressive soils. Curr. Microbiol. 4:317-320.
24. Kloepper, J.W., Schroth, M. N. (1981). Relationship of in vitro antibiosis of plant growth-promoting rhizobacteria to plant growth and the displacement of root microflora. Phytopathology 71: 1020-1024
25 Krauss, U. (1999). Pre-screening of biocontrol agents. In Workshop manual. Research methodology in biocontrol of plant diseases: with special reference to fungal diseases of cocoa, p. 55-62. U. Krauss; P. Hebbar (Eds.). Turrialba, CR, CATIE, USDA, CABI Bioscience
26 Larson, B. C., Mossier, M.A. & Nesheim, O.N. (1999). Profile: Watermelon Florida Crop/Pest Management. Disponible en http://edis.at.ufl.edu/pdffiles/PI/PI03100.pdf. [Consulta 3 de diciembre 2011].
27 Lelliott, R. A., Billing, E.; & Hayward, A. C. /1966).A determinative scheme for the fluorescent plant pathogenic Pseudomonas.. J. Appl. Bacteriol. 29:470-489.
28. Leong, J., Bitter, W., Koster, M., Marugg, J. D. & Weisbeck, P.J. (1996). Genetics of iron transport in plant growth promoting Pseudomonas putida WSC358. Betsville Symposia in Agricultural Research. The rhizosphere and growth, (Ed.) Keiter, D.L and Gregan, P.B. 14:217-275.
29. Liao, C.H. (1989). Antagonism of Pseudomonas putida strain PP 22 to phytopathogenic bacteria and its potential as biocontrol agent. Plant Disease 73:223-226.
30. Liu, L., Kloepper, J.W. & Tuzun, S. (1995). Induction of systemic resistance in cucumber against bacterial angular leaf spot by plant growth-promoting rhizobacteria. Phytopathology 85: 843 -847.
31. Lugtenberg B., Kamilova, F. (2009). Plant-Growth-Promoting Rhizobacteria. Annual Review of Microbiology, 63: 541-556
32. Lyon, R.S., Riedel, R.M. Surface sterilization of gourd (Cucurbita pepo) seed for control of bacterial fruit spot (Xanthomonas campestris pv. cucurbitae). Disponible en http://www.ag.ohiostate.edu/~vegnet/library/librimg/gourd.htm [Consulta 3 enero 2005].
33. McSpadden Gardener, B.B., Fravel, D.R. (2002). Biological control of plant pathogens: Research, commercialization, and application in the USA. Disponible en http://dx.doi.org/doi:10.1094/PHP-2002- 0510-01-RV. [Consulta 3 de diciembre 2011].
34. Moffett, M. L., Wood, B. (1979). Seed treatment for bacterial spot of pumpkin. Plant Disease Reporter 63:537-539.
35. Mora-Umaña, F. y Araya, C. M. (2002). Mancha bacteriana del fruto de melón y sandía: Manejo integrado de una emergencia. Manejo Integrado de Plagas y Agroecología (Costa Rica) 66:101-104.
36. Neilands, J.B. (1981). Microbial iron compounds. Annu. Rev. Bioch. 50:715-731.
37. Ongena, M. T., Duijff, F., Jacques, P., Thonart, P., Benhamou, N., Paulitz, T.C.,
38. Cornelis, P., Koedam, N. & Belanger, R.R. (1999). Protection of cucumber against Pythium root rot by fluorescent pseudomonads: predominant role of inducedresistance over siderophores and antibiosis. Plant Pathology 48:66–76.
39. Özdemir, Z., Zitter, T.A. (2003). Evaluation of chemical seed treatments to eliminate Xanthomonas cucurbitae from naturally infected pumpkin seeds. Disponible en http://www.apsnet.org/members/divisions/ne/meetings/Pages/2002MeetingAbstr acts.aspx [Consulta: 18 de septiembre 2011]
40. Pleban, S., Chernin, L., & Chet, I. (1997). Chitinolytic activity of an endophytic strain of Bacillus cereus. Letters in Applied Microbiology 25: 284–288.
41. Rollins, D.M. (2000). Basic Mechanisms of Antibiotic Action and Resistance. Disponible en http://www. life.umd. edu/classroom/bsci424lindex.html. [Consulta 12 de diciembre 2011]
42. Romero D, de Vicente A, Rakotoaly RH, Dufour, S.E., Veening, J.W., Arrebola, E., Cazorla, F. M., Kuipers, O. P., Paquot, M. y Pérez-García, A. (2007). The iturin and fengycin families of lipopeptides are key factors in antagonism of Bacillus subtilis toward Podosphaera fusca. Mol Plant Microbe Interact. 20 (4):430-40
43. Santos, E. R., Gouveia, E. R., Mariano, R. L. R. y Souto-Maior, A. M. 2006. Controle biológico da mancha-aquosa do melão por compostos bioativos produzidos por Bacillus spp. Summa Phytopathologica, 32(4): 376.
44. Schaad, N.W., Postnikova, E. & Parm, R. (2001). Emergence of Acidovorax avenae subsp. citrulli as a crop threatening disease of watermelon and melon. Disponible en http://www.nal.usda.gov/ttic/tektran/new2001-11-05.html [Consulta 2 de diciembre. 2011].
45. Stanier, R. Y., Palleroni, N.J. & Douderoff, M. (1966). The aerobic pseudomonads: a taxonomy study. J. Gen. Microbiol. 43:159-271.
46. Walker, R., Powell, A.A. & Seddon, B. (1998). Bacillus isolates from the spermosphere of peas and dwarf French beans with antifungal activity against Botrytis cinerea and Pythium species. J. App. Microbiol 84:791-801.
47. Weller, D.M. (2007). Pseudomonas biocontrol agents of soilborne pathogens: Looking back over 30 years. Phytopathology 97:250-256.
48. Whipps, J.M. (1997). Developments in biological control of soilborne plant pathogens. Adv. Bot. Res.26:1-134
49. Whipps, J.M. (2001). Microbial Interactions and Biocontrol in the Rhizophere. J Exp Bot 52:487–511
50. Xie, X., Wang, J., Yuan, H. (2006). High-resolution analysis of catechol-type siderophores using polyamide thin layer chromatography. J. Microbiol. Methods, 67: 390-393.
51. Yadegari M, Rahmani HA, Noormohammadi G, Ayneband, A. (2008). Evaluation of bean (Phaseolus vulgaris) seeds inoculation with Rhizobium phaseoli and plant growth promoting rhizobacteria on yield and yield components. Pak J Biol Sci.; 11(15):1935-9.
52. Zitter, T.A. (1999). Fusarium of melon, a worldwide problem in temperate and tropical regions. Disponible en http://www.actahort.org/members/showpdf?booknrarnr=492_18 [Consulta: 18 de septiembre 2011].
 a Promedio de tres réplicas
a Promedio de tres réplicas a Promedio de tres réplicas
a Promedio de tres réplicas