Salud intestinal, uso prudente de antibióticos y herramientas alternativas a los antimicrobianos en las granjas
Publicado: 21 de marzo de 2012
Por: Ignacio Badiola Sáiz CReSA (UAB-IRTA), España
Introducción
El descubrimiento de los antibióticos supuso un gran avance en la salud humana y animal al poder controlar ciertos procesos infecciosos que, con anterioridad a dicho descubrimiento, sólo eran controlados por el sistema inmunitario.
Es importante no olvidar esta capacidad de control de procesos infecciosos, por parte de los antibióticos, pues si nos vemos obligados, por causas legales (prohibición de uso) o por causas biológicas (Baparición de resistencias), a prescindir de estas herramientas, se puede producir un empeoramiento de las condiciones sanitarias que nos rodean y, por lo tanto, un mayor riesgo de infecciones de origen ambiental o alimentario.
Es importante no olvidar esta capacidad de control de procesos infecciosos, por parte de los antibióticos, pues si nos vemos obligados, por causas legales (prohibición de uso) o por causas biológicas (Baparición de resistencias), a prescindir de estas herramientas, se puede producir un empeoramiento de las condiciones sanitarias que nos rodean y, por lo tanto, un mayor riesgo de infecciones de origen ambiental o alimentario.
Muchos países de la UE apuntan que se ha abusado, en muchas ocasiones, de los antibióticos y que su uso entraña el peligro de selección de cepas resistentes. Este peligro es el que necesita ser cuantificado mediante los necesarios estudios de valoración del riesgo.
Como consecuencia negativa adicional a los buenos resultados obtenidos con el uso de antimicrobianos, durante los últimos años no se han realizado los esfuerzos necesarios para profundizar en el desarrollo de inmunoprofilácticos contra bacterias y parásitos o en el desarrollo de otras mediadas de control, como probióticos y prebióticos.
Como consecuencia negativa adicional a los buenos resultados obtenidos con el uso de antimicrobianos, durante los últimos años no se han realizado los esfuerzos necesarios para profundizar en el desarrollo de inmunoprofilácticos contra bacterias y parásitos o en el desarrollo de otras mediadas de control, como probióticos y prebióticos.
Adicionalmente, en Europa, a la problemática del uso incorrecto de antimicrobianos, se han añadido otros conceptos como el tipo de explotación, manejo o bienestar de los animales, en el sentido de una cierta imposición de métodos por parte de los países nórdicos, sin contemplar que las condiciones climáticas, o de explotación, son marcadamente diferentes a las de los países del sur.
Frente a la avalancha de críticas al uso de antibióticos en la producción animal, se debe argumentar, sin ningún tipo de complejos, que los animales también necesitan ser medicados para asegurar su bienestar y que un animal sano es, en último extremo, una garantía para el consumidor.
El sistema de registro en la UE
El sistema de registro de productos en la UE funciona sobre la base de estrictos criterios científicos de seguridad, calidad y eficacia.
El apartado de seguridad debe abarcar los factores relacionados con el animal (toxicidad aguda o crónica), los operadores (en la fase de producción y de utilización), el impacto en el medio ambiente (del producto o de las excretas de los animales) y, en el caso de los animales de producción, el consumidor (MRLs y periodos de retirada).
La calidad de un principio activo es un componente esencial de su seguridad, por lo que el sistema de registro exige que su producción se haga de acuerdo con rigurosos criterios de pureza y reproducibilidad. La empresa farmacéutica debe garantizar que un producto contenga los ingredientes que figuran en la documentación aportada, ni más ni menos, y en las proporciones indicadas.
Por último, en cuanto a eficacia, los datos aportados por la empresa farmacéutica deben probar que el producto, suministrado según la pauta especificada, es eficaz para tratar o prevenir una determinada enfermedad. En este sistema se exige a las empresas farmacéuticas el aporte de un enorme volumen de información que comprende desde características físico-químicas de las moléculas, hasta estudios de campo, realizados en varios países europeos, pasando por estudios de toxicidad, farmacocinética, residuos/determinación de los periodos de retirada, métodos de fabricación, presentaciones ... Todo este conjunto de información y pruebas es analizado por grupos de expertos independientes que, tras un análisis riguroso, aceptan o rechazan la introducción del nuevo principio activo, así como las prescripciones de uso (dosis, vías de administración, especies animales a las que va destinada, espectro de acción y periodos de retirada).
Hasta hace pocos años, los análisis de riesgo sobre resistencias no estaban contemplados como parte de la información necesaria para el registro, aunque algunas empresas realizaban estudios dirigidos a comprobar la tasa de aparición de resistencias en los microorganismos diana. No obstante, se ha visto que los estudios de análisis de riesgo, tanto en condiciones experimentales como en condiciones de campo, son muy importantes para poder aclarar, con datos fiables, el papel que un determinado principio activo pueda jugar en la aparición de microorganismos resistentes, tanto entre los microorganismos diana como entre los microorganismos no directamente relacionados. Con este tipo de valoraciones se podrá argumentar, de una forma científica y no meramente política o comercial, la posible retirada de ciertos productos o se podrá recomendar ciertos cambios en su modo de utilización.
El sistema de registro no es un sistema cerrado, ya que toda la información derivada del uso en campo, así como nuevas reclamaciones derivadas de estudios posteriores, engruesan la documentación y pueden permitir cambios sustanciales en el uso e indicaciones del preparado.
Peligro y riesgo
Aunque muchas veces estos dos conceptos son aplicados de forma indistinta, la diferencia entre ellos no es sólo semántica.
Así, el término peligro se aplica para indicar que un determinado suceso, no deseado, es posible. Mientras que el término riesgo implica la cuantificación de un peligro, es decir la probabilidad de que un determinado suceso indeseable tenga lugar.
Un ejemplo, que creo suficientemente aclaratorio para distinguir entre ambos conceptos, fue expuesto en una reunión en Bruselas por el Dr. Mackinnon, y que adaptado a nuestro país pudiera quedar así: El hacer un viaje en coche implica siempre un posibilidad de accidente (peligro), pero la probabilidad de sufrir un accidente grave con un coche de gama baja es mayor (alto riesgo) que la de sufrir un accidente grave con un BMW (bajo riesgo).
Como puede entresacarse del ejemplo, es importante no confundir ambos conceptos, y fundamentalmente no confundir a terceros, pues aunque pudiera estarse de acuerdo con una argumentación genérica de peligro, la verdadera naturaleza del mismo sólo sería resuelta tras su valoración.
Es más, a la simple argumentación de peligro en relación a la utilización de antibióticos puede argumentarse también el peligro de su no utilización, un empate técnico que sólo puede resolverse aportando los datos necesarios sobre el análisis de riesgos.
Análisis de riesgos
Generalmente el nivel de riesgo “0” no existe, aunque muchas veces se exige por presiones sociales o políticas. Por ello, en un análisis de riesgos, sobre cualquier principio activo, deberían sopesarse los potenciales beneficios y los potenciales riesgos de su utilización.
De haberse exigido niveles de riesgo “0” a la hora de registrar uno de los fármacos más utilizados en la actualidad, el ácido acetil salicílico, no se contaría con un principio activo cuyos beneficios van más allá de su poder analgésico (v.g. antiagregante plaquetario).
El principal problema que, en el momento actual, se tiene a la hora de planificar un estudio de análisis de riesgos, radica en la falta de una normativa clara que indique el tipo de pruebas a realizar y los parámetros a tener en cuenta. Estando claro, solamente, que deben incluirse estudios sobre los microorganismos diana, tanto en condiciones experimentales como de campo. Otros estudios propuestos para un valoración del riesgo se centrarían en el análisis del grado de resistencia de la flora intestinal en el caso de administración oral del producto, que por otro lado es la más habitual en el tratamiento de colectividades. En este caso se está proponiendo el estudio adicional de bacterias trazadoras representantes de la flora Gram-negativa (Escherichia coli) y de la flora Gram-positiva (Enterococos), con la posible ampliación a bacterias anaerobias (Clostridium spp. o Lactobacillus spp.).
Aun por aclarar está el punto de si debe hacerse distinción entre animales clínicamente sanos y animales clínicamente enfermos. Este punto puede ser muy importante ya que los animales con estadios clínicos avanzados suelen recibir dosis menores del antimicrobiano, al disminuir el consumo de agua o de pienso, pudiendo representar un factor de alto riesgo para la aparición de cepas resistentes que pueden infectar horizontalmente a animales correctamente tratados. Este tipo de ensayos pueden obligar a reconducir las pautas de medicación o a planificar intervenciones preclínicas con antimicrobianos, “prevenir es mejor que curar”.
Otro punto oscuro en la actualidad es si pueden plantearse modelos in vitro que permitan alcanzar resultados paralelos a los obtenidos en estudios in vivo. Este tipo de análisis podría permitir un mayor control de ciertos parámetros y podría reducir el número de animales a utilizar en los estudios de campo, así como disminuir el coste de dichas pruebas. En referencia a la posible introducción de modelos de estudio in vitro, a corto y medio plazo son necesarios importantes esfuerzos de I+D sobre los objetivos definidos por las autoridades encargadas del registro, por la industria farmacéutica y por los grupos de innovación tecnológica.
Monitorización
Tan importantes como los análisis de riesgo a nivel de experimentos controlados, son los seguimientos que deben hacerse, tras la puesta en el mercado, de los productos que han recibido el visto bueno para su comercialización.
Estos seguimientos reciben el nombre genérico de monitorización y pueden distinguirse dos subcategorías: la fármaco-vigilancia y la monitorización de resistencias.
La fármaco-vigilancia tiene como objetivo el analizar cualquier reacción adversa que pudiera estar ligada al uso de un determinado principio activo y obedece a que, no todas las posibles circunstancias de uso, han estado contempladas en las diferentes pruebas realizadas para el registro.
Los casos de posibles reacciones adversas deben reflejarse por escrito y pasar a formar parte de la documentación del producto.
De esta monitorización pueden resultar nuevas recomendaciones sobre el uso del producto, que pueden ir desde la incompatibilidad con otros preparados, farmacológicos o biológicos, hasta el descubrimiento de incompatibilidades con determinadas aguas de bebida o determinados componentes de ciertos piensos. Además, de la fármaco-vigilancia puede derivarse información que obligue a modificar la pauta de medicación, en animales de ciertas edades o circunstancias de explotación, así como la recomendación de retirada de un determinado producto.
Generalmente es la misma empresa, productora del principio activo, la que se encarga de la monitorización de reacciones adversas. No obstante esta vigilancia no se hace sistemáticamente, pues son escasas las empresas que cuentan con un departamento exclusivo de fármaco-vigilancia, y se actúa básicamente ante evidentes quejas del granjero o del veterinario responsable de la explotación.
Este tipo de monitorización debe contemplarse como un apartado más del control de calidad de producto y no como una acción fiscalizadora aunque, para la gerencia de cualquier compañía, el departamento de control de calidad siempre juega el papel de fiscal. En el caso de antimicrobianos, además de la monitorización de efectos adversos, debe hacerse una monitorización del grado de efectividad del producto contra las enfermedades reivindicadas a en el registro.
Este seguimiento debería abordarse desde dos vertientes, por un lado el estudio en profundidad de los casos en los que se haya producido un claro resultado negativo tras la medicación y, por otro, el seguimiento del porcentaje de cepas resistentes al antimicrobiano de cepas aisladas de campo, de forma aleatoria.
En el primero de los casos, el objetivo primordial es conocer si el fallo en la medicación es atribuible a manejo inadecuado, fallo en la dosificación, momento de intervención, incompatibilidad con otros principios o, por contra, es atribuible directamente al producto. En el caso de que el fallo sea atribuible al producto, es importante discernir si puede haberse producido un problema puntual en un determinado lote de producción, problemas en el control de calidad o si el fallo se debe a la presencia de cepas resistentes al principio activo.
En este último caso es importante analizar si la resistencia está ligada a genes de resistencia, que pueden ser transferidos a otros microorganismos, o si la resistencia está ligada a un aumento en la capacidad bacteriana de bombeo hacia el exterior del quimioterápico o a una disminución en la permeabilidad.
El seguimiento del grado de resistencias en cepas aisladas aleatoriamente de campo, tanto de casos clínicos como preclínicos, aporta una información muy necesaria tanto para la empresa productora como para el veterinario clínico. Con la disponibilidad de esta información se pueden llegar a establecer pautas de utilización, del arsenal de antimicrobianos disponible, mucho más racionales y efectivas que en la actualidad.
Sería interesante la creación de bases de datos, en tiempo real, sobre los resultados de estudios de monitorización de resistencias, algo que se está iniciando en sanidad humana y que aún no ha sido planteado seria y sistemáticamente en sanidad veterinaria.
Uso prudente de antimicrobianos
De las discusiones habidas en la Conferencia Científica Europea sobre el Uso de Antibióticos en Animales, celebrada el mes de Marzo de 1999 en París, se acordó que el término “prudente” puede ser intercambiado por “juicioso” o “responsable”. Con estas diferentes acepciones, queda suficientemente claro cuál debe ser el principio que debe regular la utilización de los antimicrobianos en el próximo futuro: la prescripción de antimicrobianos debe hacerse bajo la supervisión de un profesional dotado de los conocimientos necesarios y un sólido criterio, dicho profesional será el último responsable de la utilización correcta del producto. En esta Conferencia quedó claro también que la responsabilidad debe ser definida, mediante la elaboración de guías, y que el uso debe estar abierto a la auditoría externa (independiente).
El establecimiento de guías sobre el uso prudente de antimicrobianos necesita que se tenga en cuenta que:
1. Los sistemas de producción animal incluyen grupos numerosos de animales, generalmente de la misma edad y status inmunitario, que comparten un espacio aéreo común y que fácilmente entran en contacto con las excretas de otros animales.
2. Es importante contar con buenas instalaciones y con un buen manejo para poder instaurar buenas estrategias terapéuticas para controlar enfermedades infecciosas.
3. El uso prudente no debe ser tan restrictivo que comprometa el bienestar animal.
4. El uso de antimicrobianos debe aportar beneficios claros y, por lo tanto, debe basarse en un diagnóstico lo más exacto posible. Para ello es indispensable que el veterinario tenga un perfecto conocimiento del perfil sanitario de los animales a tratar y/o que pueda hacerse un estudio de identificación del agente y de su grado de sensibilidad in vitro. También es importante que se disponga de conocimientos sobre el perfil sanitario del área geográfica donde se encuentra localizada la granja.
5. Para evitar en lo posible la diseminación de posibles resistencias deben adoptarse las medidas higiénico-sanitarias oportunas. En el caso de los animales de producción, todos los sectores de la industria deben cumplir con su papel correspondiente.
6. Hay importantes diferencias nacionales, regionales o entre granjas en relación a los perfiles de enfermedad. Estas diferencias obedecen a variaciones en el serotipo o el grado de virulencia de las cepas, en el manejo, en los programas de vacunación y en el tipo de antimicrobianos usados. Por ello es difícil diseñar unas guías universales, debiéndose implementar guías nacionales, o regionales, por especie.
7. El uso prudente no debe implicar una restricción tal que favorezca la aparición de un mercado negro de antimicrobianos o de productos no registrados.
8. Es importante fomentar la formación continuada de los veterinarios con asistencias a cursos, congresos y conferencias.
El uso prudente de antimicrobianos ha de ser un componente esencial del manual de Buenas Prácticas en Veterinaria, marco en el que se debe centrar la actuación de todo profesional. En este hipotético manual, en el apartado correspondiente a antimicrobianos deberían incluirse los puntos siguientes:
1. Los antimicrobianos deben usarse para el tratamiento de infecciones, primarias o secundarias, de bacterias o parásitos.
2. La utilización de los antimicrobianos debe hacerse bajo la dirección y supervisión de un veterinario.
3. Deben realizarse los máximos esfuerzos para llegar al diagnóstico correcto. Este puede incluir estudios de laboratorio y, especialmente, el aislamiento del patógeno y la valoración del grado de sensibilidad.
4. Debe elegirse la ruta de administración más apropiada, poniendo especial atención en los animales enfermos.
5. El uso prolongado de antimicrobianos orales genera resistencias, en la flora intestinal, con más frecuencia que la administración parenteral del principio activo. No obstante, la administración parenteral en muchos sistemas de
producción, así como en muchas condiciones nosológicas, es prácticamente imposible.
producción, así como en muchas condiciones nosológicas, es prácticamente imposible.
6. Cuando se use un antimicrobiano, éste debe tener el apropiado espectro de actividad, debe calcularse la dosis más adecuada y su empleo debe prolongarse sólo durante el tiempo necesario.
7. No deben nunca descuidarse los aspectos básicos de manejo, higiene, alimentación y, cuando sean posibles, medidas de inmunoprofilaxis.
8. La utilización de antimicrobianos debe documentase apropiadamente y las cantidades usadas deben concordar con las cantidades prescritas.
9. Siempre que sea posible, los antimicrobianos deben usarse dentro de los márgenes expresados en el registro. Debiéndose restringir el uso fuera de estos márgenes a situaciones extremas en las que no se disponga de otro
producto eficaz; en este caso el veterinario responsable debe exponer, por escrito, las razones de empleo.
producto eficaz; en este caso el veterinario responsable debe exponer, por escrito, las razones de empleo.
10. El uso de promotores de crecimiento autorizados debe responder a criterios estrictos de buen manejo y no debe nunca enmascarar prácticas incorrectas. La utilización de antimicrobianos para el tratamiento de infecciones debe tener en cuenta la presencia de cualquier promotor de crecimiento en la dieta.
Todos los puntos anteriores deben servir como referencia del modus operandi y así poder continuar disponiendo, durante mucho tiempo, del potente arsenal de antimicrobianos indispensable para mantener los niveles de producción dentro de unos márgenes económicamente compatibles, así como garantizar el bienestar de los animales y la seguridad de los consumidores.
Salud intestinal y herramientas alternativas a los antimicrobianos
El intestino de los animales es un sistema complejo en el que, por un lado, se debe facilitar la entrada de los diferentes elementos necesarios para el mantenimiento del metabolismo del animal y, por otro lado, se debe mantener intacta la capacidad de contención de los factores agresivos que pueden comprometer la salud de los animales.
En este sistema, se ha establecido una simbiosis muy interesante entre el animal y una gran diversidad de microorganismos que participan tanto en el proceso de la digestión, como en el mantenimiento y maduración de las diferentes estructuras del intestino, en especial la mucosa intestinal y el sistema linfoide asociado a la mucosa intestinal. Además, algunos microorganismos son capaces de producir sustancias antibacterianas, en especial ácidos grasos volátiles y bacteriocinas que, junto con la capacidad de competir por ciertos sustratos o la de interaccionar con diferentes moléculas de adsorción, pueden permitir minimizar el riesgo de colonización por agentes con potencial patógeno o minimizar los efectos negativos de la infección por determinados patógenos.
En la producción porcina, los problemas infecciosos del sistema digestivo son una de las principales causas de pérdidas económicas, y su control, basado en la mayoría de casos en la utilización de antimicrobianos, está relacionado con el aumento del riesgo de aparición de resistencias que pueden comprometer tanto la terapéutica animal como la humana. Sin descartar, ni mucho menos, el uso de los antimicrobianos para el tratamiento de agentes patógenos, el favorecer poblaciones bacterianas con efecto “positivo” o el restablecer el equilibrio en la microbiota intestinal, roto por diferentes condiciones de estrés –cambio de alimentación, destete incluido, la reagrupación de animales de diferentes orígenes, los cambios bruscos de temperatura, fallos en los sistemas de suministro de agua o la entrada de diferentes patógenos—, son dos objetivos que, en los últimos años, se viene persiguiendo para ayudar a reducir la prevalencia y la severidad de diferentes infecciones intestinales.
Este interés por controlar de una forma más “fisiológica” los problemas infecciosos digestivos, choca con un importante desconocimiento de los componentes de la microbiota intestinal y, en especial, la definición de los componentes de lo que se debería considerar la microbiota implicada en la “salud intestinal”, un concepto totalmente confuso en la actualidad, y que probablemente debería utilizarse en plural, ya que dependiendo de la composición del pienso y del estatus fisiológico del animal, los perfiles de la microbiota intestinal asociados a salud, probablemente, deberían ser diferentes.
En diferentes estudios en los que ha participado nuestro grupo durante los últimos años, tanto en cerdos, como en aves o conejos, hemos podido observar cambios, en los perfiles de la microbiota intestinal, asociados a cambios en la formulación del pienso (cambios en la composición de materias primas, adición de enzimas, prebióticos…), a la edad de los animales o a la presencia de infecciones del tracto digestivo (Torrallardona et al., 2003; Badiola et al., 2004a y b; Nicodemus et al., 2004; Castillo et al., 2006a y b; Gomez-Conde et al., 2006; Andrés-Elias et al., 2007; Castillo et al., 2007; Chamorro et al., 2007; Gómez- Conde et al., 2007; Roca-Canudas et al., 2007; Torrallardona et al., 2007a y b; Gidenne et al., 2008; Gomez-Conde et al., 2009; Willamil et al., 2009; Chamorro et al., 2010).
En relación con el primer punto, los cambios en la formulación del pienso, la utilización de diferentes fuentes de hidratos de carbono, en especial la fuente de almidón y la fuente de polisacáridos no amiláceos (PNA), tienen una importante repercusión en los perfiles de la microbiota intestinal, así como en la predisposición a problemas infecciosos digestivos.
Los PNA solubles son hidratos de carbono altamente fermentables que aumentan la viscosidad de la digesta y disminuyen el contacto entre substratos y enzimas digestivos, lo que puede perjudicar el desarrollo de la microbiota digestiva natural. La fácil fermentación bacteriana de los PNA solubles sin digerir, favorece el crecimiento de diferentes componentes de la microbiota intestinal, que en algunos casos pueden ser beneficiosos y en otros casos pueden ser perjudiciales, en función del tipo y de la concentración que llegue a las porciones distales del intestino, así como de la especie animal, la edad y el estado del sistema inmunitario asociado a la mucosa intestinal. En general, un alto nivel de fracciones no digeridas será más perjudicial en aves que en cerdos, por las distintas características de viscosidad intestinal (unas 100 veces mayor en aves que en cerdos), y en animales jóvenes más que en animales adultos (Santomá y Pontes, 2005).
Como apuntan Pluske y cols. (2003), la fracción soluble de los polisacáridos no amiláceos puede provocar, en especial en aves, la formación de una digesta viscosa que reduce la digestibilidad de los nutrientes y su absorción. En cerdos, el aumento de la viscosidad reduce la velocidad de tránsito de la digesta a través del intestino delgado del cerdo, lo que proporcionaría más tiempo para que ciertos patógenos, como Escherichia coli, puedan proliferar.
En un estudio anterior, Pluske y cols. (1998) demostraron el efecto de la fuente de hidrato de carbono en la aparición o no de manifestaciones clínicas de disentería porcina. Estos autores encontraron una correlación directa entre la entrada de carbohidratos rápidamente fermentables al intestino grueso con la aparición de signos clínicos de disentería. En este estudio los cuadros de disentería, frecuentes en los animales alimentados con pienso formulado a base de arroz cocido y suplementado con polisacáridos no amiláceos solubles (goma de guar) o con almidón resistente (Novelose), desaparecían cuando la suplementación del pienso base se hizo con polisacáridos no amiláceos insolubles (cascarilla de avena).
El efecto positivo de inclusión de la cascarilla de avena, en piensos de lechones basados en arroz cocido o maíz cocido, sobre la incidencia de cuadros diarreicos, también ha sido observado en estudios realizados por Mateos y cols. (2006).
Por otro lado, ciertos oligosacáridos, ricos en fructosa, se han usado para aumentar selectivamente el número de Bifidobacterium spp. en el intestino grueso, incremento que se asocia a la inhibición de la colonización por ciertos patógenos (Gibson et al., 1995).
La colibacilosis postdestete es una enfermedad del intestino delgado producida por cepas de Escherichia coli enterotoxigénicas, caracterizada por la aparición de una diarrea hipersecretoria debidas a la liberación de enterotoxinas bacterianas específicas. En el intestino delgado, las fimbrias de Escherichia coli se unen a los receptores de glicoproteínas que se expresan en la membrana de las células que revisten las vellosidades intestinales. La fimbria más común asociada con la colibacilosis postdestete es la K88, también denominada F4. El receptor para K88 desaparece a las pocas semanas tras el destete, por lo que el periodo crítico de esta infección viene determinado por la expresión de dicho receptor. La colonización del intestino delgado y la diarrea generalmente tiene lugar entre los días 4 y 14 tras el destete (Bertschinger, 1999).
Los PNA, especialmente su fracción soluble, tienen un carácter antinutritivo en aves debido a su impacto negativo sobre la digestión y la absorción de nutrientes tales como el almidón, lípidos y proteína. No obstante, los mecanismos mediante los cuales los PNA empeoran la productividad en pollos de engorde no son conocidos (Mateos et al., 2002). La prevalencia y gravedad de lesiones compatibles con enteritis, especialmente en pollos de engorde, pueden disminuirse por la adición de diferentes enzimas, en especial los que favorecen la digestibilidad de los polisacáridos no amiláceos.
Tanto el tipo de cereal como la proteína presente en la dieta tienen un impacto directo sobre la proliferación y excreción de Escherichia coli hemolíticas en el tracto gastrointestinal de lechones (Pluske et al., 2003). Cuando la incidencia de desórdenes digestivos es alta, con blandeos en porcino y enteritis necrótica u otras enteritis en pollos, se recomienda reducir el nivel de proteína de la dieta y aumentar el uso de aminoácidos sintéticos (Mateos et al., 2002; Pérez y Gasa, 2002).
Se está prestando relativamente poca atención a la digestión y metabolismo de la proteína por las bacterias intestinales de los cerdos, en especial en relación con la colibacilosis. Se sabe que un grupo de bacterias entre las que se encuentran Bacteroides spp., Clostridium spp., Enterobacterium spp., Lactobacillus spp. y Streptococcus spp. poseen la habilidad de producir diaminas, tales como la putrescina, cadaverina, histamina y tiramina, por decarboxilación de ciertos aminoácidos (tirosina, triptófano y lisina) y ruptura de poliaminas (Gaskins, 2001). Porter y Kenworthy (1969), trabajando con lechones destetados de tres semanas de edad, comprobaron que la excreción urinaria de aminas estaba asociada a la diarrea postdestete, encontrando niveles más altos de putrescina y cadaverina.
Los metabolitos secundarios bacterianos resultantes de la fermentación de la proteína de la digesta son producidos en mayor cantidad en medio ácido, ácido que puede resultar de la rápida fermentación de polisacáridos no amiláceos solubles y, posiblemente, del almidón. Por lo tanto, podría existir interacción entre la concentración/tipo de la proteína y los polisacáridos no amiláceos con la etiopatogenia de la colibacilosis postdestete. A este
respecto, Aumaitre y cols. (1995) sugirieron que la adición apropiada de fuentes de PNA insolubles podría reducir los problemas de colibacilosis post-destete, y Bolduan y cols. (1988) comprobaron que la producción de diaminas en el colon se reducía linealmente con un incremento del contenido en fibra bruta del pienso para lechones destetados. En base a estos y otros trabajos, es posible esperar que diferentes fuentes de PNA puedan reducir la incidencia de colibacilosis post-destete para una concentración dada de proteína en la dieta.
respecto, Aumaitre y cols. (1995) sugirieron que la adición apropiada de fuentes de PNA insolubles podría reducir los problemas de colibacilosis post-destete, y Bolduan y cols. (1988) comprobaron que la producción de diaminas en el colon se reducía linealmente con un incremento del contenido en fibra bruta del pienso para lechones destetados. En base a estos y otros trabajos, es posible esperar que diferentes fuentes de PNA puedan reducir la incidencia de colibacilosis post-destete para una concentración dada de proteína en la dieta.
Actualmente nuestro grupo está analizando el efecto de la extrusión de cereales sobre diferentes parámetros del sistema digestivo asociados a salud intestinal.
Durante el proceso de extrusión, los productos, sometidos al efecto de altas temperaturas y altas presiones, sufren una expansión que provoca modificaciones en las cadenas de proteínas y almidón que las hace más vulnerables a los enzimas digestivos (tanto los propios del animal como los producidos por la microbiota intestinal), por lo que el producto, generalmente, se hace más digestible (Valls, 1993; Murray et al., 2001; Pérez-Navarrete et al., 2007).
Este aumento de la digestibilidad comporta cambios en el perfil de la microbiota intestinal, cambios que dependen del tipo de componente utilizado. Así, Durmic y cols. (2000), trabajando con piensos formulados a base de trigo o de sorgo, extrusionados o no, y suplementados o no suplementados con enzimas, observaron que la extrusión del trigo produjo una reducción de Lactobacillus en el intestino grueso, mientras que la extrusión del sorgo no produjo ese efecto. En el caso del sorgo, la extrusión, junto a la adición de enzimas causó un aumento significativo de anaerobios totales. Analizando especies bacterianas concretas, los autores encontraron que, en el caso del pienso con trigo no extrusionado, el 50% de las cepas aisladas del colon correspondieron a la especie Bacteroides gracilis, el 28% a Fusobacterium necrophorum, el 11% a Eubacterium aerofaciens, y el restanto a las especies Clostridium inocuum y Fusobacterium necrogenes; mientras que con el pienso formulado con trigo extrusionado, el 43% de las cepas aisladas del colon correspondieron a la especie Eubacterium aerofaciens, el 18% a Bacteroides gracilis, el 11% a Wolinella spp., y el resto a las especies Bacteroides uniformis, Fusobacterium necrophorum, Propionibacterium buccae,Porphyria gingivalis y Staphylococcus saccharolyticus. Adicionalmente, tras la infección experimental con Brachyspira hyodysenteriae, los autores encontraron una reducción del 50% en el número de animales con signos clínicos y lesiones compatibles con disentería, con el pienso formulado a base de trigo extrusionado, frente al pienso formulado con trigo no extrusionado, mientras que en el caso del sorgo el efecto de la extrusión sobre la clínica y las lesiones de disentería fue justo al contrario que en el caso del trigo.
Este aumento de la digestibilidad comporta cambios en el perfil de la microbiota intestinal, cambios que dependen del tipo de componente utilizado. Así, Durmic y cols. (2000), trabajando con piensos formulados a base de trigo o de sorgo, extrusionados o no, y suplementados o no suplementados con enzimas, observaron que la extrusión del trigo produjo una reducción de Lactobacillus en el intestino grueso, mientras que la extrusión del sorgo no produjo ese efecto. En el caso del sorgo, la extrusión, junto a la adición de enzimas causó un aumento significativo de anaerobios totales. Analizando especies bacterianas concretas, los autores encontraron que, en el caso del pienso con trigo no extrusionado, el 50% de las cepas aisladas del colon correspondieron a la especie Bacteroides gracilis, el 28% a Fusobacterium necrophorum, el 11% a Eubacterium aerofaciens, y el restanto a las especies Clostridium inocuum y Fusobacterium necrogenes; mientras que con el pienso formulado con trigo extrusionado, el 43% de las cepas aisladas del colon correspondieron a la especie Eubacterium aerofaciens, el 18% a Bacteroides gracilis, el 11% a Wolinella spp., y el resto a las especies Bacteroides uniformis, Fusobacterium necrophorum, Propionibacterium buccae,Porphyria gingivalis y Staphylococcus saccharolyticus. Adicionalmente, tras la infección experimental con Brachyspira hyodysenteriae, los autores encontraron una reducción del 50% en el número de animales con signos clínicos y lesiones compatibles con disentería, con el pienso formulado a base de trigo extrusionado, frente al pienso formulado con trigo no extrusionado, mientras que en el caso del sorgo el efecto de la extrusión sobre la clínica y las lesiones de disentería fue justo al contrario que en el caso del trigo.
Lv y cols. (2006) analizaron el efecto de la extrusión del maíz sobre diferentes parámetros productivos y digestivos de cerdos. En este trabajo, los autores encontraron diferencias en los perfiles de AGVs que, como está bien establecido, reflejan cambios en la microbiota intestinal de los animales. Así, el incremento en la inclusión de maíz extrusionado produjo un incremento lineal en la concentración de butirato en ciego y colon, mientras que la concentración relativa de propionato se redujo. Estos autores encontraron también una relación inversa entre la tasa de inclusión de maíz extrusionado y la frecuencia de diarreas en los animales examinados.
El pretratamiento de las materias primas utilizadas en la formulación de piensos, parece tener implicaciones diferentes dependiendo de la especie animal. Así, el pretratamiento térmico (PT) de algunas materias primas parece tener efectos positivos en cerdos, mientras que en aves diferentes datos apuntan a la obtención de efectos contrarios, aunque son pocos los estudios realizados y, en algunos casos, los resultados son contradictorios (Herstad y McNab, 1975; Vukic-Vranjes et al., 1994; Plavnik y Sklan, 1995; Gracia et al., 2003).
El PT aumenta la solubilidad del almidón, con liberación de amilosa y de PNA al medio, con aumento de la viscosidad intestinal (Fadel et al., 1988; Leterme et al., 1998). En dietas basadas en cebada y trigo, el PT aumenta la incidencia de problemas de enteritis en pollos de engorde, problemas que pueden minimizarse con la utilización de enzimas (Nissinen et al., 1993; Scott et al., 1997). Plavnik y Sklan (1995) encontraron que la extrusión seca o la expansión de una dieta de maíz mejoran la energía metabolizable de un 1,5% a un 3% debido, fundamentalmente, a una mejora en la digestibilidad de la fracción lipídica. Además, las altas temperaturas facilitan las reacciones de Maillard dentro de la fracción proteica, lo que reduce la disponibilidad de la lisina y, como en el caso del efecto sobre los polisacáridos, el posible compromiso de la productividad de las aves (Hodgkinson y Moughan, 2000).
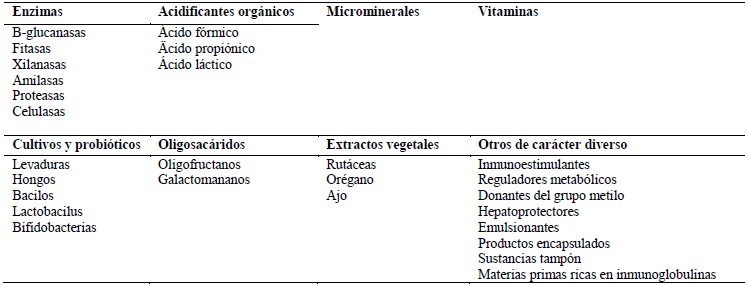
Además de los cambios en la formulación de piensos, algunos aditivos utilizados como alternativas a los antibióticos promotores de crecimiento se resumen en la siguiente tabla siguiente extraída de Mateos y cols. (2000).
Además de los cambios en la formulación de piensos, algunos aditivos utilizados como alternativas a los antibióticos promotores de crecimiento se resumen en la siguiente tabla siguiente extraída de Mateos y cols. (2000).
Temas relacionados
Autores:
Centre de Recerca en Sanitat Animal (CReSA)
Recomendar
Comentar
Compartir
2 de mayo de 2013
Hola mi nombre es mario Alcaraz soy representante de zeocol y zeoambiente en Colombia sobre el usos de las zeolitas tanto agrícola como pecuaria : 3115567065 La utilización de zeolita natural en cerdos, ha permitido obtener en todos los casos mejoras en el comportamiento animal en la conversión, obteniéndose productividades (costo/producción) superiores al 10%.
En cerdos de cebas en Brasil, la adición de un 2.5 % de zeolita natural en el alimento por sustitución de materias primas tradicionales y fuentes energéticas y protícas, mejoró la ganancia de peso diaria, al alcanzarse 934 gr, respecto al testigo sin zeolita que fue de 854 g.
Se ha comprobado mediante investigaciones, que cuando las reproductoras porcinas reciben en su dieta zeolita natural, las crías se destetan con un mayor peso y desaparecen los problemas de enteropatías, desnutrición y mortalidad, como se aprecia en la Tabla siguiente:
Control 2,5% Zeolita/día
- No. de Cerdas 10 10
- No. Crías 100 100
- Peso crías al Destete (kg) 4.7 5.2
- Enteropatías 3 0
- Desnutridos 10 0
Así mismo, los resultados de estas investigaciones han permitido identificar otros beneficios como la mejora en la eficiencia de utilización de los nutrientes, el incremento de la tasa de engorde, el control preventivo de problemas entéricos (diarreas, úlceras, etc.), el control de olores indeseables en las instalaciones, la prevención de la contaminación y desarrollo de hongos durante el almacenaje de granos y piensos, la reducción en más de un 70% de las micotoxinas específicas y no específicas contenidas en los alimentos y animales, la reducción del costo de elaboración de los piensos, la mayor durabilidad en los alimentos peletizados y la prevención del stress al destete.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.


.jpg&w=3840&q=75)




.jpg&w=3840&q=75)