Introducción y antecedentes
El universo de estudio de la presente tesis lo constituyen aquellos parásitos de los suinos cuyos estadios diseminativos (huevos, quistes fecales u ooquistes, según el caso) salen al exterior con las heces del animal. En concreto, está constituido por los siguientes taxones de parásitos:
Sus scrofa
El cerdo doméstico (Sus scrofa domesticus) es un animal ungulado monogástrico que remonta su ascendencia al jabalí, se considera una subespecie de éste, o una especie distinta por derecho propio.
Cría del cerdo en Uruguay
La cría del cerdo es una actividad tradicional en los establecimientos agropecuarios uruguayos; más del 30% de los predios tienen cerdos, al menos para autoconsumo. Según el Censo General Agropecuario 2000, la producción porcina es una actividad económicamente relevante para más de 6000 explotaciones, que tienen a los cerdos como uno de los tres rubros principales (Capra, 2003)
Según estimaciones realizadas en base al Censo Agropecuario del año 2000, la producción familiar constituye el 79% de las explotaciones del Uruguay. En el subsector porcino el 84% de los establecimientos que tienen a este rubro como principal fuente de ingreso corresponde a pequeños productores familiares, aunque sólo contribuyen con un 22% del Valor Bruto de Producción de ese rubro productivo (Capra y col., 2011). En las dos últimas décadas se ha verificado una drástica reducción del número de establecimientos dedicados a la producción de cerdos a la vez que se produce un proceso de concentración en unidades productivas de mayor tamaño. Uno de los factores de la reducción en el número de establecimientos dedicados al rubro y en el total de animales faenados ha sido la competencia del producto importado. En la actualidad se importa más de la mitad del volumen de carne y grasa requeridos por la industria chacinera (Capra y col., 2011; Castro, 2013 comunicación personal).
Declaración Jurada porcina 2012 (DICOSE)
Total de cerdos: 168020
Total de productores: 4654
Distribución de los cerdos declarados por departamento (porcentaje)
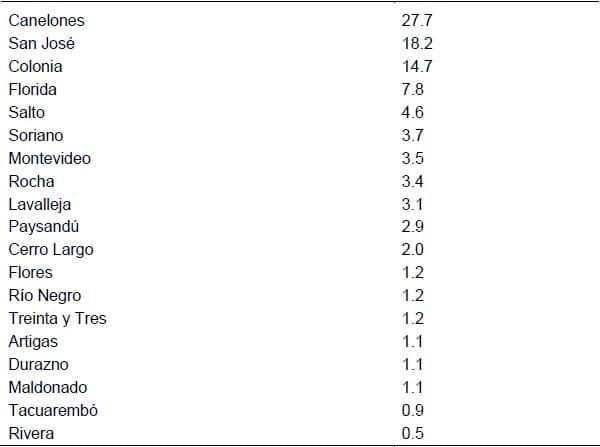
Distribución de los productores declarados por departamento (porcentaje)
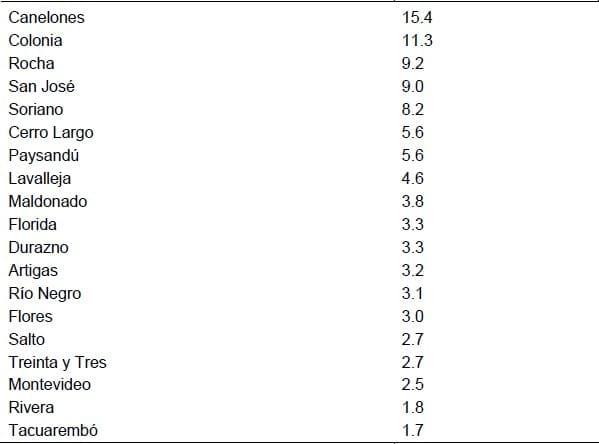
Clasificación de la producción porcina en Uruguay
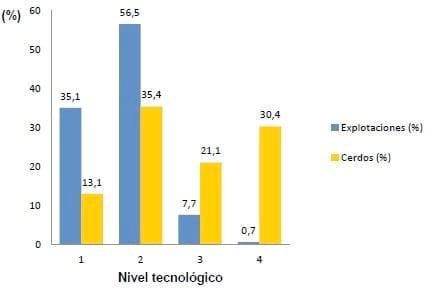
En Uruguay la producción porcina según la encuesta porcina (MGAP-DIEA-INIA, 2006) se puede clasificar en niveles tecnológicos de los productores. Se asignan cuatro categorías en función de su nivel tecnológico y de la inversión realizada en el predio. En dicha escala “tecnológica” los valores van de 1 a 4, en el extremo inferior (1) se ubican las explotaciones con escasa utilización de prácticas avanzadas y/o baja inversión en recursos e infraestructura. En el otro extremo, en la “categoría 4” se agrupan las explotaciones con mayor aplicación de tecnología e inversión. La escala de puntuación de tecnología-inversión se elabora en base a cinco atributos (edad de destete, razas de los padrillos, parideras, raciones de lechones y galpones y refugios). A cada atributo se le da un puntaje, y el puntaje resultante de la suma de ellos determina la categoría asignada a cada explotación.
En el nivel más alto (4) se ubican 18 explotaciones (0.7%), que poseen el 30.4 % de las existencias de cerdos. En el otro extremo, 947 explotaciones (35.1%) evidenciaron fuertes limitaciones tecnológicas y escasa inversión (Figura 1). Existe una estrecha asociación entre la clasificación y el tamaño productivo, dado que las explotaciones de “nivel 4” tienen en promedio 3089 cabezas cada una, frente a las 25 cabezas de las de “nivel 1”.
Figura 1. Distribución en Uruguay de las explotaciones suinas y porcentajes de cerdos según niveles tecnológicos.
Razas registradas en la ARU (2012)
Según la Asociación Rural del Uruguay (2012), en Uruguay se registraron el último año las siguientes razas de cerdos: Landrace (Landrasse), Landrace Belga, Large White y Duroc.
Parásitos del cerdo
Además de los parásitos ya mencionados, los suinos actúan como hospedadores de un amplio rango de protozoos, helmintos y artrópodos. Los siguientes parásitos utilizan al cerdo como hospedador intermediario: los protozoarios Toxoplasma gondi y Sacrocystis spp. y los cestodos Taenia solium, T. hydatigena y Echinococcus granulosus. De ellos, T. gondi y T. solium son importantes zoonosis vinculadas a la ingestión de carne cruda o poco cocida de cerdo. Otro parásito zoonótico que comparte la misma fuente de infección para el hombre es el nemátodo Trichinella spiralis, de ciclo auto-heteroxeno (es decir, el cerdo actúa simultáneamente como hospedador definitivo e intermediario), de la cual no se reportan casos en Uruguay desde 1924 (Tálice, 1943). Los cerdos también actúan como hospedadores definitivos del nematodo renal Stephanurus dentatus, cuyos huevos salen al exterior arrastrados con la orina. Entre los ectoparásitos del suino, los más comunes e importantes en nuestro país son los ácaros Sarcoptes scabiei var. suis y Demodex phylloides, y el anopluro Haematopinus suis. Ninguno de estos parásitos será objeto de atención en la presente tesis, dado que su diagnóstico coprológico es impracticable, por lo que los antecedentes que se detallarán a continuación se referirán en exclusividad a los parásitos enlistados al comienzo.
Antecedentes sobre parásitos del cerdo en Uruguay
Los antecedentes publicados sobre coccidias (Eimeria spp. e Isospora suis) del cerdo en nuestro país son muy escasos. Rodríguez González y col. (1958) señalan haber comprobado la presencia de dos especies de Eimeria en suinos, sin proporcionar la identidad específica de las mismas. En cuanto a Balantidium coli, su presencia en cerdos de Uruguay fue señalada por primera vez por Tálice & Vogelsang (1928) en Castro & Trenchi (1953-1954) y muchos años más tarde D’Alessandro & Perdomo (1987) asociaron con este protozoario un brote de diarrea en lechones postdestete. La presencia de Trichuris (aunque como T. trichiura, que es en realidad un parásito del ser humano pero casi indistinguible de T. suis) fue registrada en cerdos del Uruguay primeramente por Cassamagnaghi (1941). En los años siguientes el mismo autor describe el hallazgo de Hyostrongylus rubidus y Physocephalus sexalatus en el estómago de cerdos faenados en el Frigorífico Nacional (Cassamagnaghi, 1942) y de dos especies del género Oesophagostomum (O. dentatum y O. longicaudum) en el intestino grueso del mismo hospedador (Cassamagnaghi, 1946). La presencia de Ascaris suum o de cuadros clínicos producidos por este parásito ha sido motivo de algunas publicaciones (Vogelsang, 1927; Viera & Pereira Fonseca, 1938; Rodríguez González & Tramontano, 1955; Riet Correa, 1978). El parasitismo del cerdo por parte de Strongyloides ransomi ha pasado ampliamente desapercibido en nuestro país, y sólo Carballo (1978) menciona diagnósticos coprológicos de este helminto realizados en la Facultad de Veterinaria. Calzada (1935) realiza la primera comprobación para nuestro país de los nematodos pulmonares Metastrongylus apri y M. brevivaginatus (= Choerostrongylus pudendotectus) al describir su hallazgo en un suino sacrificado en el matadero de Las Piedras, Canelones, y proporciona una buena descripción de los mismos, incluyendo caracteres no reportados antes que permiten identificar estas especies incluso macroscópicamente. Otras referencias al parasitismo por nematodos pulmonares en suinos son proporcionadas por Riet Correa (1978), Rosso y col. (1991) y Benítez & Capellino (2008). Macracanthorhynchus hirudinaceus figura en la revisión de los parásitos del Uruguay realizada por Castro & Trenchi (1954), con base en “apuntes dictados en clase” por Carballo Pou. También Riet Correa (1978) menciona a este parásito, y Xavier y col. (1983) describen un brote de acantocefalosis suina en un establecimiento del Departamento de Canelones. Por último, Castro (2012, comunicación personal) reporta los eventos sanitarios registrados por la DILAVE “Miguel C. Rubino” en suinos domésticos y silvestres.
Pardo & García y Santos (1985) y la Encuesta porcina del Plan de Promoción Granjera (Facultad de Agronomía, DIEA, 1988) relevaron los aspectos sanitarios de la explotación de suinos, señalando entre ellos las enfermedades parasitarias.
Carballo (1978) y Pardo & García y Santos (1982) publicaron sendas revisiones sobre la importancia de los parásitos en la producción de cerdos en Uruguay.
Antecedentes de relevamientos coprológicos en producciones suinas en Uruguay
El único antecedente de este tipo en Uruguay es un trabajo no publicado realizado por Sampaio y Salles en 1995, cuyos resultados se conservan en el Departamento de Parasitología de la Facultad de Veterinaria (P. Cabrera, 2012, comunicación personal) y son utilizados en la clase correspondiente del curso de grado.
Dichos investigadores realizaron estudios coprológicos de 500 cerdos procedentes de 20 establecimientos productivos de cuatro Departamentos del país, encontrando los siguientes parásitos: Oesophagostomum dentatum, Metastrongylus spp, Ascaris suum, Trichuris suis, Hyostrongylus rubidus, Strongyloides ransomi y coccidias. Fueron diagnosticados por la técnica de flotación, utilizando solución sobresaturada de Sulfato de Magnesio. En el caso de los estrongílidos se diferenciaron mediante la técnica de cultivo de larvas. Señalaron las categorías etarias en las que la presencia de cada uno de estos parásitos era más relevante. En lechones aparecieron huevos de A. suum, Oesophagostomum, S. ransomi y T. suis. En los cachorros se observaron huevos de A. suum, Oesophagostomum, S. ransomi y T. suis. En los gordos huevos de A. suum y Oesophagostomum. En cuanto a las cerdas, se categorizaron en vacías, gestantes y lactantes. En las vacías aparecieron huevos de A.suum, Hyostrongylus y Oesophagostomum; en las gestantes se encontraron huevos de A. suum, Metastrongylus, Hyostrongylus, Oesophagostomum y T. suis. En las hembras lactantes se hallaron huevos de A. suum y Oesophagostomum. Al muestrear a los padrillos, encontraron huevos de Metastrongylus y Oesophagostomum. En la totalidad de las categorías observaron ooquistes de coccidias por método de flotación. También realizaron para cada categoría la técnica de sedimentación de Happich & Boray, y mediante la misma no se evidenció ningún taxón parasitario.
Importancia del estudio
Roepstorff & Nansen (1998) señalan que, como base para evaluar la prevalencia e impacto de las helmintosis en los suinos, se deben identificar las especies presentes en una piara, área, país o región. Las diferentes especies tienen distintos efectos patógenos y diferentes biologías. Algunas son particularmente importantes en los animales jóvenes, mientras que otras parecen acumularse en las categorías etarias mayores. Además, algunas especies son relativamente fáciles de controlar, mientras que otras son altamente persistentes en el ambiente y difíciles de combatir.
Luego de los problemas nutricionales y las enfermedades infecciosas, las parasitosis ostentan un papel relevante en las explotaciones suinas. En establecimientos con niveles alimenticios adecuados, los problemas parasitarios, tanto en sus infecciones clínicas como subclínicas, actúan como contrapesos fundamentales de los resultados a obtener con dichos niveles de alimentación (Carballo, 1978).
La producción actual de cerdos requiere ideales condiciones sanitarias y la eliminación total de esos factores de interferencia. Los ingresos económicos del criadero están ligados sobre todo a una eficiencia productiva y no tanto al volumen de producción (Carballo, 1978). Para el norte de Europa (Dinamarca), Roepstorff & Nansen (1994) señalan que, aunque es sabido que la higiene y el manejo adecuado pueden prevenir la transmisión de los helmintos, a pesar de ello el uso de antihelmínticos sigue siendo la medida más importante adoptada por los criadores de cerdos para el control de los mismos.
En los cerdos, entonces, las endoparasitosis causan infecciones clínicas y subclínicas. Las infecciones clínicas están caracterizadas por una sintomatología proteiforme, pudiendo darse muy diversos síntomas de enfermedad, como anorexia, anemia, diarrea, pero fundamentalmente pérdida de peso, llegando a debilidad, emaciación y también a muerte. Se han asociado a parasitosis vicios como mordeduras de colas y orejas, y estados de pica con ingestión de pared o cama. Los efectos clínicos de las parasitosis se hacen aún peores cuando existen complicaciones infecciosas (neumonía, enteritis, etc.) o cuando los animales están sufriendo condiciones alimenticias pobres o límites (Carballo, 1978).
Pero son las evoluciones subclínicas y asintomáticas las más importantes en su incidencia en las pérdidas globales. Los animales con infecciones subclínicas tendrán un menor consumo de alimento, así como bajas tasas de conversión, con menores márgenes de ganancia de peso en todas las categorías y edades (Carballo, 1978; Freyre, 1990).
Además del menor aprovechamiento de las raciones, en la fisiopatología de las nematodiasis sobre todo, existen diversos grados de pérdida de proteínas a nivel intestinal así como de minerales y vitaminas, y también, según los parásitos actuantes, distintos grados de alteraciones hepáticas y pulmonares, todo lo que interfiere con otras actividades orgánicas, como ser la reproductiva. La infertilidad en hembras ha sido ligada, en primer lugar a problemas nutricionales y en segundo lugar a problemas parasitarios, los que muchas veces actúan asociados. En otros casos disminuye la tasa de fecundación, determinando bajos procreos. La falta de proteínas, sobre todo, hace aumentar la incidencia del complejo mastitis-metritis-agalactia y también las pérdidas de lechones (Carballo, 1978; Freyre, 1990).
Los endoparásitos, además, no sólo pueden actuar como factores predisponentes en las enfermedades infecciosas, sino que también actúan como inoculantes de las mismas. Producen interferencias con la respuesta inmunitaria a las vacunaciones. En general podemos decir que mientras que en lechones y recría encontramos evoluciones clínicas y subclínicas, en madres y cerdos en terminación tienen mayor importancia las evoluciones subclínicas y su comportamiento como portadores y contaminantes del ambiente (Carballo, 1978)
Es importante, entonces, poder contar con información, mediante análisis coprológicos, de la o las parasitosis existentes en una piara para poder tomar las medidas de control pertinentes a cada caso en particular (dosificaciones tácticas), permitiendo con ellas prevenir la transmisión de parásitos de cerdos enfermos o portadores a cerdos susceptibles en forma directa o pasando por hospedadores intermediarios (Freyre,1990).
Los análisis coprológicos en cerdos ofrecen un medio útil de diagnóstico con fácil reconocimiento de las formas de diseminación en la mayoría de los casos. Las dificultades mayores están en la poca sensibilidad de diagnóstico de las helmintiasis por la eliminación irregular de huevos de Metastróngylus y la no diferenciación de los huevos de Hyostrongylus y Oesophagostomum si las materias fecales estuvieron cierto tiempo sin refrigeración, aunque de todas maneras en este último caso es factible recurrir al cultivo de larvas. Luego del diagnóstico preciso es posible instaurar un tratamiento y control adecuados (Carballo, 1978).
Un aspecto importante a tener presente es que mediante la coprología se pueden diagnosticar tres taxones parasitarios, que según la literatura pueden ser zoonosis. Ellos son B. coli, Ascaris y Trichuris.
Según Cordero y col. los trichuris porcinos y humanos son muy afines, aunque hay entre ellos diferencias cromosómicas y morfológicas. Es posible la infección cruzada entre ambos hospedadores, aunque no está definitivamente claro si se llega a producir la infección humana con material porcino.
Ascaris suum difiere en varios aspectos morfológicos y fisiológicos del parásito humano, y puede evolucionar en el hombre hasta las fases migratorias hepática y pulmonar (Lapage, 1982). Sin embargo, según Acha & Szyfres (2003) en el ser humano A. suum raramente llega al estado de oviposición y permanece relativamente poco tiempo en su intestino. De todos modos, según dichos autores, es posible que el daño mayor que puede causar el parásito porcino sea en la fase de migración pulmonar de las larvas. Se han asociado crisis asmatiformes que tienen base en fenómenos de hipersensibilidad, en individuos que viven en ambientes contaminados por dicho parásito (Cordero y col., 1999).
La balantidiosis está asociada a condiciones higiénicas deficientes. Es posible la difusión de quistes por las moscas y por verduras crudas, cuando se utiliza como fertilizante el estiércol porcino. Se han descrito casos mortales en humanos (Cordero y col., 1999). En nuestro país, el primer caso humano fue descrito en 1932 (Osimani, 1982). Brea & Nieto (1937) describen un segundo caso humano. En el quinquenio 1940-1945 Osimani (1982) señala haber observado varios casos en el Departamento de Parasitología de la Facultad de Medicina, pero agrega que a partir de ese año no comprobó nuevas infecciones en más de 20.000 exámentes coproparasitarios. Más recientemente, Gezuele y col. (2005) describen un caso de balantidiosis en una mujer de 47 años procedente de un complejo urbano de Montevideo que consulta por dolor abdominal tipo cólico, intermitente, de un año de evolución, con períodos de diarrea de pocos días de duración, seguido de otros de estreñimiento. Se desconoce la fuente de infección de esta paciente ya que la misma aseguró no haber tenido contacto con los cerdos.
Objetivo General
- Hacer un relevamiento coproparasitario de cerdos de diferentes categorías en criaderos familiares de distintos departamentos del país.
Objetivos Específicos
- Identificar los géneros de parásitos gastrointestinales presentes.
- Determinar presencia y prevalencia de parásitos por categoría.
- Relacionar la presencia de parásitos con las condiciones sanitarias generales, tipo de alimentación y forma de tenencia de los animales.
- Evaluar la visión de los productores en cuanto a incidencia de los parásitos en la producción.
Materiales y métodos
Obtención de las muestras
Se muestrearon 30 establecimientos familiares de nueve departamentos del país, y dos establecimientos en sistema a campo que por sus características no podemos incluirlos como criaderos familiares. Se recolectaron en promedio cinco muestras por cada uno procurando que las muestras fueran representativas de las diferentes categorías: lechones, recría-engorde, hembras reproductoras y verracos. Consideramos lechones a los animales que estaban al pie de la madre (lactantes). No podemos adjudicarle a esta categoría un rango etario preciso por la existencia de varios tipos de destete (que se realizan a diferentes edades) en nuestro medio.
Las muestras de materia fecal se colectaron directamente del suelo y no por extracción rectal, por la limitante de no contar con las instalaciones pertinentes para inmovilizar al animal. Se recogieron aquellas heces eliminadas recientemente, tomando del centro de la masa fecal para evitar en lo posible la contaminación de la muestra con elementos del ambiente. Las muestras se colocaron en bolsas de nylon y se anudaron dejando la menor cantidad de aire posible en el contenido de la bolsa, para disminuir la oxigenación de la misma. Se identificaron y transportaron en cajas conservadoras con refrigerantes previendo la llegada al laboratorio en tiempo óptimo para su procesamiento (hasta 24 horas post-colecta).
Exámenes coprológicos
Examen microscópico por enriquecimiento
a) Flotación cualitativa- método de Willis.- Como los elementos de diseminación parasitarios (huevos, quistes fecales u ooquistes) se mezclan y se dispersan en la materia fecal, es necesario la separación y concentración de los mismos. La concentración permite encontrar los elementos diagnósticos más fácilmente así como analizar un volumen mayor de materias fecales. Con el uso de soluciones de flotación se concentran los elementos parasitarios de la materia fecal en una pequeña superficie (en la parte superior de un tubo de Borrel o similar).
Se utilizaron soluciones saturadas de Sulfato de Magnesio (en la mayor parte de los casos), Sulfato de Zinc, y en ocasiones Cloruro de Sodio.
Procedimiento: con espátula se recoge una porción representativa (aproximadamente 10 gramos) de la muestra, se la vierte en un mortero y se agrega 5 a 10 veces su volumen de solución saturada (de la cual previamente se registró la densidad). Se macera obteniendo un homogeneizado líquido que se filtra con colador. El filtrado se coloca en un tubo de Borrel, llenándolo hasta formar el menisco convexo, sobre el cual se coloca un portaobjetos. Este último se deja reposar 5 minutos. Se retira conservando la mayor cantidad de líquido posible y se invierte. Se coloca un cubreobjetos comprimiendo suavemente para formar una capa fina de líquido. Luego se procede a la observación microscópica utilizando la técnica de “guarda griega” con aumento de 100x.
b) Sedimentación simple.- Se realiza una suspensión de heces en agua y posterior sedimentación, logrando la concentración de los elementos de diseminación parasitarios (huevos, quistes fecales u ooquistes) en la porción inferior de la mezcla, en el sedimento, separándolos del grueso de los detritos fecales más livianos.
Procedimiento: Se realizaron pools de materia fecal por categoría de cada criadero. Las muestras se homogeneizaron con abundante agua jabonosa, disgregándolas con un mortero. Se coló y se tamizó con malla de 100 mesh, pasando el filtrado a copas de sedimentación. Se realizaba una primera sedimentación de 20 minutos, luego se eliminaba el sobrenadante y se vertía el sedimento a copas de menor tamaño. En dichas copas se dejaba reposar por un lapso de 5 minutos hasta obtener un sobrenadante limpio. Si el sobrenadante y el sedimento no eran claros, se volvía a repetir el procedimiento. Luego mediante una pipeta se recogía el sedimento y se colocaba una gota en un portaobjeto, se cubría con un cubreobjeto y se llevaba al microscopio para la visualización de la muestra en “guarda griega”.
Cultivo y recuperación de larvas
Cuando no es posible o se torna difícil diferenciar géneros y especies de nematodos Strongyloideos a partir de sus huevos, es necesario recurrir al cultivo de larvas de tercer estadio para posterior identificación de las mismas.
Existen varios métodos de cultivo de larvas, que se hacen a partir de huevos de nematodos presentes en la materia fecal colectada. Todos los métodos se basan sobre los mismos principios: suministrar condiciones favorables que posibiliten la maduración y eclosión de los huevos, con el posterior desarrollo de las larvas, evolucionando hasta larvas infectantes, y haciendo luego que éstas se separen de las heces, concentrándolas para su recolección y análisis microscópico. Aquí se siguió en lo esencial la metodología sugerida por Niec (1968).
El éxito del cultivo depende de tres factores: humedad, temperatura adecuada y oxigenación. Las materias fecales demasiado secas deben humedecerse, y las demasiado húmedas o diarreicas deben consolidarse, agregándoles mayor cantidad de material consolidante, que en nuestro caso fue materia fecal equina desecada, esterilizada y pulverizada. Como alternativa puede utilizarse cáscara de arroz, aserrín o Vermiculita. El agua para los cultivos debe ser destilada, sin rastros de cloro, pues las larvas I y II son vulnerables a éste.
El método de cultivo empleado fue el de Roberts & O’Sullivan, de la siguiente manera: se toman unos 15 gramos de materia fecal provenientes de muestras con presencia de huevos de Strongyloideos detectados anteriormente mediante la técnica de Willis. Las materias pueden ser de una muestra individual o de un “pool” de muestras si se estudia por categoría. Se coloca en un mortero, se macera y mezcla con el sustrato (en similares cantidades o relación 1:1, dependiendo de la consistencia de la materia) hasta obtener una mezcla lo suficientemente disgregada. Esta última se coloca en un frasco de boca ancha rotulado, se humedece un poco, y se tapa con media rosca. Se lleva a incubar a 24°C (estufa del laboratorio de parasitología) durante una semana, destapando el frasco diariamente para oxigenar la preparación y controlar la formación de posibles hongos que contaminen el cultivo. Pasada la semana de incubación se deben recuperar las larvas III, para lo cual se agrega agua y se invierte el frasco destapado dentro de una caja de Petri de mayor diámetro que el frasco, y se deja así durante aproximadamente 6 horas. Transcurrido ese tiempo se colecta el líquido que pasó a la caja de Petri (por fuera del frasco) y se lo transfiere a un tubo y se deja sedimentar. Se colecta el sedimento y en él se encuentran las larvas aptas para el examen inmediato o posterior (conservándose en heladera a 4°C el tubo rotulado). Es importante destacar que las larvas se conservan durante mucho tiempo a 4° C. Esta temperatura las inmoviliza, baja el metabolismo y produce el ahorro de reservas alimenticias. De todos modos siempre es mejor observar cultivos frescos, pues las larvas mantenidas mucho tiempo en heladera presentan deformaciones tanto en su estructura interna como en sus proporciones, dificultando el diagnóstico.
Para poder apreciar los detalles morfológicos de las larvas se las debe inmovilizar. Existen dos métodos, cada uno de ellos con ventajas e inconvenientes:
1) Por calentamiento cuidadoso del material sobre el portaobjetos, pasando la suspensión de larvas sobre la llama, mueren con su cuerpo estirado, facilitando la medición, pero en cambio se altera un poco la estructura por el calor.
2) Mediante el tratamiento con solución Lugol, si bien las larvas al morir quedan algo curvas, facilita la observación de los detalles morfológicos y permite diferenciar a las larvas infectantes, de los nematodos y larvas de vida libre.
En nuestro caso se realizó la inmovilización colocando una gota o dos de solución Lugol sobre el sedimento previamente depositado en un portaobjetos. Luego fueron observadas minuciosamente las larvas en el microscopio con aumentos de 40 a 400x.
Para la identificación de las larvas a nivel de género (Oesophagostomum / Hyostrongylus) se tuvieron en cuenta su movilidad (previo a la fijación), tamaño (longitud y ancho), presencia o no de ondulaciones en la vaina y el largo de la cola de la vaina. Los huevos y larvas de helmintos fueron identificados de acuerdo con Thienpont y col., (1986).
Esporulación de ooquistes
Las muestras que presentaban cantidades significativas de ooquistes, fueron sometidas a sedimentación, se colocó el sedimento en una placa de Petri y se llevó a la estufa, 24ºC por una semana. Luego se vertió el contenido de la placa de Petri en una copa de sedimentación durante 10 minutos, se retiró el sobrenadante y el sedimento se colocó en un tubo de Borrel con solución de sulfato de magnesio y se esperó 5 minutos para que floten los ooquistes. Para la identificación se tomaron las medidas de los ooquistes y se tuvo en cuenta su forma y el número de esporoquistes.
Necropsia parasitaria
Se tuvo la oportunidad de realizar la necropsia parasitaria de un lechón de aproximadamente 1 mes de edad, el cual falleció por causa desconocida en uno de los establecimientos muestreados. El ejemplar fue remitido al Laboratorio de Anatomía Patológica de la Facultad de Veterinaria, congelado, envuelto en nylon y cartón.
Luego de revisar el exterior del animal se procedió a abrir la cavidad abdominal, separando y ligando estómago, intestino delgado e intestino grueso. Se examinó visualmente el hígado y, al abrirse la cavidad torácica, los pulmones. El estómago, intestino delgado y grueso se abrieron y su contenido se vació en sendas copas de sedimentación. Se realizaron múltiples sedimentaciones de 20 minutos de duración cada una. El sedimento resultante era colocado en cajas de Petri pequeñas (5.5 cm de diámetro) y examinado bajo lupa binocular para recolectar los ejemplares encontrados. Estos fueron luego observados en microscopio óptico, fijados con alcohol 70 %, medidos, sexados y montados.
Encuesta
Se diseñó una breve encuesta a presentar a los productores a fin de satisfacer los dos últimos objetivos específicos, con las siguientes preguntas:
1) ¿Cuántos cerdos tiene?
2) ¿Viven a campo, en confinamiento, o mixto?
3) ¿De qué se alimentan?
4) ¿Tiene otras especies productivas?
5) ¿Qué importancia le asigna a las parasitosis en cuanto a pérdidas productivas?
Ninguna (0) Poca (1) Significativa (2) Muy importante (3).
6) Dosificaciones: ¿con qué y cuándo?
Resultados
En este trabajo se muestrearon 32 establecimientos familiares de nueve departamentos del país, promediando 37 animales cada uno (de dos a 234 por establecimiento). Uno de los establecimientos fue remuestreado en otra época del año y obtuvimos resultados positivos a géneros parasitarios que en el primer muestreo resultaron negativos.
En su mayoría la modalidad productiva era de ciclo completo. El 42% de los establecimientos tenían los animales a campo, el 39% mixto y el 19% confinados. En cuanto a la alimentación, el 74% de los establecimientos suministraba ración en cantidad y calidad acorde a la categoría y posibilidades económicas del productor. Dependiendo de la ubicación de los criaderos en zonas suburbanas o rurales, el 48% daba sobras de panadería, subproductos lácteos, verduras de descarte, entre otros y el 65% tenía acceso a pasturas. El 42% de los establecimientos tenía otras especies productivas (bovinos, ovinos y aves) compartiendo ambiente con los cerdos, y el 58% no. Según la encuesta, el 70% de los productores le asignaban importancia a las parasitosis, y el restante 30% les daban escasa y nula importancia a los parásitos en la producción suina. Del total de establecimientos que trabajamos, el 43% no desparasitaban, 17% desparasitaban menos de tres veces al año y 40% lo hacían con mayor frecuencia (Cuadro 3).
Se encontraron nueve taxones parasitarios: Balantidium coli, Coccidias (Eimeria spp.), Ascaris suum, Oesophagostomum sp., Hyostrongylus rubidus [estos dos últimos agrupados en nematodos gastrointestinales indiferenciados (GI) cuando no había una cantidad suficiente de huevos para hacer cultivo de larvas], Metastrongylus sp., Strongyloides ransomi, Trichuris suis y Macracanthorhynchus hirudinaceus. Se diagnosticaron de uno a siete taxones parasitarios por establecimiento, presentándose tres taxones en la mayoría de ellos (Figura 2).
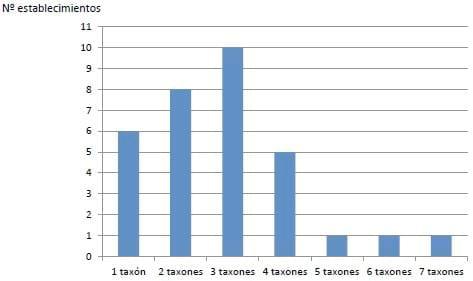 Figura 2.
Figura 2. Cantidad de taxones parasitarios encontrados por establecimiento
Las coccidias fueron el taxón presente con mayor frecuencia en cuanto al número de establecimientos positivos, seguidas por B. coli, nematodos gastrointestinales indiferenciados, Metastrongylus sp., A. suum, T. suis, S. ransomi y M. hirudinaceus (Figura 3).
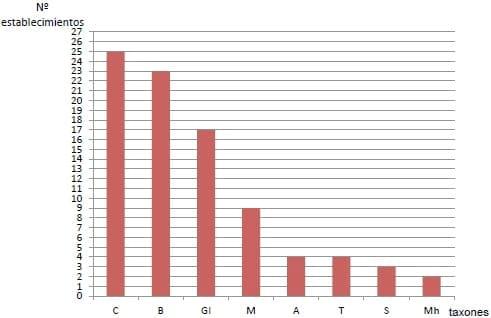 Figura3.
Figura3. Número de establecimiento positivo a cada taxón parasitario
A.= Ascaris. B.= Balantidium. C. = Coccidias. GI.= gastrointestinales indiferenciados (H.= Hyostrongylus; O.= Oesophagostomum). Mh.= Macracanthorhynchus. M.= Metastrongylus. S.=Strongyloides. T.= Trichuris.
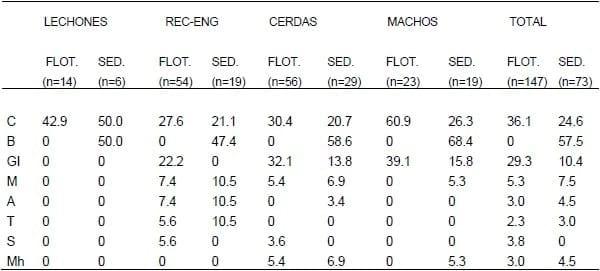
En cuanto a la categoría animal, se procesaron mediante técnicas de flotación 147 muestras de materia fecal, 14 correspondientes a lechones, 54 a la categoría recría-engorde y 79 a animales adultos (56 hembras y 23 machos). A su vez, por medio de la técnica de sedimentación se procesaron 73 pools de materia fecal de animales de la misma categoría, 6 de lechones, 19 de recría-engorde y 48 de adultos (29 de hembras y 19 de machos, aunque en ocasiones, en los machos un pool correspondió a un único individuo).
En la técnica de flotación los taxones más prevalentes fueron las coccidias seguidas por los nematodos GI indiferenciados, y en la técnica de sedimentación el de mayor hallazgo fue B.coli seguido por las coccidias (Cuadro 1).
En los lechones se encontraron sólo dos taxones parasitarios y los mismos correspondieron a protozoarios (coccidias y B. coli). En la categoría recría-engorde los taxones más abundantes fueron coccidias, nematodos GI y B. coli. No se observó a M. hirudinaceus en animales de este grupo. En los adultos el único taxón que no se visualizó fue T.suis. Los más prevalentes fueron coccidias (destacando la alta frecuencia de éstas en los machos), nematodos GI y B. coli. Es relevante destacar la alta prevalencia de este último protozoario en la totalidad de las categorías muestreadas (Cuadro 1).
Cuadro 1. Prevalencia (%) de taxones encontrados según la técnica coprológica empleada y categoría de los cerdos muestreados.
Las Coccidias, los nematodos GI y T. suis se diagnosticaron mejor con la técnica de flotación que con la de sedimentación, en contraposición a Metastrongylus sp. que lo fue por la técnica de sedimentación (Cuadro 2). En el caso de M. hirudinaceus, aunque se halló en pocas ocasiones, la flotación con una solución de densidad mayor a 1.30 y la sedimentación fueron eficaces en recuperar los huevos.
Un hallazgo relevante fue la aparición exclusiva de B. coli por sedimentación simple, mientras que los pocos hallazgos de S. ransomi fueron a través de la técnica de Willis (Cuadro 2).
Cuadro 2. Número de establecimientos positivos para cada taxón parasitario según técnica empleada / Número de establecimientos positivos para cada taxón parasitario. En el caso de técnicas de flotación se consideran dos rangos de densidades.
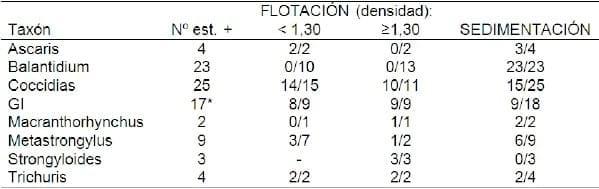
* Un establecimiento positivo fue muestreado dos veces.
Cuadro 3. Resumen de los resultados de la encuesta y cantidad e identidad de taxones para cada establecimiento en particular.
A.= Ascaris. B.= Balantidium. C. = Coccidias. GI.= gastrointestinales indiferenciados (H.= Hyostrongylus; O.= Oesophagostomum). Mh.= Macracanthorhynchus. M.= Metastrongylus. S.=Strongyloides. T.= Trichuris.
Encuesta: 1) Animales por establecimiento: más de 30 animales

, entre 15 y 30

, menos de 15

. 2) Forma de tenencia: campo (CA), confinamiento (CO), mixto (MX). 3) Alimentación: ración (R), pasto (P), sobras (S). 4) Otras especies productivas del establecimiento: tiene (T), no tiene (NT). 5) Importancia asignada por el productor a las parasitosis: ninguna (0), poca (1), significativa (2), mucha importancia (3). 6) Dosificaciones: dosifica frecuentemente

, dosifica irregularmente

, no desparasita

. Para mayor claridad, la presencia de los diferentes taxones según el sistema de producción (la columna dos del cuadro 3) se ha desglosado en el siguiente cuadro 4.
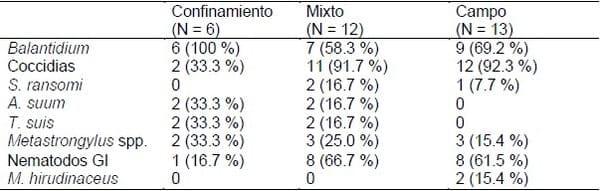
Cuadro 4. Prevalencia de los distintos taxones parasitarios según el sistema de producción de los establecimientos
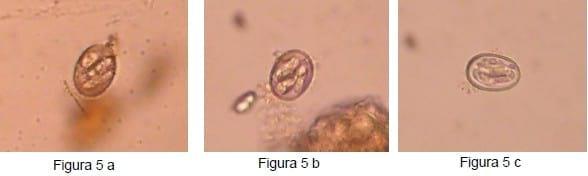
Se determinaron las dimensiones de 215 ooquistes de coccidias (Figura 4) en el total de los establecimientos positivos a las mismas. Las pocas muestras que mostraron un número significativo de coccidias se dispusieron para la esporulación de las mismas, logrando este objetivo en pocos casos. De todos modos, todas las coccidias que esporularon pertenecían al género Eimeria (Figuras 5 a, 5 b y 5 c).
Según las dimensiones de los ooquistes de las distintas especies de Eimeria que parasitan al suino, descritas en la bibliografía (Cordero del Campillo y col., 1999), se puede presumir tentativamente la existencia de cinco especies en la presente muestra: E. perminuta, E. debliecki, E. porci, E. polita, y E. scabra (Figura 6).
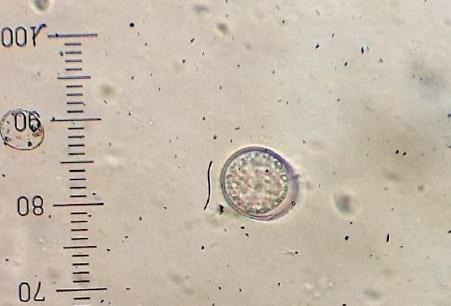 Figura 4.
Figura 4. Ooquiste de coccidia sin esporular observado mediante técnica de Willis (400 x)
Las Figuras 5 a, 5 b y 5 c. Corresponden a ooquistes esporulados de coccidias del género Eimeria (se observan cuatro esporocistos en cada ooquiste) 400x.
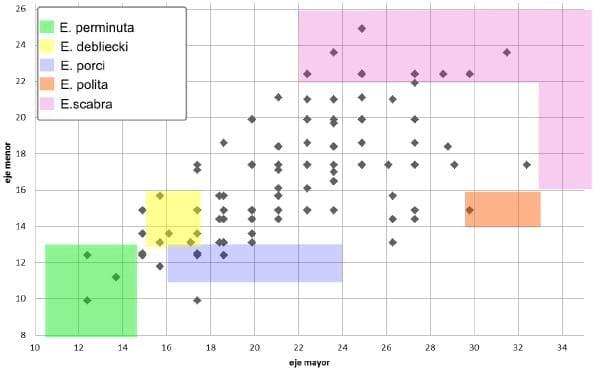 Figura 6:
Figura 6: Gráfica de dispersión de la longitud del eje mayor versus eje menor (en micras) de ooquistes individuales de coccidias; las zonas coloreadas representan áreas de no solapamiento en las medidas de ooquistes de las distintas especies de coccidias según la literatura.
En cinco establecimientos aparecieron cantidades significativas de huevos de nematodos GI y su identificación mediante cultivo de larvas (Figuras 7 y 8) proporcionó los siguientes resultados:
Establ. 1: Cerda 1: 100 % Oesophagostomum
Establ. 5: Verraco 2: 8 larvas de Hyostrongylus y 6 de Oesophagostomum
Establ. 6: Pool de muestras: 36 larvas Oesophagostomum
Establ 24: Cerdas: 40 larvas de Hyostrongylus, 2 de Oesophagostomum y 65 larvas no identificadas*
Establ 26: Verraco: 9 larvas de Hyostrongylus y 3 larvas no identificadas*
* Se trata de larvas cuya morfología y medidas no permitieron su asignación precisa a ninguno de los dos géneros.
Se tomaron las medidas (largo y ancho) de las larvas de tercer estadio mencionadas anteriormente. Para Oesophagostomum sp. la media en micras del largo fue 573 y la del ancho 28; y para Hyostrongylus sp. la media en micras del largo fue 725 y la del ancho 23.
 Figura 7:
Figura 7: L3 de Hyostrongylus rubidus (100 x)
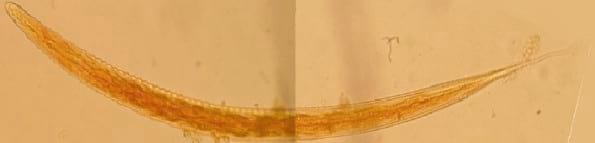 Figura 8.
Figura 8. Fotomontaje de L3 de Oesophagostomum sp. (400 x)
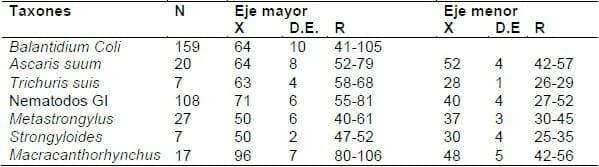
Cuadro 5. Dimensiones determinadas en micras (media, desvío estándar y rango) de los elementos parasitarios (huevos, quistes fecales) observados en los análisis coprológicos.
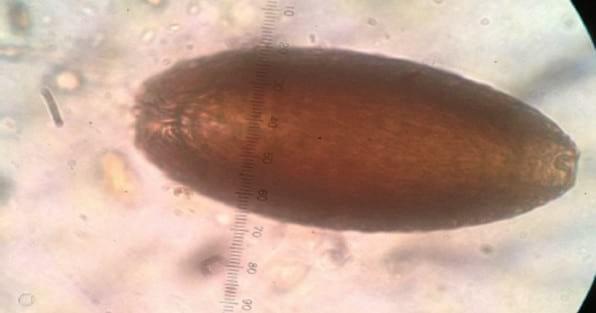 Figura 9.
Figura 9. Huevo de Macracanthorhynchus hirudinaceus (1000 x)
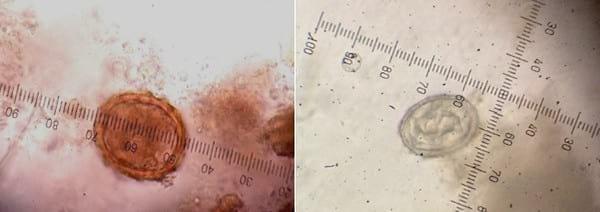 Figura 10.
Figura 10. Huevo de Ascaris suum (400 x) -
Figura 11. Huevo de Metastrongylus sp. (400 x)
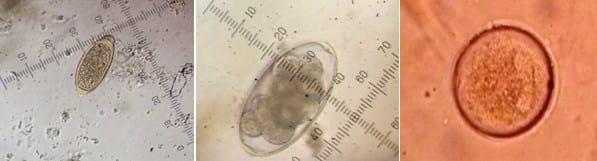 Figura 12.
Figura 12. Huevo de Trichuris suis (400 x) -
Figura 13. Huevo de nemátodo gastrointestinal indiferenciado (400 x) -
Figura 14. Quiste de Balantidium coli (400 x)
En la única necropsia realizada se halló la presencia de tres ejemplares de H. rubidus en el contenido estomacal. Se trataba de dos adultos machos y una larva 4, cuyas mediciones se proporcionan en el Cuadro 6. En intestino delgado e intestino grueso no se encontraron parásitos.
Cuadro 6. Dimensiones de dos machos y una L4 de Hyostrongylus rubidus
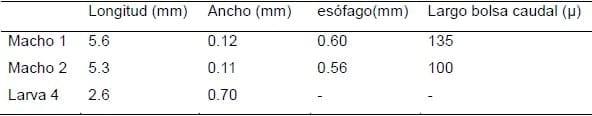
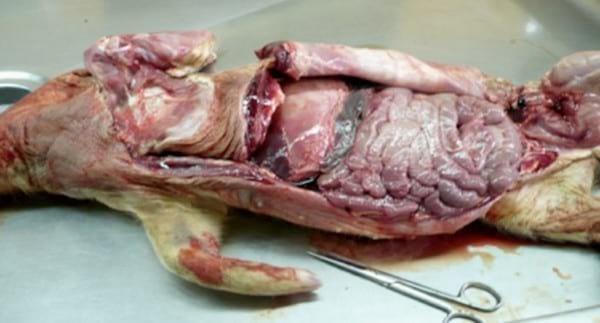 Figura 15.
Figura 15. Apertura toraco-abdominal en el curso de la necropsia parasitaria de un lechón.
 Figura 16.
Figura 16. Extracción del contenido intestinal para posterior sedimentación.
 Figura 17.
Figura 17. Extremo anterior de un ejemplar de Hyostrongylus rubidus
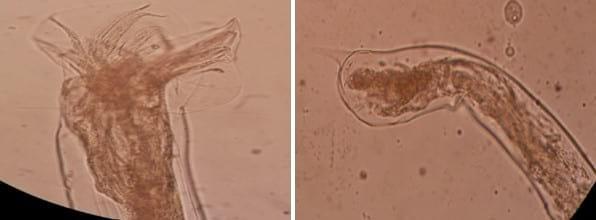 Figura 18.
Figura 18. Bolsa caudal de un macho de Hyostrongylus rubidus -
Figura 19. Extremo posterior de una L4 de Hyostrongylus rubidus
En el transcurso del trabajo se observaron también, en dos animales de un mismo establecimiento, algunos huevos con características similares al de Physocephalus (larvado y alargado, de unas 47 μ de eje mayor), pero a diferencia de éste tenían cáscara fina y los lados eran uno cóncavo y el otro convexo (Figura 21).
Otro hallazgo fue el de huevos del cestode zoonótico Hymenolepis diminuta (figura 22) en un pool de la categoría recría-engorde de un establecimiento de la periferia de Montevideo. Sin embargo, no podemos afirmar de forma contundente que pertenecieran a la materia fecal de los cerdos, ya que éstas fueron recolectadas de un establecimiento clasificado por el MGAP como dentro de riesgo rojo desde el punto de vista sanitario, y como tal existe seguramente en él una alta población de roedores conviviendo con los cerdos muestreados. Teniendo en cuenta que los primeros son los hospederos definitivos del cestode en cuestión, los huevos encontrados pueden pertenecer a materia fecal de ratas o ratones que hayan contaminado nuestra muestra (recolectada desde el piso). Algunos de dichos huevos presentaron las siguientes dimensiones (en micras): 72 x 67, 85 x 77, 77 x 72 y 77 x 75 μ. El tamaño, forma subesférica, color marrón amarillento y la ausencia de filamentos polares permitieron la identificación específica precisa.
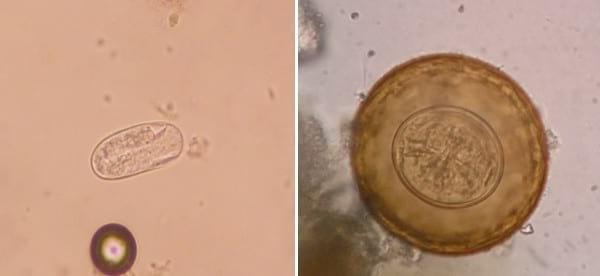 Figura 20.
Figura 20. Huevo de nematodo no identificado. -
Figura 21. Huevo de Hymenolepis diminuta
Discusión
Con la excepción de Physocephalus sexalatus se observó la totalidad de los taxones parasitarios registrados en nuestro país por Carballo (1978). Todos los establecimientos fueron positivos al menos a un taxón parasitario, encontrándose hasta siete en un establecimiento, remarcando que éste fue muestreado en dos estaciones diferentes del año (marzo y julio). Cabe remarcar que ninguno de los 32 establecimientos estudiados administraba fármacos contra protozoarios. Conforme con esto, algunos de los que suministraban nematodicidas presentaron sólo B. coli y/o coccidias.
A pesar de haber muestreado menos animales que en el trabajo realizado por Sampaio y Salles en 1995, se encontraron dos taxones parasitarios más (el ciliado B. coli y el acantocéfalo M. hirudinaceus). A pesar de que dichos autores emplearon la técnica de sedimentación de Happich & Boray, llamativamente no observaron quistes de Balantidium en ninguna de las categorías analizadas. En cuanto al no hallazgo de huevos de M. hirudinaceus por parte de Sampaio y Salles, es posible que se debiera al tipo de establecimientos productores con que trabajaron, puesto que no incluyeron a animales mantenidos a campo.
En nuestro trabajo es de destacar que se encontraron quistes de B. coli y ooquistes de coccidias en animales de todas las categorías. También Hindsbo y col. (2000), trabajando en granjas porcinas de Dinamarca, encontraron una alta prevalencia de quistes de B. coli en todas las categorías de cerdos muestreadas. Y observaron un aumento significativo en la cantidad de quistes excretados por los animales de más edad. Destacan la importancia de brindarle mayor atención a este protozoario por su alta prevalencia hallada en las granjas muestreadas en Dinamarca y el potencial riesgo zoonótico que representa. Tal como se señaló en la Introducción, en Uruguay se han diagnosticado varios casos de balantidiosis humana.
En lechones no aparecieron huevos de nematodos, sin embargo en la necropsia del lechón se observaron dos Hyostrongylus machos. Al no haber encontrado hembras del mismo género, no se puede saber si estaban en etapa de diseminación. Tampoco se observaron síntomas de parasitosis en la mucosa gastrointestinal, aunque sí se observaron trayectos parasitarios en la superficie hepática, probablemente ocasionados por larvas de Ascaris. En esta categoría solo se registraron protozoarios (coccidias y B.coli), posiblemente por el corto período prepatente de los mismos. Ambos agentes son causantes de diarreas en animales de corta edad, existiendo un caso en Uruguay de un brote de balantidiosis en lechones de un establecimiento (D´ Alessandro & Perdomo, 1987). En cuanto a las coccidias, la acción más patógena en lechones se suele adjudicar al género Isospora; aunque no se hallaron ooquistes esporulados correspondientes a este género, no podemos descartar su presencia en nuestra muestra. Para el género Eimeria, las especies más patógenas mencionadas por Cordero del Campillo y col., 1999; Sánchez y col., 2006; son E. debliecki, E. scabra, E. polita y E. spinosa mientras que el resto de las especies son escasamente patógenas.
Por su parte, Sampaio y Salles hallaron en lechones huevos de estrongilidos (Oesophagostomum), Ascaris, Trichuris y Strongyloides, así como ooquistes de coccidias. Dado el período prepatente de varios de estos géneros (5 a 6 semanas) es probable que los animales estudiados por dichos autores fueran destetados más tarde que los examinados aquí, que no tenían más de un mes de edad.
La mayor prevalencia de A. suum, Metastrongylus spp y T. suis se presentó en los animales de recría engorde. Con excepción de M. hirudinaceus, en dichos animales, se encontraron todos los taxones parasitarios, lo cual podría reflejar una alta susceptibilidad de esta categoría de animales, debido tal vez a falta de madurez inmune, así como a diversos elementos estresantes (destete, cambio de hábitat, hacinamiento, manejo intensivo). Algunos factores ambientales (el nuevo hacinamiento, la mezcla de animales de distintos orígenes y la alta rotación de lotes en el mismo potrero) posiblemente también influyen en dicha situación.
Entre las posibles razones por las cuales no apareció M. hirudinaceus en esta categoría, se pueden mencionar el largo período prepatente de este parásito (tres meses (Carballo, 1978), y la ausencia del hospedador intermediario (Dilobobderus abderus) en los sitios en que se mantiene a esta categoría. Las pocas veces que se observaron huevos de M. hirudinaceus fue en adultos, que se encontraban a campo, concordando con lo descrito en la bibliografía (Carballo, 1978). Las coccidias y B. coli se encontraron en todas las categorías, cabe destacar que este último, es el único protozoario ciliado que es una zoonosis e incluso se han reportado casos en nuestro país (Tálice & Vogelsang 1928, en Castro & Trenchi (1935-1954); Gezuele y col., 2005).
También Sampaio y Salles encontraron múltiples taxones parasitarios en sus muestras de “cachorros” y “gordos”, aunque, a diferencia de los presentes resultados, no hallaron huevos de Metastrongylus spp.
Un hecho llamativo fue la baja prevalencia de A. suum, a pesar de la gran importancia que se le suele asignar a este parásito, y la mayoría de las veces que se vio fue en las categorías de recría-engorde. Tal vez esta baja prevalencia se deba en parte a las estaciones del año en que se realizó el presente muestreo (otoño e invierno), y en épocas más cálidas pueda ser más prevalente. También es importante mencionar que dos de los cuatro establecimientos en que se encontraron huevos de A. suum no utilizaban drogas antihelmínticas. En las ocasiones que se registró T. suis fue exclusivamente en animales de las categorías nombradas anteriormente, y éste sumado a A. suum son parásitos que producen grandes pérdidas económicas por retraso del crecimiento de los cerdos (Carballo, 1978; Freyre, 1990).
A diferencia del trabajo de Sampaio y Salles, en las muestras aquí analizadas no se observó la presencia de huevos de Trichuris en la categoría de adultos. A su vez, dichos autores no hallaron huevos de Strongyloides en esta categoría, que sí se encontró, aunque a baja prevalencia, en las presentes muestras, y, como ya se dijo, tampoco encontraron huevos de M. hirudinaceus.
Es de resaltar el hallazgo de huevos de S. ransomi en muestras de dos cerdas, pues la presencia de este parásito se suele asociar a animales jóvenes. En efecto Roepstorff & Nansen (1994) señalan que los cerdos jóvenes adquieren una fuerte inmunidad contra este parásito. A pesar que la presencia de S. ransomi se toma en la literatura como indicador de mala higiene (Pinilla y col., 2005) en nuestro trabajo no se pudo comprobar esto.
Roepstorff & Jorsal (1989), realizando estudios coproparasitarios en granjas porcinas de Dinamarca, encontraron que en todos los establecimientos la prevalencia de los helmintos fue claramente dependiente de la edad. Mediante examen coprológico de suinos de 66 establecimientos, hallaron solo tres tipos de huevos de helmintos: A. suum fue el más prevalente (88%), seguido por Oesophagostomum spp. (58%) y T. suis (23%). En los cerdos de engorde y cerdas jóvenes la prevalencia de A. suum fue mayor que en las categorías adultas, lo que coincide con lo observado en nuestro trabajo, en tanto que la prevalencia de Oesophagostomum spp. aumentó con la edad. En cuanto a las formas de diseminación de T. suis solo se encontraron esporádicamente.
Surumay y col. (1994), trabajando en Venezuela, encontraron al igual que nosotros, muestras fecales de cerdos positivas a Hymenolepis, con la salvedad de que en nuestro caso eran de H.diminuta y en las de ellos H.nana. Estos autores, también atribuyen el hallazgo a la posible contaminación de los corrales con heces de roedores. En su trabajo, por otra parte, no se detectaron formas de diseminación de Metastrongylus, Macracanthorhynchus, ni B. coli, pero sí, como en el presente trabajo, huevos de A. suum, T. suis, Estrongiloideos, S. ransomi y ooquistes de coccidias.
En cuanto a las coccidias, Surumay y col. (1994) no encontraron ooquistes de Eimeria en los lechones, y sí lo hicieron en recría-engorde y adultos. Sin embargo, aparecieron ooquistes de Isospora suis en los tres grupos (categorías) de animales muestreados, presentando los lechones (de un día a 13 semanas de nacidos) la mayor prevalencia de ese último género. Esto coincide con lo señalado por varios autores, que atribuyen a I. suis la capacidad de causar coccidiosis clínica en lechones lactantes, y a Eimeria spp. principalmente en recría-engorde y adultos, sugiriendo entonces que los animales de estas dos categorías juegan un papel importante en las piaras como portadores. Situación semejante sucede con T. suis, el cual dichos autores encontraron generalmente al comenzar el engorde, dato coincidente con los resultados de nuestro trabajo.
En los seis criaderos que mantenían a los animales exclusivamente en confinamiento fue baja la prevalencia de infección con coccidias y nematodos GI (en dos y un establecimiento, respectivamente). Con respecto a las coccidias, los animales criados en confinamiento quizá desarrollen resistencia inmunitaria a la reinfección con ooquistes (Sánchez y col., 2006). En el caso de los nematodos GI tal vez el excesivo pisoteo destruya las larvas infectantes. Por otro lado, la totalidad de los criaderos en condiciones de confinamiento presentaban Balantidium, lo que podría indicar que este protozoario genera una escasa respuesta inmunitaria.
Ascaris suum y T. suis se presentaron en establecimientos de cría en confinamiento y mixtos, siendo negativos a estos parásitos los cerdos de los 13 establecimientos que los tenían en condiciones de campo. Esto se puede explicar porque estos géneros parasitarios fueron encontrados mayormente en la categoría recría-engorde, y los animales de esta categoría en general no son mantenidos en condiciones de campo, como sí lo son los animales adultos.
Los huevos de Metastrongylus spp. se observaron en animales provenientes de sistemas de producción tanto a campo, en confinamiento y mixto. Esto se explica porque los hospederos intermediarios de Metastrongylus (las lombrices de tierra) tal vez puedan vivir en diversos tipos de ambientes con la condición de que se conserve una capa de tierra en alguna parte del hábitat. Es decir, a diferencia de los escarabajos hospedadores de M. hirudinaceus, las lombrices no están restringidas a localizarse sólo en condiciones de campo.
Llamativamente, los establecimientos en que se alimentaba a los animales con ración, o con ración y pasto, fueron también los que presentaron mayores prevalencias de Ascaris, Trichuris y Metastrongylus. Esto refleja probablemente un problema de higiene y de humedad ambiental, que favorecen la supervivencia de los huevos de los dos primeros géneros y la presencia de lombrices de tierra. Por el contrario, la prevalencia de coccidias, B. coli y los nematodos GI varía poco con los distintos tipos de alimentación.
En cuanto a la convivencia con otros animales productivos (bovinos, ovinos, gallinas), en los criaderos en que ello ocurría tendió a haber un mayor número de especies de parásitos en los suinos (media: 3.46 especies), en comparación con los establecimientos en donde no habían otras especies productivas (media: 2.33 especies de parásitos por establecimiento). No obstante, dichos valores no presentaron diferencias estadísticas significativas (test de Mann Whitney, p>0.10).
Con respecto a la importancia que los productores asignan a las parasitosis, el 70 % de ellos consideran que las parasitosis son significativamente o muy importantes en la producción suina. Para el resto, salvo un productor que consideró que los parásitos carecen totalmente de importancia, la importancia de las parasitosis es escasa.
De los nueve productores que asignaron poca o ninguna importancia a las parasitosis, ocho de ellos actuaban en consecuencia y no administraban ningún tipo de antihelmíntico a sus animales. Con respecto a los 12 productores que consideraban que las parasitosis tenían una importancia significativa, su conducta con respecto a la administración de antihelmínticos se dividió en tercios iguales: un tercio no utilizaba drogas antihelmínticas, un tercio desparasitaba esporádicamente y otro tercio lo hacía frecuentemente. De los nueve productores que asignaban mucha importancia a las parasitosis, siete administraban frecuentemente antihelmínticos.
Las drogas utilizadas pertenecían a dos grupos químicos: lactonas macrocíclicas (Ivermectina y Doramectina) e imidazotiazoles (Levamisol), solos o combinados entre sí. Algunos productores alternaban entre estos dos principios activos. O sea que en ningún caso se utilizaron drogas efectivas contra protozoarios.
Dejando de lado, entonces, los protozoarios, en ocho establecimientos no se encontraron huevos de helmintos; siete de esos ocho establecimientos correspondían a productores que dosificaban frecuentemente. El promedio de especies de helmintos por establecimiento fue de 1.6 para los establecimientos que no desparasitaban (N = 13), también de 1.6 para los que desparasitaban esporádicamente (N = 5) y de menos de la mitad, 0.6, en el caso de los establecimientos que desparasitaban frecuentemente (N = 12). Esto permite inferir que el empleo de tratamientos antihelmínticos tiene un efecto positivo en disminuir la presencia y la variedad de taxones helmínticos. No obstante, dado el muy limitado número de principios activos utilizados, en un programa de desparasitación frecuente, se debería estudiar en profundidad la potencialidad de desarrollo de resistencia antihelmíntica como se hace en otras especies productivas. A este respecto, interesa señalar que ya se han diagnosticado en otros países cepas de Oesophagostomum sp. de suinos resistentes al levamisol (Bjørn y col. 1990).
Mediante técnicas coprológicas de flotación se pudieron diagnosticar exitosamente coccidias, nematodos GI, T. suis y S. ransomi, mientras que Metastrongylus sp. fue más fácilmente diagnosticable mediante la técnica de sedimentación. En el caso de A. suum los resultados son difíciles de conciliar: se diagnosticó en técnicas de flotación con soluciones de densidad inferior a 1.30 y en técnicas de sedimentación; tal vez estos resultados se deban al escaso número de veces que se diagnosticó a este helminto. Para M. hirudinaceus tanto las soluciones densas (densidad mayor a 1.30) como la sedimentación fueron eficaces en la recuperación de sus huevos. En cambio, los quistes fecales de B. coli aparecieron exclusivamente mediante la técnica de sedimentación.
Se confirma, entonces, que la técnica de flotación con soluciones de densidad mayor a 1.30 (sulfato de magnesio o de zinc) es la que permite recuperar la gran mayoría de los elementos parasitarios en el caso de los suinos, aunque quizá no sea tan efectiva como la sedimentación en recuperar los huevos de Metastrongylus spp.
Ahora bien, en el caso de pretender diagnosticarse específicamente al ciliado B. coli se hace necesario recurrir a técnicas de sedimentación.
Si bien los métodos diagnósticos eran cualitativos, el hecho de ver generalmente pocos elementos diseminativos por muestra analizada sería indicativo de bajas cargas parasitarias y, por tanto, de ausencia de cuadros clínicos debidos a parasitosis, lo que concuerda con lo observado en los criaderos al momento de recoger las muestras.
Aunque el número de ooquistes de coccidias que se lograron esporular no fue muy significativo, todos ellos pertenecían al género Eimeria, identificándose tentativamente tres especies que según la literatura (Cordero del Campillo y col., 1999; Sánchez y col., 2006) son potencialmente patógenas para los lechones: E. debliecki, E. scabra y E. polita. La especie Isospora suis, considerada la más patógena (Cordero del Campillo y col., 1999; Sánchez y col., 2006), no pudo ser diagnosticada en este estudio, pero no podemos descartar su presencia.
Sólo en cinco establecimientos la cantidad de huevos de nematodos GI fue suficiente como para permitir el cultivo de larvas; en dos de ellos se encontró Oesophagostomum sp., en dos se halló Oesophagostomum sp más H. rubidus, y en un establecimiento se halló H. rubidus. Además, en dos de los establecimientos se encontraron larvas que no pudieron ser asignadas a ninguno de dichos dos géneros, ni tampoco a Trichostrongylus spp. por no ser de cola corta. El único otro género de Strongyloideo presente en suinos que elimina huevos morulados con las heces es Bourgelatia, pero no se pudo hallar la descripción de sus larvas en la literatura. .
Según Cordero del Campillo y col., 1999 los quistes de B. coli son casi esféricos y miden entre 40-100 micras, lo que coincide bien con los resultados de nuestro estudio (Cuadro 5). Lo mismo ocurre con las medidas registradas de los huevos (largo y ancho) de A. suum, T suis, S. ransomi y M. hirudinaceus que son compatibles con las registradas por Cordero del Campillo y col., 1999; Thienpont y col., 1986, aunque en el caso de Metastrongylus spp. y de nematodos GI algunas de nuestras mediciones caen por fuera del rango señalado por dichos autores.
Conclusiones
- Los 32 establecimientos estudiados fueron positivos a al menos un taxón de parásitos.
- En la categoría lechones se observaron solo protozoarios.
- La categoría recría-engorde presentó la totalidad de los taxones parasitarios observados en este trabajo salvo M. hirudinaceus.
- Es destacable la alta prevalencia del protozoario ciliado zoonótico Balantidium coli, en todas las categorías estudiadas.
- Llamativamente, se halló una baja prevalencia de Ascaris suum.
- Aunque las técnicas de flotación con soluciones de alta densidad (> 1.30) permitieron detectar la mayor parte de los géneros parasitarios, los quistes de Balantidium sólo se diagnosticaron por sedimentación, por lo que estas técnicas tienen un carácter complementario en el diagnóstico coprológico de suinos.
- Según se desprende de los resultados de la encuesta, junto con el relevamiento coproparasitario, el empleo de tratamientos antihelmínticos tiene un efecto positivo en disminuir la presencia y variedad de taxones helmínticos.
Bibliografía
1. Acha, P., Szyfres, B. (2003). Zoonosis y Enfermedades Transmisibles Comunes al Hombre y a los Animales. 3a. Ed. Washington D.C. Publicación Científico y Técnica No. 580. OPS-OMS. Vol. III. 413 p.
2. Benítez, G., D. Capellino. (2008). Estudio de lesiones con aspecto de Echinococcosis quística en la especie porcina (Sus scrofa domesticus). Tesis de Grado, Facultad de Veterinaria, Universidad de la República. 90 p.
3. Bjørn, H., Roepstorff, A., Waller, P. J. & Nansen, P. (1990). Resistance to levamisole and cross-resistance between pyrantel and levamisole in Oesophagostomum quadrispinulatum and Oesophagostomum dentatum in pigs. Vet. Parasitol., 37: 21-30.
4. Brea, R. J., Nieto, C. A. (1937). Balantidiasis humana en el Uruguay: (Contribución a su estudio). Arch. Urug. Med. Cir. Espec., 11: 720-733.
5. Calzada, V. ( 1935). Sobre los helmintos que parasitan los animales del Uruguay. Metastrongylus apri (Gmelin, 1791), Metastrongylus brevivaginatus Ralliet y Henry, 1907, Nematodirus spathinger (Ralliet 1896), Trichostrongylus extenuates (Railliet, 1898) Ransom, 1907. La primera comprobación en Uruguay. Arch. Soc. Biol. Montevideo, 6 (1): 32-50.
6. Capra, G., (2003). Sistemas de producción de cerdos en el Uruguay - Revista Plan Agropecuario, 47-52. Disponible en: http://www.planagro.com.uy/publicaciones/revista/R106/R106_47.pdf. Fecha de consulta: 17/08/2013.
7. Capra, G., Repiso, L., Fadiletti, F., Martínez, R., Cozzano, S., R. Márquez. (2011). Efecto de la dieta de cerdos en crecimiento sobre el valor nutritivo y la aptitud tecnnológica de la carne y grasa. Rev. Lab. Tec. Uruguay, 6: 11-20.
8. Carballo, M (1978) Importancia de las Endoparasitosis en la Producción de Cerdos. Veterinaria (Montevideo) 14 supl 2: 17-25.
9. Carballo Pou, M. (1947). Curso de Parasitología Veterinaria. (Apuntes de clases dictadas por el Dr. Mariano Carballo Pou, Director del Instituto de Anatomía Patológica y Parasitología de la Facultad de Veterinaria) An. Fac. Uruguay, (Apartado), 5 (1): 7-74.
10. Cassamagnaghi, A. (h). (1941). Trichuris trichuria en los cerdos del país. Bol. Dir. Ganad. Uruguay, 25 (3): 414-418.
11. Cassamagnaghi, A. (1942). Contribución al estudio de los parásitos del cerdo en el Uruguay. An. Fac. Vet. Uruguay, 1: 153-156.
12. Cassamagnaghi, A. (h). (1946). La oesofagostomosis suina. Dos especies reconocidas en los cerdos del país. Su importancia económica. Bol. Dir. Ganad. Uruguay, 28 (1): 429-442.
13. Castro, E., Trenchi, H. (1954). Fauna parasitológica comprobada en el Uruguay. Rev. Med. Vet. Uruguay, 7 (54): 1-77.
14. Castro, G. (2011). Informe de actividades de vigilancia epidemiológica en porcinos desarrolladas en 2011. DGSG, MGAP. Uruguay. Comunicación personal. 11/09/2013.
15. Castro, G. (2012). Informe de actividades de vigilancia epidemiológica en porcinos desarrolladas en 2010. DGSG, MGAP. Uruguay. Comunicación personal. 18/09/2013.
16. Castro, G. (2013). Datos de la cadena productiva porcina de Uruguay. DGSG, MGAP. Uruguay. Comunicación personal. 18/09/13.
17. Cordero del Campillo, M., Hidalgo ArgÜello M. R.; Díez Baños N. (1999) Parasitosis del aparato digestivo. En: Cordero del Campillo M., Rojo Vázquez F. A. Parasitología Veterinaria, Madrid, McGraw Hill-Interamericana, pp. 451- 482.
18. D’Alessandro, J., Perdomo, E. (1987). Diarreas en lechones posdestete asociada a Balantidium coli. IV Congreso Nacional de SMVU, Montevideo 11- 14 de noviembre. Uruguay. p 42.
19. Facultad de Agronomía, DIEA y Plan de Promoción Granjero. (1988). Encuesta sobre la situación porcina en el Uruguay. Ed. Facultad de Agronomía. Uruguay. [S.l.] : [s.n]. 55 p.
20. Freyre, A (1990) Parásitos internos del cerdo. Rev. Plan Agrop. 18 (53): 26- 29.
21. Gezuele, E.; Fernández, N.; Dimenza, M., Ponte, P. (2005) Un caso de balantidiasis humana paucisintomática, Rev. Med. Uruguay 21: 164-166.
22. Hindsbo, O. Nielsen, C. V.; Andreassen, J.; Willihgham, A.; Bendixen, M. A.; Nielsen, M. ; A., Nielsen, N. O. (2000). Age-dependent ocurrence of the intestinal ciliate Balantidium coli in pigs at a danish research farm. Acta Vet. Scand. 41 (1): 79-83.
23. Lapage G. (1982). Parasitología Veterinaria, México, Ed. Continental 790 pp.
24. MGAP-DIEA-INIA. (2006). Encuesta Porcina. Uruguay. No publicado.
25. MGAP-DIEA. (2010). Anuario Estadístico Agropecuario. Disponible en: www.mgap.gub.uy/Dieaanterior/.../DIEA-Anuario-2010w.pdf. Fecha de consulta: 12/09/13.
26. Niec, R (1968). Cultivo e identificación de larvas infectantes de nematodes gastrointestinales del bovino y ovino. Román Niec: Buenos Aires: INTA. 37p.
27. Osimani JJ. (1982). Ciliados. Balantidiasis. En: Osimani JJ. Parasitología Médica. Montevideo: Librería Médica. Vol.I, p. 146-155.
28. Pardo, G., García y Santos, R. (1982). Parasitosis de importancia en la producción de cerdos. Alm. Bco. Seg. Estado. Uruguay, p. 212-219.
29. Pardo, G., García y Santos, R. (1985). Algunas de las afecciones más comunes en el cerdo y su prevención. Alm. Bco. Seg. Estado. Uruguay, p. 146-153.
30. Pinilla, J.C.; Dasilva, N.; González, C., Tepper, R. (2005) Prevalencia e intensidad de infección de parásitos gastrointestinales en cerdos alojados en diferentes sistemas de producción, Rev. UNELLEZ. Cien. Tec. 23: 51-61.
31. Riet Correa, F. (1978). Enfermedades de los suinos diagnosticadas por el Centro de Investigaciones Veterinarias “Miguel C. Rubino” durante el período 1969-1976. Veterinaria (Montevideo), suplemento nº 2: 5-10.
32. Rodríguez González, M., Castro, E., Podestá, M., Fostel, R., y Ottonelli, J. (1958). Comprobación en suinos de Sarcoptes scabiei var. suis y dos especies diferentes de Eimeria. An. Fac. Vet. 8, (6): 259.
33. Rodríguez González, M., R. Tramontano (1955). Obstrucción del colédoco por Ascaris suis. Rev. Med. Vet., Uruguay, 8 (55): 36-38.
34. Roepstorff, A., Jorsal, S.E. (1989). Prevalence of helminth infection in swine in Denmark. Vet. Parasitol. 33: 231-239.
35. Roepstorff, A., Nansen, P. (1994). Epidemiology and control of helminth infections in pigs under intensive and non intensive production systems. Vet. Parasitol. 54: 69-85.
36. Roepstorff, A., Nansen, P. (1998). Epidemiology, diagnosis and control of helminth parasites of swine. FAO Animal Health Manual N° 3, Roma, 161 pp.
37. Rosso, H.; Geribaldi, P.; Campot, J.; Mato, D.; Reiggia, S., Techera, V. (1991). Hallazgos de patología pulmonar en cerdos faenados. II Jornadas Técnicas de la Facultad de Veterinaria, Montevideo, p. 171.
38. Sánchez Acedo C. y col (2006). Coccidiosis porcinas. Disponible en: http://www.engormix.com/MA-porcicultura/sanidad/articulos/coccidiosisporcinat999/165-p0.htm. Fecha de consulta: 10/10/2013.
39. Surumay, Q; Moreno, L; Morales, G; Morales, A., Castillo, L. (1994). Parasitosis porcinas diagnosticadas en el instituto de investigaciones veterinarias período 1987-1992. Vet. Trop. 19: 63-70.
40. Talice, R. (1943). ¿Constituye la triquinosis un problema médico-higiénico en el Uruguay? Arch. Uruguayos Med. Cir. Esp. 23 (6): 535-553.
41. Thienpont, D.; Rochette, F., Vanparijs, O (1986). Diagnosing helminthiasis by coprological examination. 2ª. ed, Beerse: Janssen Research Foundation, 205 p.
42. Viera, O. y Pereira Fonseca, T. (1938). Descripción de un interesante caso de parasitosis masiva de hígado de suino (lechón) por Ascaris suum o lumbricoides. An. Fac. Vet., Uruguay, 4: 373-374.
43. Vogelsang, E. (1927). Enorme invasión de Ascaris en un porcino. Rev. Med. Vet., Uruguay, 29: 474.
44. Xavier, J.; Salles, J.; Etchegaray, F., Silva, M. (1983). Comunicación sobre acantocefalosis suina en un establecimiento del Departamento de Canelones. Primera comprobación. Primeras Jornadas Técnicas de la Facultad de Veterinaria, 6-7 de octubre. Uruguay, pp. 52-53.






 * Un establecimiento positivo fue muestreado dos veces.
* Un establecimiento positivo fue muestreado dos veces.