Nuevos avances en el diagnóstico y control de Actinobacillus pleuropneumoniae, un patógeno todavía de actualidad
Publicado: 17 de enero de 2012
Por: M. Gottschalk, DMV, PhD, Profesor Titular. Facultad de Medicina Veterinaria, Universidad de Montreal,Québec, Canada.
Introducción
La pleuroneumonía porcina causada porActinobacillus pleuropneumoniae (App) es una enfermedad contagiosa que se encuentra distribuida en todo el mundo causando importantes pérdidas económicas1. Los signos clínicos principales en la fase aguda de la enfermedad son anorexia, depresión, fiebre, tos, disnea y/o polipnea y a veces vomito. La enfermedad puede progresar rápidamente y la muerte puede ocurrir en pocas horas. Siendo, en algunos casos, el hallazgo de cerdos muertos el primer indicio de la presencia de App. La enfermedad también puede manifestarse bajo la forma crónica, donde los signos clínicos son menos evidentes, pero las pérdidas de producción y las lesiones al matadero (así como adherencia, pleuritis y abscesos pulmonares) son comúnmente observadas. Por último, en muchas explotaciones el App está presente en forma subclínica. Esto ocurre de manera frecuente en granjas convencionales afectadas no solo con diferentes serotipos de baja virulencia (véase más adelante), sino también con serotipos de alta virulencia. En este último caso, pueden surgir brotes en la presencia de enfermedades concomitantes o como consecuencia de cambios de manejo en la piara1. Por consiguiente, la identificación temprana de granjas infectadas de forma subclínica es crucial para el control de la enfermedad donde los animales portadores son una de las fuentes principales de transmisión entre los animales. La aparición de la enfermedad clínica en estos brotes está relativamente bien controlada en Estados Unidos y Canadá, pero sigue siendo un problema en varios países de Latino-América, El Caribe, Asia y Europa. El destete precoz, practicado en sistemas de producción multisitios, ayuda en muchos casos a controlar la enfermedad clínica en América del Norte. De hecho, en Canadá y Estados Unidos, dinero y esfuerzo han sido principalmente dirigidos hacia el monitoreo de las infecciones subclínicas en las granjas de reproductores y en el mantenimiento de granjas libres sea de los serotipos virulentos más comunes de App (granjas comerciales convencionales)o de todos los serotipos de App (granjas de alto nivel sanitario o “SPF”). Casos clínicos han sido observados ocasionalmente en granjas SPF de alto estatus sanitario, infectadas con serotipos menos virulentos (observaciones no publicadas). La estandarización y aplicación de nuevas herramientas de diagnóstico ha tenido un gran impacto en el diagnóstico, control y eliminación de estas infecciones subclínicas. Durante mis 25 años de experiencia en esta enfermedad, he estado expuesto de manera frecuente a situaciones donde veterinarios experimentados han tenido que tomar decisiones difíciles concernientes al estatus de App de granjas, particularmente en ganados multiplicadores y núcleos.
Excepcionalmente, algunas de estas situaciones terminan en tribunales de justicia. ¿Sin embargo, existe una forma de reducir las probabilidades de que esto pase, y ayudar a los médicos veterinarios a tomar la decisión correcta? Este documento tratará de abordar las preguntas más formuladas y relevantes del tema.
Una corta introducción sobre el agente etiológico
App puede ser clasificado en base a sus características de crecimiento in vitro y sus requerimientos por el factor V (NAD) en2 biotipos, biotipo I (NAD-dependiente) y biotipo II (NAD-independiente). Este dato es más importante para los expertos en diagnostico que para los médicos veterinarios. Sin embargo, estos últimos deben tener en cuenta que las cepas clasificadas como biotipo II, a veces reportadas como App atípicas, pueden causar problemas clínicos sobre el terreno2. Ocasionalmente, estas cepas no pueden ser aisladas en animales portadores con la utilización de procedimientos que han sido estandarizados para la detección de cepas típicas del biotipo I. De hecho, estas cepas del biotipo II no presentan los patrones típicos de crecimiento observados en el biotipo I de App (bien conocidos por la mayoría de veterinarios) y las colonias son semejantes a las de Actinobacillus suis, que viene a complicar el diagnostico de casos clínicos. En este momento, tenemos 15 serotipos reconocidos (según la composición del polisacárido capsular) de App. De estos, los serotipos del 1 al 12 y el 15 han sido descritos como biotipo I de App, y los serotipos 13 y 14 como atípicos del biotipo II. Algunas cepas de los serotipos 2, 4, 7 o 9 pueden clasificarse también como atípicas del biotipo II, descritas principalmente en Europa2. Para complicar aún más las cosas, hay excepciones que pueden producirse. Como por ejemplo, las cepas del serotipo 13 del biotipo I (App típica) que han sido recientemente aisladas en Canadá y EE.UU. Algunos serotipos comparten antígenos comunes (a nivel de los LPS). Estos antígenos son actualmente usados en pruebas serológicas (véase más adelante) y clasificados en grupos serológicos: serotipos 1, 9 y 11; serotipos 3, 6, 8 y 15; serotipos 4 y 7. La diferencia del serotipo 5 en 5a y 5b no tiene ninguna aplicación práctica (diferencias antigénicas mínimas) y ambos tienen un potencial de virulencia similar. Algunas cepas que no se pueden tipificar (del biotipo I y el biotipo II) también han sido aisladas de casos clínicos en EE.UU. y Europa (resultados no publicados). Sin embargo, estas cepas no tipificables son extremadamente raras; además, mucha precaución debe tomarse cuando algunas de ellas son aisladas de cerdos clínicamente sanos, ya que pudieran ser especies diferentes de App (véase más adelante).
1. ¿Están los serotipos virulentos de App distribuidos geográficamente igual?
La respuesta es NO. Esto es muy importante, ya que la vigilancia serológica para detectar los animales infectados subclínicamente, debe normalmente ser dirigida hacia los serotipos más importantes en un país o continente dado. ¿Pero, cuáles deben ser considerados como "los serotipos más importantes"? Este es uno de los muchos aspectos incomprendidos de esta infección: a pesar del comercio internacional, algunos de los serotipos virulentos de App persisten en un continente y están ausentes en otros. La prevalencia de un serotipo debe ser estrechamente asociada a los serotipos aislados de los animales enfermos. Por App, los serotipos que son altamente prevalentes por serología (animales infectados subclínicamente) son a menudo diferentes de esos que son frecuentemente aislados de los animales enfermos, como recientemente se demostró en Canadá 4. Además, algunos serotipos son "altamente contagiosos" (véase más adelante), algunas granjas positivas son detectadas fácilmente por serología, mismo cuando una cantidad pequeña de animales por granja es evaluado. Los médicos veterinarios deben interpretar cuidadosamente los resultados de "prevalencia" publicados en la literatura. También, la mayoría de estudios no distinguen las cepas aisladas provenientes de granjas diferentes de un mismo sistema piramidal: una misma cepa serotipada varias veces en el mismo sistema puede cambiar la verdadera prevalencia de un serotipo asociado a la enfermedad en un área determinada. Por último, datos confiables de serotipos asociados a casos clínicos quedan perdidos (o son viejos) en muchos países. Esta información debe ser accesible, puesto que cualquier medida de control que el país quisiera tomar, debe ser basada en los serotipos más importantes de cerdos clínicamente afectados.
Tabla 1: Serotipos de App más comúnmente asociados a la enfermedad en diferentes áreas (pueden existir ciertas excepciones)
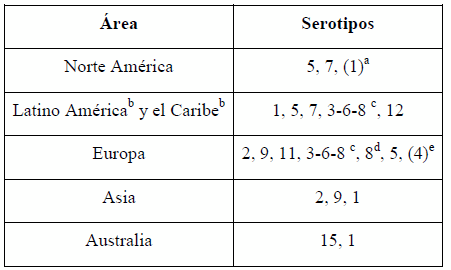
a Frecuentemente el serotipo más extendido, también es rápido a aislar de animales enfermos
bDatos disponibles en pocos países. Según cepas que he recibido de Argentina, al menos los serotipos 1, 4, 5, 7, 12, 3/6/8 y 15 están presentes
c Reacción cruzada: difícil a diferenciar
d PCR confirmado: Reino Unido
e Solo España, raro en otros países
bDatos disponibles en pocos países. Según cepas que he recibido de Argentina, al menos los serotipos 1, 4, 5, 7, 12, 3/6/8 y 15 están presentes
c Reacción cruzada: difícil a diferenciar
d PCR confirmado: Reino Unido
e Solo España, raro en otros países
Finalmente, existen serotipos que son considerados con una virulencia de baja a moderada en la mayoría de los países (serotipos 3, 12, 10, 14). Los serotipos 10 y 14 no han sido aislados en la mayoría de los países y son extremadamente raros. El serotipo 12 puede causar la enfermedad clínica pero la mayoría de las veces no es el causante de brotes epidémicos. El serotipo 3 siempre ha sido considerado como un serotipo de baja virulencia. Es curioso como el Reino Unido fue el único país que reportó que la mayoría de los aislados provenientes de animales enfermos corresponden con este serotipo. Recientes investigaciones, utilizando técnicas de PCR, demostraron que estos aislados eran en realidad serotipo 8 y no serotipo 3, confirmando de esta manera datos previos sobre la baja virulencia del serotipo 35. Además, estos datos confirmar la dificultad de diferenciar los serotipos 3, 6 y 8 con el método de serotipificación.
2. ¿Todas las cepas de un serotipo dado presenta la misma virulencia?
La respuesta es NO. Como se puede observar en la tabla 2, aislados de un mismo serotipo pueden variar en su virulencia, a veces dependiendo de su lugar de origen. Animales infectados experimentalmente con el serotipo 2 de cepas francesas de App, manifestaron signos clínicos pocas horas post-inoculación y una alta mortalidad. Animales infectados con cepas canadienses del mismo serotipo no presentaron ningún signo clínico, ni tan siquiera fiebre. Este es un ejemplo evidente de la diferencia entre dos grupos de cepas del serotipo 2: las cepas europeas producen las toxinas ApxII y ApxIII, mientras que las cepas canadienses (y EE.UU.) producen ApxII solamente. Sin embargo, no está completamente aclarado si tal diferencia puede explicar la falta total de virulencia. Más interesante aun, los animales infectados con la cepa canadiense fueron completamente protegidos contra la cepa francesa en un segundo desafío (resultados no publicados). Por otra parte, cepas del serotipo 4 son descritas como altamente virulentas en España, pero no es así en la mayoría de los otros países donde está reportada. Cuando se compararon 2 cepas aisladas de animales clínicamente sanos en Canadá (únicas cepas aisladas hasta ahora en Norte América) con las cepas españolas, no se pudieron detectar diferencias en cuanto a la producción de toxinas ni en cuanto a características antigénicas (resultados no publicados). No obstante, infecciones experimentales con ambos tipos de cepas y en paralelo no han sido efectuadas hasta ahora. Finalmente, cepas del serotipo 15 en Australia son consideradas como importantes desde el punto de vista clínico, pero son aisladas ocasionalmente de casos puntuales (y no endémicos) en otros países, como Canadá, EE.UU., México, Japón y Brasil.
Tabla 2. Ejemplos de la variabilidad en virulencia de cepas de App de un mismo serotipo aislado en diferentes zonas geográficas
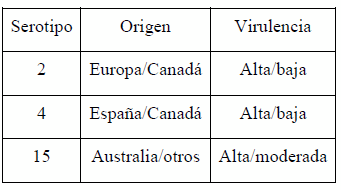
Por último, aunque la mayoría de cepas de un serotipo dado de un área geográfica especifica pueden tener un mismo potencial de virulencia, pueden darse algunas excepciones. Cepas del serotipo 1 de App, confirmadas genéticamente, aisladas en Canadá de animales sanos fueron incapaces de producir la enfermedad en una infección experimental en animales susceptibles (resultados no publicados).
3. ¿El nivel de virulencia está siempre relacionado con la presencia de toxinas?
Sin duda alguna, las toxinas Apx constituyen los factores de virulencia más importantes de App. Sin embargo, ellas no son los únicos. Está claro que la presencia de ambas toxinas, ApxI y ApxII, generalmente confieren un nivel de virulencia importante a las cepas de los serotipos 1, 9, 11 o 5. No obstante, esto no es siempre lo que ocurre. Algunas de las cepas no virulentas del serotipo 1 de Canadá, mencionadas anteriormente, carecen de genes responsables de la producción de toxinas (ApxI), pero otras poseían estos genes que codificaban para ambas toxinas (ApxI y ApxII).Por tanto, otros factores (hasta ahora no caracterizados) pueden tener un impacto en la virulencia de cepas. Otro ejemplo es la comparación de los serotipos 12 y 7. Ambos serotipos producen solamente ApxII; sin embargo, las cepas del serotipo 7 son más virulentas que esas del serotipo 12. El serotipo 7 es, en efecto, el segundo serotipo más frecuentemente aislados de animales enfermos en Canadá en los últimos años (resultados no publicados). Del mismo modo, el serotipo 10 fue originalmente (y erróneamente) reportado como altamente virulento, basado en la alta producción de la toxina hemolítica ApxI y la virulencia evaluada en un modelo de ratón. Sin embargo, de acuerdo a mis conocimientos, este serotipo nunca ha sido aislado de casos clínicos en Norte América y los reportes sobre los aislamientos de animales enfermos, en otros países, no son claros. Además, no se ha podido reproducir la enfermedad en animales infectados experimentalmente con estas cepas (resultados no publicados).
4. ¿Puede una misma cepa mostrar un grado mayor de virulencia en una granjay en otra no? Si la respuesta es "SI", ¿cómo hacer para confirmar que es la misma cepa comportándose de manera diferente y no dos cepas diferentes?
Estas dos preguntas son importantes y por la primera la respuesta es SI. Estuvimos hablando sobre serotipos virulentos; serotipos que son virulentos en un continente pero que no lo son en otro; cepas deficientes de determinadas toxinas o de algún factor de virulencia… pero, ¿la misma cepa provoca la enfermedad o no en dos granjas diferentes? Si, esto es posible, pero es difícil decir con qué frecuencia puede ocurrir. Esta es una de las razones porque todavía tenemos problemas con el App. Poniendo un ejemplo: una granja multiplicadora serológicamente positiva a un serotipo virulento (infección subclínica sin enfermos ni lesiones) que venda animales a una granja convencional conocida como libre de dicho serotipo; si aparecen signos clínicos en la granja convencional… ¿podemos sospechar que es la cepa presente en la multiplicadora? Es algo nada fácil a probar, pero es posible tener una cepa que no cause ningún signo clínico ni lesiones en una granja y cause problemas en otras con estados de salud y sistemas de manejo diferentes. Ya hemos demostrado un aumento significativo de la virulencia de cepas de App en un modelo de coinfección con Mycoplasma hyopneumoniae6.
En 2012, App permanece como un misterio en algunos aspectos. Queda claro que estas son situaciones donde una cepa virulenta quizás no produce la enfermedad en granjas bien controladas y con un buen sistema de manejo, sin la existencia de otras infecciones concomitantes importantes, pero pueda producir la enfermedad en condiciones menos favorables de crianza. Por otra parte, serotipos con una virulencia relativamente baja (como el serotipo 12) frecuentemente es el causante de la enfermedad en granja con un nivel sanitario elevado y libres de las infecciones más importantes. Sin embargo, este serotipo es mucho menos frecuente en ganados comerciales ya infectados por otros patógenos, incluyendo otros serotipos de App y A. suis. De esta manera se ha formulado la hipótesis que en tales granjas, los animales tendrían un nivel de anticuerpos suficientemente alto contra las toxinas (producidas por otros App o A. suis) que quizás protejan al animal contra cepas de baja virulencia. Esto es solo una hipótesis ya que todo no está aclarado ni conocido en lo que se refiere a este patógeno.
Para contestar a la segunda pregunta:¿cómo hacer para confirmar que las cepas presentes en dos ganados diferentes es una misma? Desafortunadamente, para esta pregunta, ojala pudiéramos formar parte de la teleserie C.S.I., pero no lo somos, y el análisis de resultados de laboratorio donde las cepas son genéticamente comparadas no es fácil. Primero, hay varias técnicas diferentes descritas en la literatura y es difícil determinar cuál es la mejor. Segundo, cuando dos cepas son diferentes según una técnica confiable, podemos asumir que ellas son diferentes. Pero cuando ellas son idénticas según la prueba de laboratorio… no podemos llegar a una conclusión. Muchas cepas de App son "clónales" (una sola cepa única o "clon" de donde todas las cepas fueron derivadas y distribuidas mundialmente), y como consecuencia no podemos diferenciarlas. Idénticas "genéticamente" no quiere decir que son 100% la misma cepa ya que una de ellas puede haber perdido (o adquirido) factores de virulencia, resistencia a antibióticos, etc. Un ejemplo: cepas virulentas francesas de App del serotipo 2, discutidas anteriormente, son genotípicamente idénticas a la normalmente cepa no virulenta canadiense del mismo serotipo. Entonces sería un error concluir que ellas son la misma cepa con el mismo potencial de virulencia. Sin embargo, ellas son probablemente similares antigénicamente, de la misma manera que cepas no virulentas brindaron una protección contra infecciones con cepas virulentas. A veces, la susceptibilidad a los antibióticos es también utilizada para comparar cepas: la concentración mínima inhibitoria debe ser usada para diferentes antibióticos, y las cepas deben ser enviadas a dos laboratorios diferentes (y comprobadas al menos dos veces en cada uno) para así comparar los resultados, ya que a veces son diferentes de acuerdo a la técnica usada. A veces en un mismo laboratorio hay variabilidad en los resultados de los análisis sobre una misma cepa.
Para contestar a la segunda pregunta:¿cómo hacer para confirmar que las cepas presentes en dos ganados diferentes es una misma? Desafortunadamente, para esta pregunta, ojala pudiéramos formar parte de la teleserie C.S.I., pero no lo somos, y el análisis de resultados de laboratorio donde las cepas son genéticamente comparadas no es fácil. Primero, hay varias técnicas diferentes descritas en la literatura y es difícil determinar cuál es la mejor. Segundo, cuando dos cepas son diferentes según una técnica confiable, podemos asumir que ellas son diferentes. Pero cuando ellas son idénticas según la prueba de laboratorio… no podemos llegar a una conclusión. Muchas cepas de App son "clónales" (una sola cepa única o "clon" de donde todas las cepas fueron derivadas y distribuidas mundialmente), y como consecuencia no podemos diferenciarlas. Idénticas "genéticamente" no quiere decir que son 100% la misma cepa ya que una de ellas puede haber perdido (o adquirido) factores de virulencia, resistencia a antibióticos, etc. Un ejemplo: cepas virulentas francesas de App del serotipo 2, discutidas anteriormente, son genotípicamente idénticas a la normalmente cepa no virulenta canadiense del mismo serotipo. Entonces sería un error concluir que ellas son la misma cepa con el mismo potencial de virulencia. Sin embargo, ellas son probablemente similares antigénicamente, de la misma manera que cepas no virulentas brindaron una protección contra infecciones con cepas virulentas. A veces, la susceptibilidad a los antibióticos es también utilizada para comparar cepas: la concentración mínima inhibitoria debe ser usada para diferentes antibióticos, y las cepas deben ser enviadas a dos laboratorios diferentes (y comprobadas al menos dos veces en cada uno) para así comparar los resultados, ya que a veces son diferentes de acuerdo a la técnica usada. A veces en un mismo laboratorio hay variabilidad en los resultados de los análisis sobre una misma cepa.
Dos granjas infectadas con la misma cepa quizás es la consecuencia de una transmisión indirecta (fómites o par aerosol como ocurre de manera más frecuente) o la introducción directa de animales portadores. Lo primero a hacer para prevenir la introducción de App en una granja porcina es asegurarse que los animales que serán introducidos no estén infectados. Los cerdos son obviamente la fuente mayor de infección y es de importancia capital encaminar todos los esfuerzos para determinar con precisión si los nuevos animales representan un peligro o no para el ganado. Para eliminar la posibilidad de que animales portadores utilizados como remplazo son los responsables de la introducción de la infección en una granja, deben haber pruebas serológicas contundentes negativas del ganado de origen. Estas son, sin embargo, datos claros que sugieren la transmisión indirecta del microorganismo, incluyendo el aerosol que es considerado en determinadas circunstancias como la fuente principal de contamination7.
5. La serología es reconocida como la mejor forma de identificar ganados infectados subclínicamente. ¿En la ausencia de signos clínicos, que categoría de animales deben ser muestreados?
Si, la serología es el medio diagnóstico más rentable. Los animales a muestrear dependerán del sistema de producción. Cuando es un sistema de tres sitios que recibe animales de una única granja de cerdas, los animales a muestrear serán los de cebo, siempre escogiendo los más adultos (cerca de 6 meses de edad). Lo mismo podemos hacer en sistemas de un solo sitio, donde los animales con frecuencia seroconvierten a edades tempranas. Como muestra las Figuras 1 y 2, los anticuerpos están presentes hasta los 6 meses de edad. Pero el problema sería cuando granja está infectada en el sitio 3 y además recibe animales provenientes de diferentes granjas de reproductoras. Ya que las diferentes fuentes son mezcladas; ¿Podemos muestrear los animales enseguida que llegan al sitio 3? ¿Se pueden muestrear cerdos muy jóvenes o del sitio 2? Veamos cómo podría comportarse la cinética de los anticuerpos en una piara donde el sitio 1 está infectado (reproductoras).
Normalmente, los lechones infectados y no infectados estarán juntos y algunos tendrán anticuerpos maternales. El decline de estos anticuerpos será a partir de la semana 4-8 (dependiendo del nivel de anticuerpos y también de la prueba usada en el laboratorio para su detección).En ese preciso momento, puede empezar la seroconversión en los animales infectados, pero el tiempo necesario para detectar estos anticuerpos estará influenciado de la prevalencia de la infección: que puede tomar de 3-4 semanas a 10-12 semanas por animal para seroconvertir, dependiendo de la prevalencia de los lechones infectados después del destete y de la carga bacteriana de los animales portadores (prevalencia) (ver Figuras 1 y 2). Algunos animales nunca desarrollaran anticuerpos detectables.
Figura 1:Cinética de anticuerpos contra App generalmente observada en granjas de un solo sitio (la cinética puede variar también en dependencia de la prevalencia de animales infectados)
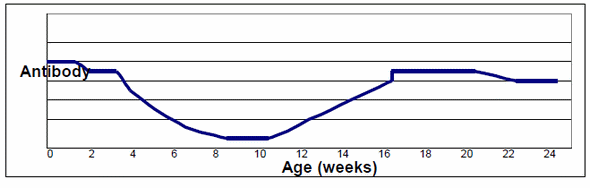
Figura 2: Cinética de anticuerpos contra App que puede ser observada en sistemas de producción multisitios (la cinética también puede variar en dependencia de la prevalencia de animales infectados)
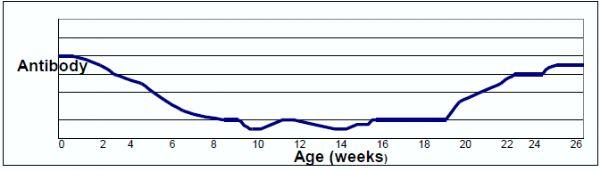
Entonces, lechones en el sitio 2 y por lo general, al comienzo del sitio3, serán serológicamente negativos, mismo si están infectados. Las cerdas deben ser el blanco para identificar cuáles de las granjas de sitio 1 están infectadas, infiriendo que los lechones vienen de estas reproductoras que podrían estar infectadas. Las pruebas serológicas a veces son eficientemente utilizados para el muestreo de reproductoras en Norte América. Sin embargo, debe tenerse presente que en la mayoría de los casos estas pruebas han sido validadas en los cerdos de crecimiento-engorde y no en animales adultos. Debe tenerse precaución a la hora de interpretar los resultados de la prueba usada, ya que pueden darse algunas reacciones no específicas. Los veterinarios deben trabajar estrechamente con los laboratorios diagnósticos par bien analizar los resultados. De todos modos, nuestra experiencia indica que las reproductoras pueden ser muestreadas con la serología (prueba de LPS como antígeno: pruebas de tipo “a”, ver la sección siguiente) y la información venida de estos análisis es muy útil (resultados no publicados).
6. ¿Qué prueba serológica debe ser utilizada?
Existen tres tipos de pruebas serológicas: a) las que son específicas para serotipo/serogrupo, b) las que pueden detectar todos los serotipos de App (sin discriminación entre serotipos) y c) las que pretenden diferenciar una mezcla de serotipos basados en algunos antígenos comunes.
-La prueba de tipo "a" usa como antígeno el LPS altamente purificado que puede identificar serotipos (como 2, 5, 10, 12 y 14) o serogrupos (como 1, 9, 11; 3, 6, 8, 15 o 4, 7) que afectan a la granja, ayudando a los veterinarios a tomar decisiones. Normalmente para reducir los costos, se escogen los serotipos más importantes causantes de los signos clínicos en el/los país/es (Tabla 1). Otra prueba también clasificada en esta categoría (que no está disponible comercialmente) es la prueba de fijación del complemento, en estos momentos usada por muy pocos laboratorios. Esta prueba presenta una alta especificidad pero muy baja sensibilidad y curiosamente es exigida por algunos países (Rusia, China) como prueba de referencia para la importación de animales. Al utilizar esta prueba se corre el riesgo de introducir animales infectados en estos países (resultados falsos negativos). Además, es relativamente difícil a estandarizar.
-La simple prueba de tipo "b" (detecta todos los serotipos de App sin discriminar ninguno) es disponible: es basada en ApxIV, una toxina que es especifica de App y que solamente es producida in vivo. Esta prueba debe ser principalmente utilizada para el monitoreo de granjas con un alto nivel de salud conjeturado como libre de App. Al utilizar esta prueba en ganados convencionales puede probablemente arrojar resultados positivos ya que la mayoría de estas granjas están infectados subclínicamente con serotipos de una virulencia relativamente baja. Estos resultados positivos deben ser confirmados con serotipos/serogrupos específicos en pruebas de ELISA para determinar si serotipos virulentos están presentes o no en la granja en cuestión.
- La prueba de tipo "c" utiliza como antígeno las toxinas ApxI o ApxII, entre otros. Bien que los serotipos productores de estas toxinas pueden ser detectados, la existencia de falsos positivos debe tenerse en cuenta, ya que especies de bacterias otras que App (como A. suis, presente en la mayoría de ganados)4 son capaces de producir estas toxinas. Normalmente la interpretación de este tipo de prueba es compleja.
Cuando se utilizan las pruebas serológicas, se debe tener en cuenta que la sensibilidad y especificidad va variar de una prueba a la otra. Por ejemplo, la detección de la presencia de los anticuerpos maternales: con la prueba de fijación del complemento la respuesta puede ser de 4 semanas, mientras que con un ELISA de LPS podría ser de hasta 9 semanas. Entonces los resultados obtenidos no son absolutos, ya que dependerán de la prueba empleada y la toma de decisiones (como por ejemplo: vacunación de lechones) puede ser afectada por esos resultados. Además, la medición de anticuerpos mediante la utilización de pruebas comerciales para evaluar la respuesta contra una vacuna no es siempre una buena idea. Las pruebas ELISA comerciales han sido desarrolladas, estandarizadas y validadas para medir anticuerpos en animales infectados. Animales vacunados desarrollaran anticuerpos contra los antígenos incluidos en la vacuna, y estos antígenos pueden ser diferentes a aquellos utilizados en el ELISA. Un resultado positivo puede ser interpretado como una respuesta vacunal. Sin embargo, resultados negativos no serán concluyentes a menos que se haya determinado con anterioridad que la prueba sea capaz de detectar anticuerpos desarrollados gracias a esa vacuna específicamente. Del mismo modo debe quedar claro, que por ejemplo, la prueba de ApxIV, detecta anticuerpos producidos contra un antígeno solamente in vivo.
Esto significa que los anticuerpos detectados con esta prueba no están asociados a una vacuna, a menos que sea una vacuna atenuada. Solo una vacuna atenuada (por el serotipo 5 de App)ha sido comercializada hasta ahora y no es ampliamente usada. Además, según mis conocimientos, no se conocen datos sobre los anticuerpos anti-ApxIV inducidos por esta vacuna. Finalmente es importante comprender que no hay una prueba con 100% de especificidad y 100% de sensibilidad. La mejor manera de optimizar la vigilancia serológica es muestreando un número significativo de animales como frecuentemente y razonablemente sea posible. Debe recordarse que resultados negativos muestreando 30 animales de un ganado de cebo no provee un 100% de certeza de la negatividad del ganado. De hecho, el nivel de detección dependerá, entre otras cosas, de la sensibilidad y especificidad de la prueba y de la prevalencia de la infección. Por ejemplo, en las explotaciones por bandas, se da el caso donde se han obtenido resultados negativos sobre 30 muestras de una banda, pero un numero claro de animales positivos en otro banda, (con la confirmación de la presencia de una infección subclínica en el ganado) (resultados no publicados). Esto simplemente demuestra que los resultados de una banda a otra no son necesariamente compatibles, por razones que hasta ahora no han sido identificadas.
7. ¿En un ganado infectado, el porcentaje de animales seropositivos puede variar de un serotipo a otro?
Definitivamente la respuesta es SI. Normalmente, no se encuentran altos niveles de seroconversión (baja prevalencia) en granjas infectadas subclínicamente con algunos serotipos de alta virulencia, como los serotipos 1, 9, 11 o 5, y los animales reactores pueden ser serológicamente no detectados. Mismo en granjas infectadas de forma crónica que manifiestan signos clínicos, a veces la seroconversión en los grupos de cebo no es tan alta como se hubiera esperado. Existen otros serotipos que son considerados altamente "contagiosos", al menos desde el punto de vista serológico. Los ganados infectados con los serotipos 3, 6, 8, 15, 12 y en menor medida, serotipo 7, generalmente presentan un alto nivel de seroprevalencia. Desde el punto de vista práctico, analizando 30 muestras, la presencia de 3-4 resultados claramente positivos, por los serotipos 1 y 5, pueden considerarse como muy significativa. Estos resultados ya han sido observados, en el pasado, en reproductoras en sistemas multisitios (con una sola fuente de cerdas) con la presencia de serios brotes clínicos causados por el serotipo 5 en el sitio 3: se muestrearon 30 animales del sitio 1 y de ellos solo 3 eran positivos8. Por otra parte, la mayoría de esas 30 cerdas muestreadas en el mismo sitio 1 fueron positivas al serotipo 7, aunque signos clínicos relacionados con este serotipo no se observaron en el sitio 38. De manera similar al serotipo 7, una granja porcina infectado con una cepa del serotipo 8 o 12, normalmente presentaran más del 50% de muestras positivas. De hecho, la alta "infectividad" de estos serotipos no es solo en "serología", pero es probablemente real, ya que en general los casos de fracaso en la aplicación un programa de destete precoz medicamentado para eliminar el App son asociados a los serotipos 3, 6, 8 o 12 (resultados no publicados).
8. ¿Es necesario detectar la presencia de App en granjas infectadas subclínicamente por otros medios que la serología?
Solo las granjas de reproducción que presenten algunos resultados serológicos positivos y que no parece conforme con la historia sanitaria del ganado quizás sea interesante hacer otras pruebas. Tres diferentes enfoques pueden tenerse en cuenta: a) aislamiento; b) detección del antígeno; c) detección del ADN. Pero las dos primeras interrogantes serían: 1. Qué animales deben seleccionarse para el muestreo y 2. Qué tipo de muestra. La primera pregunta es fácil a responder: se debe comenzar a muestrear los animales seropositivos. Se ha demostrado que, si los animales están infectados, habrá más posibilidad de detectar el App en esos que presentan anticuerpos9. Idealmente seria muestrear cerdos con una seroconversión reciente, pero esos animales son muy difíciles a identificar. La segunda respuesta es más complicada. Muchos veterinarios practicantes les gusta enviar muestras de pulmón mismo si no tienen lesiones. Es necesario aclarar que el App no es un habitante normal de los pulmones, y que si se encuentra, probablemente habría debido causar daños en este órgano. Enviar pulmones sanos de un animal seropositivo es, en la mayoría de los casos, una pérdida de tiempo: los resultados serán negativos. Muchas personas concuerdan que las amígdalas son las mejores muestras para ser analizadas, ya que App generalmente invade las criptas de este órgano. Hemos previamente demostrado la biopsia de amígdalas puede ser enviada como muestra, aunque la sensibilidad es más baja que al utilizar la amígdala entera9. El uso de hisopos o raspados ha sido sujeto de discusión varias veces, pero nunca ha sido validado en la práctica.
Volviendo a las técnicas utilizadas, el aislamiento toma demasiado tiempo y generalmente tiene baja sensibilidad, ya que las amígdalas son tejidos altamente contaminados. Hay pruebas que han sido desarrolladas basadas en la utilización de bolitas inmunomagnéticas y que tienen una alta sensibilidad y a veces son aplicadas10, 11, pero son caras y también toman tiempo para tener los resultados. Si una colonia aparentemente de App es aislada de una amígdala, esta debe ser confirmada con un PCR específico para App para que se considere realmente un App, ya que otros microorganismos similares pueden ser identificados equivocadamente por medio de pruebas bioquímicas tradicionales o serotipado. La detección de antígenos directamente de las amígdalas no es aconsejable ya que reacciones cruzadas con otras bacterias son presentes y casi siempre hay reacciones falsas positivas. La detección del ADN por PCR es usada frecuentemente. Sin embargo, si bien es útil, esta técnica requiere de validación: algunas de ellas son capaces de detectar todos los serotipos de App, y así pueden ser aplicadas en los ganados libres de este patógeno. Las pruebas PCR para serotipos específicos han sido desarrolladas, pero no han sido validadas en la práctica (solamente se ha hecho en cultivos puros). Entonces, estas pruebas pueden ser usadas pero sus resultados deben ser interpretados con mucha precaución. La detección de App por PCR se ha realizado directamente de las muestras o después del cultivo de estas, donde la sensibilidad y la especificidad ha sido variable9. La detección de App a partir de fluidos orales ha sido recientemente reportada12 pero en animales infectados experimentalmente y solamente algunos días después de la infección. Hay que tener en cuenta que la cantidad de App liberado en animales crónica o subclínicamente infectados puede ser considerablemente baja.
Resultados obtenidos hasta ahora sugieren, que se debe utiliza la amígdala como muestras, preferiblemente la amígdala entera después de la necropsia de (generalmente) animales de alto valor. Todavía queda la interrogante: si el App está presente, ¿estará distribuido igualmente en las dos amígdalas? ¿Debe analizarse solo una de las dos? ¿En la amígdala la distribución de App es homogénea? Todas están preguntas están sin respuesta por el momento. Por esa razón, habitualmente consideramos un resultado positivo como un resultado útil, pero un resultado negativo puede indicar que el App no está presente o que el laboratorio no fue capaz de detectarlo.
9. Como controlar la pleuroneumonía porcina…
No se puede hablar de control de la enfermedad, sin controlar la infección. Y para controlar la infección, se debe prestar atención a la trasmisión del patógeno. La transmisión de la bacteria por vía indirecta (viento, vestimentas, herramientas, etc.) es posible, aunque menos frecuente. La frecuencia de dicha transmisión será inversamente proporcional a la calidad de los métodos utilizados en bioseguridad y directamente proporcional a la densidad de granjas vecinas a distancia reducida. De todos modos, la introducción de la infección en una granja es en muchos casos causada por el ingreso de animales portadores. En las granjas infectadas, el contagio se efectúa normalmente por vía aerógena, cuando los animales están en contacto y por el aire, en distancias cortas. Se considera en general, que la entrada de jóvenes marranas de reemplazo es uno de los puntos claves de la transmisión de la infección. Los lechones que nacen de estos animales son excretores de la bacteria en número superior que los que provienen de marranas más viejas. El reagrupamiento de lechones provenientes de distintas maternidades, de las cuales al menos una está infectada, es muchas veces suficiente para provocar una eclosión de la enfermedad. En los sistemas en rotación, la fuente de infección original son las madres que infectan verticalmente los lechones.
En el engorde, la introducción constante de animales infectados estimula constantemente la infección. Una vez establecida la infección en el engorde, mismo si los lechones que entran del destete no están más infectados, los animales de más edad portadores mantendrán la infección activa. Es importante recordar que la morbilidad y la mortalidad varían mucho ya sea entre las distintas granjas o en una misma granja a lo largo del tiempo. Esas variaciones pueden deberse a las condiciones de manejo y/o a la virulencia de la cepa, como se indico previamente. Los sistemas de producción pueden influenciar la aparición de signos clínicos. Contrariamente a lo que ocurre con otras infecciones, la experiencia en Dinamarca indica que los problemas clínicos se observan sobretodo en las granjas que aplican un sistema “todo adentro – todo afuera”. Sin embargo, hay que evitar las generalizaciones: hay distintos sistemas, algunos de los cuales manejan sistemas por naves y otros por salas.
En este ultimo tipo de instalación, se mantienen a eces varios grupos de diferente edad en el mismo edificio separados entre sí mediante tabiques y puertas. Varios estudios han mostrado que los signos clínicos se observan más seguido en sistemas por salas” que por sistemas “por nave”, debido a la contaminación cruzada entre las distintas salas. En las granjas infectadas, es posible mantener la infección bajo control y que la enfermedad no sea clínicamente importante. La introducción de animales de reemplazo es un punto crítico, ya que es uno de los aspectos que puede mantener la infección muy activa en la maternidad. La introducción de marranas libres de la infección a una maternidad infectada debe hacerse con cuidado. En general se recomienda que todas las hembras de reposición permanezcan en una nave de cuarentena, sobretodo si son compradas fuera de la granja. En dicha nave, los animales se pueden inmunizar mediante vacunas (idealmente) o por infección natural.
Cuando la enfermedad clínica aparece, urge controlarla para reducir las pérdidas por mortalidad. En los casos de la enfermedad muy aguda, uno de los aspectos más importantes es la identificación de los signos clínicos muy temprano. Las decisiones a tomar son el tipo de medicamento a utilizar y la vía de administración. Para que sea eficaz, el tratamiento debe instaurarse desde el principio de la enfermedad, apenas aparecen los signos clínicos. En los casos híperagudos, todos los animales deben tratarse individualmente por vía parenteral. El tratamiento puede continuarse en el agua, pero es importante remarcar que los animales enfermos no se desplazan para tomar agua. La utilización de marcadores para indicar cuáles fueron los animales que han sido tratados es primordial, para poder hacer un seguimiento de la eficacia del tratamiento. En los casos menos agudos, y cuando los animales todavía pueden desplazarse, puede intentarse un tratamiento global en el agua, aunque existe siempre el riesgo que los niveles de antibiótico en ciertos animales no sea adecuado (por bajo consumo), lo que provoque sintomatología aguda y aumento de secreción de bacterias con la consecuente diseminación de la enfermedad.
Para la elección del tipo de antibiótico es importante tener el resultado del antibiograma para asegurar una buena respuesta clínica. Sin embargo, no se puede esperar y el tratamiento hay que instaurarlo muy rápidamente. Varios antibióticos pueden utilizarse, aunque no todos tienen a priori la misma eficacidad. Antibióticos que han demostrado una buena actividad son, por ejemplo, enrofloxacina, ceftiofur, clorfenicol, tulatromicina y tilmicosina. Otros antibióticos como la ampicilina y las tetraciclinas dan resultados menos espectaculares, dependiendo la cepa. La penicilina por lo general no da excelentes resultados. Obviamente, y una vez más, depende muchas veces de la resistencia frente a los antibióticos de la cepa actuante. La importancia del nivel de mortalidad/morbilidad es también importante. Se debe hacer un cálculo concreto de las pérdidas, ya que en ciertas ocasiones es más conveniente utilizar un antibiótico menos eficaz pero mucho menos caro que un antibiótico que presenta una eficacia muy elevada, a un costo también muy elevado. Es importante remarcar que a mayor eficacidad de un antibiótico, menor resistencia a una nueva infección e incluso, baja respuesta serológica.
Una vez el brote controlado, hay que pensar en la prevención del próximo brote…En el caso de la pleuroneumonía porcina, lo primero es tomar una decisión de base: se quiere eliminar la infección o simplemente reducir los problemas y convivir con la infección? Los dos objetivos pueden ser validos, dependiendo los gastos y el tipo de explotación. Obviamente, en el caso de los reproductores y, si es posible, de los multiplicadores, es indispensable una eliminación de la infección y un control estricto para evitar toda posible fuente de contaminación. Para ello, se debe utilizar la serología para evitar cualquier entrada de animales infectados. Una vez más, esto es posible solo en granjas que poseen medidas de bioseguridad, ya que los riegos de re-infección son altos.
En granjas comerciales con signos clínicos agudos, es probablemente más rentable controlar la mortalidad y vivir con la infección. Para ello, la medicación preventiva y la vacunación son las metodologías más aconsejables. En el caso de la medicación preventiva, es importante conocer la cinética de la infección para decidir el momento adecuado para el tratamiento. Dado que en muchas ocasiones las infecciones por App se desplazan al final de la engorda, la utilización de antibióticos se hace cada vez más dificultoso. En los casos donde la infección es más temprana, en ciertas ocasiones los signos clínicos se desplazan pero no desaparecen. Es importante indicar que el tratamiento puede desplazarse muchas veces a las madres…con el objetivo de reducir la prevalencia (transmisión a los lechones) y al mismo tiempo, reducir la aparición de signos clínicos.
Con respecto a la vacunación, en el caso de la pleuroneumonía porcina, es importante el nivel de IgG y sobre todo, el nivel de IgA en las mucosas respiratorias. Presentemente, hay numerosas vacunas autorizadas a ser utilizadas en Canadá y USA: todas bacterinas, dirigidas a los serotipos 1, 5 y 7. Estas vacunas (poco utilizadas en estos países) reducen mortalidad y lesiones; dado que hay poca variación entre las cepas de terreno que pertenecen a un mismo serotipo, deberían dar protección contra la mayoría de las cepas de campo (que pertenecen al mismo serotipo). El aspecto más importante: la protección es específica del serotipo que se encuentra en la vacuna. De hecho, la respuesta en anticuerpos interfiere con la serología tradicional diagnostica (aunque no interfiere con la técnica de detección de la toxina ApxIV). Una segunda categoría de vacunas, disponible en México y otros países de América, Europa y Asia, es en este caso una vacuna a sub-unidades. Esta vacuna está basada en la utilización de las toxinas purificadas (ApxI, ApxII y ApxIII), combinadas a una proteína de superficie. Esta vacuna tiene la ventaja de ser protectoras contra todos los serotipos de App, lo que facilita su utilización mismo sin saber cuál es el serotipo actuante. Es importante remarcar que hay pocos laboratorios capaces de serotipificar App. Esta vacuna no interfiere con ninguno de los kits comerciales que efectúan la serología para el diagnostico. De modo similar a las bacterinas, la vacunación con este producto ayuda a controlar los signos clínicos y disminuye las lesiones. Un último tipo de vacuna ha recientemente sido comercializada. Es una vacuna “mixta”, donde se introducen un lado “bacterina” (serotipos 1, 5 y 2) y se le agregan las toxinas purificadas. De esto modo, en teoría, se combina la actividad de antígenos de superficie junto con toxinas. Se debería esperar una protección elevada frente a los serotipos 1 (9 y 11), 5 y 2 y una protección contra la actividad toxica producida por otros serotipos.
Una vez más, lo primero a considerar es que no existe ninguna vacuna 100% efectiva. Como en el caso del tratamiento con antimicrobianos, la vacunación puede disminuir el nivel de mortalidad y el grado de las lesiones pulmonares. Sin embargo, no impide la infección ni la eliminación (aunque sí podría reducirla) por parte de los animales ya infectados. Sin embargo, el hecho de disminuir la eliminación (ya sea por mayor inmunidad o por reducir signos clínicos), reduce la concentración bacteriana en el medio ambiente lo que, por consecuencia, tiene una influencia en la prevalencia.
Menor es la prevalencia, menor son los riesgos de explosión clínica. Por último, es muy difícil correlacionar el nivel de anticuerpos con protección (como mencionado antes). Además, muchas variaciones en la protección se han observado con distintas vacunas comerciales. Con la excepción de la presencia de serotipos en una granja que estén ausentes en las vacunas comerciales, las autovacunas, utilizadas en algunos países como Francia, no son justificadas, ya que App presenta poca variación antigénica.
La vacunación debe efectuarse en el momento oportuno. Como se menciono antes, las jóvenes marranas (sobretodo si son negativas) mantienen muchas veces activa la infección. Se recomienda vacunarlas antes de hacerlas entrar en contacto con las marranas más viejas. Además, la vacunación de todas las madres es muchas veces beneficiosa para estabilizar la inmunidad del hato y guardar un mismo nivel de anticuerpos maternales. Uno de los aspectos más delicados es la interferencia con los anticuerpos maternales. De hecho, no hay diferencias entre los dos tipos de vacuna: la interferencia hipoteca muchas veces el resultado obtenido. Se recomienda no vacunar (primera dosis) antes de las 6-8 semanas de vida y, la segunda dosis, 2-3 semanas más tarde. Si bien se debe adaptar las edades de la vacunación al manejo y a otras vacunaciones, es extremadamente peligroso reducir la edad de la primera dosis. Si bien no ha sido demostrado muy claramente, muchas veces la presencia de una infección activa en los lechones por el virus PRRS parece disminuir la respuesta a la vacunación contra App, por lo que el momento ideal de la vacunación debe ser analizado caso por caso, y se debe discutir con especialistas y sobretodo, con el personal calificado de los laboratorios que comercializan y conocen bien la actividad de sus vacunas.
10. Existen algunas "legendas urbanas" sobre App…
Algunas "legendas urbanas" circulan. Una de ellas dice que "un animal infectado con un serotipo no desarrollara la enfermedad al infectarse con otro serotipo". Este planteamiento es falso. Quizás pueda suceder que animales que se recuperen de un episodio de algunos de los serotipos de App estén protegidos contra infección (enfermedad) causada por otros serotipos relacionados (con un LPS similar y/o un perfil de toxinas similar). Pero esto no se puede aplicar a todos los serotipos. Otra"legenda urbana" dice que "la presencia de una serología positiva contra un serotipo virulento (en una región especifica) y en ausencia de enfermedad clínica debe ser interpretada como un resultado falso positivo". Eso quizás fue verdad muchos años atrás cuando pruebas de baja especificidad eran usadas… pero no ahora, y sería extremadamente peligroso pensar de esta manera, ya que muchas de las pruebas serológicas disponibles hoy día son altamente específicas. Y, otra vez, una granja sin signos clínicos, ni lesiones al matadero puede estar infectada de modo subclínico con un serotipo virulento y una cepa, potencialmente, virulenta.
Conclusiones
App sigue siendo un problema hoy día en los ganados porcinos en muchos países donde la industria porcina es considerada como importante. El tipo de problema no será el mismo en todos los países: en algunos, casos clínicos de pleuroneumonía porcina con importantes pérdidas económicas siguen presentes, y altos niveles de lesiones al matadero pueden ser observadas. En otros, se formulan la pregunta: ¿Cuántas granjas infectadas subclínicamente presentarían signos clínicos si los antibióticos no fueran utilizados rutinariamente? Y esa es una pregunta imposible a responder, pero que es una realidad que probablemente enfrentan muchas granjas. En otros países, ambos, infecciones clínicas y crónicas son relativamente bien controladas, pero las infecciones subclínicas siguen preocupando a los productores porcinos (especialmente reproductores), y no precisamente porque estas infecciones sean asociadas a importantes pérdidas económicas. De hecho, en estos países, muchos productores no quieren estar infectados con cepas/serotipos de alta virulencia, en algunos casos sobre todo por cuestiones comerciales. En los rebaños de reproducción están siempre preocupados con la venta de animales portadores que puedan infectar otras granjas. Hoy día todavía existen contradicciones, después de 50 años de experiencia con la enfermedad, en cuanto a por que algunas cepas de App son capaces de producir la enfermedad en algunas granjas y en otras no. Esto prueba una vez más que todo no está claramente entendido con el App, y a veces es difícil tomar decisiones, pero la ciencia ha progresado y continuará haciéndolo en los años a venir.
Referencias
1.Gottschalk. M. et al., 2012, Actinobacillosis. In: Karriker L, et al. (editors), Diseases of Swine, 10th edition, Wiley Publishers, Hobokin, NJ (in press).
2. Maldonado J., et al., 2009. J Vet Diagn Invest21, 854-857.
3. Perry M. et al., 2011. Vet. Microbiol. Ahead of print.
4. MacInnes J. et al., 2008. Can. J. Vet. Res. 72:242-248.
5. O'Neill C. et al. 2010. Vet. Rec. 167 :661-662.
6. Marois C. et al. 2009. Vet. Microbiol.135 :283-291.
7. Desrosiers R. 2004. Howard Dunne Memorial Lecture.Proc AASV. 1-30.
8. Broes, A. et al. 2007. J Swine Health Prod. 15:264–269.
9. Fittipaldi N. et al., 2003. J Clin Microbiol. 41:5085-93.
10. Gagné A. et al. 1998. J. Clin. Microbiol. 36:251-254.
11. Angen O. et al. 2001. VetMicrobiol. 79:19-29.
12. Costa G. et al. 2012. J. Swine Health Prod. 20: 78-81.
2. Maldonado J., et al., 2009. J Vet Diagn Invest21, 854-857.
3. Perry M. et al., 2011. Vet. Microbiol. Ahead of print.
4. MacInnes J. et al., 2008. Can. J. Vet. Res. 72:242-248.
5. O'Neill C. et al. 2010. Vet. Rec. 167 :661-662.
6. Marois C. et al. 2009. Vet. Microbiol.135 :283-291.
7. Desrosiers R. 2004. Howard Dunne Memorial Lecture.Proc AASV. 1-30.
8. Broes, A. et al. 2007. J Swine Health Prod. 15:264–269.
9. Fittipaldi N. et al., 2003. J Clin Microbiol. 41:5085-93.
10. Gagné A. et al. 1998. J. Clin. Microbiol. 36:251-254.
11. Angen O. et al. 2001. VetMicrobiol. 79:19-29.
12. Costa G. et al. 2012. J. Swine Health Prod. 20: 78-81.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación




