Estres en cerdos
Neuroinmunoendocrinologia del estrés, Citoquinas y sistema endocrino (Parte III y IV)
Publicado: 28 de marzo de 2011
Por: MVZ. Guadalupe Edgar Beltrán Rosas, NutriFad Asesoría Técnica Porcícola, México
Citoquinas (parte 3)
Introducción
Las citoquinas constituyen un grupo grande de moléculas que participan en la señalización entre las células durante las respuestas inmunitarias. Por lo general son proteínas pequeñas solubles y, en algunos casos glicoproteínas, producidas por una célula que pueden afectar al comportamiento y las propiedades de otras células. Son producidas por diferentes tipos de células inmunitarias, y por lo general regulan las fases efectoras de la respuesta inmunitaria tanto natural como específica. En la inmunidad natural, las citoquinas efectoras son producidas principalmente por los fagotitos mononucleares y por ello se les conoce como monoquinas. Las monoquinas pueden ser producidas directamente como respuesta a un estímulo microbiano, o bien en respuesta a los linfocitos T estimulados por antígenos, como parte de una respuesta específica. (Talamás 2005).
También desempeñan un papel importante como coestimuladores de la activación de linfocitos, proporcionando mecanismos de amplificación para las respuestas inmunitarias especificas. La mayoría de las citoquinas presentes durante una respuesta inmunitaria específica son producidas por los linfocitos T activados, y tales citoquinas han sido denominadas linfoquinas. En general, las citoquinas provenientes de los linfocitos T son las moléculas efectoras de la inmunidad mediada por células y son también responsables de la comunicación entre células de los sistemas inmunitario e inflamatorio. Los linfocitos T producen varias citoquinas que regulan la activación, el crecimiento y la diferenciación de diferentes poblaciones de linfocitos. Algunas otras funciones como activadoras y reguladoras de células inflamatorias tales como los fagocitos mononucleares, los neutrófilos y los eosinófilos. Existe también otro grupo de citoquinas producidas tanto por linfocitos como por fagocitos mononucleares llamadas de forma genérica factores estimuladores de colonias (CSF, colony-stimulating facors), las cuales estimulan el crecimiento y la diferenciación de los leucocitos inmaduros de la médula ósea (Talamás 2005). Una forma de clasificar las citoquinas es en relación con sus funciones (Cuadro 3).
Cuadro 3. Relación entre citoquinas y sus funciones | |
Función | Citoquinas |
Mediadores de la inmunidad natural | IFN-α ó b (Tipo I), TNF-b, IL-1, IL-6, Quimioquinas (IL-8, MCP-1, MIP-1α y 1b) |
Reguladores de la activación, el crecimiento y la diferenciación de los linfocitos | IL-2, IL-4 y TGF-b |
Activadores de las células inflamatorias | IFN-g, LT, IL-10, IL-5, IL-12, MIF |
Estimuladores del crecimiento y la diferenciación de leucocitos inmaduros | CFs, IL-3, ligando para c-kit, SCF, GM-CSF, M-CSF, G-CSF, IL-7, IL-9, IL-11 |
Fuente: Talamás, (2005).
Desde el punto de vista químico, las citoquinas << linfoquinas, monoquinas, interleuquinas, interferones, factores de crecimiento >> (Santomá y Pontes, 2006), son hormonas parecidas a proteínas (factores polipeptídicos) liberadas por una variedad de tipos celulares (Klasing y col.,1995; Stahly, 1996; Nazará, 1996; Cisneros, 1999; 2000; Johnson et al., 2001; Obled, 2002; Santomá y Pontes, 2006), incluso células mononuclear mieloide (por ejemplo, monocitos y macrófagos) (Johnson et al., 2001; Pié et al., 2004), además incluyen células epiteliales, endoepiteliales y fibroblastos, cuales son fuentes efectivas (Pié et al., 2004). Como la primera línea de defensa contra la invasión de patógenos (es decir, como parte de la inmunidad de respuesta), las células mononucleares mieloides son únicamente acompañantes a identificar y responder a los patógenos y proporciona una señal a las reservas de concentración del cuerpo como impedir la infección (Johnson et al., 2001).
Las citoquinas inducen sus efectos en tres formas: ellas pueden actuar sobre la misma célula que las produjo, (un efecto autócrino); sobre los nódulos linfoides y espacios articulares (un efecto parácrino); o sistemáticamente, parecido al de las hormonas (efecto endócrino). Sus más importantes acciones en la inflamación son sus efectos sobre el endotelio, leucocitos, y fibroblastos, y la inducción de las reacciones de fase aguda sistémica. En el endotelio, ellas inducen un espectro de cambios, la mayoría regulados a nivel de la transcripción de genes, referido como activación endotelial. En particular las citoquinas inducen la síntesis de moléculas de adhesión endotelial, otras citoquinas, factores de crecimiento, eicosanoides, e incremento de la trombogenicidad de superficie del endotelio y óxido nítrico (Nazará, 1996).
Citoquinas pro-onflamatorias
Las citoquinas como la interleuquina-1 (IL-1), interleuquina-6 (IL-6), y factor de necrosis de tumor (TNF-α), son pro-inflamatorias, y que, en cierta medida, el predominio de una u otra es susceptible de ser influenciado por la nutrición (Santomá y Pontes, 2006).
Interleuquina-1
El IL-1 es el termino para dos mediadores polipéptidos (IL-1α y IL-1β) que son integrados en los mas potentes y en las células activadoras multifuncionales descritos en la inmunología y la biología de las células. El tamaño de las dos formas de las moléculas secretadas es aproximadamente 17.5 kDa, originalmente conocidas como "pirógeno endógeno" o "mediadores endógenos leucocitos", la caracterización y la purificación bioquímica de las moléculas culminadas con la definición de IL-1. Otro miembro de la familia IL-1 es el receptor antagonista IL-1 (IL-1ra) que se comporta como un receptor puro endógeno antagonista de IL-1, bloqueando muchos de los efectos biológicos de ambos IL-1α y IL-1β in vivo e in vitro. Las células de la familia de monolitos y macrófagos son las principales fuentes de células IL-1, sin embargo muchas de esas células tienen el potencial de expresar la citoquina. En turno el IL-1 tiene un amplio rango de efectos de células y órganos (Figura 15). Células similares secretan 17 kDa IL-1ra y, el estimulo de respuesta comparable, como la producción de IL-1 (Llamas et al., 2006c).
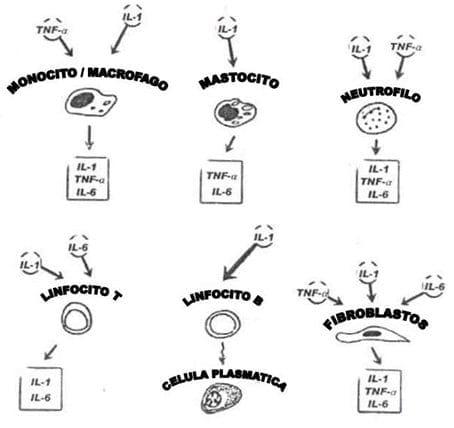
Figura 15. Las citoquinas pro-inflamatorias, interleuquina-1 (IL-1), factor de necrosis tumoral-alfa (TNF-α) e interleuquina-6 (IL-6): sus fuentes primarias y células principales. Fuente: Llamas et al., (2006c).
Cuando la IL-1 se produce en grandes cantidades, entra a la circulación y actúa como una hormona endocrina, que tiene la capacidad de producir fiebre, inducir la síntesis de las proteínas de fase aguda y de iniciar el desgaste metabólico o caquexia (Talamás, 2005).
Además Sapolsky et al., (1987) demostraron que, como resultado de la acción central del IL-1, los estímulos liberan la hormona corticotropina (CRH) por el hipotálamo y subsecuentemente induce la producción de la hormona adrenocorticotropina (ACTH) por el pituitaria, por ultimo causan la liberación de glucocorticoides (GC) en la sangre por las adrenales. Por eso el GC actúa como un inhibidor endógeno del IL-1. La activación del eje HPA puede ser considerado como un mecanismo de control de la producción y toxicidad de IL-1. En adición el IL-1 ha sido descrito como el principal pirógeno endógeno (EP) vía interacción con CNS. La acción del pirógeno del IL-1 es como consecuencia de un aumento en la producción de prostaglandina central (PG) (Llamas et al., 2006c).
Interleuquina-6
Interleuquina-6 la proteína IL-6 pesa entre 23 y 30 kDa y se puede expresar por una cantidad de células. Los monolitos y macrófagos pueden ser los primeros al liberar el IL-6 cuando ocurre una inflamación (Figura 15). Adicionalmente los productos de los monolitos y macrófagos, y el IL-1 y el TNF son fuertes inductores de IL-6.
La IL-6 es una citoquina pleiotropica, con acciones de muchos procesos fisiológicos e inmunológicos (por ejemplo reacciones de fase aguda, respuestas inmuno hormonal, inflamación y hematopoyesis) que tiene propiedades pro-inflamatoria y anti-inflamatorias. Uno de los roles primarios de IL-6 es como la mayor citoquina que inicia la respuesta de la fase hepática aguda. Y por eso esta molécula fue conocida como el "factor estimulador de hepatocito" por eso este mediador es liberada a sitios de inflamación y después circula para actuar específicamente sobre las células del hígado. Además el IL-6 endógenos controla la regulación de citoquinas inflamatorias el IL-1 y TNF-α, actuando y preservando las respuestas inflamatorias destructivas. Similarmente a otras citoquinas, la producción de IL-6 es tan bien suprimida por GC. En los cerdos, los niveles de IL-6 aumentan después la administración de LPS (Llamas et al., 2006c).
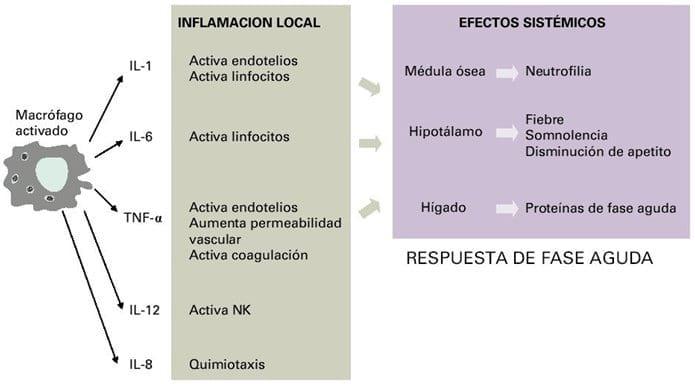
Las interleuqinas más importantes de la inmunidad innata son las sintetizadas por los macrófagos (IL-1, IL-6 e IL-12), y no sólo tienen efecto a acción local sino que tienen un efecto general sobre el organismo (Figura 16). Además, preparan la respuesta adaptativa actuando cobre los linfocitos (Porras y col., 2008).
Figura 16. Acción local y sistémica de las citoquinas secretadas por los macrófagos en respuesta a una infección. Fuente: Porras y col., (2008).
Factor de necrosis tumoral
El TNF tiene características múltiples como IL-1 existe en dos formas moleculares el TNF-α y TNF-β, en ambos casos con un peso molecular de aproximadamente de 17 kDa (Llamas et al., 2006c). El TNF-α previamente llamada "caquectina", es sintetizado por diversos tipos celulares, como macrófagos, monocitos, queratinocitos, linfocitos T y B, células NK, neutrófilos, astrositos y células endoteliales (Talamás 2005). Linfotoxinas o TNF-β es exclusivamente producida por la activación de linfocitos T y B (Llamas et al., 2006c).
Su presencia trae como consecuencia efectos muy diversos, dado que modula la expresión genética de factores de crecimiento, citoquinas, factores de transcripción, receptores celulares y proteínas del huésped contra infecciones por bacterias gramnegativas (LPS). Es un mediador tanto de la inmunidad natural como de la adquirida y, de hecho, constituye un eslabón entre las respuestas de inmunidad específica y de inflamación aguda (Talamás 2005).
Cuando un animal de experimentación se expone al TNF de forma crónica, éste induce las alteraciones metabólicas características de la caquexia, estando que se distingue por la pérdida de células musculares y adipositos (Talamás 2005). La actividad de TNF corresponde con el IL-1, como en el caso de la IL-1 la TNF-α pueden inducir temperatura directa vía estimulación de prostaglandinas (PG) o indirectamente por la liberación IL-1, TNF-α también tiene una importante propiedad inflamatoria con IL-6 e IL-1, que es la inducción de proteínas de fase aguda por el hígado. Evidencias han demostrado que TNF-α interactúan indirectamente con el CNS, mecanismos vía leptina (Llamas et al., 2006c).
IL-1 IL-6 y TNF α
La mayoría de las citoquinas pro-inflamatorios, IL-1, IL-6 y TNF-α, tienen múltiples fuentes blanco y múltiples funciones (Cuadro 4), regulan no solo el proceso inflamatoria a un nivel local, también regulan una variedad de repuestas del sistema nervioso central (CNS), incluyendo cambios en la actividad neuroendocrina. TNF-α es el primero por aparecer en los eventos inflamatorios, estimulando la producción de ambos IL-1 y IL-6. Similarmente, IL-1 estimula ambos TNF-α y IL-6, en contraste, IL-6 ejerce sus efectos anti-inflamatoria e inmunosupresivo, actuando como un inhibidor de la producción de ambos de otras citoquinas. Adicionalmente, las tres citoquinas pueden estimular su producción en una forma autocrina/paracrina (Llamas et al., 2006c).
Cuadro 4. Funciones biológicas especificas de las citoquinas interleuquina-1 (IL-1), -6 (IL-6), y factor de necrosis tumoral-alfa (TNF-α) | |
Citoquinas | Funciones especificas |
IL-1 | Activación de estroma, condrocitos y epitelio en la respuesta localizada en el tejido dañado. Regulación de los linfocitos B en la médula ósea. Medición de tejidos infiltrados de leucocitos (vía IL-8). Activación de osteoblastos, del hueso y degradación de cartílagos. |
TNF-α | Inducción de la producción. Participación en la destrucción de células por supresión de síntesis de proteínas como resultado caquexia. Causan daños en endotelio local. |
IL-6 | Participación en la inducción y diferenciación de citotóxicos linfocitos T. Estimulación de la diferenciación de células hematopoyéticas. Modulación de la producción de IL-1 y TNF. |
Fuente: Llamas et al, (2006c).
La IL-1, IL-6 y TNF-α, son responsables para la inducción de la respuesta de la fase aguda hepática, inducción de la temperatura y comportamientos de enfermedades, la activación de B, T y células NK, inducción del IL-2 en células T y la estimulación del eje HPA (Llamas et al., 2006c).
Muchas citoquinas incluyendo el factor de crecimiento transformante β (TGF-β), IL-1α, y IL-6 son constituyentes expresados por el epitelio intestinal y pueden tener un papel en el sistema basal de las células inmunes dentro de la mucosa, en las células epiteliales de crecimiento y en la homeostasis. Otras citoquinas, como IL-8, IL-1β, y TNF-α son también expresados por las células epiteliales normales pero son marcadamente aumentados en la respuesta en la infección por microorganismos (Pié et al., 2004).
Las citoquinas pro-inflamatorias como la TNF-α y el IL-1β alteran los ritmos cardiacos, y son también involucradas en la regulación fisiológica del sueño. Ambos también comparten importantes propiedades pro-inflamatorias como la inducción de cambios en la actividad sintética del hígado (Llamas et al., 2006a).
Las citoquinas como IL-1, IL-6, y TNF-α, activa el sistema inmunológico y altera los procesos metabólicos en los animales (Williams et al., 1997; Cisneros, 1999; 2000; Harris, 2000; Johnson et al., 2001; Obled, 2002; Liu et al., 2003), estas son monoquinas primarias involucradas con una menor productividad (Cuadro 5) (Klasing y col.,1995).
Cuadro 5. Papeles superpuestos de citoquinas de los leucocitos en la regulación del metabolismo. | |
Respuesta | Citoquinas responsables |
General Descenso del consumo voluntario Aumento del metabolismo basal Aumento de la temperatura corporal | IL-1, TNF IL-1, TNF IL-1, IL-6 |
Metabolismo de la glucosa Aumento de la oxidación de glucosa Aumento de la síntesis de glucosa | IL-1, TNF IL-1 |
Metabolismo de los lípidos Menor actividad lipoproteína lipasa Aumento de la lipólisis en adipositos Mayor síntesis hepática de triglicéridos | IL-1, TNF IL-1, TNF TNF |
Metabolismo de proteínas Mayor síntesis de proteínas de la fase aguda Aumento de la degradación de proteína muscular | IL-1, TNF, IL-6 IL-1 |
Metabolismo de minerales Aumento de la síntesis de metalotionina Aumento de la síntesis hepática de ceruloplasmina | IL-6 IL-1, IL-6 |
Liberación de hormonas Aumento de la liberación de corticosteroides Descenso de la liberación de tiroxina Aumento de la liberación de insulina y glucagón | IL-1, IL-6 IL-1 IL-1, TNF |
Fuente: Klasing y col,(1995).
El TNF-α también provoca agregación y activación de neutrófilos, conduciendo a una respuesta aumentada de estas células a otros mediadores, y la liberación de enzimas proteolíticas de las células mesenquimales, de esta manera contribuyen al daño tisular (Nazará, 1996). La reducción en el consumo voluntario de alimento es asociada con una descarga de IL-1-inducida por la hormona liberadora de corticotropina (corticotropin-releasing hormoneCRH) y IL-8, qué sirve como un estimulante de la proteína del hipotálamo lateral (Williams et al., 1997; von Borell, 2001). Metabólicamente, la administración de citoquinas (IL-1, TNF-α) induce la anorexia, deprime la síntesis proteica, y estimula la degradación proteica en el músculo esquelético (Williams et al., 1997; Cisneros, 1999; 2000; Johnson et al., 2001; Obled, 2002), además del incremento de la lipólisis en tejido adiposo y disminuye la síntesis de triglicéridos en hígado y un aumento en la excreción de nitrógeno (Johnson et al., 2001). A nivel de cerebro produce anorexia y letargia además de aumentar la termogénesis (Cisneros, 1999; 2000; Obled, 2002). Además de calcemia a expensas de los huesos <>, consecuente todo ello con la actuación de las citoquinas pro-inflamatorias (Santomá y Pontes, 2006) (Figura 17).
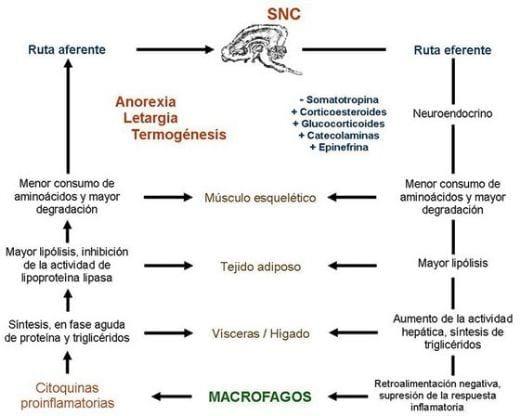
Figura 17. Estimulación de los procesos infecciosos. Fuente: Jonson (1997); citado por Cuarón (1999).
La baja tasa de crecimiento corporal y la eficacia de utilización del alimento en los animales desafiados antígenicamente está debido en parte a su bajo consumo de alimento (Williams et al., 1997; Cisneros, 1999; 2000; Obled, 2002; Liu et al., 2003); sin embargo, otros cambios metabólicos también mediados por citoquinas juegan un papel porque la administración de un antígeno no patógeno (lipopolisacárido) reduce la ganancia corporal y la ganancia: alimenticia.Estos cambios metabólicos incluyen el aumento de la degradación de proteína del músculo esquelético, la disminución de la síntesis de proteína del músculo esquelético, aumento del tamaño del hígado y síntesis de proteína del corazón, y aumenta la resorción del hueso (Williams et al., 1997; Johnson et al., 2001). Las citoquinas median estas alteraciones en la síntesis de proteínas del músculo esquelético y degradación por la disminución de la liberación de las hormonas anabólicas como la somatotrópica y el factor de crecimiento insulínico (IGF-1), el aumento catabólico (glucocorticoides) liberación de la hormona, y por la inhibición directa del músculo proteolítico inhibidor calpastatin. Además, la atrofia del timo es asociada con la liberación de la citoquinas puede producir que disminuya la liberación de la hormona somatotrópica como péptidos del timo la timosina a-1 disminuyendo la liberación de somatostatina del hipotálamo (Figura 18) (Williams et al., 1997; Harris, 2000).
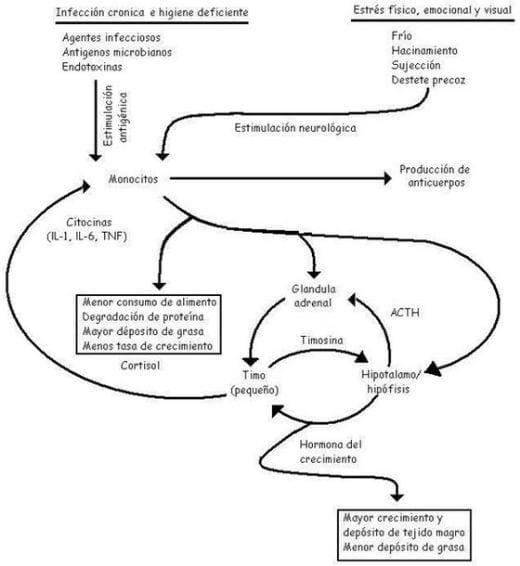
Figura 18. Efectos del estrés. Fuente: Harris (2000).
Las diferencias en la cinética de proteína del músculo durante la sepsis entre músculos compuestos de fibras de contracciones rápidas y fibras de contracciones lentas podrían ser de importancia. En los recientes años, se han seleccionado a los cerdos para la producción de carne para una velocidad máxima de crecimiento, porque los cerdos seleccionados para una velocidad de crecimiento máximo tiene una proporción mayor de músculos que contienen músculos de contracciones rápidas vs., los músculos de contracciones lentas, los efectos de citoquinas en el crecimiento de tejido músculos son potencialmente más deletéreos en los magros, los genotipo más modernos (Johnson et al., 2001).
Se presentan varios efectos inmunológicos y metabólicos importantes de estas moléculas en el cuadro 6. Los cambios metabólicos inducidos por estas moléculas son la homeostasis en naturaleza y así los nutrientes que habrían ido hacia el crecimiento y la acreción de los músculos esqueléticos van a apoyar los sistemas de defensa del huésped, que en este momento es de prioridad más alta. Porque la acreción de la proteína eficaz rápida es una meta de producción en el cerdo y las citoquinas inflamatorias tiene los efectos profundos en la acreción de la proteína (Johnson et al., 2001).
Cuadro 6. Los efectos inmunológicos y metabólicos de citoquinas producidos por los macrófago. | ||
Interleuquina-1 | Interleuquina-6 | Factor de tumor y necrosis-a |
Efectos inmunológicos mayores | ||
Activa los linfocitos | Activa los linfocitos Producción del anticuerpo Síntesis proteica en la fase aguda | Inflamación |
Efectos metabólicos mayores | ||
Degradación de proteína de músculos | Degradación de proteína de músculo | Degradación de proteína de músculo |
Reducción de la síntesis de proteína del músculo | Reducción de la síntesis de proteína del músculo | Reducción de la síntesis de proteína del músculo |
Fiebre | Fiebre | Fiebre |
Anorexia | Síntesis proteica en la fase aguda | Anorexia |
Hipoferremia | Lipólisis | |
Hipozincemia | ||
Hipercupremia |
Fuente: Johnson et al, (2001).
El período de bajo consumo de alimento después del destete también causa una respuesta inflamatoria en el tracto gastrointestinal que inicia en la función y respuesta inmune. Las investigaciones han demostrado que la expresión de los genes de las citoquinas pro-inflamatorias IL-1, IL-6 y TNF- α mRNA aumenta en los 2 días posteriores al destete, momento en que la altura de las vellosidades, la profundidad de las criptas y las actividades específicas de las enzimas intestinales están más afectadas (Pié et al., 2004; Pluske, 2005). El destete se asocia con el incremento de la concentración de IL-1 en plasma en sangre en lechones. Finalmente se incrementa la concentración en plasma de fibrinógeno, en las proteínas de la fase aguda de la inflamación y se incrementa las concentraciones de proteasa en los tejidos intestinales. Después de estos 2 días del post-destete los niveles de mRNA de las citoquinas regresan a los niveles como en pre-destete con la excepción de los niveles de TNF- a mRNA en el intestino distal, para quedar en niveles altos (Pié et al., 2004). El destete, al menos en la primera semana, está asociado a una sobre-regulación de ciertos genes de expresión de las citoquinas, que influyen en el consumo de alimento y muy probablemente contribuyen a los desórdenes funcionales que favorecen la diarrea, aunque el mecanismo(s) exacto de este proceso todavía no ha sido completamente establecido (Pluske, 2005).
El tracto gastrointestinal constituye una extensa superficie en la que se produce un contacto íntimo entre el organismo y las substancias de la dieta, microorganismos, parásitos y toxinas exógenos. El intestino permite el paso de sustancias a la circulación sistémica, pero al mismo tiempo excluye compuestos patógenos (Spreeuwenberg, 2002; Alzola, 2002). El tracto gastrointestinal tiene múltiples mecanismos de defensa inespecíficos e inmunológicos. Los mecanismos no específicos influyen en la producción de ácidos gástricos, peristaltismo, capa mucosa, estrecha unión entre las células epiteliales, proteolisis, resistencia contra la colonización por bacterias patógenas y el eje intestino hepático. La defensa inmunológica del intestino delgado incluye la producción de inmunoglobulinas secretoras, células M y linfocitos (Spreeuwenberg, 2002).
Citoquinas anti-inflamatorias
Otras citoquinas son conocidas por propiedades anti-inflamatorias y por eso controlan las respuestas de las citoquinas pro-inflamatorias bloqueando estas respuestas o suprimiendo su intensidad. Estas citoquinas inflamatorias tienen la habilidad de suprimir la síntesis de IL-1, TNF y otras citoquinas en la inmunidad periférica y células no inmunes. Por esos son relevantes para la regulación de la respuesta d la fase aguda, las mayores citoquinas anti-inflamatorias incluyen IL-1ra, IL-4, IL-6, IL-10, IL-11, IL-13 y factor de crecimiento transformante-beta (TGF-β, transforming growth factor). Estos mediadores anti-inflamatorios son producidos en la conjugación con citoquinas pro-inflamatorias y por lo tanto su producción puede ser estimulada por la administración de LPS. Esta conocido que el resultado final de las enfermedades están determinadas por la balanza entre los efectos de citoquinas pro-inflamatorias y anti-inflamatorias (Llamas et al., 2006c).
Las respuestas colectivas del estrés
Las citoquinas producidas en la periferia en el sitio inflamatorio actúan en un nivel central en el cerebro. Las rutas de transmisión de la periferia al cerebro pueden ser hormonal y/o neural. La ruta hormonal se refiere a la acumulación de citoquinas en el sitio de infección o inflamación después en la sangre que esta circulando en el cerebro y, finalmente, cruzando la barrera hematocefálica (blood-brain-barrier [BBB]) a puntos fijos, por ejemplo organum vasculosum lamina terminalis (OVLT). En este sitio van a reaccionar con los receptores específicos. Sin embargo las citoquinas son grandes y moléculas linfofobicas, y por eso no van ha penetrar la BBB en una cantidad suficiente para causar reacciones fisiológicas que ocurren. Además, de sus reacciones en el cerebro no pueden ser directos y requieren moléculas intermediarias como la prostaglandina (PG). El PG son moléculas linfofilicas que se difunden libremente, son neuroactivas y ha sido demostrado que son inducidas por citoquinas. El estrés puede influir la permeabilidad del BBB permitiendo factores endógenos y exógenos que entran y salen del CNS (Llamas et al., 2006b).
La noción que el sistema inmune es un órgano sensitivo difusor fue revelado como una ruta atractiva de comunicaciones entre la periferia y el cerebro en la ruta neural (Figura 19) (Llamas et al., 2006b; van Borell, 2001). Los órganos sensitivos comunican al cerebro vía nervio sensoriales periféricos. El calor y el dolor, que son signos asociados con la inflamación, son también sensores en la naturaleza. El nervio vago es el único nervio periférico que pueden actuar como un nervio inmune-sensorial. La interrupción de la ruta neural vía vagotomia, resulta de una inhibición de ambos componentes centrales de la respuesta del estrés y la inducción de citoquinas en el cerebro para respuestas a la estimulación inmune periférica. El nervio vago también inerva estructuras que tienen que ver con la respuesta inmune como el bazo y nódulos linfáticos, vía fibras aferentes. Este proviene a la contribución sensorial al cerebro de estas estructuras. Invadiendo patógenos que se unen a las células inmunes como, los macrófagos, que son cerca a los terminales sensoriales vagales y están asociadas con paraganglia. La activación de estas células inmunes inducen la difusión de citoquinas que en turno van a unir al receptor sobre paraganglia resultando en la difusión de transmisores en las fibras vagales. La activación de las fibras vagales resulta en la baja de neutransmisores en el nucleus tractus solitarius (NTS), que es el sitio nervio vagal de terminación en el cerebro. Diferentes rutas de comunicación existe entre el NTS y las regiones en el cerebro que controla el eje de HPA y otros principales sistemas regulatorios (Llamas et al., 2006b).
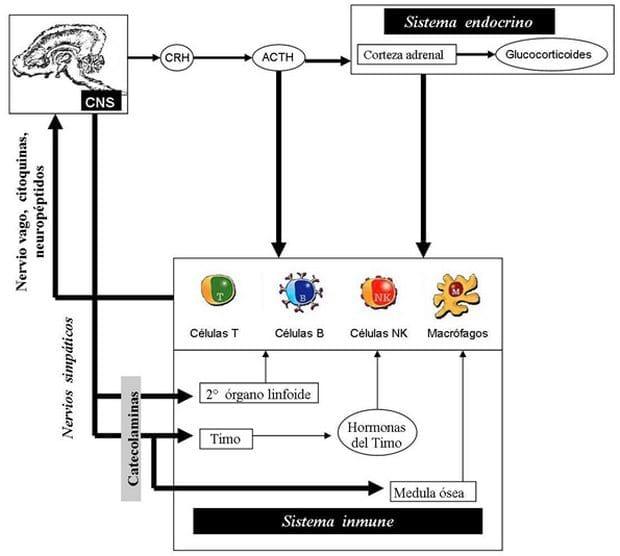
Figura 19. Representación esquemática de la comunicación bi-direccional entre el cerebro y el sistema inmune vía el nervio vago (modificado de Marier and Watkins, 1999).
Ambas rutas de comunicaciones, hormonal y neural forman un grupo completo. Consecuentemente es más fácil de entender como un estresor, excepto un microbio o patógeno pueden activar la respuesta de estrés. Mientras un agente infeccioso inicia la respuesta como activando las células del sistema inmune (macrófagos), otros estímulos pueden activar la respuesta del estrés a otros niveles. En este sentido es desconocido si la producción de citoquinas ocurre primeramente en el cerebro o en la periferia. Por ejemplo las citoquinas pueden ser sintetizadas o dispersadas en el CNS por células microglial. Esas células específicas en el cerebro son derivadas de los monolitos que subsecuentemente diferencian en macrófagos peri-vasculares y finalmente entran al cerebro en etapa temprana, antes a la completación del BBB. Sin embargo es posible que las neuronas puedan también sintetizar las citoquinas. Además las citoquinas en primer lugar son producidas en el cerebro pueden estimular la producción de otras citoquinas en la periferia a sido demostrado que el estrés aumenta permeabilidad del tracto gastrointestinal que permite endotoxinas intestinales a estimular la producción de citoquinas. Esta va a soportar la hipótesis del la síntesis periférica primaria de las citoquinas. A pesar de todo, el resultado debe de ser igual, sin tomar en cuenta en donde el punto de cascada inicia (Llamas et al., 2006b).
Las citoquinas producidas centralmente o periféricamente actúan como un neurotransmisor en el cerebro iniciando la descarga de productos caracterizados de la respuesta del estrés del cerebro a la periferia. Las estaciones de control para estas respuestas en el cerebro son localizadas en el hipotálamo y en la base del cerebro. El principal mediador son el CRH y el AVP neuronas de la PVN del hipotálamo, y los ceruleus locus (LC) sistema-norepinefrina (NE) de la base del cerebro estos dos hacen el sistema simpático central. Sin embargo el cerebro va influir todos los órganos del cuerpo y el eje HPA y el sistema eferente simpático/adrenomedular, que son efectores límbico de la respuesta inmune. En adición, las conexiones neurales existen entre el CRH y el sistema neural LC/NE del sistema simpático central (Figura 20), con CRH y NE estimulando ellos mismos. Consecuentemente la activación de la ruta noradrenergica por los resultado del CRH en la secreción de NE por el sistema nervioso simpático periférico y la descarga de NE y E de la médula adrenal (Llamas et al., 2006b).
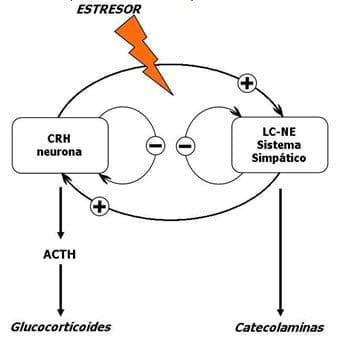
Figura 20. Mecanismos moduladores de la secreción de CRH. Las neuronas hipotalamicas CRH estimulan ambos pituitaria secreciones de ACTH y el sistema central LC/NE resultando respectivamente en secreciones al glucocorticoides y catecolaminas.
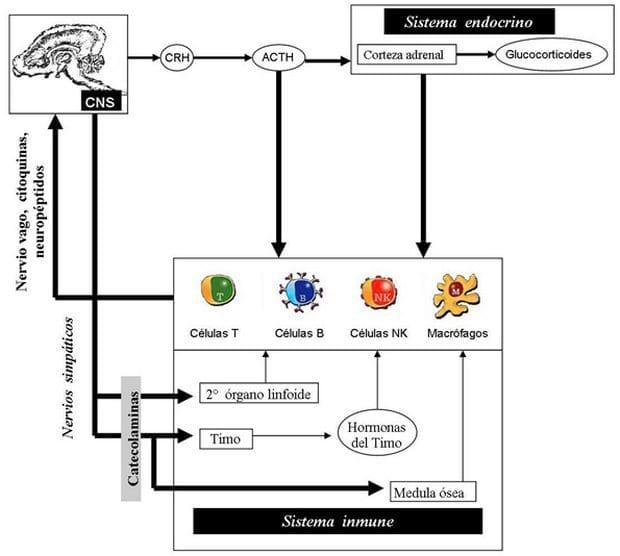
Sin embargo las respuestas al estrés involucran la activación de los nervios (central y autonómica), endocrino y sistema inmune. La interacción entre estos 3 sistemas van a regular y determinar el resultado de las respuestas del estrés (Figura 21) (Llamas et al., 2006b).
Figura 21. Interacción entre los sistemas nervioso, endocrino e inmune. Fuente: Llamas et al, (2006b).
Cuando ocurren lesiones, traumas, o infecciones en los tejidos, una serie de reacciones son expresadas por el huésped para prevenir daños a los propios tejidos, aislar y destruir los organismos infectados y activar los procesos de recuperación que son necesarios para que el organismo regrese a su función normal. La respuesta local de los tejidos a estas lesiones o infecciones son conocidas como inflamación aguda, como en los primeros e intermedio grupos de células, metabólicas, endocrino y cambios fisiológicos son conocidas como respuesta de fase aguda (Llamas et al., 2006c).
La respuesta de fase aguda es parte del sistema de defensa en el huésped innata contra traumas de inflamación e infecciones. Puede ser considerado como el tipo más preventivo de las respuestas humoral inmune y, como ha sido observado en la evolución, además la respuesta de fase aguda juega un papel a mayor adaptabilidad y rol de defensa (Llamas et al., 2006c).
La respuesta de fase aguda
Durante la respuesta de fase aguda, el estado homeostático es subjetivo a cambios que pueden afectar el comportamiento del estado fisiológico la bioquímica y los niveles nutricionales del huésped. Gabay and Kushner (1999) describieron en detalle la panorámica de los cambios inducidos durante la respuesta de fase aguda (Cuadro 7). Sin embargo el término de la respuesta de fase aguda se refiere a los cambios dramáticos en la actividad sintética del hígado. Consecuentemente los cambios en la concentración de proteínas derivados de hepatocitos, conocido como proteínas de fase aguda (APP) son observados (Llamas et al., 2006c).
Cuadro 7. Fenómeno de la fase aguda |
Cambios neuro-endocrinos |
Temperatura, somnolencia y anorexia Aumento en la secreción de CRH, ACTH y cortisol Aumento en la secreción de arginina-vasopresina (AVP) Aumento en la secreción adrenal de catecolaminas |
Cambios hematopoyéticos |
Anemia de enfermedades crónicas Leucocitosis Trombocitosis |
Cambios metabólicos |
Degradación de músculos y balance negativo del nitrógeno Disminución de gluconeogénesis Disminución de la producción de insulina como el factor de crecimiento (IGF)-1 Osteoporosis Aumentos en lipogénesis hepática Aumento de lipólisis en tejido adiposos Disminución de la actividad de lipoproteína en los músculos y tejidos adiposos Caquexia |
Cambios hepáticos |
Síntesis de proteínas de la fase aguda Aumentos en la metalotrionina, induce la síntesis de oxido nitroso, heme oxigenasa, magnesio súperoxido dismutasa, y tejidos inhibidores de metaloproteinasa-1 Disminución en la actividad fosfoenolpiruvato carboxiquinasa |
Cambios en la constitución del plasma no proteíco |
Hipozincaemia, hipoferremia, y hipercupremia Incremento de retinol en plasma y concentración de glutamina |
Fuente: Llamas et al, (2006c).
Dos respuestas fisiológicas son asociadas con la inflamación aguda. Primero las citoquinas pueden causar la elevación de la regulación térmica en el hipotálamo. La segunda respuesta se refiere a alteraciones del metabolismo y genética en el hígado (Llamas et al., 2006c).
El hígado es la principal fuente de mediadores inflamatorios sistemáticos, que dramáticamente afectan sus funciones y metabolismos. Durante la respuesta de fase aguda, da como resultado aumento de peso hepático durante los primeros días después de la infección. Básicamente dos mayores clases de alteración ocurren (1) cambios en los elementos ultra estructural, sus constituyentes químicos, y (2) cambios en las actividades especificas de las enzimas hepáticas especificas. Los cambios en la concentración de "proteínas de fase aguda" (APP) es la alteración mas relevante en el metabolismo en el hígado (Llamas et al., 2006c).
La citoquinas inflamatorias IL-1, IL-6, y TNF- a se conoce por aumentar la proporción de captación del aminoácido hepática y síntesis de la proteína. El aumento en la síntesis de la proteína hepática produce un aumento neto en la acreción de la proteína hepática y aumenta en la descarga proteica en la circulación. Generalmente se acepta que el aumento en la producción de proteína de la fase aguda es (ceruloplasmina, haptoglobina, fibrinógeno, a-acido-glicoporteína, a-macroglobulina, hemopexina) de importancia fundamental y es una respuesta adaptable necesaria para la supervivencia del animal (Klasing y col.,1995; Johnson et al., 2001; Santomá y Pontes, 2006). Las proteínas liberadas por el hígado tienen una serie amplia de funciones entre ellas es proteger al huésped del impacto potencialmente dañino de la respuesta inmune (Klasing et al., 1995). Se conocen que las proteínas de fase aguda refuerzan la fagocitosis de los macrófagos y la habilidad de la lisis, inhiben la actividad de proteasa del suero, y alteran las concentraciones minerales al plasma, entre otras funciones (Johnson et al., 2001). Este proceso requiere más energía y aminoácidos que los necesarios para los leucocitos (Klasing y col.,1995).
La regulación de la repuesta de la fase aguda
El inicio de las reacciones en la repuesta a una amenaza homeostática esta basada sobre la activación de macrófagos, en los sitios de inflamación, o en el centro del celebro. (Figura 22) Como consecuencias de esta activación, una gran cantidad de mediatores son liberados. Las citoquinas transmiten señales a una variedad de repuestas de células como el estrés, inflamación, inmunidad y reparación de los tejidos. Las citoquinas pueden generar y argumentar la repuesta como regular la activación de células locales (fibroblastos, células endoteliales, tejidos, macrófagos y mastocitos); reclutando y activando otras células inflamatorias incluyendo los monolitos, linfocitos, neutrófilos y eosinófilos. Además estos mediadores actúan como activadores de la respuesta inmune para ayudar la eliminación de patógenos y la resolución de otras enfermedades inflamatorias. Las citoquinas son también constitutivamente producidas, e involucran en la fisiología normal del estatus inmunológico. Por ejemplo las citoquinas inflamatorias han sido implicadas en la transición de dormir a despertar, la fase folicular a la fase lútea en ciclo oestrus durante la gestación (Llamas et al., 2006c).
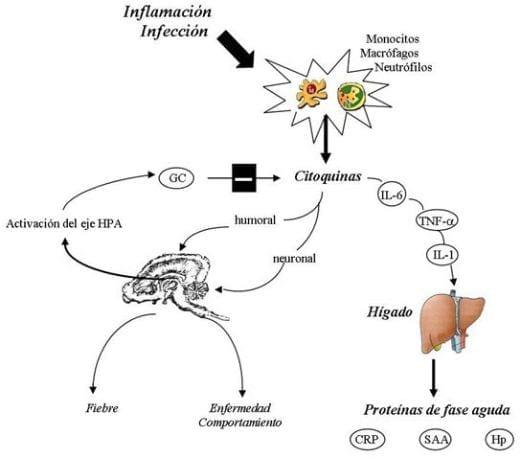
Figura 22. Respuesta de fase aguda. La activación del sistema inmune en la respuesta a infecciones o inflamaciones causa la secreción de citoquinas debido a macrófagos y neutrófilos. Estas moléculas se van al cerebro por vía neuronal o por humoral y activan el eje (HPA). Citoquinas pro-inflamatorias tumor necrosis alfa, (TNF-a), interleuquina-1 (IL-1) y IL-6 estimula la producción de proteínas de fase aguda en el hígado. [Proteína C-reactivo (CRP), suero amiloide A (SAA) y haptoglobina (Hp)]. Las citoquinas son también responsables para el proceso febriles y las enfermedades en el comportamiento. Glucocorticoides (GC), el producto final de la activación del eje HPA, inhibe la producción de citoquinas pro-inflamatorias, regulando la respuesta de la fase aguda. Fuente: Llamas et al, (2006c).
Las citoquinas son involucradas en un lugar extensivo que involucra sinergismo tal como interacciones antagonistas, exhibe ambos efectos negativos y positivos sobre varias células principales. Las citoquinas pueden inducir la producción de otros mediadores de la familia citoquinas como una cascada de citoquinas que no funcionan puramente en el sistema uni-direccional amplificado. Generalmente casi todas las citoquinas pueden inducir la secreción por lo menos uno de los mediadores (Cuadro 8). Los mecanismos aseguran que todas las células del cuerpo tienen la protección de ser involucrados en el inicio o la propagación de la respuesta de la fase aguda. Esta demuestra que la respuesta de la fase aguda es una suma integrada de cargas para regular los cambios en la expresión de los genes. En este sentido un número del proceso biológico requiere la acción secuencial y/o simultanea de varias citoquinas. El resultado fisiológico durante la exposición de la amenaza potencial a la homeostasis esta determinada por un efecto en la reacción entre los números de citoquinas (Llamas et al., 2006c).
Cuadro 8. Funciones biológicas especificas de las citoquinas Interleuquina-1 (IL-1), -6 (IL-6), y factor de necrosis tumoral-alfa (TNF-a) | |
Citoquinas | Funciones especificas |
IL-1 | Activación de estroma, condrocitos y epitelio en la respuesta localizada en el tejido dañado. Regulación de los linfocitos B en la médula ósea. Medición de tejidos infiltrados de leucocitos (vía IL-8). Activación de osteoblastos, del hueso y degradación de cartílagos. |
TNF-a | Inducción de la producción. Participación en la destrucción de células por supresión de síntesis de proteínas como resultado caquexia. Causan daños en endotelio local. |
IL-6 | Participación en la inducción y diferenciación de citotóxicos linfocitos T. Estimulación de la diferenciación de células hematopoyéticas. Modulación de la producción de IL-1 y TNF. |
Fuente: Llamas et al, (2006c).
Proteínas de la fase aguda
Durante la respuesta de fase aguda, la concentración de muchas proteínas en el plasma cambian después de un estimulo de la fase aguda. Sin embargo la fuerza, la magnitud, y la dirección de la respuesta es caracterizada por una proteína plasmática. El término proteína de fase aguda (APP) se refiere a varias proteínas con diversas propiedades fisicoquímicas y funciones biológicas, pero con un destaque común: todas son producidas por células parenquimales del hígado. Las proteínas de fase aguda fueron descritas como "trauma inducible producidas por glucoproteínas plasmáticas del hígado". APP tuvo un rango amplio de actividades, como agentes neutralizadores inflamatorios para minimizar la extensión de tejido dañado o participación de la reparación de tejido del huésped este contribuye a la defensa del huésped. La concentración de APP se incrementa a un 25 % o más durante la respuesta de fase aguda, son llamadas ATP positivos. Muchas de los APP y glicoproteínas contienen cantidades significantes de carbohidratos. Las síntesis de otro APP tal como albúmina, transferrina y factor de crecimiento de insulina, que son producidas en condiciones normales, disminuyen a los estímulos. Estos APP cuyas concentraciones son reducidas son conocidas como APP negativas (Llamas et al., 2006c).
Varios mediadores son capaces de regular la expresión de la genética de los APP en los hepatocitos, que son usualmente expuestos a mezclas complejas de moléculas extra celulares incluyendo citoquinas y otras moléculas biológicamente activas, como los glucocorticoides y factores de crecimiento. Estos mediadores pueden ser divididos en 4 diferentes categorías que en turno regulan diferentes grupos de APP. Sin embargo APP pueden ser clasificados como tipo 1 APP, que son inducidos por el IL-1 y TNF-α; y el tipo 2 APP inducidos por IL-6 y tipo citoquina IL-6 (Cuadro 9). Al caracterizar del tipo 1 APP es que sus síntesis es inducida sinergisticamente por TNF-α, IL-1 y IL-6 y el tipo 2 APP no son inducidas sinergisticamente por IL-1, además el tipo1 APP son caracterizados por un aumento dramático en sus concentraciones después de los estímulos inflamatorios y normalización rápida, y por otro lado el tipo 2 APP esta caracterizado por un aumento después del tipo 1, elevándose por dos semanas (Llamas et al., 2006c).
Cuadro 9. Regulación de proteínas de la fase aguda hepática.
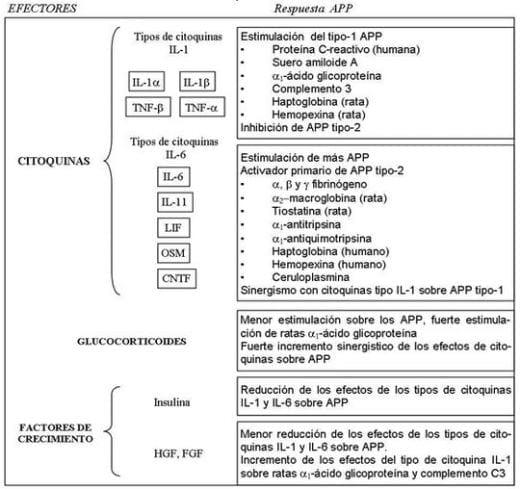

Abreviaturas: APP, proteínas de la fase aguda; IL, interleuquina; TNF, factor de necrosis tumoral; LIF, factor inhibidor leucemia; OSM, oncostaina M; CNTF, factor neurotrofico ciliar; HGF, factor de crecimiento hepatocito; FGF, factor de crecimiento fibroblasto. Fuente: Llamas et al, (2006c).
Sin embargo una gran variabilidad en la respuesta APP existe entre diferentes especies. En realidad, la respuesta tiene un formato de las proteínas de la fase aguda en especies específicas. Por ejemplo en los cerdos la mayor cantidad de APP son proteínas C-reactivas (CRP) y suero amiloide A (SAA) (Llamas et al., 2006c), mientras haptoglobina (Hp) y el ácido α1-glucoproteína (AGP) son moderados de APP (Llamas et al., 2006c; Sorrells et al., 2006). En adición la respuesta de la fase aguda hepática en cerdos es caracterizada por la síntesis del APP especifico positivo llamado proteína de la fase aguda mayor (pig-MAP) (Llamas et al., 2006c).
Las funciones de APP todavía no han sido completamente elucidadas pero aparecen que tienen funciones dirigidas a la recuperación y reparación de tejidos y limitando el daño causado de infecciones e inflamaciones. El APP puede actuar como una hemoglobina libre buscando y uniendo componentes bacteriales, activando complementos y atrapando microorganismos y sus productos. Algunos APP son también capaces de unir cationes divalentes que son necesarios para proliferación de muchos microorganismos. Adicionalmente, APP incluye inhibidores y antioxidantes de proteasa que neutralizan las enzimas proteolíticas que reactivan oxigeno liberados por leucocitos que salieron a los sitios de infecciones y le causan daño a los tejidos del huésped (Llamas et al., 2006c).
Sistema endocrino (parte 4)
Introducción
Todos los tejidos especializados del organismo necesitan funcionar de forma integrada. Dicha integración es posible por la acción de dos grandes sistemas de control: el sistema nervioso, que establece unas red de información electroquímica entre el cerebro y los tejidos, y el sistema endocrino, que utiliza mensajeros químicos, denominados hormonas (Tresguerres, 2005).
En el sistema endocrino, la regulación y la función de los canales de calcio es importante en las respuestas hormonales. Ejemplo de esta regulación lo constituye la tirotropina (TSH), que es capaz de movilizar el Ca2+ intracelular y regular los canales de Ca2+ para inducir la salida de yodo del tirocito. Los canales de calcio sensibles al voltaje (VSCC) se encuentran en la membrana plasmática de células musculares, neuronas y células gliales. Estos canales regulan la entrada de calcio a la célula y median funciones fisiológicas, tales como el crecimiento neural, la regulación enzimática, la expresión génica y la salida de neurotransmisores de las terminales nerviosas.
Los canales de calcio sensibles a voltaje son proteínas transmembrana que se encuentran ampliamente distribuidas en diferentes tipos celulares excitables y no excitables. Corresponden a la principal vía de entrada de calcio en el músculo cardíaco y el músculo liso, participan también en la salida de neurotransmisores desde células endocrinas y neuronas sensitivas, así como en procesos de degeneración axonal (Santisteban y Aranda, 2005).
Hipófisis
La hipófisis tiene dos porciones, la adenohipófisis y la neurohipófisis. Durante el desarrollo ontogénico, la adenohipófisis se origina como una evaginación dorsal del techo de la faringe del embrión y establece contacto con la neurohipófisis, un crecimiento ventral del suelo del diencéfalo (hipotalámico). El resultado es la íntima relación neural y vascular con el hipotálamo. Debido a estas relaciones el hipotálamo. Debido a estas relaciones el hipotálamo influye profundamente sobre el funcionamiento de la hipófisis (Dellmann, 1994).
La adenohipófisis glandular consta de tres partes. La pars distalis (o lóbulo anterior) constituye la mayor parte de la glándula, la pars intermedia (lóbulo intermedio) está estrechamente adherida al lóbulo neural, y la pars tuberalis forma un manguito alredor de la eminencia media (Dellmann, 1994).
La neurohipófisis consta de eminencia media, que es continua proximalmente con el hipotálamo, el talloinfundibular, que es la continuación distal de la eminencia media y el lóbulo neural (pars nervosa) (Dellmann, 1994).
Adenohipófisis
Pars distalis: En la pars distalis se sintetizan las siguientes hormonas: hormona del crecimiento o somatotropina (STH); prolactina, tirotropina (TSH); gonadotrofinas, homona estimulante de los folículos (FSH) y hormona luteinizante (LH); procorticolipotrofina que se divide en adrenocorticotrofina (ACTH), b y g-lipotrofina (LPH), endorfinas, hormona estimulante de los melanocitos (MSH), y péptido del lóbulo intermedio similar a la corticotrofina (CLIP) (Dellmann, 1994).
Pars intermedia: La pars intermedia está estrechamente asociada con la neurohipófisis. Las células de la pars intermedia penetran en el lóbulo neural, y en la pars intermedia hay axones neurosecretoras y aminérgicos (Dellmann, 1994).
Pars tuberalis: La pars tuberalis rodea a la eminencia media en forma de manguito, además contiene algunas células gonadotróficas y tirotróficas, células secretorias que no se encuentran en ninguna otra porción de la adenohipófisis (Dellmann, 1994).
Neurohipófisis
La neurohipófisis no es de por sí una glándula endocrina, sino que más bien es parte de un sistema, el hipotálamo-nuerohipofisario. En efecto, las hormonas que son liberadas de las terminaciones axónicas en el lóbulo neural son sintetizadas en el pericarion neural de los núcleos supraóptico y paraventricular hipotalámicos magnocelulares. Estos núcleos se caracterizan por poseer grandes células con una reacción inmuhistoqupímicas positivas para la hormona antidiurética (ADH o vasopresina) o bien para oxitocina (Dellmann, 1994).
Glándula adrenal
En el cerdo las adrenales son largas y angostas, se encuentran en el borde medial del riñón y están en contacto con el pilar del diafragma y la vena cava posterior (García, 1986). La glándula adrenal en los mamíferos consiste en dos órganos separados, la médula adrenal en el interior de la glándula, y la corteza, que rodea la médula por fuera de la glándula. La médula produce las catecolaminas, adrenalina, noradrenalina y dopamina. La corteza se comprende de la zona glomerulosa, que produce mineralocorticoides (MR) (predominantemente aldosterona), la zona fasciculada y la zona reticularis que producen glucocorticoides (GR) y andrógenos (Squires, 2003).
Glándulas suprarrenales
Las dos glándulas suprarrenales, en posición inmediatamente craneal al riñon, tienen una corteza (externa) y una médula (interna). La médula suprarrenal es homogénea y contiene gránulos de secreción (Figura 23) (Hafez, 1996).
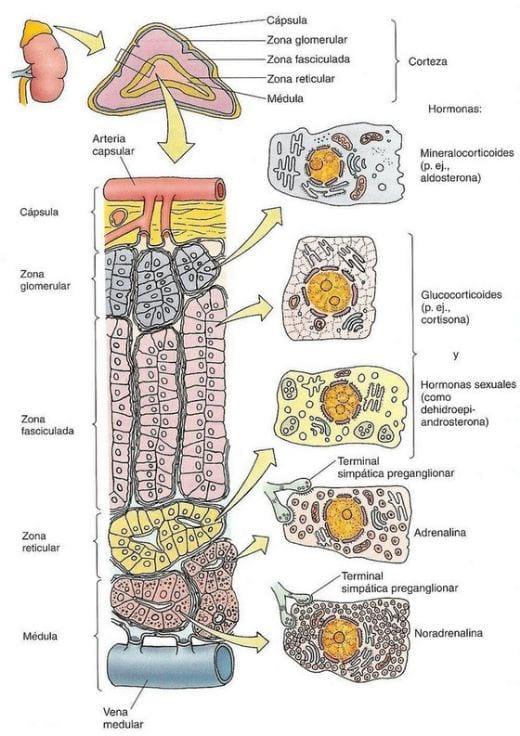
Figura 23. Esquema de la glándula suprarrenal y sus tipos de células. Fuente: Gartner y Hiatt, (2001).
Respuestas hormonales al estrés
El mantenimiento y consistencia del entorno interior dentro de los límites u homeostasis es crítico para la supervivencia del organismo. La preservación de este ambiente interior requiere la adaptación continua a estímulos externos o interiores o estresores, involucrando al comportamiento, cambios endocrinos y autónomos necesarios a anticiparse, prevenir y neutralizar las perturbaciones (Karman, 2003).
Los mecanismos por los cuales cambios neuroendocrinos ocurren en respuesta, son principalmente organizados por el cerebro, con la secreción en el hipotálamo que libera hormonas, así la tensión aumenta la actividad del sistema nervioso simpático y el eje hipotalámico-pituitario-suprarrenal, actúa para reforzar la secreción de glucocorticoides (Alarcón y col., 2008).
Una de las estaciones principales de control del sistema del estrés esta ubicado en el hipotálamo (Llamas et al., 2006b). Una vez que el estrés ha sido percibido, se ponen en marcha dos mecanismos:
1) El sistema medular hipotalámico-adrenal involucra el hipotálamo, glándula pituitaria, la ruta simpático neural a la médula adrenal, y la liberación de epinefrina (adrenalina) por la glándula suprarrenal (von Borell, 2001). Esta respuesta de estrés que puede tener un impacto fisiológico intenso pero es de corta duración llamado síndrome de huída o lucha (fight-flight síndrome: FFS) (von Borell, 2001; Campo y col., 2002; Karman, 2003; Squires, 2003);
2) El eje hipotalámico-pituitario-adrenocortical o -adrenal (hypothalamic-pituitary-adenalHPA), respuesta del estrés representa una duración larga, respuesta sostenida a los estresores "síndrome de adaptación general" (general adaptation syndromeGAS) (von Borell, 2001; Campo y col., 2002), que interviene cuando el sistema biológico falla en hacer frente al estrés y se suprime la actividad relacionada con el comportamiento. Así pues, cuando se requiere una respuesta al estrés a corto plazo interviene el sistema nervioso simpático y la médula adrenal (sistemaSA) (Campo y col., 2002; Squires, 2003), mientras que los efectos a largo plazo son debidos a los cambios en hipotálamo y la función pituitaria, siendo de estos la activación de la producción de glucocorticoides por la corteza adrenal (eje HPA) (Squires, 2003).
Se mencionan tres fases de la respuesta del estrés que describe como 1) la alarma (fase de emergencia), seguido por 2)resistencia (es decir, liberación de corticosteroides), con un resultado no productivo y 3)agotamiento del sistema de respuesta (manifestaciones pre-patológicas) y eventualmente la muerte.
El eje HPA
La activación del eje HPA es principalmente que afecta emocionalmente al animal; los estresores no activan necesariamente la activación del sistema HPA cuando el animal no percibe la situación estresante u opresiva. Sin embargo, los centros del cerebro cognoscitivos como la corteza cerebral perciben las amenazas externas y actúan para comenzar los mecanismos de la respuesta vía signos nerviosos que activan (von Borell, 2001), una respuesta a los estresores agudos es la activación del eje HPA, causa aumentó de la síntesis de la hormona liberadora de corticotropina (corticotropin-releasing hormoneCRH [un péptido de 41-aminoácidos también conocido como factor liberador de corticotropina, CRF]) (Hicks et al., 1998; von Borell, 2001; Squires, 2003; Karman, 2003; Karman et al., 2003a; Gupta et al., 2004), y arginina-vasopresina (AVP) (Moya et al., 2006b), en las neuronas parvocelular del núcleo paraventricular (nucleus paraventricular: PVN) del hipotálamo y su descarga en la circulación del portal dentro de unos segundo del ataque del estrés (Figura 24) (Squires, 2003; Karman, 2003; Gupta et al., 2004). Además que el eje HPA juega un papel importante en la regulación del metabolismo de energía durante el estrés, tanto en la movilización de las reservas energéticas como en la regulación del consumo voluntario (Fernández, 2000; Piedrafita y Manteca, 2002; Fábrega y col., 2003; Leek et al., 2004).
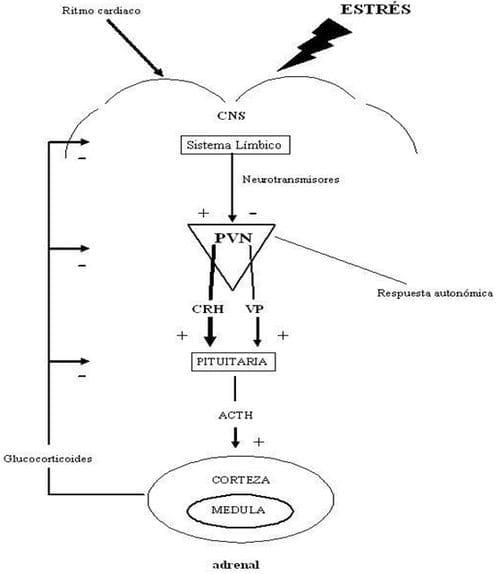
Figure 24. Diagrama que ilustra las respuestas integradas para dar énfasis a la activación del eje hipotálamo-pituitaria-adrenocortical y la regeneración y efectos regulador de glucocorticoides. El núcleo paraventricular (PVN) en el hipotálamo recibe el estimulador e inhibición del sistema límbico. La secreción de hormona adrenocorticotropina (ACTH) de la pituitaria anterior es principalmente controlado por hormona liberadora de corticotropina (CRH) y vasopresina (VP). ACTH estimula la síntesis y secreción de glucocorticoides de la corteza adrenal que ejerce la regeneración negativa en el sistema. Modificado deKarman, (2003).
El CRH hipotalámico es un neuropéptido responsable para las respuestas endocrinas, autonómicas, inmunológicas, y conductuales de los mamíferos estresados (Gupta et al., 2004). Un mayor papel de la CRH es la regulación del eje HPA a través de la inducción de la producción de POMC (propiomelanocortina) de la que derivan la ACTH (hormona adrenocorticotropa), β-endorfinas, β-lipotropina, y hormona estimulante a-melanocitos/ a-melanotropina (hormonas melanotropas) (Hicks et al., 1998; von Borell, 2001; Piedrafita y Manteca, 2002; Gupta et al., 2004), de la glándula pituitaria anterior y glucocorticoides de la glándula adrenal (Gupta et al., 2004), estos efectos se resumen en la figura 25.
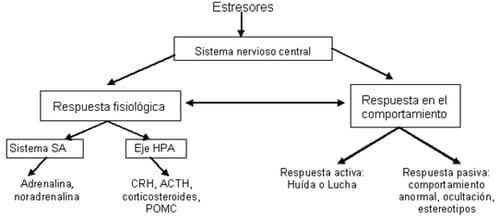
Figura 25. El esquema de respuesta global al estrés. Fuente: Squires, (2003).
En muchos casos se dice que el CRH es la forma de estimulación de secreciones de ACTH, pero eso no es absoluto, con AVP (y posible oxitocina) contribuyendo a secreciones extensas que varia con la naturaleza del ingenio fisiológico. Sin embargo el AVP tiene poca actividad secretora sobre ACTH (Llamas et al., 2006b), el AVP es un factor potente sinérgico con el CRH (Squires, 2003; Karman, 2003; Llamas et al., 2006b), esto puede ser debido a que la vasopresina (VP) libera péptidos derivados de POMC (propiomelanocortina), como la β-endorfina. Estos péptidos opiodes tienen un efecto analgésico y reducen la respuesta al estrés por inhibición de la liberación de CRH (Squires, 2003). El ACTH en turno, es el principal regulador de secreciones de glucocorticoides por la corteza adrenal (Figura 26) por la promoción y consumo de colesterol y su conversión enzimática a cortisol, corcotosterona y hormonas glucocorticoides (Squires, 2003; Karman, 2003; Llamas et al., 2006b).
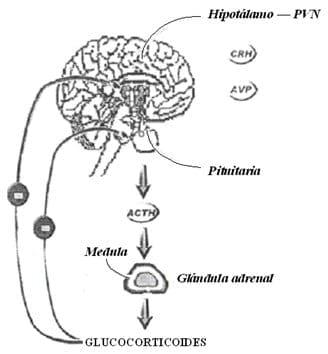
Figura 26. Diagrama esquemático del mayor componente del eje hipotálamo-pituitario-adrenal (HPA). Fuente: Llamas et al, (2006b).
La hormona CRH no sólo activa el eje HPA, también tiene una función de neurotransmisor en el cerebro. Por ejemplo, la administración del intracerebroventricular de CRH activa el sistema simpático y sistema adrenomedular, produciendo elevaciones de concentraciones en plasma de catecolaminas y aumentos en la presión arterial y ritmo cardiaco. Las respuestas incrementadas de glucocorticoides en la sangre puede inhibir la secreción de ACTH de la glándula pituitaria (control de retroalimentación; figura 27). Sin embargo, la liberación de ACTH es dependiente en la intensidad del estresor y modula por un mecanismo de retroalimentación sensible al estado basal. Por consiguiente, los estresores apacibles podrían ser inhibidos gradualmente por una retroalimentación de glucocorticoides, considerando que no se inhiben los estresores severos.
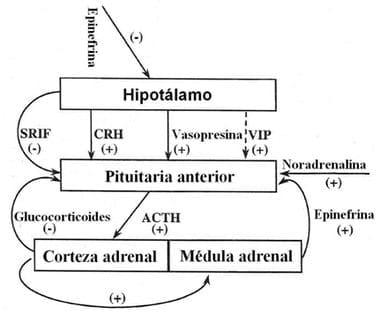
Figure 27. La regulación de secreción de glucocorticoides. SRIF = hormona inhibidora de la hormona somatotropina (somatostatina); CRH = hormona liberadora de corticotropina; VIP = Péptido intestinal vasoactivo (vasodilatory intestinal peptide). Fuente: von Borell, (2001).
Se han identificado los receptores de CRH en diversas regiones del cerebro incluyendo áreas implicadas en la función cognoscitiva así como en áreas límbicas implicadas en las emociones (von Borell, 2001). La hipersecreción de CRH provoca actividad de la inmunosupresor, la disminución del consumo de alimento, reduce la ganancia de peso, modula la actividad locomotora (Liu et al., 2003; Gupta et al., 2004; Lee et al., 2005), cambios en la fase aguda de concentración proteica en plasma (Liu et al., 2003; Lee et al., 2005), y limita la eficacia de la reproducción disminuyendo actividad secretora de las células productoras hormona del crecimiento (GH); hormona somatotrópica (STD) (Liu et al., 2003; Gupta et al., 2004) y hormona liberadora de gonadotropina (GnRH) (Gupta et al., 2004). Consecuentemente los cambios resultan en un pobre crecimiento (Liu, et al., 2003).
Los mineralocorticoides (MR) promueven el transporte de membrana entre compartimientos líquidos intracelulares y extracelulares. Los glucocorticoides (GR) son secretados por la zona fasciculada de la corteza adrenal. Su secreción es regulada por ACTH adenohipofisaria. Estímulos como el estrés causan la secreción de corticotropina, lo que incrementa las concentraciones de glucocorticoides por encima de los valores normales. La secreción excesiva de ACTH causa hipertrofia adrenal debido a los GR (Hafez, 1996). El glucocorticoide de mayor producido en los cerdos es el cortisol (Squires, 2003).
Glucocorticoides (GR)
Durante el estado de homeostasis, los glucocorticoides (GR) regulan las acciones de la norepinefrina y otras catecolaminas en la sangre permitiendo a las hormonas un funcionamiento normal y manteniendo así las condiciones de la homeostasis. En respuesta a los eventos del estrés los niveles de glucocorticoides son elevados y regulan las reacciones de las hormonas previniendo el sistema inmune (Alarcón y col., 2008).
La secreción excesiva de ACTH estimula la descarga de GR de la corteza adrenal en la sangre de los animales estresados (Hicks et al., 1998; Cuarón, 1999; Piedrafita y Manteca, 2002). Los GR juegan un rol como inductor en el proceso de la fase aguda y actúa sinergéticamente como mediadores de citoquinas en los cambios en el gen de expresión ácido a1-glucoproteína (AGP) (Sorrells et al., 2006). Los GR puede llevar a la atrofia del músculo, hipertensión, enfermedad arterial, deterioro de crecimiento y reparación del tejido, así como el inmunosupresión. Es más, los glucocorticoides ejercen la regeneración negativa al nivel pituitaria anterior, hipotálamo y límbico suprahipotálamo estructura como el hipocampo y la amígdala, controla la actividad del eje HPA (Figura 28)(Karman, 2003).
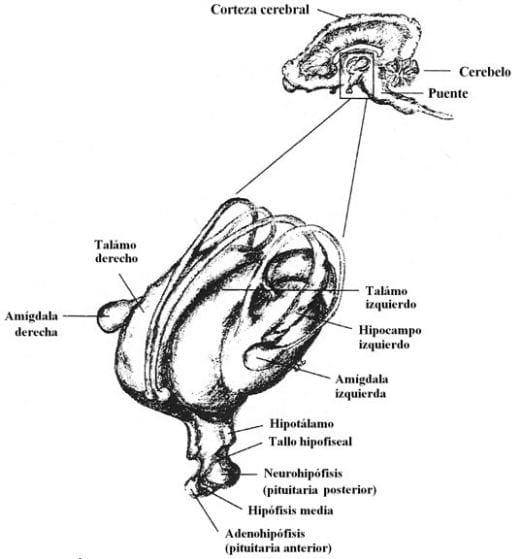
Figura 28. Sistema límbico Fuente: Swing et al, (1999); citado por von Borell, (2001).
Por lo tanto, los GC son los efectores finales del eje HPA, participando en el control de la homeostasis del cuerpo y en la respuesta al estrés del organismo. El GC se regula la actividad basal del eje HPA, que es necesario para el mantenimiento homeostático y para detener la respuesta del estrés. Sin embargo, el GC inhibe retroactivamente sobre la síntesis de ACTH a los niveles pituitarios y sobre la liberación de CRH del hipotálamo que va a limitar la duración de los tejidos expuestos a GC (Figura 26). Este mecanismo constituye a la reacción principal regulatoria para el mantenimiento homeostática (Llamas et al., 2006b).
Los MR y GR se han encontrado en los lóbulos frontales de la corteza cerebral, en la amígdala y en el hipocampo. Los papeles de estas regiones cerebrales en el procesamiento cognitivo, memoria y en la respuesta emocional sugieren que el cortisol esta involucrado en estos procesos. A partir de un amplio rango de estudios se sabe que la amígdala está asociada con las respuestas al miedo. Protege al núcleo paraventricular (PVN) del hipotálamo en donde CRH regula a la ACTH (Zanella y Broom, 2003).
Estos receptores, MR y GR, son caracterizados por diferentes esteroides específicos y distribución neuroanatómica. Dentro del sistema nervioso central (CNS), los receptores MR se localiza predominantemente en el hipocampo y septum. Los MR liga el glucocorticoides con afinidad alta pero la capacidad baja, es operacional cuando los niveles de glucocorticoides son bajos, y regula las fluctuaciones diurnas en condiciones de circulación básales bajas de GR. Los receptores de GR son extensamente distribuidos en el cerebro. La muestra de afinidad relativamente baja pero la capacidad alta de ligar GR (Karman, 2003).
Cortisol
La secreción de cortisol en la respuesta de estresores diferentes ha sido evaluada y ahora, esta considerada como un indicador del bienestar. Aumentos en las concentraciones de cortisol ha sido reportado en las respuestas de estresores físicos, como en la castración de los machos, restringidos, y en el transporte. El destete, el mezclado de los cerdos también induce en la síntesis de cortisol. Alternativamente, la secreción de cortisol es también estudiado en la administración de ACTH. En el desafió de ACTH ha sido usado para determinar los efectos sociales, tipos de corrales y el estrés pre-natal, sobre las respuestas de cortisol inducidos (Llamas et al., 2006b).
Cortisol actúa por la regeneración negativa en el hipotálamo y pituitaria, el cortisol disminuye la producción de CRH y ACTH. La respuesta de HPA ocurre más despacio (minutos a horas) y tiene un efecto más general en el animal que la respuesta de SA. La ACTH se secreta de una manera pulsátil a lo largo del día y se piensa que refuerza atención, motivación, aprendizaje y retención de memoria, sin embargo ACTH y CRH suprimen la reproducción.
El sistema LUC-NE también está envuelto en la respuesta de estrés, cuando la noradrenalina aumentan la actividad del cerebro general y estimulan la descargo de CRH (Figura 29). CRH, a su vez, estimula la liberación noradrenalina que actúa localmente y sistémicamente. Los receptores de CRH están presentes en varias áreas del cerebro involucradas con la función cognoscitiva y emoción. La respuesta a CRH depende de la experiencia anterior y tipo de estresores así como la disposición genética del animal.
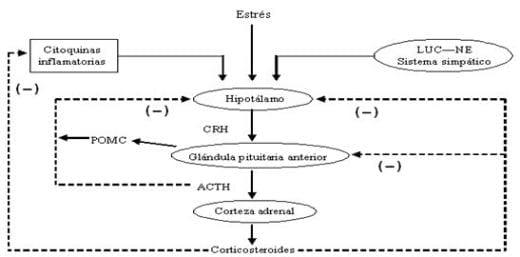
Figura 29. Respuesta del eje HPA al estrés Fuente: Squires, (2003).
CRH actúa vía dos clases de receptores, CRHR1 y CRHR2 (a, β y forma g) todos de los cuales son receptores G-proteína-acoplada. Hay también una proteína CRH-fijación que se piensa que regula la respuesta libre extracelular de CRH. La CRHR1 se une a un incremento como ansiedad en el comportamiento y se localizó en la corteza del cerebro y cerebelo. La CRHR2a se localiza en los septum laterales y paraventricular y núcleos ventromediales del hipotálamo; CRHR2β se encuentra en el corazón, músculo esquelético y en el plexo coroide y arteriola cerebrales en el cerebro; y CRHR2g se localiza en la amígdala (Squires, 2003).
El estrés en el embarque, estrés social, estímulos eléctricos, estrés calórico, suspensión alimenticia y agua, puede aumentar la concentración de cortisol en el plasma en los cerdos. Durante la producción y comercializando de cerdos, varios situaciones opresivas o estresantes llevan a las pérdidas de la producción y enfermedades patológicas (Hicks et al., 1998).
Cuando se secreta cortisol excesivamente durante un largo periodo, este ejerce efectos negativos sobre los sistemas digestivos, inmunitarios (Grandin, 1984; Piñeiro, 2002; Muñoz, 2002; Lapuente y Rosell, 2003; Ruiz y Manteca, 2004d; Leek et al., 2004), un incremento en los neutrófilos circulatorios: proporción de linfocitos, eleva la temperatura del cuerpo (Leek et al., 2004), y reproductivos (cerdos adultos) (Cuadro 10) (Muñoz, 2002; Ruiz y Manteca, 2004d).
Los animales alojados individuales pueden reaccionar diferentemente al mismo estímulo, mientras dependiendo de su constitución genética y las experiencias anteriores. El ritmo cardiaco, efectos medioambientales, así como la edad, sexo el estado fisiológico y densidad de la población, también puede afectar las reacciones de individuos al estrés. Los comportamientos útiles por sobrevivir incluyen los nivel de actividad, postura, vocalización, agresividad, modelos de movimiento, consumo de alimento, consumo de agua, y sueño (Squires, 2003).
Cuadro 10. Efecto de una secreción excesiva y prolongada de corticoides en el cerdo | |
Sistema digestivo | ● Desarrollo de ulceras gástricas ● Aumento del catabolismo proteico ● Aumento del catabolismo lipídico |
Sistema inmunitario Efecto directo | ● Disminución en los niveles de inmunoglobulinas, linfocitos ● Disminución de monolitos ● Disminución del tamaño del timo |
Indirectos | ● Retención de zinc, cobre en el hígado ● Alteraciones en la mucosa digestiva ● Desincronización de los ritmos hormonales |
Endocrinos | ● Catecolaminas ● Citoquinas ● ACTH/CRH, glucocorticoides ● Modificación de los niveles de prolactina, renina, hormona del crecimiento y β-Endorfinas. |
Comportamiento/fisiológicos | ● Actividad/ Falta de sueño ● Posturas/Estereotipos ● Consumo de agua y alimento ● Ritmo cardiaco y presión sanguínea |
Fuente: Muñoz (2002) y Squires, (2003).
Sistemas de habilidad
El bienestar de un animal puede ser afectado por el estimulo y puede ser percibido como inocuos o amenazadores (Karman, 2003; Llamas et al., 2006b). Si estos estímulos son percibidos como un amenazador, el animal va a reaccionar, las respuestas pueden ser divididas en tres etapas generales (Figura 30). El reconocimiento de un estimulo como un amenazador a la homeostasis (estresores) constituyen a la primera etapa de su respuesta. Subsecuentemente, el animal obtiene defensas biológicas y mecánicas contra el estresor, incluyendo la adaptación y respuestas de habilidad designado a regresarlo a su estado normal de su balance y equilibrio. Estas respuestas de adaptación pueden ser especificas a los estresores, o generalizado y no especifico. Las respuestas de lo último generalmente ocurren solo si la magnitud del amenazador a la homeostasis se excede a un cierto punto. Finalmente el estresor puede tener diferentes consecuencias. Si el animal no es capaz de aumentar las respuestas apropiadas al estímulo amenazador, este puede resultar en un estado pre-patológico o, muerte del animal en casos muy drásticos (Llamas et al., 2006b).
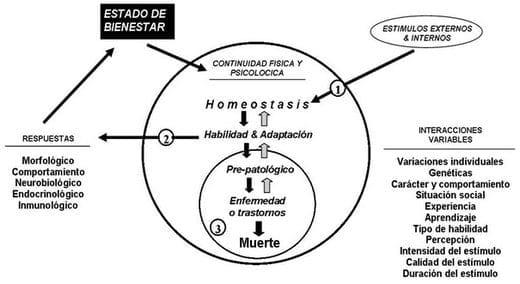
Figura 30. La representación esquemática de un modelo del estrés del animal. La percepción del estímulos como un amenazador a la homeostasis (1) pueden ser modificados por muchas interacciones variables, al inicio de la respuesta del estrés. El resultado final de las respuestas a los estresores pueden ser diferentes dependiendo de su adaptación y habilidad de las respuestas biológicas activadas (2). Si el animal no es capaz a resistir los efectos que lo hacen sentir mal de los estímulos, se va a desarrollar en un estado pre-patológico que puede tener consecuencias fatales en algunos casos. Fuente: Llamas et al, (2006b).
Henry y Stephens (1977) citados por von Borell, (2001), supusieron que la amígdala e hipocampo están envueltos en dos procesos diferentes de habilidad que permiten a un animal responder o amenazar y los estímulos frustrantes (concepto de habilidad/predecible). Varios estudios han confirmado que estímulos imprevisibles o ingobernables activarán la vía hipocampal y el eje HPA, llevando a la depresión de la conducta. La habilidad de ajustar algunos estresores (controlar), sin embargo, parece estar bajo el mando de la amígdala a través de la activación del sistema nervioso simpático y prepara el animal para "huída o lucha" o FFS (Figura 31).
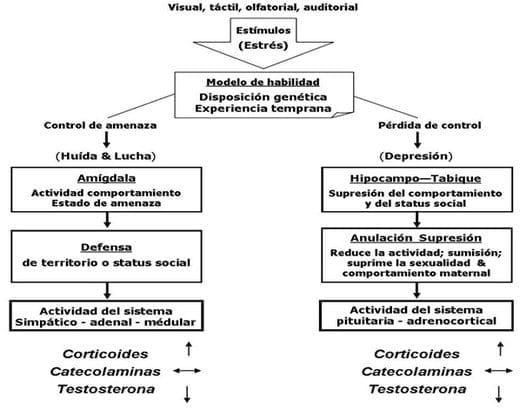
Figura 31. Concepto de habilidad/predecible Fuente: Henry and Stephens, (1977); citado por von Borell, (2001).
La investigación ha documentado la existencia de básicamente dos maneras diferentes de habilidad con situaciones estresantes u opresivas (por ejemplo; incremento en el ritmo cardíaco y tensión arterial) (von Borell, 2001; Squires, 2003; Karman, 2003). Primeramente, la habilidad activa, pareciéndose la respuesta de FFS inmediata que se caracteriza por una activación alta del sistema modulatorio simpático adrenal, los estudios en las estrategias de habilidades individuales diferentes han mostrado que animales pre-activados (proactive) (removiéndolos de la fuente de estrés o quitándoselas) parecía ser predominados por el sistema nervioso simpático, considerando que los animales re-activados (reactive) (apuntó para reducir el impacto emocional del estrés) parecía ser predominados por sistema nervioso parasimpático (von Borell, 2001; Squires, 2003), y secundariamente, la habilidad pasiva, parecida la respuesta de conservación-retiro, caracterizado por un aumento del sistema pituitario adrenal cortical (Karman, 2003).
Intrigantemente, cada individuo parece tener una preferencia para uno o la otra estrategia de habilidad, activación de uno o el otro sistema depende de muchos factores como la disposición genética, experiencia temprana (Karman, 2003), habilidad cognoscitiva, y en la calidad y cantidad del estresor. Las situaciones de incertidumbre, presión social y miedo son los estresores potentes con relevancia para el bienestar animal, llevando severos daños a los órganos designado específicos y tejidos o incluso a la muerte (von Borell, 2001; Llamas et al., 2006b). Varios estudios han mostrado que las dos estrategias conductuales son muy puestas en correlación con diferencias fisiológicas y regulación neuroendocrina. Los numerosos estudios en la vulnerabilidad individual a las enfermedades relacionadas al estrés son basados en el uso de líneas generadas por la selección genética en estas estrategias conductuales (Karman, 2003; Karman et al., 2003b).
El estrés ocurre cuando la homeostasis de un animal se amenaza, y esto puede tener los efectos negativos dramáticos en el sistema inmunológico, reproducción y el crecimiento, la disminución de la eficacia en la utilización nutriente para el mantenimiento y desarrollo de los animales (Figura 32). En el animal joven, una pérdida de eficacia de crecimiento por el estrés puede compensarse un poco por la eficacia incrementada del uso nutrientes por la termogénesis. Además de las respuestas endocrinas, el estrés reduce la disponibilidad de nutrientes disminuyendo el apetito, motilidad del intestino y absorción de nutrientes, y afectando los niveles de actividad del animal (Squires, 2003).
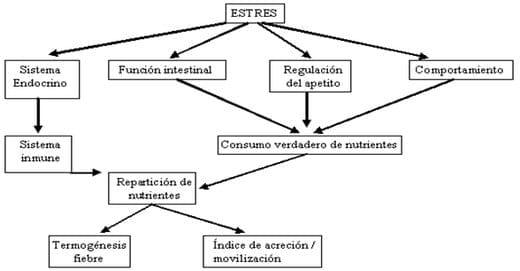
Figura 32. Efecto del estrés sobre el consumo y utilización de nutrientes. Fuente: Squires, (2003).
El estrés en general es una respuesta catabólica, ya que esta movilización de energía del cuerpo es para ponerlas a disposición del cerebro y de los músculos. Las catecolaminas aumentan la función cardiovascular y en conjunción con las glucocorticoides producen un incremento de la gluconeogenésis, la degradación proteica en las fibras musculares, la lipólisis y la concentración de ácidos grasos en sangre, a la vez que se produce una acción anti-inflamatoria (Piedrafita y Manteca, 2002; Squires, 2003). Inconsecuencia todo esto tiene un costo biológico, ya que el animal destina energía que debería haberse dedicado al crecimiento para atender al estrés (Piñeiro, 2002).
Los factores estresantes exigen un mayor aporte de energía para los procesos de mantenimiento de los lechones lo cual obtendrán a partir de la movilización de sus reservas corporales, explicando así la pérdida de peso observado en los primeros días después del destete (Reis y Mariscal, 2004). Una mejora global del estatus de salud y otros factores (manejo, instalaciones, medioambiente) incrementa el crecimiento, contribuyendo a una mejora en los índices productivos (Mahan et al., 2004).
Los sistemas modernos de producción exponen a los animales a ambientes más estresantes que cuando éstos son criados libremente, y a pensar de que se trata de minimizar el estrés en los animales, en la mayoría de éstos, el estrés se refleja en los perfiles endocrinos lo cual trae como consecuencia cambios en e......
Literatura citada
- Alarcón, R. A. D., J. G. Gamboa, A., y H. Janacua, V. 2008. El papel de las hormonas en el estrés porcino. Vol. II, No.2 Mayo-Agosto. Tecnociencia Chihuahua p-p: 72-80.
- Alzola, R. 2002. Tejido hemocitopoyetico linfoide (sistema inmunitario). Curso de histología, embriología y teratología. UNCPBA.
- Blakiston. 1983. Diccionario breve de medicina. Ediciones científicas La prensa médica mexicana, S.A. de C.V.
- Campo, J. L., M. G. Gil, y S. G. Dávila. 2002. El bienestar de los animales domésticos. Departamento de mejora genética. Instituto nacional de investigación agraria y alimentaría. Madrid.
- Cisneros, G. F. 1999. Factores no nutricionales que limitan el consumo de alimento en cerdos. Los Porcicultores y su entorno. Año 3, No. 14.
- Cisneros, G. F. 2000. Efectos del estrés en la producción porcina. Los porcicultores y su entorno. Año 3, No. 14.
- Collado, V. M., R. Porras, M. T. Cutuli, E. Gómez-Lucía. 2008a. Sistema inmune innato I: Sus mecanismos. Departamento de sanidad Animal, Facultad de Veterinaria, Universidad Complutense, Madrid España. Revista Complutense de ciencias veterinarias 2008 2(1): 1-16.
- Collado, V. M., R. Porras, M. T. Cutuli. 2008b. Respuesta inmune innata: su papel en la prevención y lucha frente a las infecciones. Departamento de sanidad Animal, Facultad de Veterinaria, Universidad Complutense, Madrid España. Información Veterinaria. Junio.
- Cuarón, I. J. A. 1999. Nutrición y Enfermedad. IX Congreso Nacional AMENA, Asociación Mexicana de Especialistas en Nutrición Animal A. C. México.
- de la Fuente, del R. M. 2005. Bases funcionales de la respuesta inmunitaria. Capítulo 22. Fisiología humana. Ed. McGraw-Hill Interamericana de España, S.A.U. 3era ed. p-p. 331-346.
- Dellmann, D-H. 1994. Histologia veterinaria. Sistema endocrino. Dellmann Dieter-H. Ed. ACRIBIA, S. A. ed 4ta. Zaragoza.
- Fábrega, E., A. Velarde, y Mantecas. 2003. Bienestar animal y calidad. IRTA. http://www.irta.es/xarxatem/FABREGA_CAS.htm
- Fernández, C. J. 2000. Descripción del comportamiento alimentario en cuatro razas porcinas y estudio de su relación con la productividad, el gen del halotano y la jerarquía social. http://www.tdx.cbuc.es/TESIS_UAB/AVAILABLE/TDX-0226102-1442339/JFC1de4.pdf
- García, de la P. J. 1986. Manual de endocrinología veterinaria. Facultad de Medicina Veterinaria y Zootecnia, Departamento de Fisiología y Farmacología. UNAM.
- Gartner, P. L., y L. J. Hiatt. 2001. Texto atlas de histología. Ed. Mc Graw-Hill, 2da ed. Philadelphia.
- Gupta, S., B. Earley, S. T. L. Ting, N. Leonard, and M. A. Crowe. 2004. Tchnical note: Effect of corticotrophin-releasing hormone on adrenocorticotropic hormone and cortisil in steers. J. Anim. Sci. 82:1952-1956.
- Hafez, E. S. E. 1996. Reproducción, hormonas y factores de crecimiento. Reproducción e inseminación artificial en animales. 6ta, ed. Ed. McGraw - Hill interamericana. USA.
- Harris ("Hank"), D. L. 2000. Multi-site pig production. Iowa State University. Press/Ames.
- Hicks, T. A., J. J. McGlone, C. S. Whisnant, H. G. Kattesh, and R. L. Norman. 1998. Behavioral, endocrine, immune, and performance measures for pigs exposed to acute stress. J. Anim. Sci. 76:474-483.
- Johnson, R. W., J. Escobar, and D. M. Webel. 2001. Nutrition and immunology of swine. Nutrition Swine, 2da ed., Ed. CRC Press. Florida.
- Karman, A. G. 2003. Neuroendocrine adaptation to stress in pigs, CRH and vasopressin in the paraventricular nucleus. Thesis Wageningen University, The Netherlands.
- Karman, A. G., A. T. D. van Kesteren-Buiting, N. A. Geverink, F. J. C. M. van Eerdenburg, V. M. Wiegant, E. M. van der Beek. 2003a. Individual housing affects vasopressin but not corticotropin-releasing hormona peptide expression in the paraventricular nucleus in pigs depending on coping strategy. Thesis Wageningen University. The Netherlands.
- Karman, A. G., A. T. D. van Kesteren-Buiting, M. Loos, V. M. Wiegant, E. M. van der Beek. 2003b. Corticotropin-releasing hormona mRNA expression in the paraventricular nucleus in pigs is affected by individual housing depending on coping strategy. Thesis Wageningen University, The Netherlands.
- Klasing, K., R. Roura, y D. Korver. 1995. Interacciones entre nutrición y sistema inmune. Univ. Of California. Davis. FEDNA.
- Lapuente, S., y C. Rosell. 2003. Problemática actual de la patología digestiva en lechones. Departamento Técnico, Elanco Valquímica, S. A. NANTA.
- Lee, C., L. R. Giles, W. L. Bryden, J. A. Downing, D. C. Collins, and P. C. Wynn. 2005. The effect of active immunizatrion against adrenocortocotropic hormone on cortisol, β-endorphin, vocalization, and growth in pigs. J. Anim. Sci. 83:2372-2379.
- Leek, A. B. G., B. T. Sweeney, P. Duffy, V. E. Beattie, and J. V. O'Doherty. 2004. The effect of stocking density and social regrouping stressors on growth performance, carcass characteristic, nutrient digestibility and physiological stress responses in pigs. Animal Science 79:109-119.
- Liu, Y. L., D. F. Li, L. M. L. M. Gong, G. F. Yi, A. M. Gaines, and J. A. Carroll. 2003. Effects of fish oil supplemention on the performance and the immunological, adrenal, and somatotropic responses of weaned pigs after an Escherichia coli lipopolysaccharire challenge. J. Anim. Sci. 81:2758-2765.
- Llamas, M. S., L. Boyle, P. B. Lynch and S. Arkins. 2006a. Pro-inflammatory cytokine and acute phase protein responses to low-dose lipopolysaccharide (LPS) challenge in pigs. Animal Science. 82: 527-534.
- Llamas, M. S., L. Boyle, P. B. Lynch and S. Arkins. 2006b. Stress biology in the pig (part 1). The Pig Journal 57, 8-29.
- Llamas, M. S., L. Boyle, P. B. Lynch and S. Arkins. 2006c. The acute phase response in the pig (part 2). The Pig Journal 57, 30-56.
- Llamas, M. S., L. Boyle, P. B. Lynch and S. Arkins. 2006d. Sickness behaviour and stress susceptibility in the pig (part 3). The Pig Journal 57, 57-69.
- Mahan, D. C., N. D. Fastinger, and J. C. Peters. 2004. Effects of diet complexity lactose levels during three starter phases on psotweaninig pig performance. J. Anim. Sci. 82:2790-2797.
- Muñoz, L. A. 2002. Bienestar de los cerdos: Las normas Europeas y una propuesta de bienestar razonable. I Congresso Latino Americano de Suinocultura. Brasil.
- Nazará, C. S. 1996. Procesos de enfermedad, Texto de patología general veterinaria. Universidad Autónoma de Chiapas. México.
- Obled, Ch. 2002. Necesidades de aminoácidos en estados inflamatorios.
- Pié, S., J. P. Lallès, F. Blazy, J. Laffitte, B. Sève, and I. P. Oswald. 2004. Weaning is associated with an upregulation of expression of inflammatory cytokines in the intestine of piglets. J. Nutr. 134: 641-647.
- Piedrafita, J., y X. Manteca. 2002. Mejora genética del comportamiento y del bienestar del ganado rumiante. Barcelona. http://www.unavarra.es/rmga/JPiedrafita.pdf
- Pluske, J. R. 2005. Alimentación y morfología intestinal en porcino. Universidad de Murdoch. Australia.
- Porras, R., V. M. Collado y A. Doménech. 2008. La respuesta inmune innata local y sistémica frente a la infección. Dpto. Sanidad Animal. Facultad de Veterinaria. Universidad Complutense. Madrid. Información Veterinaria. Septiembre.
- Reis, S. T. C., y L. G. Mariscal. 2004. Preferencia alimenticia y comportamiento zootécnico en lechones alimentados con dietas formuladas con diferentes tipos de suero de leche deshidratado.
- Richard, B. R., M. L. Verdecia., M. Torres. 1991. Elementos de anatomofisiología veterinaria. Ed. Pueblo y Educación.
- Romero, L. (¿?). Proceso inflamatorio. Departamento de patología. FMVZ - UNAM.
- Ruiz, de la T. J. L., y X. Manteca. 2004d. El concepto de estrés y su influencia sobre la productividad.
- Santisteban, P. y A. Aranda. 2005. Mecanismos de acción hormonal. Capitulo 66. Fisiología humana. Ed. McGraw-Hill Interamericana de España, S.A.U. 3era ed. p.p 803-817.
- Santomá, G. y M. Pontes. 2006. Influencia del alojamiento sobre la nutrición de aves y cerdos. Tecna/Trouw nutrition international. XXII Curso de especialización FEDNA.
- Sorrells, A. D., S. D. Eicher, K.A. Scott, M. J. Harris, E. A. Pajor, D. C. Lay, and B. T. Richert. 2006. Postnatal behavioral and physiological responses of piglets from gilts housed individually or in groups during gestation. J. Anim. Sci. 84:757-768.
- Spreeuwenberg, M. A. M. 2002. Nutrición y salud del lechón destetado. Nutreco Swine Research Centre, The Netherlands.
- Squires, J. E. 2003. Applied animal endocrinology (Effects of stress; What is stress?) Department of Animal and Poultry Science, University of Guelph, Guelph, Ontario, Canada. CABI Publushing.
- Stahly, T. 1996. Influencia de la activación del sistema inmunitario sobre la productividad y las características nutricionales de dietas para cerdos. University State Iowa. USA. FEDNA.
- Tamalás, R. P. 2005. Bases celulares y moleculares del sistema inmunitario. Capítulo 21. Fisiología humana. Ed. McGraw-Hill Interamericana de España, S.A.U. 3era ed. p-p. 309-330.
- Tolleson, D. R., 2007. Physiological indicators of tick-induced stress in grazing animals: detection by non-invasive bio-forensic techniques. Submitted to the office of graduate studies of Texas A&M University in partial fulfillment of the requirements for the degree of doctor of philosophy. Texas.
- Tresguerres, F. A. J. 2005. Introducción al sistema endocrino: conceptos de hormona. Capítulo 65.Fisiología humana. Ed. McGraw-Hill Interamericana de España, S.A.U. 3era ed. p-p 794-802.
- von Borell, E. H. 2001. The biology of stress and its application to livestock housing and transportation assessment. J. Anim. Sci. 79(E. Suppl.):E260-E267.
- Williams, N. H., T. S. Stahly, D. R. Zimmerman. 1997. Effect of chronic immune system activation on the rate, efficiency, and composition of growth and lysine needs of pigs fed from 6 to 27 kg. J. Anim. Sci., 75:2463-2471.
- Zanella J. A., y M. D. Broom. 2003. Medidas neurofisiológicas que nos hablan del bienestar animal. Curso "Fronteras de la Medicina Veterinaria". México.
Temas relacionados
Autores:
Recomendar
Comentar
Compartir
31 de marzo de 2011
Estimados amigos y colegas.
Muchas gracias por sus comentarios, espero que en un futuro no muy lejano, podamos conjugarnos para realizar un artículo, con todas sus ideas, y poder compartirlas con la comunidad.
Recomendar
Responder
UNAM - Universidad Nacional Autónoma de México
29 de marzo de 2011
Edgar te felicito por esta publicación, muy completa y bien tratada, no es un tema fácil de poner y explicar y a mi gusto lo has logrado de maravilla
Recomendar
Responder
29 de marzo de 2011
Muchas gracias amigos, por sus comentarios, son alentadores para continuar con el envió de mas artículos.
Recomendar
Responder
27 de marzo de 2015
muy buenos dias Dr. Edgar Beltran me uno a los comentarios de los otrospaneistas .. felicidades un buen articulo que de seguro sra de mucha utilidad.. saludos
Recomendar
Responder
30 de marzo de 2011
FELICITACION POR EL TRABAJO, POCOS VECES SE TIENE LA OPORTUNIDAD ARTICULOS CON UN BUEN NIVEL DE CONOCIMIENTOS ADEMAS PORQUE ESTOS LLEGUEN A OTROS
Recomendar
Responder
30 de marzo de 2011
felicitaciones por esta publicacion esta muy completa y la verdad que es untema dificil de explicar y de entender gracias
Recomendar
Responder
29 de marzo de 2011
29/03/2011.- Excelente trabajo, muy bien expuesto y con una documentaciòn cientifica actualizada, FELICITACIONES y gracias por suministrar esta valiosa compilacion.
Recomendar
Responder
29 de marzo de 2011
muy buen trabajo,y muy bien desarrollado gracias por brindarnos tus conocimientos
Recomendar
Responder
Recomendar
Responder

29 de marzo de 2011
Muy buen trabajo, recopilación de información indispensable y de buen nivel Felicitaciones.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.