Principales puntos críticos en un centro de inseminación
Todos estos puntos podemos resumirlos en tres pilares fundamentales:
● Calidad del agua de laboratorio.
● Temperatura de trabajo y conservación de las dosis seminales.
● Bioseguridad, higiene y desinfección.
Agua de Laboratorio
La calidad del agua de laboratorio empleada constituye el primer punto a valorar.
Hemos de tener en cuenta que no cualquier tipo de agua es válido para permitir la supervivencia de las células espermáticas; pues estas necesitan unas condiciones específicas para su conservación óptima como son, por ejemplo, un pH entre 6.8 y 7.6, una osmolalidad de entre 280 y 330 miliosmoles/kg (aunque son capaces de resistir rangos mayores en el caso de la osmolalidad). Es por ello que se utiliza agua de laboratorio a la que se añade diluyente, para proporcionar a los espermatozoides el medio más adecuado a sus requerimientos fisiológicos; tanto fisico-químicos como nutricionales.
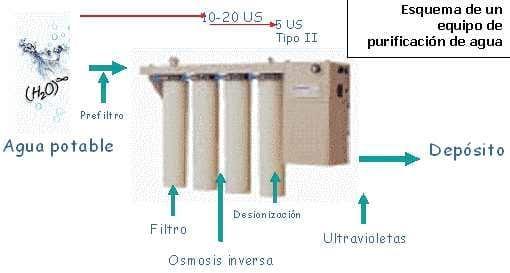
Nos encontramos de esta manera con que hay varios tipos de agua en función de su grado de destilación y pureza, todos susceptibles de ser utilizados en inseminación; a saber: TIPO I, TIPO II, y TIPO III.
De ellas el agua “ultrapura” es la TIPO I, pero apenas se emplea por ser de muy elevado coste su producción. Por eso las más utilizadas son las TIPO II y TIPO III.
Existen diversos sistemas de depuración de agua como la ósmosis inversa, destilación, desionización, etc. Según empleemos unos u otros, o combinaciones de ellos, obtendremos los distintos tipos de agua de laboratorio de mayor o menor pureza.
De todas formas, se emplee el tipo que se emplee, el agua de laboratorio debería cumplir unos mínimos recomendados en cuanto a sus propiedades y contenidos:
- Conductividad < 10 microsiemens/cm
- pH entre 5 y 8
- Dureza cálcica < 3 mg CaCo3 /l
- Presencia de bacterias < 50 ufc/ml
Un error bastante común a la hora de comprobar el grado de desionización de un agua de laboratorio es fijarse tan sólo en el pH. Esto, si bien es un método rápido y cómodo, no es fiable; pues a pesar de que es cierto que cuanto más pura sea un agua más se acercará su pH a la neutralidad (pH 7) hay que contar con que el agua capta CO2 del ambiente, lo que hace que su pH varíe mientras que se mantiene inmutable su carga iónica. Por ello hemos de medir la conductividad del agua para averiguar realmente su grado de desionización. Esto es, cuanto menor sea el valor obtenido para este parámetro menor será la capacidad del agua para conducir la electricidad, y por consiguiente menor la cantidad de iones en disolución; puesto que el agua pura no conduce la electricidad. Para hacernos una idea podemos comentar que la conductividad de un agua mineral común se encontraría en torno a los 300 µsiemens/cm.
Otro valor importante a considerar es el de la dureza cálcica, pues la presencia de Ca en el medio induce reacciones de capacitación en los espermatozoides; con lo que se acorta considerablemente el tiempo de vida útil de las dosis seminales, ya que los espermatozoides mueren poco tiempo después de capacitados.
Respecto a la carga bacteriana, obviamente esta ha de ser la menor posible para evitar posteriores problemas de contaminación en las dosis seminales.
En cuanto al origen del agua del laboratorio tenemos dos posibilidades, emplear agua destilada comercial envasada o producir nuestra propia agua de laboratorio.
En caso de optar por comprar el agua lo recomendable, ya que su calidad viene garantizada por el fabricante, sería adquirirla en envases pequeños, de no más de 5 litros, pues además de facilitar su manejo, esto nos asegura que se gasta cuanto antes evitando su contaminación una vez abierto el envase.
Si, por el contrario, decidimos producir nuestra propia agua a partir de agua corriente hemos de asegurarnos la máxima calidad posible del agua de partida (difícilmente conseguiremos agua de laboratorio de calidad si partimos de aguas fecales o excesivamente duras, por ejemplo). Lo ideal es utilizar agua potable de red tratada con cloro, lo que nos asegura una baja carga microbiana, a la que aplicaremos un adecuado proceso de purificación que elimine dicho cloro, pues es tóxico para el semen, y la mayor cantidad posible del resto de solutos. Fundamental en este punto es el mantenimiento en adecuadas condiciones de los equipos de ósmosis inversa, filtros, resinas, depósitos y cualesquiera elementos que intervengan en su producción para asegurar una óptima calidad del agua obtenida.
Es recomendable para verificar dicha calidad del agua resultante el realizar análisis periódicos de esta, tanto fisico-químicos como microbiológicos.
Temperatura
En el apartado concerniente a la temperatura hemos de señalar que hay dos momentos claramente diferenciados a los que corresponden respectivamente otros dos rangos de temperatura también distintos:
1- Recogida/procesado y envasado → 35-37ºC.
2- Conservación de las dosis seminales → 15-17ºC.
1- Todo el material que entre en contacto con el semen debe estar atemperado previamente a 35-37ºC para evitar problemas de aglutinación y disminución de la calidad seminal, por ejemplo durante la recogida, o errores de apreciación como pueden ser bajas motilidades aparentes por estar los portaobjetos demasiado fríos o calientes a la hora de la valoración, etc. Para ello es importante que todos los aparatos y sistemas se hallen en correcto estado de funcionamiento y calibración.
2- Por encima de 21ºC pueden producirse alteraciones de la membrana citoplasmática de los espermatozoides.
Por debajo de 14ºC aumenta mucho el riesgo de shock por frío de las células espermáticas. Hay que señalar que los espermatozoides porcinos son particularmente sensibles al frío en comparación con los de otras especies animales debido a la especial composición de su membrana en lo que a la proporción de fosfolípidos, ácidos grasos saturados e insaturados, y colesterol se refiere. Esta es una de las razones que explican la dificultad que se encuentra a la hora de llevar a cabo la criopreservación de espermatozoides de cerdo y las menores fertilidad y prolificidad obtenidas al inseminar con semen descongelado respecto al semen refrigerado.
Es así mismo muy importante verificar que la temperatura permanece constante durante la conservación, pues tan perjudiciales son las altas o bajas temperaturas como las fluctuaciones bruscas de esta para los espermatozoides. Los cambios operados en la fluidez de la membrana de forma reiterada dan como consecuencia un “desgaste” de la misma con la consiguiente disminución del periodo de vida útil de las dosis seminales. Para monitorizar dicha temperatura tenemos a nuestra disposición un amplio abanico de posibilidades como son la utilización de termómetros de máximas y mínimas; o, si se quiere mayor precisión, se pueden emplear elementos electrónicos de medición y registro (“datalogger”) o incluso el uso de cámaras de conservación con alarma incorporada que avisan cuando la temperatura interior supera determinado rango prefijado, bien sea por exceso o por defecto.

El elaborar y mantener las dosis seminales con la menor carga bacteriana posible es otro de los aspectos fundamentales para producir y distribuir un semen de calidad.
Lo primero es proteger nuestro centro de inseminación de la entrada de potenciales patógenos; para lo cual hemos de observar una serie de medidas de bioseguridad. De todas formas, y dado que el objetivo de este artículo se centra en el trabajo dentro del propio centro, no profundizaremos demasiado en este campo, limitándonos a citar las normas básicas de bioseguridad que deberían seguirse en cualquier centro de inseminación para evitar la entrada de agentes infecciosos que pudieran tanto afectar a la salud de los verracos como ser transmitidos vía semen:
● Centro alejado de otras explotaciones u otros posibles focos de contagio
(carreteras, mataderos, etc).
● Vallado de todo el perímetro (impedir el acceso de personas o animales salvajes
y/o domésticos).
● Vados y arcos de desinfección.
● Restricción y registro de visitas.
● Cuarentena obligatoria y alejada del centro para todos los nuevos animales.
Pero centrándonos en el propio centro de inseminación y la actividad diaria que en el se desarrolla podemos determinar que los principales puntos de riesgo que pueden actuar como focos de origen de contaminación bacteriana son:
■ Fecal.
■ Pelo, piel, prepucio del verraco.
■ Humanos, portadores de determinada flora cutánea.
■ Agua de boca; esta ha de estar tratada con cloro.
■ Agua destilada.
■ Vegetales (cama y/o comida).
■ Aire, sistemas de ventilación.
■ Patologías del verraco; orquitis, cistitis, uretritis, etc.
■ Materiales y maquinaria del laboratorio.
Así pues, una vez conocidos los posibles focos de contaminación, vamos a pasar a enumerar una serie de estrategias las cuales, incidiendo sobre dichos puntos, nos pueden ayudar a eliminar o reducir al máximo la presencia de bacterias en las dosis seminales:
● Utilizar material desechable.
● Cortar el pelo del prepucio frecuentemente.
● Emplear la técnica del doble guante para llevar a cabo la extracción.
● Vaciar el divertículo prepucial antes de la extracción y limpiar la zona alrededor.
● NO RECOGER la fracción pre-espermática pues contiene gran cantidad de bacterias procedentes del tracto uretral.
● Durante la extracción mantener el pene del verraco horizontal y paralelo al suelo para evitar que por el escurran impurezas al vaso de recogida.
● Realizar la extracción de machos problemáticos al final para evitar contaminaciones cruzadas.
● Limpiar la sala de recogida tras cada jornada y la cuadra del verraco al menos una vez a la semana utilizando un producto desinfectante.
● Lavar el material reutilizable del laboratorio con un detergente neutro que no deje residuos, después aclararlo con agua destilada, y en caso de que el material lo permita, esterilizarlo por calor en la estufa (120ºC durante 2h. por ejemplo).
● Lavar el laboratorio diariamente (suelo y superficies) con detergentes que no dejen residuos.
● Hacer circular cada día solución jabonosa por los circuitos y gomas de máquinas y bombas peristálticas, aclarar con agua destilada y volver a hacer circular alcohol de 70º, aclarando con agua destilada antes de su nuevo uso.

Técnica del doble guante, con el de fuera se realiza la limpieza y con el de dentro la extracción; es importante mantener el pene del verraco paralelo al suelo.

Son fundamentales la limpieza del laboratorio y las máquinas como las líneas de envasado.
Especial relevancia, hasta el punto de convertirse en un punto rítico en si mismas, tienen las gomas y conductos de las máquinas como las líneas de envasado, bombas peristálticas en general y cualquier circuito por el que pase el semen o el diluyente. Esto obedece a que su luz interior constituye un lugar ideal para que las bacterias se acantonen, ya que se dan las condiciones idóneas de humedad y temperatura si estos sistemas no son correctamente desinfectados.
Se hace por tanto necesario resaltar la importancia que reviste la concienzuda limpieza y desinfección diaria de todo el material que entra en contacto con el semen y el diluyente, pues estos, dada su composición rica en nutrientes, se ofrecen como medios de cultivo idóneos para el desarrollo de microorganismos a pesar de la inclusión de antibióticos; a los cuales, por otra parte, cada vez es mayor el número de bacterias que presentan resistencias. No en vano, algunas de estas especies bacterianas aisladas e identificadas en cultivos de dosis seminales (es el caso por ejemplo de Serratia marcescens) son las mismas responsables de no pocos procesos nosocomiales en las unidades de cuidados intensivos de los hospitales; haciendo harto complicada la tarea de los médicos a la hora de hacerles frente dada su enorme capacidad para desarrollar resistencias, incluso a antibióticos de la más reciente aparición.
Conviene reseñar, por otra parte, que la inclusión de combinaciones antibióticas en la formulación de los diluyentes tiene como objetivo el inhibir la proliferación bacteriana para conservar el mayor tiempo posible la vida útil de las dosis seminales; no el eliminar su presencia de las mismas. Cuanto más potente y de mayor espectro sea esta combinación antibiótica, mejor desarrollará su función, pero ante la presencia de presiones de infección altas o aparición de cepas resistentes no queda más alternativa que potenciar las medidas de higiene y desinfección.
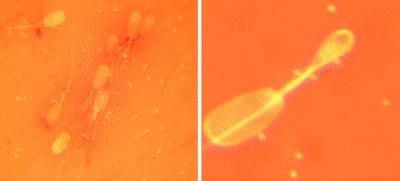
Gran presencia de bacilos en una dosis seminal Contaminación por cocos 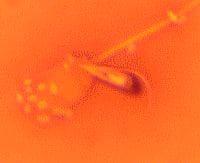
Espermatozoide muerto con bacterias adheridas a su cabeza.
Bibliografía
-W. L. Flowers. Water Quality considerations for A.I. Dept of animal Science, North Carolina State University, Raleigh, NC.
-J. Gadea. Los diluyentes de inseminación artificial porcina. REVISIÓN. www.um.es/grupo-fisiovet
-K.E. Waterhouse, P. M. De Angelis, T. Haugan, H. Paulenz, P. O. Hofmo, W. Farstad. Effects of in vitro storage time and semen-extender on membrane quality of boar sperm assesed by flow cytometry. Teriogenology (2004) Dec;62(9):1638-51.
-Real Decreto 324/2000, de 3 de marzo, por el que establecen normas básicas de ordenación de explotaciones porcinas.
-J. Gadea. El uso de semen porcino congelado. Mundo Ganadero. 169: 60-62 (2004).
-T. Cremades, J. Roca, H. Rodríguez Martínez, T. Abaigar, J. M. Vázquez, E. A. Martínez. Kinematic changes during the cryopreservation of boar spermatozoa.
J Androl (2005) Sept-Oct; 26(5):610-8.
-G. C. Althouse, C. E. Kuster, S. G. Clark, R. M. Weisiger. Field investigations of bacterial contaminants and their effects on extended porcine semen. Theriogenology (2000) 1167-76.
-G. C. Althouse, K. G. Lu. Bacteriospermia in extended porcine semen. Treiogenology (2005) 573-584.
-Directiva 90/429/CEE del consejo, de 26 de junio de 1990, por la que se fijan las normas de policía sanitaria aplicables a los intercambios intracomunitarios y a las importaciones de esperma de animales de la especie porcina.
-G. Almond, P. Poolperm. Semen contamination and choosing antibiotics. Prooceedings of the North Carolina Healthy Hogs Seminar.
-Hume E BH, Willcox M, Aparición de Serratia marcescens como un patógeno de superficie ocular. Archivos Sociedad Española de Oftalmología, oct. 2004, vol.79, no.10, p.475-481. ISSN 0365-6691.
-Famiglietti A., Quinteros M., Vázquez M. et al. Consenso sobre las pruebas de sensibilidad a los antimicrobianos en Enterobacteriaceae. Revista Argentina de Microbiología, ene/mar 2005, vol.37, no.1,p.57-66. ISSN 0325-7541.














