Efecto Antioxidante De Lycospersicum Esculentum en Ensayos con Semen Porcino
Publicado: 25 de enero de 2012
Por: Prenna Gisella (Becaria de Estudio de la CIC); Gavazza, M; Marmunti, M; Piergiacomi, V; Palacios, A. (Cátedra de Bioquímica, Facultad de Ciencias Veterinarias) Sara Williams (Cátedra de Reproducción Animal, Facultad de Ciencias Veterinarias); Gutiérrez, A.M (Cátedra de Fisiología Animal, Facultad de Ciencias Naturales y Museo). UNLP,Buenos Aires (Argentina)
INTRODUCCIÓN
El oxígeno es esencial para la vida, pero puede ser tóxico cuando se presentan situaciones desfavorables en las cuales hay una producción exagerada de sus especies reactivas. Las membranas de los espermatozoides son ricas en ácidos grasos polinosaturados y son sensibles al daño oxidativo mediado por el proceso de peroxidación lipídica [1], ésta es causa potencial de infertilidad en machos de numerosas especies. Los niveles en los cuales los espermatozoides pierden movilidad in vitro se correlacionan con la tasa de peroxidación lipídica que sufren. Los antioxidantes son sustancias que cuando se encuentran presentes en bajas concentraciones respecto a los sustratos oxidables, retrasan o anulan la oxidación de dicho sustrato [2]. Existen evidencias de que los carotenoides podrían actuar como antioxidantes para la prevención de muchas enfermedades. El licopeno se halla casi exclusivamente en el tomate y sus productos. El objetivo de este estudio fue analizar la susceptibilidad a la peroxidación lipídica mediante la adición in vitro del antioxidante vegetal Lycospersicum esculentum (tomate) en muestras de semen porcino.
MATERIAL Y MÉTODOS
Se trabajó con muestras de semen porcino durante las diferentes etapas del proceso de criopreservación: 1) a 15ºC, 2) 15ºC + medio Boarciphos A (previo al enfriamiento), 3) a 5ºC + medio Boarciphos A y 4) a 5ºC + medio Boarciphos A + B. Los espermatozoides se obtuvieron por el método descripto por Dandekar y col., 2002 [3]. Se determinaron proteínas por el método de Lowry y col, 1951 [4]. Los lípidos fueron extraídos por el método de Folch y col, 1957 [5]. Los ésteres metílicos de ácidos grasos se analizaron por cromatografía gaseosa.
El antioxidante utilizado se obtuvo de manera sencilla y abundante a partir de tomate, utilizando solventes como hexano y etanol. Se inició la peroxidación lipídica (PL) no enzimática por adición de ascorbato-Fe++ (concentración final 0,4 mM). Se prepararon muestras con 1 mg de proteína en buffer fosfato 0,05 M, pH 7,4 a 37 °C, volumen final 1 ml y se le agregaron 500 μg del antioxidante. Se prepararon muestras testigo, con ascorbato pero sin antioxidante.
La emisión lumínica se cuantificó en un contador de centelleo líquido, determinándose las cuentas por minuto (cpm) cada 10 minutos, en un lapso de 120 minutos totales.
El antioxidante utilizado se obtuvo de manera sencilla y abundante a partir de tomate, utilizando solventes como hexano y etanol. Se inició la peroxidación lipídica (PL) no enzimática por adición de ascorbato-Fe++ (concentración final 0,4 mM). Se prepararon muestras con 1 mg de proteína en buffer fosfato 0,05 M, pH 7,4 a 37 °C, volumen final 1 ml y se le agregaron 500 μg del antioxidante. Se prepararon muestras testigo, con ascorbato pero sin antioxidante.
La emisión lumínica se cuantificó en un contador de centelleo líquido, determinándose las cuentas por minuto (cpm) cada 10 minutos, en un lapso de 120 minutos totales.
RESULTADOS
Los valores de emisión lumínica de las diferentes etapas del proceso de criopreservación (Fig.1) fueron estadísticamente significativos valores de la emisión lumínica de las muestras con ascorbato, se observó que en presencia del antioxidante los valores fueron más bajos. Durante el proceso de LP, se observó que el porcentaje de ácidos grasos (AG) no saturados de las muestras tratadas con ascorbato (31,3%) disminuyó significativamente con respecto a los controles (53,73%). El porcentaje de AG no saturados de las muestras con el antioxidante fue de aproximadamente 62,03% siendo este valor similar al de las muestras controles.
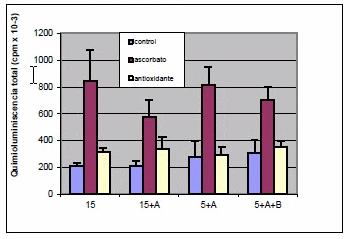
DISCUSIÓN
Los antioxidantes previenen la lipoperoxidación utilizando diferentes mecanismos. El licopeno posee una elevada capacidad in vitro para ligarse al oxígeno singulete. Nuestros resultados indican que la PL podría ser uno de los mecanismos bioquímicos responsables de los cambios fisiológicos durante la criopreservación. El licopeno ejerció un efecto protector ya que los principales AG no saturados no fueron afectados por el proceso de lipoperoxidación.
BIBLIOGRAFÍA
1- Sheweita SA y col Mechanism of male infertility: role of antioxidants. Curr Drug Metab. 2005 6: 495- 501.
2- Faudale M y col Antioxidant activity and phenolic composition of wild, edible, and medicinal fennel from different Mediterranean countries. J Agric Food Chem 2008 26;56 (6):1912-20.
3- Dandekar SP y col Lipid peroxidation and antioxidant enzymes in male infertility. J Postgrad Med. 2002 48: 186-189.
4- Lowry OH y col Protein measurement with Folin phenol reagent. J Biol Chem. 1951 193:265-275.
5- Folch J y col A simple methods for the isolation and purification of total lipids from animal tissues. J Biol Chem 1957.226: 497-509.
2- Faudale M y col Antioxidant activity and phenolic composition of wild, edible, and medicinal fennel from different Mediterranean countries. J Agric Food Chem 2008 26;56 (6):1912-20.
3- Dandekar SP y col Lipid peroxidation and antioxidant enzymes in male infertility. J Postgrad Med. 2002 48: 186-189.
4- Lowry OH y col Protein measurement with Folin phenol reagent. J Biol Chem. 1951 193:265-275.
5- Folch J y col A simple methods for the isolation and purification of total lipids from animal tissues. J Biol Chem 1957.226: 497-509.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación





