Las producciones intensivas de rumiantes en Uruguay se apoyan en el uso de pasturas de alta calidad. En lechería, éstas representan más del 50% de la dieta. Además de la ventaja económica, el uso de pasturas como alimento tiene otros beneficios. Entre ellos puede mencionarse su contribución con el medio ambiente, el bienestar animal y algunos aspectos distintivos que hacen a la calidad del producto final y a sus propiedades nutracéuticas (Chaudry, 2008).
Este material tiene como objetivo discutir aspectos relacionados a la interacción de la pastura de buena calidad con otro tipo de alimentos. La discusión, basada en experimentos realizados en nuestro país, plantea algunos puntos críticos que hacen a la sincronización de nutrientes necesaria para una correcta utilización de la dieta en su conjunto.
La Microbiota ruminal
La población microbiana ruminal, intrínsecamente asociada al animal es el centro de la discusión a nivel mundial en lo que se refiere a nutrición animal en los últimos cinco años (Karnati et al., 2003; Ungerfeld et al., 2007; Firkins et al., 2007; Gozho y Mutsvangwa, 2008; Días et al., 2008; Lodge-Ivey et al., 2009) La microbiota ruminal, tal cual se la designa en la actualidad, proporciona al rumiante la oportunidad de digerir la fibra de los alimentos y es además la principal fuente de
proteína de alta calidad. Está representada por bacterias (10
7 - 10
9 UFC/ml) con más de 50 géneros, arqueas (10
7 -10
9 UFC/ml) con 7 especies diagnosticadas, protozoos (10
4 - 10
6/ml) con 25 géneros, hongos (10
3 -10
5 zoosporas/ml) con 5 géneros y bacteriófagos (10
8 -10
9 /ml). Como se aprecia una de las características de la población microbiana es la diversidad (Kamra 2005).
Como se aprecia una de las características de la población microbiana es la diversidad (Kamra 2005). En el rumiante esta población microbiana encuentra las condiciones para desarrollarse y crecer: un medio líquido y ambiente anaerobio, con temperatura y presión osmótica controladas, aporte de alimentos (sustratos) en forma semi-continua y eliminación de deshechos (CO2, CH4, AGV, N-NH3) (Russell y Hespell, 1981; Van Soest, 1994, Weimer, 1998). Además, el propio recambio microbiano posibilita la reproducción de los mismos.
Esta relación, en principio ideal, conlleva sus ineficiencias. Se dan pérdidas energéticas (principalmente por producción de metano) y de materias nitrogenadas (por una utilización incompleta del N-NH3 generado en el rumen) (Fonty et al., 1995). La optimización en el crecimiento de la masa microbiana es uno de los factores que deben preocupar al nutricionista. No sólo por lo que la masa microbiana significa como alimento y procesador de fibras, sino también porque, su correcto manejo, posibilita diminuir las ineficiencias mencionadas, al captar, por ejemplo, una mayor proporción del N-NH3 generado. Esto tiene además repercusiones positivas sobre el ambiente, al reducir los desechos contaminantes (Tamminga 1996). El término optimización de la masa microbiana formada en el rumen implica dos conceptos:
Producción Microbiana: indica la generación de microorganismos en términos de cantidad diarias. Se refiere a los g o kg de masa microbiana (o de N microbiano) formado en el rumen por día. Es variable con el tipo de animal, tamaño del rumen, cantidad de alimento consumida, etc. ?
Eficiencia de producción de proteína microbiana. Esta se refiere a la cantidad de microorganismos generados por unidad de alimento. Se expresa de diferentes formas: masa microbiana (o N microbiano) en función de la MS ingerida, de la MO ingerida, o, lo más habitual, de la MO digerida o fermentada en el rumen (MODR o MOF, respectivamente). Ambos conceptos son importantes, pero si se trata de evaluar la efectividad de un
alimento o una dieta para proveer proteína microbiana, consideramos indicado trabajar en base a la eficiencia de producción de proteína microbiana.
Para lograr la máxima eficiencia, el aporte de nutrientes para los microorganismos, especialmente carbohidratos y materias nitrogenadas, debe ser el necesario (Russell et al., 1992; Clark et al, 1992). Además dichos nutrientes deben estar disponibles en forma sincrónica, aunque algunos autores ponen en duda este concepto (Valkeners et al., 2006; Hall and Huntington, 2008).
Es necesario puntualizar, que no todos los compuestos que son nutrientes para el rumiante, lo son para los microorganismos. La MO utilizable por estos últimos, es la que tiene capacidad de ser fermentada en el rumen (fermentescible). Las paredes celulares, el almidón y la proteína degradable en rumen, junto con los azúcares, son fuente de energía fermentescible formando la MOF (materia orgánica fermentescible en rumen). Otros compuestos muy energéticos como los lípidos, ácidos orgánicos o el almidón no degradable en rumen, así como la proteína no degradable, no forman parte de la MOF por su baja fermentación ruminal. Por ende poco aportan para el crecimiento microbiano. La fuente de nitrógeno proviene de la proteína y el nitrógeno no proteico de los alimentos que son degradados en el rumen, además de la urea re-circulante que ingresa por vía sanguínea o por la saliva. No aportan al crecimiento microbiano la proteína de pasaje y la proteína unida a taninos o lignina (Van Soest, 1994).
¿En qué consiste al Sincronización?
El concepto de sincronización de nutrientes se refiere al hecho de proporcionar al sistema ruminal las fuentes de proteína y energía en forma simultánea y en las cantidades requeridas a fin de optimizar su utilización por la microbiota asociada (Hall y Huntington, 2008). Teóricamente de esta forma se lograría el máximo crecimiento microbiano y el mayor aporte de nutrientes para el animal. El principal aporte en cantidad y calidad de nutrientes proviene de la dieta pero existen también factores intra y extrarruminales que son determinantes. La urea re-circulante y los aminoácidos sintetizados por el animal provenientes de la movilización de tejidos, son por ejemplo, fuentes no dietarias de nitrógeno para el rumen (Vérité y Peyraud, 1990) La fuente de carbohidratos y la cinética de su disponibilidad son factores determinantes en el logro de la sincronización de nutrientes (Lee et al., 2003). Henning et al, (1991), trabajando con cultivos microbianos, observó que la rápida disponibilidad de energía, y no la sincronización en el aporte de nutrientes, fue la determinante para el crecimiento de la masa microbiana.
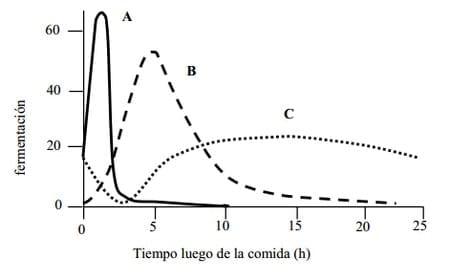
La disponibilidad de energía a nivel de rumen puede ser muy distinta según la fuente de carbohidrato de que se trate, debido a las diferentes velocidades de fermentación. La velocidad es muy rápida para los solubles como los azúcares y muy lenta para los estructurales como la celulosa (ver figura 1) Es importante puntualizar que en el caso de la energía no existe, a nivel de rumen, una fuente endógena que compense desbalances temporales como en el caso del N. Por ello,
capitalizar la disponibilidad ruminal de carbohidratos sería el objetivo de la sincronización (Hall y Huntington, 2008). Sin embargo, hasta el momento, los modelos de predicción de respuestas que se utilizan para la formulación de dietas (como el NRC del año 2001) son relativamente insensibles a cambios en las cinéticas de degradación de los carbohidratos (Hall, 2004).
Figura 1. Cinéticas de fermentación de distintos tipos de carbohidratos. A: carbohidratos de rápida fermentación, B: carbohidratos de moderada velocidad de fermentación, C: carbohidratos de lenta fermentación. (Adaptado de Hall y Huntington,
2008)
De todas formas, más allá de las cinéticas de degradación de las fuentes de carbohidratos, existen otros factores que influyen en el animal, y por lo tanto en los fermentación. Factores como el pH ruminal, la cantidad de concentrado, el
tipo específico de compuesto suministrado, por ejemplo, modifican la cinética de degradación del almidón y de los carbohidratos no amiláceos (Huntington, 1997)
Estos aspectos, como se verá, hacen que muchas veces los resultados no sean los previstos cuando se formula una dieta.
Características de los alimentos con los que pretendemos lograr la “sincronización” de nutrientes
Las pasturas
Las especies forrajeras que se utilizan en nuestro país en los sistemas intensivos, representadas principalmente por gramíneas C3, leguminosas y sus mezclas, poseen algunas características particulares que es conveniente describir.
De acuerdo con un relevamiento realizado en nuestro país, que incluyó forrajes provenientes de más de 40 parcelas de establecimientos productivos, las pasturas presentaron una composición característica de un alto valor nutritivo (Cajarville et al., 2007). Cortadas en el momento que en los predios se consideraba óptimo para su consumo, la composición fue la siguiente (base seca): 18% de MS, 19 % de PB, 40 % de FND y entre un 6 y un 10 % de azúcares dependiendo fundamentalmente de la época del año y del momento del día.
La proteína de estos forrajes, se caracteriza por ser altamente soluble y de muy rápida degradación (Sauvant et al., 1995; Cohen, 2001; Repetto et al., 2005), dando como resultado altas concentraciones instantáneas de N-NH3 en el rumen (Nápoli y Santini, 1988; Khalili y Sairanen, 2000; Cajarville et al., 2006a y b). Por otra parte, la degradabilidad de las fracciones fibrosas de este tipo de pasturas, según diferentes trabajos realizados en nuestro país, se ubica en torno al 50-60% (Cajarville et al., 2003; Aguirre et al., 2005; Cajarville et al., 2006a), valores que pueden catalogarse como altos, considerando que se trata de las porciones menos degradables de los forrajes.
Como resultado de las características químicas de estos forrajes, la fermentescibilidad de los mismos cuando se la mide a través de la producción de gas in vitro es elevada (Berthiaume et al, 2006; Britos et al., 2006; Caramelli et al., 2008; Britos et al., 2009). La alta fermentescibilidad lleva a que la concentración media de AGV en el rumen sea también alta. En experimentos realizados por nuestro equipo con animales consumiendo exclusivamente praderas, la concentración media de AGV fue de 95 Mmol/ml de líquido, con picos máximos de 130 Mmol/ml luego de 4 horas del comienzo de la ingesta (Cajarville et al., 2006b). Estas concentraciones son superiores a las comunicadas por la bibliografía para dietas forrajeras, además de tener una elevada proporción de propiónico. En general, dietas basadas en forrajes, ricas en celulosa pobres en almidón y con contenidos intermedios de azúcares, resultan además en una elevada proporción de acetato dentro de los AGV (Church, 1993, Van Soest, 1994).
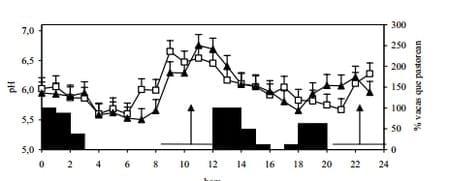
Las características de alta fermentescibilidad y por lo tanto, de alta producción de AGV, promueven, cuando la pastura no es limitante en cuanto a cantidad, ambientes ruminales que se caracterizan por valores de pH relativamente bajos (figura 2), fundamentalmente en los horarios posteriores a pastoreos intensos (Cajarville et al., 2006 a y b, Cazulli et al., 2007).
Figura 2. Evolución del pH ruminal a lo largo del día en vacas en pastoreo suplementadas con trigo (cuadrados abiertos) o maíz (triángulos negros) (medias ± DS; n = 4). Las áreas en negro representan la proporción de vacas pastoreando luego del período de confinamiento. Las flechas indican el momento de la suplementación; las líneas bajo las flechas indican los períodos de confinamiento (Extraído de Cajarville et al., 2006a)
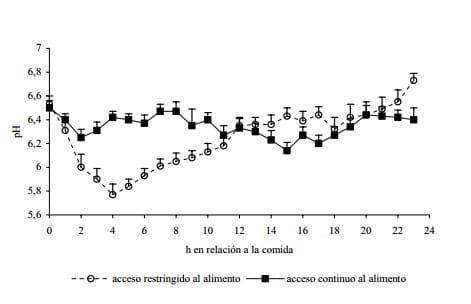
En ocasiones, estos pH llegan a valores considerados dentro de los propios de acidosis subclínica (SARA) (Brossard et al., 2003; Krauze y Oetzel, 2006). En un análisis de datos provenientes de varios experimentos (figura 3) en los cuales se trabajó con animales consumiendo dietas con predominio de pasturas templadas suministradas frescas (pastoreo o jaula), se observó que el tiempo de acceso al alimento tenía una importante influencia tanto en los valores como en la dinámica de pH ruminal. Así, los animales con acceso restringido al alimento, presentaron valores de pH más altos y más estables a lo largo del día, independientemente si habían recibido o no suplementación con concentrados (Cajarville et al., 2006 c)
Figura 3. Dinámica de pH ruminal de animales con acceso restringido a alimento (n = 32) y acceso continuo al alimento (n = 26) (medias ± ES). Datos extraídos de Cajarville et al. (2006c) correspondientes a 1392 mediciones de pH realizadas en un total de 58 animales, distribuidos en 13 tratamientos experimentales con dietas a base de pasturas templadas suministradas frescas.
Sin embargo, en un experimento posterior del mismo equipo, en el que se midió el pH ruminal de animales alimentados exclusivamente con lotus, no pudieron detectarse diferencias en el pH cuando los animales tuvieron acceso continuo al forraje o acceso restringido en horas (6 horas diarias) al mismo (Pérez-Ruchel et al., 2008). Esta contradicción en resultados obtenidos a partir de experimentos realizados por el mismo equipo, podría deberse a las características de los forrajes consumidos (capacidad tampón, compuestos fenólicos, etc.), tema en el cual debe profundizarse.
Por otra parte, la alta fermentescibilidad, sumada a los altos contenidos en proteínas solubles y muy degradables, son factores que promueven el crecimiento y desarrollo activo de la microbiota como ya fue señalado. Trabajos recientes, realizados en nuestro país y en el extranjero, indican, como veremos más adelante, que tanto la cantidad como la eficiencia de producción de proteína microbiana que se sintetiza a partir de estos forrajes son altas.
Los Suplementos
La disponibilidad de los nutrientes provenientes de los granos de cereales para los microorganismos ruminales difiere según el tipo de grano y el procesamiento del mismo. En 1997, Huntington comunica valores muy variables, oscilando entre 50 y 94 % de degradación en el rumen. La degradación ruminal condiciona el grado de utilización de los granos por el rumiante, especialmente por la microbiota ruminal (Huntington, 1997; Owens y Zinn, 2005). La magnitud y la tasa de digestión ruminal del almidón es mayor para granos como el trigo y la cebada y menor para el maíz y el sorgo. Para cada grano a su vez dependerá básicamente del genotipo en cuestión (Martin et al., 1999).
Otro aspecto determinante del comportamiento a nivel ruminal es el procesamiento de los granos (Hill et al., 1991; Huntington, 1997; Owens y Zinn, 2005). En general el efecto del procesamiento está en relación con la alteración que provoca en el grano. De esta forma, tratamientos como el quebrado actúan mediante la simple ruptura del pericarpio y exposición del endospermo, el molido disminuye además el tamaño de partícula incrementando la superficie de ataque. Cuando el tratamiento es más intenso se produce una ruptura de la matriz proteica como en el ensilado de grano húmedo. Otros procesos que involucran vapor y calor como el extrusado provocan además la gelatinización del almidón.
A nivel nacional, en trabajos realizados por el equipo de la Facultad de Veterinaria, se observaron diferencias muy importantes a partir del mismo cereal y genotipo. La degradabilidad in situ de granos de sorgo cosechados temprano y conservados como grano húmedo (GH, 25% de humedad) fue 50% superior a la de granos provenientes de la misma chacra, cosechados en forma tardía (14 % de humedad) (Curbelo et al., 2007a). La degradabilidad de los GH fue tan alta, que no pudo ser incrementada por el uso de aditivos (Curbelo et al., 2007b). Al estudiar la digestibilidad intestinal de los residuos no digeridos en rumen de sorgos se observó (datos sin publicar) que los genotipos con bajos tenores de taninos, presentaban digestibilidades aceptables (valores cercanos al 80%), pero los genotipos altos en taninos mostraron una digestibilidad muy baja (cercana al 50%), independiente en este caso del momento de cosecha (GH o seco). Estos resultados indican que en el caso de los genotipos de sorgo altos en taninos, de difícil digestión, es imprescindible apuntar a realizar tratamientos que mejoren su aprovechamiento a nivel de rumen.
Mc.Allister et al. (1993) estudiaron la importancia de la matriz proteica en la digestión ruminal de granos de maíz y de cebada. Estos autores concluyeron que la estructura del endospermo y el grado de organización de la matriz proteica influyen más en la degradación del almidón, que propiedades intrínsecas del mismo como la relación amilosa/amilopectina o la cristalinidad.
Existen, además de los granos de cereales, alimentos ricos en energía alternativos, generalmente provenientes de agroindustrias. Ejemplo de ellos son alimentos que hoy se utilizan ampliamente en el país como la pulpa de citrus, los derivados del maíz y la cascarilla de soja. Estos brindan energía principalmente a partir de carbohidratos estructurales, lo que a priori supone un riesgo menor de acidosis (Ipharraguerre y Clark, 2003; Henrique et al., 2004).
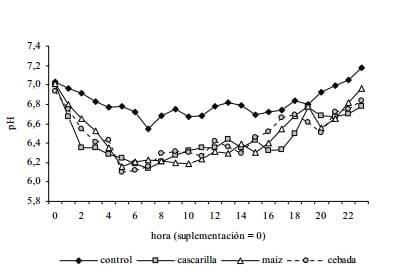
Sin embargo, en un trabajo del equipo de la Facultad de Veterinaria, Britos et al (2009), suplementando vaquillonas que consumían silo de pradera de muy buena calidad como único alimento o suplementadas con distintas fuentes de carbohidratos (cascarilla de soja, grano de maíz o grano de cebada) observaron que el pH ruminal medio fue menor en los animales suplementados, pero no detectaron diferencias entre suplementos (figura 4). En el mismo trabajo, se midió la dinámica de producción de gas in vitro de los inóculos provenientes de los animales sometidos a los distintos tratamientos. En este caso, el volumen de gas producido por el líquido de los animales suplementados y no suplementados no fue diferente. Este interesante resultado, indicaría similares potencialidades fermentativas para la microbiota de animales suplementados y no suplementados.
Figura 4. Dinámica de pH ruminal de vaquillonas (n = 24) consumiendo silo de pradera ad libitum, o suplementadas con concentrados energéticos de distinta velocidad de fermentación. Datos extraídos de Britos et al., 2009
Algunos resultados de la experimentación sobre suplementación que pueden generar nuevas hipótesis.
Como se fundamentó previamente, el objetivo de la alimentación debería ser el aumento de la producción de proteína microbiana en el rumen. El uso de alimentos que se agregan a las pasturas de buena calidad como suplementos debería destinarse al aumento de esta producción y, sobre todo, al logro de una mayor eficiencia de síntesis.
La pregunta que debemos hacernos entonces es: ¿podemos mejorar lo que aportan las pasturas de buena calidad? ¿cuáles son los aspectos posibles de ser mejorados? Si bien los datos no son aún concluyentes, existen algunos antecedentes que nos permiten hipotetizar sobre estas preguntas.
En un concepto tradicional, la captura del exceso de amonio ruminal, proveniente de forrajes con cantidades importantes de N de rápida degradación, podría ser mejorada utilizando como complemento carbohidratos de rápida degradación. Ello llevaría a mejorar la eficiencia de síntesis de proteína microbiana. Algunos datos recientes provenientes del hemisferio norte, ponen al menos en duda este axioma. En EEUU, Broderick et al. (2008) realizaron un experimento con vacas lecheras alimentadas a base de silo de alfalfa y maíz planta entera, en el que reemplazaron almidón proveniente de grano de maíz por azúcar (sacarosa). Los autores observaron que el incremento de sacarosa resultó en incrementos lineales de consumo y de la producción de grasa, así como en disminuciones de las concentraciones ruminales de N-NH3 y de la eliminación de compuestos nitrogenados en la orina. Sin embargo, esto no se acompañó de incrementos en la producción de proteína microbiana ni de su eficiencia, ni tampoco en la producción de proteína en leche. Por su parte, Gozho y Mutsvangwa, 2008, trabajando con dietas a base de fardo de alfalfa y silo de cebada, alimentaron vacas con dietas conteniendo un 50% de concentrado que incluía 4 fuentes de grano distintas (cebada, maíz, trigo o avena). Estos autores, observaron que con las dietas conteniendo maíz y cebada se lograron aumentos de la producción de leche, pero que éstos eran ocasionados por aumentos en el consumo más que por mayor eficiencia. Es importante destacar, que, a diferencia de lo que ocurre en nuestras condiciones, en estos experimentos la base de estas dietas eran forrajes conservados, con una alta proporción de alimentos concentrados y con sistemas de alimentación totalmente mezclados.
Sin embargo, en el año 2000, en Argentina, García et al. (2000), habían realizado un experimento en el que compararon la producción de proteína microbiana de vaquillonas consumiendo avena, sin suplementar o suplementada con maíz o cebada. Observaron eficiencias de 22-28 g Nmo/kg de MO aparentemente digerida en rumen. No encontraron diferencias entre tratamientos, por lo que los autores sugierieron que el forraje proveía suficiente energía para la fermentación microbiana.
En Uruguay, Tebot (2008), trabajando con ovinos en condiciones de ingestión alta pero restringida, comparó el ambiente ruminal y la producción de proteína microbiana de los animales consumiendo sólo forraje, o parcialmente sustituido por concentrados energéticos de diferente velocidad de degradación (cebada o melaza). Si bien se observaron cambios en algunos parámetros del ambiente ruminal, el uso de concentrados energéticos no aumentó la producción de proteína microbiana ni su eficacia de síntesis.
En el mismo sentido y en forma casi simultánea, Azevedo (2008), trabajando en Río Grande do Sul (Brasil) con ovinos consumiendo raigrás ad libitum, suplementados o no con concentrados, observó aumentos de consumo en los animales que recibían suplementos, que se tradujeron en mayores síntesis de proteína microbiana. Sin embargo, la eficiencia de síntesis fue similar en los animales suplementados y en los que consumían forraje solo.
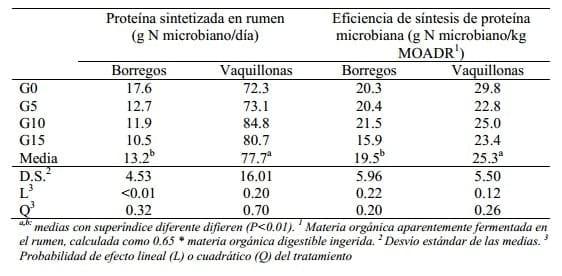
En un trabajo reciente realizado en el Campo Experimental de Libertad (Facultad de Veterinaria, Uruguay), Aguerre et al. (2009) estudiaron el efecto de la incorporación de niveles crecientes de grano de sorgo a vaquillonas y borregos que consumían una dieta a base de lotus. Los autores observaron que la síntesis de proteína microbiana disminuyó linealmente con el aumento de la suplementación en los borregos, mientras que no fue afectada en las vaquillonas. La eficiencia de síntesis de proteína microbiana fue mayor para las vaquillonas que para los borregos, pero no estuvo afectada por la suplementación en ninguna de las dos especies (tabla 1).
De este último trabajo, hay dos aspectos que son de interés a remarcar. En primer lugar, las eficiencias de producción de proteína microbiana en terneras alimentadas exclusivamente con forraje fueron altas y similares a las observadas por García et al. (2000) para una categoría similar alimentada también exclusivamente con pastura de buena calidad.
Tabla 1. Síntesis de proteína microbiana ruminal y eficiencia de síntesis microbiana de borregos y vaquillonas alimentadas con pastura fresca (Lotus corniculatus) ad libitum no suplementada (G0) o suplementada con sorgo molido a 5, 10 o 15 g/kg PV (G5, G10 y G15, respectivamente)(Datos de Aguerre et al., 2009).
En segundo lugar, al igual que los trabajos anteriormente mencionados (Broderick et al., 2008, Gozho y Mutsvangwa, 2008 y Azevedo, 2008), en este último trabajo se observaron aumentos de consumo (Aguerre et al., 2008) que no se radujeron, al menos en principio en aumentos en la eficiencia de producción de proteína microbiana.
A la luz de estos resultados cabe preguntarnos:
¿Estamos en el camino correcto intentando mejorar la eficiencia con que producen proteína microbiana animales consumiendo pasturas de buena calidad suplementando las pasturas con granos?
¿No sería más lógico considerar la pastura de buena calidad un alimento “completo” y suplementarla con otro alimento completo para lograr mayores producciones en base a aumentos de consumo?
Si seguimos este camino, deberíamos cambiar el concepto a la hora de formular las dietas en los sistemas productivos. No deberíamos formular una única dieta, suplementando las “carencias” o “excesos” de las pastura, sino que deberíamos comenzar a formular el suplemento con la concepción de “dieta completa”.
Referencias
Aguirre N., Azanza G., Fagalde D. 2005. Efecto de la adición de lactosuero sobre la degradabilidad ruminal de ensilados de pradera. Tesis de grado. Facultad de Veterinaria, UdelaR. 11
Azevedo G. 2008. Valor alimentar de dietas com azevém (Lolium multiflorum, LAM.) e suplementação nitrogenada ou energética. MSc Thesis. Universidade Federal de Santa Maria, Santa María, RS, Basil.
Aguerre M., Cajarville C., Kozloski G.V., Repetto J.L. 2009. Ruminal microbial protein synthesis of wethers and heifers fed fresh temperate pastures supplemented or not with sorghum grain XIth International Symposium on Ruminant Physiology, ClermontFerrand, France, September 6-9 (aceptado)
Aguerre M., Cajarville C., Machado V., Persak G., Bambillasca S., Repetto J.L. 2008 Dry matter intake and digestibility of wethers and heifers fed temperate pastures supplemented or not with sorghum grain. Book of abst for the 10th World Conference on Animal Production: 128
Berthiaume R., Tremblay G., Castonguay Y., Bertrand A., Bélanger G., Lafreniére C., Michaud R. 2006. Length of the daylight period before cutting improves rumen fermentation of alfalfa assessed by in vitro gas production. Journal of Dairy Science. 89 (Suppl. 1): 102.
Britos A., Mendoza A., Claramunt M., Karlen M., Kelly G., Magallanes L., Ramírez S., Zunini A., Repetto J.L., Cajarville C. 2009. Effect of carbohydrate source on rumen fluid pH and in vitro gas production (GP) in heifers fed pasture silage. Joint Annual Meeting of ADSA-CSAS-ASAS. Montreal, Quebec, Canada, July 12-16 (aceptado)
Britos A., Repetto J.L., Errandonea N., Garciarena D., Cajarville C. 2006. Efecto del momento de corte y del proceso de ensilaje sobre la fermentescibilidad de forrajes templados: producción de gas in vitro. XIV Jornadas de Jovens Pesquisadores da AUGM. p. 534.
Broderick G. A., Luchini N. D., Reynal S. M., Varga G. A., Ishler V. A. 2008. Effect on Production of Replacing Dietary Starch with Sucrose in Lactating Dairy Cows. J Dairy Sci. 91: 4801-4810.
Brossard L., Martin C., Michalet-Doreau B. 2003. Ruminal fermentative parameters and blood acido-basic balance changes during the onset and recovery of induced latent acidosis in sheep. Animal Research. 52: 513–530
Cajarville C., Aguerre M., Echarri V., Repetto J.L. 2003. Ruminal degradation of cellwall constituents of lucerne as fresh forage and lucerne ensiled with different doses of fresh cheese whey as additive. Proc. of the IX World Conference on Animal Production: 26.
Cajarville C., Aguerre M., Repetto J.L. 2006a. Rumen pH, NH3-N concentration and forage degradation kinetics of cows grazing temperate pastures and supplemented with different sources of grain Animal Research. 55: 511-520 12
Cajarville C., Pérez A., Aguerre M., Britos A., Repetto J.L. 2006b. Effect of the timing of cut on ruminal environment of lambs consuming temperate pastures. Journal of Dairy Science (89), (Suppl. 1): 103
Cajarville C., Britos A., Caramelli A., Antúnez M., Zanoniani R., Boggiano P., Repetto J.L. 2007. El horario de corte y el tipo de metabolismo fotosintético afectan la relación azúcares/nitrógeno de las pasturas. Arch. Latinoam. Prod. Anim. Vol. 15 (Supl. 1): 408-409
Caramelli A., Antúnez M., Britos A., Zanoniani R., Repetto J.L., Boggiano P.,Cajarville C. 2008. Efecto del horario de corte sobre la producción de gas in vitro de pasturas. Proc. XXXVI Jornadas Uruguayas de Buiatría: 265-266 Cazzuli G., Repetto J. L., Pérez A., Britos A., Aguerre M., Garín D., Cajarville C. 2007. Dinámica de pH y N-NH3 en terneras alimentadas con pastura templada en horarios restringidos. Proc. XXXV Jornadas Uruguayas de Buiatría: 338-339
Chaudry A.S. 2008. Forage based animal production systems and sustainability, an invited keynote. R. Bras. Zootec. 37 (Supl. E.): 78-84
Church D.C. 1993. El rumiante: fisiología digestiva y nutrición. Zaragoza, Ed. Acribia, 641p.
Cohen D.C. 2001. Degradability of crude protein from clover herbages used in irrigated dairy production systems in Northern Victoria. Aust. J. Agric. Res. 52: 415-425.
Clark J.H., Klusmeyer T.H., Cameron M.R. 1992. Microbial protein synthesis and flows of nitrogen fractions to the duodenum of dairy cows. J. Dairy Sci. 75: 2304-2323.
Curbelo A., Cajarville, C., Melognio E., Ortiz R., Repetto J.L. 2007a. Cinética de degradación ruminal de granos de sorgo: efectos del genotipo y del ensilado. Archivos Latinoamericanos de Producción Animal, v. 151: 368.
Curbelo A., Cajarville C., Melognio E., Ortiz R., Repetto J.L. 2007b. Cinética de degradación ruminal de granos húmedos de sorgo: efecto de la aplicación de diferentes aditivos. Proc. XXXV Jornadas Uruguayas de Buiatría: 311-312
Dias M., Leão M. I., Detmann E., Valadares Filho S. C., de Vasconcelos A. M., de Souza Shirley, Paulino M. F., Bonomo T. 2008. Técnicas para estimativa da digestibilidade e produção microbiana em bovinos. R. Bras. Zootec., 37: 504-512.
García S.C., Santini F.J., Elizalde J.C. 2000. Sites of Digestion and Bacterial Protein Synthesis in Dairy Heifers Fed Fresh Oats with or Without Corn or Barley Grain.
Journal of Dairy Science. 83: 746-755.
Gozho G.N., Mutsvangwa T. 2008. Influence of carbohydrate source on ruminal fermentation characteristics, performance, and microbial protein synthesis in dairy cows. J. Dairy Sci. 91: 2726-2735
Firkins J.L., Yu Z., Morrison M. 2007. Ruminal nitrogen metabolism: perspectives for integration of microbiology and nutrition for dairy. J. Dairy Sci. 90 E1-16E.
Fonty G., Jouany J.P., Forano E., Gouet Ph. 1995. L’ecosystème microbien du réticulorumen. En: Nutrition des ruminants domestiques. Ed. INRA, Paris.
Hall M.B., Huntington G.B. 2008. Nutrient siynchrony: Sound in theory, elusive in practice. J. Anim. Sci. 86(E. Suppl.): E287-E292
Hall M.B. 2004. Short communication: effect of carbohydrate fermentation rate on estimates of mass fermented and milk response. J. Dairy Sci. 87: 1455-1456.
Henning, P.H., Steyn D.G. y Meissner. 1991. The effect of energy and nitrogen supply patterns on rumen bacterial growth in vitro. Anim. Prod. 53: 165-175
Henrique W., Moraes Sampaio A.A., Leme P.R., Duarte Lanna D.P. Alleoni G.F., Viana Coutinho J.L. 2004. Desempenho e características da carcaça de tourinhos Santa Gertrudes confinados, recebendo dietas com alto concentrado e níveis crescentes de polpa cítrica peletizada. R. Bras. Zootec. 33: 463-470
Hill T.M., Schmidt S.P., Russell R.W., Thomas E.E., Wolfe D.F. 1991. Comparison of urea treatment with established methods of sorghum grain preservation and processing on site and extent of starch digestion by cattle. J. Anim. Sci. 69: 4570-4576.
Huntington G. B. 1997. Starch utilization by ruminants: from basics to the bunk. J. Anim. Sci. 75: 852-867. Ipharraguerre I.R., Clark J.H. 2003. Soyhulls as an alternative feed for lactating dairy cows: a review. J. Dairy Sci. 86: 1052-1073
Khalili H., Sairanen A. 2000. Effect of concentrate type on rumen fermentation and milk production of cows at pasture. Anim. Feed Sci. Technol. 84: 199.
Kamra, D.N. 2005. Rumen microbial ecosystem. Curr. Sc. 89:124-135.
Karnati S. K. R., Yu Z., Sylvester J. T., Dehority B. A., Morrison M., Firkins J. L. 2003.Technical note: Specific PCR amplification of protozoal 18S rDNA sequences from DNA extracted from ruminal samples of cows. J Anim Sci 81: 812-815.
Krause K.M., Oetzel G.R. 2006. Understanding and preventing subacute ruminal acidosis in dairy herds: a review. Anim. Feed Sci. Technol. 126: 215-236.
Lee M.R.F., Merry R.J., Davies D.R., Moorby J.M., Humphreys M.O., Theodorou M.K., MacRae J.C., Scollan N.D. 2003. Effect of increasing availability of watersoluble carbohydrates on in vitro rumen fermentation. Anim. Feed Sci. Technol. 104:
59-70.14
Lodge-Ivey S. L., Browne-Silva J., Horvath M. B. 2009. Technical note: Bacterial diversity and fermentation end products in rumen fluid samples collected via oral lavage or rumen cannula J Anim Sci 2008-1472v1-20081472.
Martin C., Philippeau C., Michalet-Doreau B. 1999. Effect of wheat and corn variety on fiber digestion in beef steers fed high grain diets. J. Anim. Sci. 77: 2269-2278.
McAllister T.A., Phillipe R.C., Rode L.M., Cheng K.J. 1993. Effect of the protein matrix on the digestion of cereal grains by ruminal microorganisms. J. Anim. Sci. 71. 205-212.
Nápoli G.M., Santini F.J. 1988. Suplementación energético-proteica de forrajes frescos en condiciones de pastoreo: I. Efecto sobre el medio ambiente ruminal y la degradabilidad proteica. Rev. Arg. Prod. Anim. Vol. 8, Sup.1: 39
Nocek J.E.1997. Bovine acidosis: implications on laminitis. Journal of Dairy Science. 80: 1005-1028.
Owens F.N. y Zinn R. A. 2005. Corn Grain for Cattle: Influence of Processing on Site and Extent of Digestion. Proc. Southwest Nutr. Conf. 86-112.
Pérez-Ruchel A., Cajarville C., Sanguinetti F., Iturria C., Saavedra W., Repetto J.L. 2008. Feeding schedule had no effect on ruminal pH of wethers fed Lotus corniculatus. Book of abst. for the 10th World Conference on Animal Production: 129
Rémond D., Nozière P., Poncet C. 2002. Effect of time of starch supply to the rumen on the dynamics of urea and ammonia net flux across the wall of sheep. Animal Research. 51:3-13.
Repetto J.L., Cajarville C., D’Alessandro J., Curbelo A., Soto C., Garín D. 2005. Effect of wilting and ensiling on ruminal degradability of temperate grass and legume mixtures. Animal Research. 54: 73-80
Repetto J.L., Britos A., Errandonea N., Cozzolino D., Cajarville C. 2006. Effect of harvest schedule and plant part on in vitro gas production of temperate forages. J. Dairy Sci. Vol. 89 (Suppl. 1):102.
Russell J.B., Hespell R.B. 1981. Microbial rumen fermentation. J. Dairy Sci. 64: 1153.
Russell J. B., O'Connor J. D., Fox D. G., Van Soest P. J., Sniffen C. J.. 1992. A net carbohydrate and protein system for evaluating cattle diets: I. Ruminal fermentation J Anim Sci 1992. 70:3551-3561.
Sauvant D., Grenet E., M-Doreau B. 1995. Dégradation chimique des aliments dans le réticulo-rumen: cinétique et importance. En: Nutrition des ruminants domestiques. Ed. INRA, Paris.
Tamminga S. 1996. A Review on Environmental Impacts of Nutritional Strategies in Ruminants. J. Anim. Sci. 74: 3112-3124 15
Tebot I. 2008. Efecto de los suplementos ricos en energía sobre la función ruminal y el metabolismo del nitrógeno en ovinos alimentados con pasto fresco. MSc Thesis. Universidad de la República, Montevideo, Uruguay.
Ungerfeld E.M., Kohn R.A., Wallace R.J., Newbold C.J. 2007. A meta-analysis of fumarate effects on methane production in ruminal batch cultures. J. Anim. Sci. 85: 2556–2563
Valkeners D., Thewis A., Amant S., Beckers Y. 2006. Effect of various levels of imbalance between energy and nitrogen release in the rumen on microbial protein synthesis and nitrogen metabolism in growing double-muscled Belgian Blue bulls fed a corn silage-based diet. J. Anim. Sci. 84:877–885.
Van Soest P.J. 1994. Nutritional ecology of the ruminant. 2a. ed., Ithaca, Ed. Cornell University Press, 476p.
Vérité R., Peyraud J.L. 1990. Nutrición nitrogenada. En: Alimentación de bovinos, ovinos y caprinos. INRA. Ed. Mundi-Prensa, Madrid.
Weimer P. J. 1998. Manipulating Ruminal Fermentation: A Microbial Ecological Perspective. J. Anim. Sci. 1998. 76:3114–3122