Valoración invitro fluido ruminal y celulasa de tres subproductos agrícolas conservados para la alimentación de rumientes
Publicado: 6 de enero de 2015
Por: León Montenergo
Los métodos in vivo para determinar la digestibilidad han sido los tradicionalmente utilizados tanto en zonas templadas como tropicales para obtener la información básica requerida de los alimentos. No obstante tales métodos son costosos, tediosos y laboriosos ya que requieren infraestructura, animales, alimento, mano de obra y mayor tiempo con respecto a los métodos de laboratorio.
Es importante tener en cuenta que las técnicas de digestibilidad in vivo por recolección total de heces (DRTH) no miden la absorción como tal, sino la desaparición o bien una retención de las fracciones del alimento que ocurre en el tracto gastrointestinal (TGI) del animal. También debe considerarse que esta retención es bruta, en el sentido de que no se discrimina el segmento del TGI donde realmente ocurre tal desaparición.
El método convencional de determinación de la digestibilidad por colecta total de heces (digestibilidad in vivo), data desde antes del siglo XIX y permaneció por mucho tiempo como el más preciso y comúnmente utilizado para rumiantes y no rumiantes. Sin embargo por ser una técnica tan laboriosa, numerosas técnicas alternativas han sido sugeridas para predecir la digestibilidad. Navaratne (1990).
No solo la digestibilidad in vivo representa un medio útil para aproximarse al valor nutricional de los alimentos; una estimación de tal valor también puede hacerse a través de; características del forraje, (relación hoja-tallo o edad), análisis químicos, métodos in vitro, medidas físicas, análisis fecal y marcadores internos indigestibles. Minson (1990).
Dentro de la anterior clasificación, las técnicas in vitro han sido las más utilizadas; este grupo incluye las técnicas de solubilidad en líquido ruminalpepsina y solubilidad en celulasa.
La técnica de solubilidad en líquido ruminal-pepsina, es también conocida como el método de Tilley y Terry, 1963. Esta técnica se basa inicialmente en una fase fermentativa con microorganismos contenidos en el líquido ruminal de animales canulados y luego una fase enzimática con pepsina en medio acido, añadiendo ácido clorhídrico (HCl).
En 1973 Jones y Hayward, estandarizaron el método pepsina-celulasa, utilizando una preparación de celulasa cruda comercial, en una sola fase de digestión enzimática. Luego, en al año 1975, incluyeron el pretratamiento con pepsina alcanzando a mejorar la correlación con los valores in vivo.
El empleo correcto de las técnicas in vitro o de laboratorio permite, en un tiempo relativamente corto, obtener un alto número de repeticiones o de muestras según sea el interés. Así mismo, en vista del mayor control de las condiciones, se espera que estas técnicas tengan una menor variabilidad.
Según Marshall (1997), el método Tilley y Terry (1963), ha sido el más comúnmente utilizado como método in vitro para predecir la digestibilidad en rumiantes y como una herramienta de selección para mejorar la calidad nutricional de los forrajes. Para Pace et al (1984), citado por Omed et al (1989), esta técnica es confiable, segura y precisa para un amplio rango de forrajes, sin embargo, su aplicación tiene la desventaja de necesitar animales canulados en el rumen para proveer el líquido ruminal. Existen actualmente restricciones que manejan las comisiones de ética de los organismos internacionales y nacionales de investigación para el uso de animales canulados y este es otro punto a tener en cuenta.
Aunque la técnica pepsina-celulasa obvia la necesidad de utilizar animales canulados y es recomendable por eliminar variaciones entre corridas, es una técnica costosa; además puede presentar una considerable variación en la actividad enzimática de una fuente comercial a otra. Las técnicas enzimáticas tienen la ventaja de ser completamente independientes del animal, lo cual resultaría en una menor variación, por lo que estas técnicas son relativamente fáciles de estandarizar. Marshall et al. (1997).
Según Ayres (1991), ambas pruebas de digestibilidad han sido ampliamente adoptadas en los laboratorios de análisis de alimentos a través del mundo. No obstante el procedimiento licor ruminal-pepsina es preferido para el análisis de muestras de forrajes de diversa morfología y genotipo, donde se presenten facilidades para manejar animales fistulados.
MATERIAL Y METODOS
La investigación se ejecuto en la Finca Experimental “La María”, localizada en el km 7,0 de la vía Quevedo-Mocache; provincia de Los Ríos. Su ubicación geográfica es de 01° 6’ 20’’ de latitud Sur y de 79° 29’ 23’’ de longitud Oeste, a una altura de 73 msnm. El trabajo de campo tuvo una duración 150 días, entre los meses de noviembre 2010 hasta marzo 2011. Los análisis de laboratorio fueron realizados en la Facultad de Ciencias Pecuarias de la Escuela Superior Politécnica de Chimborazo (ESPOCH), ubicada en la Panamericana Sur, km. 1,5 de la Ciudad de Riobamba, Provincia de Chimborazo, a una altitud de 2740 msnm, 01°38’ de latitud Sur y 78°40’ de longitud oeste
Este procedimiento es tomado de la técnica “Tilley y Terry, 1963” e involucra primeramente un periodo de incubación de 48 horas con microorganismos del rumen en un medio buffer y en segundo término, la digestión con una mezcla de ácido clorhídrico - pepsina. Las cantidades de materia seca (MS) o materia orgánica (MO) que desaparecen después de ambas etapas, se consideran como “digeridas” (Guevara, 2008).
3.4.2. Esquema del experimento en la digestibilidad (fluido ruminal)
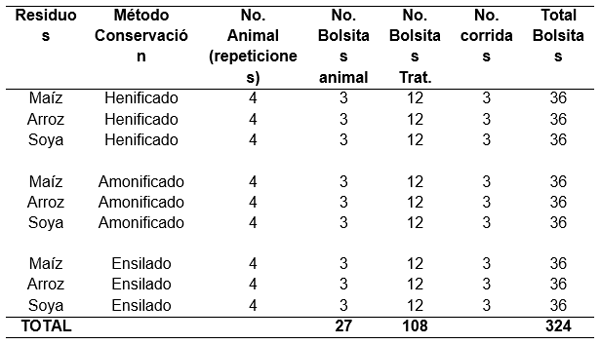
En el Cuadro 9 se presenta el esquema de los tratamientos del experimento, donde se utilizaran cuatro toros Brahaman (repetición) en los cuales se introdujeron las muestras de residuos de maíz, arroz y soya bajo los tres formas de conservación (henificado, amonificado y ensilado), por cada residuo de cosecha se utilizaron tres bolsitas con dos gramos de alimento y se incubaron por 48 horas. Se realizaron tres corridas, en las semanas 1, 2 y 3, para el efecto se utilizaron 108 bolsitas en cada semana o corrida, dando un total 324 bolsitas.
Cuadro 9. Esquema para la digestibilidad in vitro con fluido ruminal de MS de los residuos de cosecha: arroz, maíz y soya (henificado, amonificado y ensilado) a las 48 h de incubación. Fca. Exp. “La María”. UICYT-FCP-UTEQ
3.4.3. Análisis estadístico
En la técnica de digestibilidad in vitro con fluido ruminal, se dispuso de un diseño bloques completamente al azar (DBCA) en un arreglo factorial 3 (Residuos de cosecha) x 3 (Técnicas de conservación), con cuatro repeticiones, en el Cuadro 10 se presenta el esquema del ADEVA. Se bloqueo el peso de los toros.
Cuadro 10. Esquema del análisis de varianza para la digestibilidad in vitro con fluido ruminal de MS de los residuos de cosecha: arroz, maíz y soya (henificado, amonificado y ensilado) a las 48 h de incubación. Fca. Exp. “La María”. UICYT-FCP-UTEQ

3.5. Métodos para determinar la digestibilidad in vitro por celulasa
3.5.1. Principio
La muestra del alimento es tratado con una solución de Pepsina en ácido clorhídrico durante 24 horas en 39ºC, seguido por calentamiento durante 45 minutos en 80ºC. Después de la filtración el residuo es tratado con una solución de buffer de celulaza de Trichoderma viride durante 24 horas en 39ºC. Finalmente, la suspensión es filtrada, secada e incinerada (Guevara, 2008).
3.5.2. Esquema del experimento en la digestibilidad in vitro (celulasa)
Se efectuó la primera fase de la técnica de Tilley y Terry (1963) para cuantificar la desaparición ruminal in vitro de MO de los residuos de cosecha de maíz, arroz y soya (henificados, amonificados y ensilados), para lo cual se colecto fluido ruminal de un toro brahaman con canula ruminal y alimentado ad libitum con pasto saboya y balanceado. Las muestras de residuos se colocaran en tubos de polipropileno y se incubaron con la mezcla de saliva de McDougall + fluido ruminal en relación (4:1) durante 48 horas a temperaturas y pH similares a los del rumen (39ºC y 6.8 respetivamente). En los cuadros 11 y 12 se presenta el esquema de los tratamientos del experimento y del análisis de varianza.
3.5.3. Procedimiento de la digestibilidad in vitro con celulasa
Este sistema de digestibilidad in vitro se basa en la primera etapa en una fermentación en un sistema cerrado, es decir, los productos de la fermentación no son removidos, en la primera etapa se adiciona una solución amortiguadora con el fin de mantener el pH en alrededor de 6.9, para que actúen las bacterias ruminales, especialmente las celuloliticas. En la segunda etapa de esta técnica se lleva a cabo una digestión con pepsina en medio acido, añadiendo HCl. Esta etapa es comparativa a lo que sucede en el abomaso. Los principales pasos a seguidos fueron:
- Obtención del inoculo.
- Mezclado de la solución amortiguadora y del inoculo.
- Pesar la muestra.
- Blancos y estándares.
- Inoculación.
- Agitación.
- Segunda etapa, HCl más Pepsina.
- Filtrado.
- Calculo de la digestibilidad in vitro de la MS.
Cuadro 11. Esquema para la digestibilidad in vitro con celulasa de MS de los residuos de cosecha: arroz, maíz y soya (henificado, amonificado y ensilado). Fca. Exp. “La María”. UICYT-FCP-UTEQ
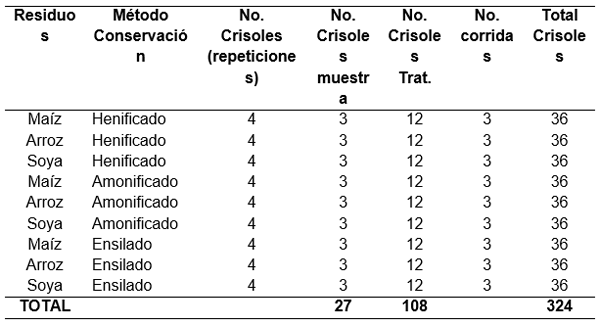
Cuadro 12. Esquema del análisis de varianza para la digestibilidad in vitro con celulasa de MS de los residuos de cosecha: arroz, maíz y soya (henificado, amonificado y ensilado). Fca. Exp. “La María”. UICYT-FCP-UTEQ

RESULTADOS Y DISCUSION
En el Cuadro 14, se presentan los resultados expresados como porcentaje de materia seca (MS) para la digestibilidad in vivo, y para cada una de las técnicas evaluadas.
Cuadro 14. Valores de digestibilidad de la materia seca (%), in vivo, liquido ruminal-pepsina y pepsina-celulasa, para tres subproductos tropicales conservados (henificados, amonificados y ensilados). Fca. Exp. “La María”. UICYT-FCP-UTEQ
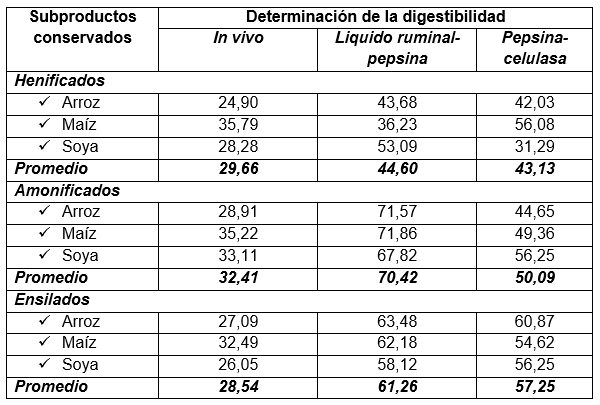
Los valores absolutos entre la técnica in vivo (30,20) son diferentes a los obtenidos con las técnicas líquido ruminal-pepsina (58,76) y pepsina-celulasa (50,16), presentándose una diferencia de 24,26 unidades aproximadamente con respecto a la técnica in vivo. Aceptándose la hipótesis “El proceso digestivo de los rumiantes se puede reproducir in vitro, obteniéndose valores similares o superiores a los de la digestibilidad in vivo”.
Estos resultados difieren con los de Jones y Hayward (1973), quienes notaron que la digestibilidad por el método de la celulasa fue numéricamente unas 25 unidades por debajo de los valores in vivo, para muestras de pastos de baja digestibilidad. Una observación muy similar presentaron Adegbola y Paladines (1977), donde la digestibilidad de la materia seca por el método pepsina-celulasa fue cuantitativamente unas 10 unidades por debajo de los valores in vivo para pastos de baja digestibilidad y de 17 a 20 unidades para pastos de alta digestibilidad.
Los bajos valores de digestibilidad en celulasa respecto a los obtenidos con la técnica de Tilley y Terry pueden estar afectados, más por la concentración del pretratamiento que por la concentración de la celulasa. Esto parece indicar el trabajo realizado por Allison y Borzuck (1978), citados por López y Roldan (1991), quienes con el uso de un pretratamiento fuerte (pepsina en HCl 0,125N), independiente de la calidad del pasto lograron incrementar los valores de la digestibilidad de la materia seca hasta los valores obtenidos por la técnica del liquido ruminal-pepsina.
Omed (1989), al comparar el método pepsina-celulasa, respecto al uso de dos métodos microbiales (liquido ruminal y heces), encontró que los valores de los métodos microbiales eran más cercanos a sus respectivos valores in vivo.
En el Cuadro 15, se presentan las ecuaciones de regresión obtenidas para las dos técnicas de digestibilidad in vitro frente a la digestibilidad in vivo.
Cuadro 15. Ecuaciones de regresión simple entre digestibilidad in vitro (x) e in vivo (y) para tres subproductos tropicales conservados (henificados, amonificados y ensilados) por medio de dos técnicas in vitro. Fca. Exp. “La María”. UICYT-FCP-UTEQ
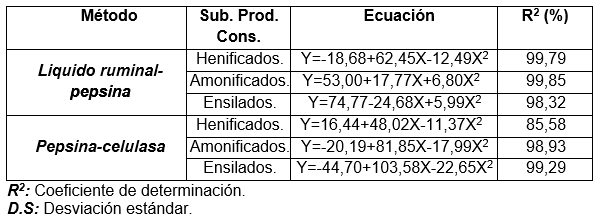
De acuerdo al Cuadro 15, los coeficiente de determinación (R2), para las ecuaciones 1; 2 y 3 (técnica líquido ruminal-pepsina), indican que el 99,79; 99,85 y el 98,32% de la variación total de la digestibilidad in vivo esta explicada por el modelo; el resto, o sea el 0,21; 0,15 y 0,28% es la variación no explicada por la regresión.
En el caso de las ecuaciones 4; 5 y 6, los R2 indican que el 85,58; 98,93 y 99,29% de la variación total de la digestibilidad in vivo esta explicada por el modelo, el 0,42; 0,07 y el 0,71% es la variación no explicada por la regresión. El intercepto presenta valores muy diferentes para las dos técnicas, al compararlos por medio de la ANAVA, se encontró diferencia estadísticamente significativa (p<0,01). Sin embargo debe tenerse en cuenta que el intercepto no siempre tiene una interpretación practica y algunas veces es solo un termino de ajuste que permite representar la tendencia de los datos.
El coeficiente de regresión en este caso para las seis ecuaciones muestran valores cercanos a uno (1), los valores según la ANAVA, aceptándose la hipótesis “Los valores de digestibilidad in vitro de la MS de los residuos de cosecha están altamente correlacionados con los obtenidos mediante prueba de digestibilidad in vivo. Por consiguiente los métodos in vitro sirven para predecir la digestibilidad de la MS, MO, EB y la ED de los residuos de cosecha para la alimentación de rumiantes.
El mayor R2 de la primera ecuación, además del bajo valor de la desviación estándar, obtenidos en el presente trabajo para la técnica del liquido ruminal pepsina con respecto a la técnica pepsina-celulasa, coincide con los reportes de trabajos realizados para forrajes de zona templada por Terry et al (1978), Cerda et al (1989), Terramoccia et al (1989), también Alluzio et al y Antongiovanni et al citados por Antongiovanni y Acciaaoli (1995).
Sin embargo Peña y Paladines (1979) y Navaratne (1990), contrario a los resultados obtenidos en el presente trabajo, reportan valores más altos o iguales del coeficiente de determinación, así como desviaciones estándar más bajas para la técnica pepsina-celulasa al compararla con la técnica liquido ruminal-pepsina.
Para Troelsen y Hanel (1966), citados por Minson (1990), la variación encontrada en la actividad celulolitica del licor ruminal es un problema de la técnica. Este problema causa diferencias entre semanas en los valores obtenidos de digestibilidad in vitro (líquido ruminal-pepsina), Dansa y Deries (1984), citados por Minson (1990). Estos problemas pueden ser controlados usando más de un animal fistulado, estandarizando la dieta del animal donante y colocando estándares en todas las corridas. Giraldo (1996).
El método de Tilley y Terry se considera un método referente para calcular la digestibilidad en alimentos para rumiantes, el cual ha sido modificado y adaptado según el tipo de alimento a analizar, al igual que se han desarrollado y probado diferentes tampones de dilución para ajustar el pH del inóculo, Giraldo et al (2007).
Trabajando con dos forrajes diferentes como fuente de inoculo García y Sánchez (1988), concluyeron que la digestibilidad con licor ruminal, parece no estar afectada por la fuente del inoculo, siempre y cuando no existan grandes diferencias en la composición química entre ellos.
Algunos autores trabajando con leguminosas, mezclas de gramíneas y leguminosas, henos, ensilajes, pajas y subproductos agrícolas han encontrado una mejor confiabilidad de sus resultados con la técnica del licor ruminal que los obtenidos con la técnica pepsina-celulasa, es el caso de Terry et al (1978), Albuzio (1988), citado por Antongiovanni y Acciacioli (1995), Antongiovanni et al (1992), citados por Antongiovanny y Acciaoli (1995) y Navaratne (1990), Arce et al (2003). La técnica pepsina-celulasa parece ser más sensible a la variación de las especies forrajeras, además las celulasas comercialmente disponibles varían considerablemente en su capacidad digestiva Marten y Barnes (1979).
Para el grupo de subprouctos evaluados en el presente trabajo, la técnica Líquido ruminal-pepsina fue más precisa al compararla con la técnica del licor ruminal-pepsina, al presentar un modelo más estable. Sin embargo fue menos exacta en vista de que se distancio más del valor real (in vivo), y su coeficiente de determinación (R2), fue ligeramente superior con respecto a la técnica del licor ruminal.
López y Roldan (1991), consideran la validez y la aceptación del método pepsina-celulasa por su precisión en la predicción de la digestibilidad de la materia seca y también la alta repetibilidad y baja variabilidad de los resultados en el laboratorio.
Al igual que en la presente investigación, Arce et al (2003), al comparar los dos métodos encontraron que los valores de digestibilidad del método enzimático (pepsina-celulasa), fueron estadísticamente menores a los del método Tilley y Terry. Sin embargo, estos hallazgos podrían atribuirse, por un lado, a la riqueza del inóculo ruminal, donde actúan todo un conjunto de enzimas provenientes de los diferentes microorganismos (bacterias,
protozoarios y hongos) que causan una mayor degradación de los forrajes, mientras que el método enzimático trabaja solo con celulasa proveniente de un hongo.
Pese a su exactitud, según Giraldo et al (2007), y a todas las modificaciones y adaptaciones el método Tilley y Terry sigue siendo un procedimiento que consume mucho tiempo y trabajo, además cada alimento debe incubarse por separado, limitando el número de muestras a ser analizadas por corrida o tanda.
La fermentación in vitro de los forrajes mediante un inóculo de microorganismos ruminales presenta probablemente el mejor cálculo hecho en laboratorio sobre la digestibilidad in vivo. Sin embargo, los ensayos in vitro requieren una fuente uniforme y confiable de inóculo ruminal que a menudo es difícil de obtener. Los problemas que mayormente se presentan son: la variación en la actividad del fluido ruminal, variaciones incontrolables que se dan dentro del laboratorio y entre laboratorios, y la disponibilidad de animales ruminalmente canulados. Arce et al (2003).
Después de examinar la repetibilidad de los resultados obtenidos en un laboratorio y de la reproducibilidad de resultados logrados entre diferentes laboratorios, Antongiovanni y Acciacioli (1995), sugieren que dentro de los métodos in vitro, la técnica enzimática empleada por Jones y Hayward es la alternativa más valida a los análisis clásicos de Tilley y TerryFinalmente en pastos tropicales, varios autores también han encontrado una mayor precisión de la técnica pepsina-celulasa, para predecir la digestibilidad de la materia seca invivo, es el caso de Adegbola y paladines (1977), Peña y Paladines (1979), Narváez y Lazcano (1989) y Navaretne (1990).
CONCLUSIONES
La técnica líquido ruminal-pepsina fue más precisa al compararla con la técnica del licor ruminal-pepsina, al presentar un modelo más estable. Sin embargo fue menos exacta en vista de que se distancio más del valor real (in vivo), y su coeficiente de determinación (R2), fue ligeramente superior con respecto a la técnica del licor ruminal.
La técnica pepsina-celulasa presentó valores absolutos superiores con respecto a la digestibilidad in vivo.
- La técnica pepsina-celulasa parece ser más sensible a la variación de las especies forrajeras, además las celulasas comercialmente disponibles varían considerablemente en su capacidad digestiva.
- La mayor ventaja para la técnica pepsina celulasa en cuanto a su ejecución es obviar la necesidad de utilizar animales canulados y todo lo que ello implica, sin embargo la técnica Tilley y Terry presento un mayor coeficiente de determinación, es decir, más exactitud con respecto a los valores in vivo.
- Considerar a la digestibilidad in vitro como un método valido para estimar la digestibilidad in vivo en alimentos para rumiantes, por ser más precisas, rápidas y económicas.
- Utilizar la técnica in vitro (licor ruminal), por que parece no estar afectada por la fuente del inoculo, siempre y cuando no existan grandes diferencias en la composición química entre ellos.
- Evaluar otros subproductos agrícolas y pecuarios aplicando las técnicas liquido ruminal-pepsina y pepsina-celulasa, para estimar la digestibilidad in vivo de los alimentos para rumiantes (vacunos, ovinos, caprinos).
BIBLIOGRAFIA
Adegbola A., Paladines O. 1977. Prediction of digestibility on the dry matter of tropical forages from their solubility in fungal cellulase solutions. Journal of the science of food and agriculture. 28 (1): 775-785.
Allison, D.W. 1969. Forage lignins and their relationships to nutritive value. Proc. Nat. Conf. For: Qual. Eval. Utilization. Nebraska Center for continuing education lincon. Nebraska, USA En: Elías, A. 1983. Digestión de pastos y forrajes Capitulo IV 187- 246 En: Los pastos en cuba. Ed. Instituto de Ciencia Animal. La Habana Cuba 675 pp
Arce C, et al. 2003. Estudio comparativo de la digestibilidad de forrajes mediante dos métodos de laboratorio. Revista de Investigaciones Veterinarias del Perú. 14 (1): 7-12.
Ayres J. 1991. Sources of error with in vitro digestibility assay of pasture feeds. Grass and Forage Science. 46: 89-97.
Castellanos, A.; Llamas, G., y Shimada, A. 1990. Manual de Técnicas de investigación en Rumiología. México, 267 p.
Giraldo L, et al. 2007. Comparación de dos técnicas in vitro e in situ para estimar la digestibilidad verdadera en varios forrajes tropicales. Revista Colombiana de Ciencias Pecuarias. 20 (2007): 269-279.
Giraldo, L. 1996. Manejo y utilización sostenible de pasturas. Medellín. Universidad Nacional de Colombia, p 359.
Jones D., Hayward M. 1973. A cellulasa digestión technique for predicting the dry matter digestibility of grasses. Journal of the science of food and agriculture. 24 (1973):1419-1426.
Jones D., Hayward M. 1975. The effect of pepsin pretreatment of herbage on the prediction of dry matter digestibility from solubility in fungal cellulose solutions. Journal of the science of food and agriculture. 26 (1975): 711-718.
López H., Roldan M. 1991. Estandarización del método de la celulasa para la determinación de la digestibilidad in vitro. Medellín. Universidad Nacional de Colombia. Facultad de Ciencias Agropecuarias. p 44.
Marshall D, et al. 1997. Alternative techniques for measuring nutrient digestión in ruminants. Journal of Animal Science. 75(1997): 2256-2276.
Marten G., Barnes R. 1979. Prediction of energy digestibility of forages with in vitro rumen fermentation and fungal enzyme systems. Workshop standardization of analytical methodology for feeds. Ottawa. Memory p 61-71.
Minson D. 1990. Forage in ruminant nutrition. San Diego. Academic Press. P 483.
Navaratne H, et al. 1990. Comparison of four techniques for predicting digestibility of tropical feeds. Animal feed science and technology. 29 (1990):209-221.
Omed H. 1989. A comparison of three laboratory techniques for the estimation of the digestibility of feedstuffs for ruminants. Journal of Agricultural science. 113 (1989): 187-194.
Peña M., Paladines O. 1979. Digestibilidad de la material seca de forrajes tropicales usando el método de solubilidad en pepsina-celulasa. Turrialba. 29 (3):189-194.
Terry R. 1978. Comparison of two in vitro procedures using rumen liquorpepsin or pepsin-cellulase for prediction of forage digestibility. Journal of the British Grassland Society. 33 (1978): 13-18.
Tilley J. M. and Terry R. A. 1963. A two stage technique for the in vitro digestion of forage crops. Journal of British Grassland Society. 18: 104-111.
Tilley J., Terry R. 1963. A two stage for the in vitro digestion of forage crops. Journal of the British Grassland Society. 18(1963): 104-111
Temas relacionados:
Autores:
Universidad Técnica Estatal de Quevedo - UTEQ
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.




.jpg&w=3840&q=75)