Hipocalcemia: nuevas alternativas de prevención mediante la alimentación
Publicado: 31 de marzo de 2014
Por: Mercado, F. Nutricionista de Rumiantes. Trouw Nutrition México. , Martín-Tereso, J. Manager Ruminant Research Centre (RRC). Nutreco, Boxmeer, Holanda
Introducción
En todas las especies de mamíferos la nutrición del calcio juega un papel fundamental tanto en el desarrollo fetal como neonatal. El calcio es indispensable para el desarrollo de tejidos muscular y óseo así como en el mantenimiento de respuestas vitales (latido del corazón, transmisión nerviosa, contracción muscular, etc.). Por esto mantener una concentración lo más constante de calcio en sangre es de importancia vital para el animal. La selección natural se ha encargado de seleccionar mecanismos hormonales de regulación, también conocidos como mecanismos homeostáticos, que aseguran una cierta concentración de calcio en sangre a través de procesos como absorción intestinal, movilización ósea, y recuperación a nivel renal.
Durante la gestación y hasta el momento del parto, el feto adquiere dicho calcio a través de la placenta procedente de la sangre materna. Los requerimientos del calcio crecen cuantitativa y paulatinamente a medida que el tamaño del feto aumenta. Este incremento gradual en absorción de calcio del feto a través de la placenta otorga el tiempo necesario al organismo materno para activar los procesos de autorregulación. Justo después del parto, la transferencia de calcio materno-filial tiene lugar a través de la leche materna para lo cual también es preciso cierta cantidad de calcio en sangre. Generalmente los mamíferos suelen tener necesidades en calcio pre y post-parto muy similares, es por esta razón que dentro especies domésticas seleccionadas por su viabilidad reproductiva (bovinos para carne, ovinos para carne) no son comunes los desajustes en mecanismos homeostáticos del calcio al parto. No así en ganado bovino productor de leche, donde la demanda de calcio puede ser 3.5 veces más que en el periodo pre parto, esto provoca desajustes en los mecanismos homeostáticos del calcio, finalizando en muchas ocasiones en una hipocalcemia pos parto.
Por ello en los sistemas productivos modernos de ganado lechero la situación es radicalmente diferente. Al contrario que en el bovino para carne el potencial lechero de las vacas de alta producción excede sustancialmente los requerimientos nutritivos de calcio y energía de su progenie. Es un hecho evidente que la capacidad de producción lechera ha incrementado significativamente en los últimos años gracias a la mejora genética. La selección de parentales ha puesto principalmente énfasis en este parámetro y no tanto en la detección de animales con un sistema fisiológico lo suficientemente robusto y dinámico para alcanzar esos altos niveles productivos. Es lógico entonces pensar que la transición en las vacas de leche modernas supone un reto mucho mayor en términos de regulación metabólica que para los animales de hace 50 años.
La fiebre de leche, representa uno de los desajustes metabólicos más frecuentes en la explotación de ganado lechero con una incidencia en el 84% de las granjas (USDA 2008). Este desajuste metabólico tiene lugar después del parto debido a las altas productividades de las vacas de leche, que requieren una rápida adaptación de vaca seca a vaca lactante. La incidencia de la fiebre de la leche aumenta un 9% con cada lactación (DeGaris and Lean, 2008) de manera simultánea al incremento en producción de leche y, lógicamente a medida que se hace mayor la disparidad entre los requerimientos cálcicos del animal y su capacidad homeostática. La mayor incidencia tanto de cetosis como de fiebre de la leche en vacas multíparas en comparación con las primíparas pone de manifiesto la necesidad de una mayor adaptación nutricional energética y mineral al comienzo de la lactación en animales multíparas.
Varios autores han mostrado la tasa de reposición de vacas de leche aumenta a medida que el sistema de producción se intensifica (Hare et al., 2006; Weigel et al., 2003). Altos niveles productivos en vacas lecheras están directamente relacionados con un incremento en la incidencia de desórdenes metabólicos pos partos (Fleischer et al., 2001) y, a su vez, con una menor resistencia a estas. Este hecho explica, al menos parcialmente, la necesidad de una mayor tasa de reposición a medida que la productividad del establo aumenta.
Al contrario que su nivel productivo, la vida útil de las vacas lecheras se ha reducido en las últimas décadas. Únicamente el 40% de la vacas de leche superan la segunda lactación y solo en contadas ocasiones alcanzan la octava lactación (Hare et al., 2006). La vaca de leche no llega a alcanzar ni tan siquiera un tercio de su vida natural, estimada en 30 años (Barja, 2006), y por consiguiente es poco probable que la mayor incidencia de enfermedades en vacas multíparas este causado por la degeneración asociada al envejecimiento. Más bien parece estar causado por un fallo en la adaptación fisiológica durante el periodo de transición.
Nuestro objetivo como nutricionistas es paliar parcial o totalmente este desajuste metabólico a través de estrategias que mejoren la capacidad de adaptación metabólica de la vaca en la transición. La puesta en marcha de estrategias nutricionales específicas para el comienzo de lactación puede incrementar en primera instancia el bienestar animal y, potencialmente, alargar la vida útil de estos animales a través de una menor tasa de desecho. En el establo, tener una tasa de desecho reducida se traduce en una mayor rentabilidad por animal así como en una reducción del impacto ambiental de la explotación por unidad de producto ya que se reduciría el número de animales improductivos (Tamminga, 2003).
Definición de la fiebre de la leche
La fiebre de la leche es un desajuste metabólico que conlleva una reducción de los niveles de calcio en sangre o lo que es lo mismo hipocalcemia. En condiciones normales el nivel del calcio en sangre se suele mantener por encima de 8 mg/dl. Sin embargo la concentración de calcio en sangre se reduce en mayor o menor medida en vacas de leche después del parto. Recientemente, Reinhardt et al. (2011) estimaron que el calcio en sangre post-parto bajaba por debajo de 8 mg/dl en el 25% de vacas de primera lactación, en el 41% de las vacas de segunda lactación y hasta en el 54% de las vacas de quinta lactación. A pesar de que la hipocalcemia clínica o subclínica no se puede catalogar como un parámetro discreto, se ha usado los niveles de calcio en sangre para clasificar la gravedad del problema. Niveles de 6 a 8 mg/dl se clasifica como un problema de fiebre de leche subclínica y niveles menores a 6 mg/dl se ha clasificado como un problema clínico de fiebre de la leche.
Aunque la incidencia de la hipocalcemia post-parto en ganado lechero puede ser una excepción, los procesos metabólicos que aseguran el mantenimiento del nivel de calcio en sangre no suelen fallar en otras especies. Y de hecho, incluso en las vacas de leche los bajos niveles de calcio que no suelen persistir más que unos pocos días después del parto a pesar de la creciente demanda en calcio asociada al comienzo de la lactación. Esto se explica por la activación de los mecanismos homeostáticos de regulación del calcio que compensan la mayor cantidad de calcio retirado del torrente sanguíneo para la síntesis de leche. Por tanto, la causa de una hipocalcemia se debe a un retraso en la respuesta de mecanismos adaptativos en la homeostasis del calcio.
Homeostasis del Calcio
Las vacas lecheras necesitan de mecanismos que regulen los niveles de calcio de una forma muy precisa que eviten la presencia de problemas metabólicos relacionados con el calcio. Fluctuaciones muy por encima o por debajo de la concentración óptima de calcio conllevaría consecuencias fatales, esto debido a que las necesidades de este mineral cambian de una forma repentina después del parto. Por ende, existen mecanismos hormonales de regulación del calcio en sangre que influencian transportadores trans-epiteliales en diversos tejidos, y sobre todo cuantitativamente en riñones e intestino. En cuanto al calcio, existen procesos biológicos que aportan (reabsorción renal, absorción intestinal, movilización de calcio óseo etc.) y otros que substraen este mineral (eliminación en orina, deposición de calcio en hueso etc.) del torrente sanguíneo.
La concentración de calcio en sangre se modifica como consecuencia de cambios en los procesos mencionados. Esas variaciones en concentración de calcio sanguíneo por encima o por debajo del nivel óptimo tienen como respuesta la activación del sistema de regulación hormonal propio del animal. Principalmente la regulación está controlada a través de la acción coordinada de la parathormona (PTH) y el calcitriol y su acción a nivel de diferentes órganos y tejidos. El caso de los rumiantes la absorción del calcio puede ocurrir simultáneamente en el rumen e intestino (Sidler-Lauff et al., 2010).
La glándula paratiroidea dispone de receptores de calcio que evalúan su concentración en sangre, respondiendo con la síntesis y liberación de PTH al torrente sanguíneo cuando los niveles de calcio son relativamente bajos. Inicialmente la PTH tiene una acción de recuperación de calcio a nivel renal, reduciendo así las pérdidas urinarias de calcio y aumentando su disponibilidad en sangre para el animal. Cuando los niveles de calcio son altos, por tanto en ausencia de PTH, el calcio se pierde en orina reduciendo su concentración en sangre. A su vez, la PTH estimula la hidroxilación de la 25-hidroxivitamina D a calcitriol a nivel renal.
El calcitriol por su parte estimula la absorción activa del calcio en el tracto gastrointestinal que representa una de las mayores fuentes de calcio para compensar los requerimientos del animal. El tiempo necesario desde la síntesis del calcitriol hasta que la absorción activa de calcio es funcional demora alrededor de un día en ratas (Ambrecht et al., 1998), sin embargo en vacuno de leche se estima que es aproximadamente de dos días (Martin-Tereso et al., 2011).
Si el calcio recuperado de la reabsorción renal y la absorción activa a nivel intestinal no es suficiente, en este momento se inicia la movilización de calcio óseo, pero para ello es necesaria la presencia de las dos hormonas simultáneamente.
Este proceso de regulación es continuo y dinámico en función del estado fisiológico de la vaca. Al comienzo de la lactación el calcio óseo es movilizado ya que el dietético no basta para cubrir las necesidades de producción independientemente de cuanto eficaz sea la absorción activa y pasiva de calcio en el tracto gastrointestinal. Posteriormente, cuando la lactación avanza el calcio de la dieta es suficiente para satisfacer las necesidades de producción, sin embargo la absorción activa se mantiene para recuperar las reservas óseas utilizadas anteriormente.
Procesos de transporte trans-epiteliales
Existen dos procesos de difusión del calcio a través de los epitelios, la difusión pasiva y la absorción activa a través de células epiteliales. La primera ocurre a través de las uniones de las células epiteliales siempre y cuando los gradientes de concentración de calcio lo permitan. Sin embargo la absorción activa está sometida a una mayor regulación y juega un papel determinante en la homeostasis del calcio.
La reabsorción renal y absorción intestinal del calcio son procesos de absorción trans-celular coordinados a través del metabolismo homeostático del calcio y que permiten la absorción de este mineral independientemente del gradiente. El proceso de absorción trans-epitelial se puede dividir en tres fases, (1) la entrada asistida del calcio al interior del citoplasma celular, (2) asociación de este calcio a una proteína de transporte y (3) liberación del calcio al siguiente espacio extracelular a través de un transportador de membrana.
Movilización de calcio óseo
El tejido óseo supone un importante mecanismo de control homeostática del nivel de calcio en sangre. El tejido óseo tiene una función estructural y el calcio representa uno de sus constituyentes principales, este tejido está en continúa remodelación para lo cual precisa de calcio. Por ello una parte del calcio disponible en sangre es retirado del torrente sanguíneo en momentos en los que el tejido óseo se está generando. El calcio por tanto supone un requerimiento nutritivo en fases de síntesis de tejido óseo.
No obstante el calcio almacenado en los huesos representa una importante fuente de este mineral que puede ser vertido al torrente sanguíneo en periodos en los que su concentración en sangre es baja. Sin embargo la cantidad de calcio rápidamente disponible es relativamente pequeña (aprox. 10 g) y corresponde a la fracción soluble en los huesos, el resto forma parte de la estructura ósea y para su movilización es necesario un proceso catabólico del hueso.
La hormona que regula la movilización de calcio óseo es principalmente la PTH, pero su acción está fuertemente ligada al calcitriol (Panfitt, 1976). La PTH inicia la reabsorción de calcio óseo para compensar los niveles bajos de calcio en sangre y al mismo tiempo promueve la síntesis de calcitriol, y este último induce la absorción activa de calcio a nivel gastrointestinal. Si el nivel de calcio es restablecido a través de la dieta, la síntesis de PTH cesa y se inicia la excreción renal de calcio.
Los efectos transitorios de la PTH y el calcitriol se explican sobre su influencia en la actividad de las células encargadas de la regeneración ósea. La actividad de los osteoclastos es inhibida directamente por la calcitonina (Martin y Udagawa, 1998), pero su actividad se incrementa indirectamente a través de los osteoblastos (Greenfield y Miyauchi, 1999). Los osteoblastos tienen receptores específicos para la PTH y el calcitriol, y estos median en la transformación de pre-osteoclastos en osteoclastos activos. La activación de los osteoclastos ya presentes tiene lugar en unas 6 horas, pero para que el número de osteoclastos aumente significativamente pueden necesitarse dos días. Esto tiene implicaciones directas en vacas en transición, ya que estos cambios homeostáticos no ocurren lo suficientemente rápido para recuperar la repentina bajada de calcio en sangre debido a las crecientes necesidades de este mineral para la lactación. De forma similar a como ocurre con la absorción gastrointestinal activa, la vaca gestante precisa de 48 horas de estimulación con PTH para que tenga lugar una movilización efectiva de calcio óseo (Goff et al., 1986). Este intervalo de tiempo coincide con el periodo crítico para la aparición de la fiebre de la leche en vacas de alta producción, justo los primeros días posteriores al parto.
Estrategias nutritivas para influir el metabolismo del calcio
Como se ha expuesto previamente, la fiebre de la leche debe ser considerada como un fallo fisiológico en la adaptación durante el proceso de transición y no, como erróneamente se pensaba, a una inadecuada suplementación de calcio. A lo largo del tiempo se ha trabajado con varias estrategias nutricionales, desde una perspectiva preventiva para combatir la fiebre de la leche. Inicialmente estas estrategias nutricionales se enfocaron en la suplementación con vitamina D y en cambios en los niveles nutricionales de la relación calcio:fósforo. Paralelamente y en los últimos años también han sido empleadas otras estrategias con el objetivo de estimular la homeostasis del calcio en los últimos estadios de gestación previos al parto.
1- Dietas bajas en calcio
Una vez comprendido que la fiebre de la leche estaba asociada a un fallo en los mecanismos homeostáticos del calcio, se propusieron dietas bajas en calcio durante el periodo de preparto. El suministro de dietas en preparto extremadamente bajas en calcio se puede considerar una estrategia preventiva que promueve la adaptación prematura de la regulación metabólica del calcio. Dicha estrategia ha resultado efectiva en numerosas ocasiones, y parece tener una efectividad del 100% siempre y cuando la ingesta de calcio se mantenga por debajo de 20 g al día (Thilsing-Hansen et al., 2002).
Sin embargo formular raciones que contengan 1.5 g de calcio por kg de materia seca resulta muy difícil de conseguir, y más concretamente con las exigencias nutricionales durante un periodo fisiológico tan crítico como el preparto. Uno de los factores que ha impedido que esta estrategia resulte práctica, es la enorme dificultad para formular raciones bajas en calcio. Por norma general los forrajes verdes exceden esos niveles de calcio siendo tan solo la paja de cereal el único forraje con niveles relativamente bajos en calcio.
2- Reducción de la diferencia catión – anión dietética
Una de las estrategias nutricionales más extendidas y exitosas para la prevención de la fiebre de la leche es la formulación de dietas con un balance catión-anión (DCAD) negativo. Esta metodología induce al animal a un estado moderado de acidosis metabólica, lo que conlleva una acidificación de la sangre. El balance catión-anión es calculado a través de la diferencia entre equivalentes de cationes de Na y K y aniones de Cl y S en la dieta, expresado en miliequivalentes por kg de materia seca (Block, 1984). El uso de DCAD en dietas de preparto ha sido ampliamente documentado en el pasado (Roche, 2003), solo hay que tener un buen protocolo de manejo y aplicación para que estas sean de fácil implementación y con buenos resultados.
El modo de acción de las dietas preparto con DCAD negativo ha estado sujeto de numerosas discusiones. En realidad fueron valores positivos de DCAD los que demostraron tener un efecto negativo sobre la fiebre de la leche en lugar de valores negativos de DCAD estar relacionados con una menor incidencia de la fiebre de la leche. Algunos autores han sugerido que la alcalosis metabólica asociada a valores positivos de DCAD tiene un efecto negativo en la respuesta que a nivel renal genera la PTH (Horst et al., 1994) . Este efecto solo puede ser revertido acidificando la sangre lo cual a su vez incrementa la respuesta del calcitriol (Goff et al., 1991).
Otra posible explicación sobre el efecto preventivo asociado a la utilización de valores negativos de DCAD sería su efecto inductor en los procesos homeostáticos del calcio. Es posible que si los valores de DCAD son lo suficientemente negativos la absorción gastrointestinal del calcio sea estimulada para compensar las mayores pérdidas de calcio renales asociadas a situaciones de acidosis metabólica (Schonewille et al., 1994). Esto se explicaría por el efecto negativo que el pH tiene en el canal TRPV5 a nivel renal, como anteriormente se ha explicado.
En resumen, utilizar valores negativos de DCAD en dietas preparto puede ser un medio efectivo para reducir la incidencia de la fiebre de la leche actuando de un modo similar a ofrecer dietas bajas en calcio. En ambos casos se crea un déficit de calcio previo al parto y esto estimula la activación de los mecanismos homeostáticos del calcio a través de la absorción gastrointestinal activa. Si incrementando la absorción de calcio en la dieta no se pueden compensar las pérdidas urinarias también se activará la movilización de calcio óseo.
3- Uso dietético de antagonistas del calcio
Durante esta última década se ha reconsiderado el principio de las dietas bajas en calcio para prevenir la hipocalcemia. Sin embargo se ha hecho desde la novedosa perspectiva de reducir la disponibilidad de calcio sin modificar la cantidad bruta de calcio ingerido. Este objetivo se puede conseguir a través de antagonistas del calcio que añadido a la ración tienen el potencial de fijar este mineral durante su recorrido en el tracto gastrointestinal disminuyendo su disponibilidad nutricional.
Las zeolitas son aluminosilicatos que disponen en su estructura cationes hidratados que están unidos muy débilmente a su matriz. La debilidad de estos enlaces permite que sean intercambiados por otros cationes cuando se encuentran en medio acuoso. Las zeolitas han mostrado una efectividad similar a la de dietas sintéticas bajas en calcio (Thilsing-Hansen et al., 2002). Su modo de acción es aún incierto, aunque inicialmente se pensó que la prevención de la hipocalcemia se debía a la inducción de la absorción activa de calcio intestinal al reducir la disponibilidad del calcio en la dieta. Más recientemente ha sido sugerida la hipofosfatemia asociada al uso de zeolitas como un posible factor en su acción beneficiosa para la prevención de la fiebre de la leche.
A pesar del gran potencial demostrado, el uso de zeolitas está asociado con una depresión de la ingesta de materia seca. Esto no ha sido apreciado por todos los autores, aunque en muchos casos se justifica por el hecho de que ofrecían raciones restringidas y no a libre disposición. La dosificación aproximada que confiere resultados técnicos satisfactorios sin penalizar excesivamente la ingesta es de aproximadamente 23 g por kg de materia seca (Grabherr et al., 2009).
Una de las mayores dificultades del uso de antagonistas del calcio es evitar los efectos adversos en ingesta diaria. El ácido fítico es uno de los compuestos naturales que pueden reducir la disponibilidad del calcio fijándolo a otra estructura. Este compuesto se puede encontrar en cantidades relativamente altas en subproductos de cereales que debido a su composición química y valor nutricional puede ser empleado fácilmente en dietas de rumiantes. El ácido fítico ya ha sido empleado con éxito en nutrición humana para prevenir la formación de cálculos renales, reduciendo la absorción intestinal de calcio y por tanto una menor excreción renal de este mineral.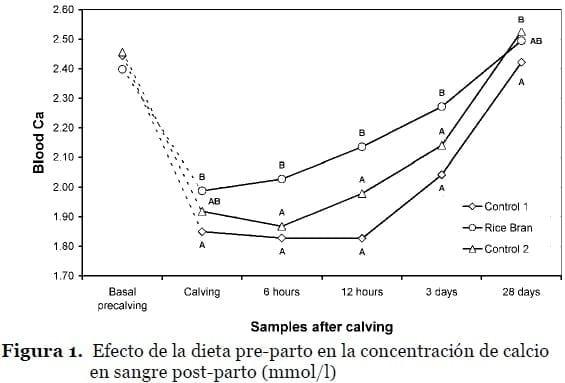
Uno de las limitaciones del ácido fítico en rumiantes es que es potencialmente degradable en rumen. Varios estudios recientes han demostrado que la degradación ruminal del ácido fítico contenido en alimentos está íntimamente relacionado con la degradabilidad de las proteínas vegetales en la dieta, y por consiguiente, que los tratamientos a los alimentos que promueven una mayor tasa de proteína by-pass resultan también efectivos para reducir la degradabilidad del ácido fítico (Bravo el at., 2002). Por tanto es posible proteger el ácido fítico de la degradación ruminal a través de tratamientos tecnológicos.
El tratamiento de subproductos de cereales con productos o transformaciones que disminuyan su degradabilidad ruminal, ha mostrado una estrategia eficaz para inducir la regulación metabólica temprana del calcio en dietas de preparto (Martín-Tereso et al., 2010). Esta respuesta se debe a una muy baja disponibilidad del calcio en dieta que obliga al animal a activar sus mecanismos homeostáticos de absorción activa intestinal y movilización del calcio óseo. El valor profiláctico de este alimento ha sido y sigue siendo objeto de estudio por nuestro grupo.

Reconocimientos
El presente abstract es una versión abreviada del artículo publicado por Martín-Tereso y Verstegen (2011).
Lista de referencias
Armbrecht HJ, Boltz MA, Christakos S, et al. (1998) Capacity of 1,25-dihydroxyvitamin D to stimulate expression of calbindin D changes with age in the rat. Arch Biochem Biophys 352, 159–164.
Barja G (2002) Rate of generation of oxidative stress-related damage and animal longevity. Free Radical Biol Med 33, 1167–1172.
Bieglmayer C, Prager G & Niederle B (2002) Kinetic analyses of parathyroid hormone clearance as measured by three rapid immunoassays during parathyroidectomy. Clin Chem 48, 1731–1738.
Block E (1984) Manipulating dietary anions and cations for prepartum dairy cows to reduce incidence of milk fever. J Dairy Sci 67, 2939–2948.
Bouillon R, Van Cromphaut S & Carmeliet G (2003) Intestinal calcium absorption: molecular vitamin D mediated mechanisms. J Cell Biochem 88, 332–339.
Bronner F (2003) Mechanisms of intestinal calcium absorption. J Cell Biochem 88, 383–393.
Case RM, Eisner D, Gurney A, et al. (2007) Evolution of calcium homeostasis: from birth of the first cell to an omnipresent signalling system. Cell Calcium 42, 345–350.
DeGaris P & Lean I (2008) Milk fever in dairy cows: a review of pathophysiology and control principles. Vet J 176, 58–69.
Fleischer P, Metzner M, Beyerbach M, et al. (2001) The relationship between milk yield and the incidence of some diseases in dairy cows. J Dairy Sci 84, 2025–2035.
Goff J, Littledike E & Horst R (1986) Effect of synthetic bovine parathyroid hormone in dairy cows: prevention of hypocalcemic parturient paresis. J Dairy Sci 69, 2278–2289.
Goff JP, Horst RL, Littledike ET, et al. (1986) Bone resorption, renal function and mineral status in cows treated with 1,25-dihydroxycholecalciferol and its 24-fluoro analogues. J Nutr 116, 1500–1510.
Goff J, Horst R, Mueller F, et al. (1991) Addition of chloride to a prepartal diet high in cations increases 1,25-dihydroxyvitamin D response to hypocalcemia preventing milk fever. J Dairy Sci 74, 3863–3871.
Grabherr H, Spolders M, Furll M, et al. (2009) Effect of several doses of zeolite A on feed intake, energy metabolism and on mineral metabolism in dairy cows around calving. J Anim Physiol Anim Nutr (Berl) 93, 221–236.
Greenfield E, Bi Y & Miyauchi A (1999) Regulation of osteoclast activity. Life Sci 65, 1087–1102.
Halloran BP & De Luca HF (1981) Intestinal calcium transport: evidence for two distinct mechanisms of action of 1,25-dihydroxyvitamin D3. Arch Biochem Biophys 208, 477–486.
Hare E, Norman H & Wright J (2006) Survival rates and productive herd life of dairy cattle in the United States. J Dairy Sci 89, 3713–3720.
Hoenderop J, van Leeuwen J, van der Eerden B, et al. (2003) Renal Ca 2 wasting, hyperabsorption, and reduced bone thickness in mice lacking TRPV5. J Clin Invest 112, 1906–1914.
Horst R, Goff J & Reinhardt T (1994) Calcium and vitamin Dmetabolism in the dairy cow. J Dairy Sci 77, 1936–1951.
Khanal R & Nemere I (2008) Regulation of intestinal calcium transport. Annu Rev Nutr 28, 179–196.
Martin T & Udagawa N (1998) Hormonal regulation of osteoclast function. Trends Endocrinol Metab 9, 6–12.
Martín-Tereso J, Gonzalez A, Van Laar H, et al. (2009) In situ ruminal degradation of phytic acid in formaldehyde-treated rice bran. Anim Feed Sci Technol 152, 286–297.
Martín-Tereso J, Martens H & Deiner C, et al. (2010) Effect of Rumen Protected Rice Bran on Serum Ca of Multiparous Dairy Cows at Calving. 14th international Conference of Production Diseases in Farm Animals, Ghent 2010. Zelzate, Belgium: University Press.
Martín-Tereso J, Derks M, van Laar H, et al. (2010) Urinary calcium excretion in non-lactating dairy cows in relation to intake of fat-coated rice bran. J Anim Physiol Anim Nutr (Berl) 94, 129–136.
Martín-Tereso J, van Puijenbroek R, van Laar H, et al. (2011) Effect of feeding rumen protected rice bran on calcium homeostasis of non-lactating multiparous cows. J Anim Physiol Anim Nutr (Berl) 95, 236–244.
Martín-Tereso J & Vertegen WA, (2011) A novel model to explain dietary factors affecting hypocalcaemia in dairy cattle. Nutr. Research Reviews, 24, 228-243.
Nilius B, Prenen J, Hoenderop J, et al. (2002) Fast and slow inactivation kinetics of the Ca2þ channels ECaC1 and ECaC2 (TRPV5 and TRPV6). Role of the intracellular loop located between transmembrane segments 2 and 3. J Biol Chem 277, 30852–30858.
Norman A, Friedlander E & Henry H (1981) Determination of the rates of synthesis and degradation of vitamin D-dependent chick intestinal and renal calcium-binding proteins. Arch Biochem Biophys 206, 305–317.
Parfitt A (1976) The actions of parathyroid hormone on bone. Relation to bone remodelling and turnover, calcium homeostasis, and metabolic bone disease. Part II. Metabolism 25, 909–955.
Reinhardt TA, Lippolis JD, McCluskey BJ, et al. (2011) Prevalence of subclinical hypocalcemia in dairy herds. Vet J 188, 122–124.
Reksen O, Tverdal A & Ropstad E (1999) A comparative study of reproductive performance in organic and conventional dairy husbandry. J Dairy Sci 82, 2605–2610.
Roche J, Dalley D, Moate P, et al. (2003) Dietary cation–anion difference and the health and production of pasture-fed dairy cows 2. Nonlactating periparturientcows. J Dairy Sci 86, 979–987.
Schonewille JT, Van’t Klooster AT, Dirkzwager A, et al. (1994) Stimulatory effect of an anion(chloride)-rich ration on apparent calcium absorption in dairy cows. Livest Prod Sci 40, 233–240.
Schroder B & Breves G (2007) Mechanisms and regulation of calcium absorption from the gastrointestinal tract in pigs and ruminants: comparative aspects with special emphasis on hypocalcemia in dairy cows. Anim Health Res Rev 7, 31–41.
Sidler-Lauff K, Boos A, Kraenzlin M, et al. (2010) Influence of different calcium supplies and a single vitamin D injection on vitamin D receptor and
calbindin D9k immunoreactivities in the gastrointestinal tract of goat kids. J Anim Sci 88, 3598–3610.
Siener R, Heynck H & Hesse A (2001) Calcium-binding capacities of different brans under simulated gastrointestinal pH conditions. In vitro study with 45 Ca. J Agric Food Chem 49, 4397–4401.
Suzuki Y, Landowski C & Hediger M (2008) Mechanisms and regulation of epithelial Ca2þ absorption in health and disease. Annu Rev Physiol 70, 257–271.
Tamminga S (2003) Pollution due to nutrient losses and its control in European animal production. Livest Prod Sci 84, 101–111.
Taylor M, Knowlton K, McGilliard M, et al. (2008) Blood mineral, hormone, and osteocalcin responses of multiparous Jersey cows to an oral dose of 25-hydroxyvitamin D3 or vitamin D3 before parturition. J Dairy Sci 91, 2408–2416.
Thilsing-Hansen T, Jørgensen R & Østergaard S (2002) Milk fever control principles: a review. Acta Vet Scand 43, 1–19.
Vogetseder A, Karadeniz A, Kaissling B, et al. (2005) Tubular cell proliferation in the healthy rat kidney. Histochem Cell Biol 124, 97–104.
Weigel K, Palmer R & Caraviello D (2003) Investigation of factors affecting voluntary and involuntary culling in expanding dairy herds in Wisconsin using survival analysis. J Dairy Sci 86, 1482–1486.
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicaciónZinpro
12 de octubre de 2014
Federico . Todas las vacas de leche , sobre todo en pastoreo , comen tierra , lo que sucede es que uno generalmente no lo cuantifica . Yo en orden de prioridades a revisar pienso en Acidosis ruminal quiza por un cambio brusco de dieta de vaca seca a dieta preparto ( no se que pesada es su racion ) , el siguiente punto es cetosis y si esto se da unos dias antes de parto, revise cetosis subclinical. De ahi en adelante revisar nivel de sodio . Generalmente este problema no esta asociado a fosforo u otros minerals , como mucha gente piensa .
Zinpro
9 de octubre de 2014
No estoy de acuerdo con el uso de zeolitas de la forma como se enfoca en este articulo , no le encientro sentido buscar un mecanismo para ligar calico , donde sabemos que tambien estaremos ligando magnesio y otros micronutrientes. Excepto que presenten informacion realmente cientifica y bien fundamentada yo no recomiendo esta practica a ningun productor . La utilizacion del Balance cation anion es el metodo mas seguro y probado cientificamente para manipular el metabolism del calcio y lograr reducir tanto la fiebre de leche como la hipocalcemia subclinical a la cual estan ligados otros problemas metabolicos como retencion de placenta, desplazamiento de abomazo , cetosis y mastitis .
Aparte de la informacion cientifica que s mucha , nosotros hemos podido verificar el impacto del BCA en reduccion de hipocalcemia subclinical y por ende en problemas metabolicos asociados y aun mas , el impacto positive en produccion de leche dada la respuesta de la vaca en consume de material seca y mejoras en los picos de produccion .
Universidad Central Marta Abreu - UCLV
2 de octubre de 2014
Opino que la propuesta de profilaxis de la Paresia de las vacas lecheras mediante la utilización de dietas como DCAD negativa donde podrían emplearse Zeolitas naturales u otros intercambiadores iónicos es aceptable , muy buena. Al respecto, ya hace mas de 15 años se han venido publicando mas de 100 artículos científicos que la corroboran absolutamente como la mejor alternativas de prevención de la Hipocalcemia postparto de las vaca lechera, Fiebre Vituallar o de la Leche o Paresia o Coma puerperal
Universidad Nacional Mayor de San Marcos (Perú)
29 de septiembre de 2014
La verdad es que no encuentro la relación entre peróxidos e hipocalcemia, o está pretendiendo promocionar HEPATO-JECT, como preventivo de hipocalcemias?, no creo que sea lo mas prudente. La hipocalcemia y las sales aniónicas han sido bien estudiadas y con las diferencias de marca que siempre hay, las sales aniónicas llevan a un DCAD negativo, y cuanto mas negativo sea habrá menos casos de hipocalcemia. Los antioxidantes y radicales libres hay que llevarlos a otro contexto. Saludos
Universidad Nacional Mayor de San Marcos (Perú)
14 de abril de 2014
Me gustaría tener el artículo original, si no es molestia mi correo es aldelgadoc@gmail.com. De hecho al leer lo publicado supuse era error de traducción. Gracias y saludos.
Nutreco
14 de abril de 2014
Estimado Dr Delgado,
Para mayor grado de detalle, sugiero que lea el artículo original publicado en Nutrition Research Reviews (2011), del cual este artículo es una versión muy abreviada y en Español.
En cuanto a la frase que cita, es en efecto errónea pues se tradujo de forma incorrecta. La intención de esa frase era explicar que en opinión del autor, la reducción del DCAB es una estrategia de prevención en lugar de la idea generalmente aceptada de que el DCAB positivo es una causa del problema. Gracias por detectar esta errata. Este argumento queda extensivamente explicado en el artículo original y es apoyado por un modelo teórico de balance de Ca.
Gracias por su interés en nuestro artículo.
Universidad Nacional Mayor de San Marcos (Perú)
14 de abril de 2014
Coincido en que es una buena revisión, sin embargo no encuentro la explicación de como es que el calcio óseo es movilizado, quien lo hace y como lo hace. De otro lado la tendencia mundial a explicar mejor la prevención de la hipocalcemia por mejor movilización de calcio óseo es mas importante que el calcio dietético, coso que el autor sostiene a la inversa, por lo demás es una buena contribución, en donde habría que dejar muy claro algunos conceptos y para muestra basta un botón: "En realidad fueron valores positivos de DCAD los que demostraron tener un efecto negativo sobre la fiebre de la leche en lugar de valores negativos de DCAD estar relacionados con una menor incidencia de la fiebre de la leche."
Lo de las zeolitas al no tener una clara explicación en cuanto a su mecanismo, mejor lo dejaré para cuando esto este mejor dilucidado. Saludos.
Nutreco
14 de abril de 2014
Estimado Ricardo, el alimento para poder aplicar esta tecnología en las dietas preparto se llama CalFix. En este momento no lo tenemos disponible en Sudamérica, pero estamos trabajando en poder tenerlo en el mercado en el corto plazo.
Atentamente,
Rubén Gregoret
20 de octubre de 2015
En teminos mas sencillos la DCAD,es el uso de elementos con cargas negativas (Bio-chlor,Soychlor);lo que induce un medio interno acido,por lo que los mecanismos homeostaticos de la vaca mantienen activo el sistema regulador del calcio para equilibrar el medio interno (Ca cation, elemento con carga positiva).En lo personal para los que no podemos acceder a estas tecnologias en estos tiempos de crisis mundial;les recomiendo el uso de dietas bajas en calcio sin olvidar el potasio que tambien es un cation importante.Las dietas de preparto no deberan contener forrajes de estado fenologico corto,ya que estos son ricos en potasio. saludos desde San Luis Potosi,Mexico.












.jpg&w=3840&q=75)