INTRODUCCIÓN
La Tuberculosis bovina es causada por una bacteria intracelular obligatoria, acido-alcohol resistente denominada Mycobacterium bovis. En bovinos Bos taurus-indicus, la exposición a este microorganismo desarrolla una enfermedad crónica que pone en peligro la salud del animal así como su productividad, ocasionando innumerables pérdidas económicas en aquellos paí- ses afectados [2]. Esta es una enfermedad granulomatosa, cuyos efectos patológicos se reflejan principalmente en el tracto respiratorio alto, por lo que se presume que su contaminación se produce principalmente por la vía de la exposición aerógena al M. bovis [7]. Los bovinos (Bos taurus, indicus) infectados sirven de fuente de infección hacia otros bovinos, sin embargo, se ha podido observar en algunos países, que algunas especies de fauna silvestre, actúan como reservorio de la infección, complicando aún más el complejo epidemiológico de la enfermedad [9, 23].
El M. bovis es miembro de los microorganismos que conforman el complejo tuberculoso y representa un serio riesgo zoonótico para la salud del humano. En países desarrollados, la transmisión de este agente al humano ha sido disminuida en años recientes. Sin embargo, en el contexto de las enfermedades bacterianas inmunosupresoras, el M. bovis constituye una de las principales amenazas para la salud pública [8, 21].
Vista la implicación económica y de salud de esta enfermedad se hace necesario desarrollar métodos efectivos para su control y erradicación. La prueba cutánea con tuberculina y la eliminación de animales positivos hasta el presente, ha sido la base de la mayoría de los planes de control y erradicación por varios años. Esta metodología ha tenido éxito en varios países. Sin embargo, nuevas estrategias diagnósticas han tenido que ser desarrolladas en aquellos países donde la prueba cutánea con la tuberculina, no fue suficiente para la completa erradicación de la enfermedad, por tanto, se hace necesario incrementar el conocimiento acerca de la respuesta inmune frente al M. bovis, con el fin de aplicar estos nuevos conocimientos al desarrollo de métodos diagnósticos más eficaces de la enfermedad [1].
La célula linfocitaria T es la primera célula involucrada en la infección con el M. bovis del ganado vacuno [6, 27]. La respuesta inmune celular domina como principal respuesta en esta enfermedad [22]. Todas las sub poblaciones linfocitarias T (Tγð, TCD4 y TCD8α β) han sido involucradas en la respuesta anti-micobacterias en ganado vacuno. La secuencia de participación de estas sub poblaciones estaría iniciada por los Tγð, seguidos por los TCD4 y más tarde, con predominancia de los TCD8α β [29]. Las células Tγð poseen la capacidad de producir IFN-γγγ, sin embargo, ellas producen menos cantidad que las células TCD4+ [34]. Las células Tγð servirían de enlace entre la inmunidad innata y la inmunidad adaptativa del sistema inmune [4, 6, 12, 18].
Particularmente importante es el establecimiento de una respuesta inmunitaria tipo Th1, caracterizada por la producción de IFN-γγ, considerada esencial como vía de activación de los macrófagos. En ganado vacuno infectado con M. bovis, la sub población TCD4+ parece dominar este tipo de células productoras de IFN-γγ responsable de activar la capacidad anti-micobacteriana del macrófago. Las células TCD8, se encuentran envueltas, principalmente, en la lisis de las células infectadas [14, 26, 29, 33].
A pesar de la dominancia inicial de la respuesta inmune celular, se le ha dado un enfoque especial dentro de los aspectos inmunológicos de la tuberculosis bovina, a la investigación de la respuesta humoral [10]. Actualmente existe un gran interés en el estudio y caracterización de nuevas proteínas potencialmente antigénicas para ser utilizadas en los estudios seroló- gicos de alta especificidad [14, 16, 18]; de todas maneras, la evaluación de la respuesta celular, sigue siendo el objetivo de estudio de primera línea en tuberculosis bovina “in vivo”, la medida de la respuesta celular tradicionalmente utilizada en el mundo entero es la prueba cutánea con tuberculina derivada de M. bovis, la cual puede arrojar reactores falsos positivos por su reacción cruzada con otras micobacterias, por lo que se recomienda aplicar paralelamente con la tuberculina derivada del M. avium. Estas continúas reacciones cruzadas frente a la tuberculina del M. bovis, han avivado las investigaciones sobre nuevas proteínas antigénicas del agente capaces de ser utilizadas de manera más especifica en el diagnóstico [26].
El desarrollo de métodos de diagnósticos basados en la detección de IFN-γγ, resultó ser uno de los mejores trabajos para optimizar el diagnóstico del M. bovis [41], especialmente para detectar animales infectados durante la etapa inicial de la respuesta inmune celular utilizando como reactivo estimulante de la producción del IFN-γγ, el PPD-B, el PPD-A o antígenos purificados como el ESAT-6 [27, 28, 36].
Ha sido demostrado en una población de ganado vacuno infectado con M. bovis, que los individuos que responden a la intradermorreacción con la tuberculina no son precisamente los mismos positivos a la prueba del IFN-γγ. Algunos animales aparecen positivos en ambas pruebas pero otros pueden aparecer positivos solo a la intradermorreacción con la tuberculina o al IFN-γγ, por lo que se recomienda utilizar las dos pruebas en paralelo para incrementar la sensibilidad del diagnóstico. Ambos grupos de animales corresponden a diferentes patrones de respuesta inmunitaria a la infección por el M. bovis [23, 24].
El nivel de anticuerpos anti M. bovis, de la clase IgG1 se encuentra correlacionado positivamente con cambios patológicos en tuberculosis bovina en períodos de tiempo prolongados. Estas observaciones indican la posibilidad de la aplicación de más de una prueba en combinación, para proveer una mejor información del estatus en el que se encuentra la enfermedad en el individuo. En la infección con micobacterias, los cambios en el balance de una respuesta dominante Th1 hacia una más prominente Th2, se encuentra asociado a progresión de la enfermedad, producción de anticuerpos dependiente de los linfocitos B y anérgia de la respuesta inmune celular [3, 15, 30].
En tuberculosis bovina, el análisis del perfil de las citocinas de clones de células T reactivas al M. bovis, provenientes de animales infectados experimentalmente, indican que la proporción de clones de células T expresando Th0 (capaces de secretar IFN-γγ e IL-4/ respuesta IgG1), se encuentra asociada con el desarrollo de una enfermedad más severa [38]. Los animales que mantienen un perfil de citocinas Th1 (IFN-γγ), presentan un bajo nivel de enfermedad, con lesiones restringidas al tracto respiratorio superior [38].
El objetivo principal de este trabajo fue el utilizar varias herramientas diagnósticas para evaluar la respuesta inmunitaria de bovinos infectados con M. bovis y establecer los diferentes patrones de respuesta en ganado vacuno expuesto en condiciones naturales a la infección, relacionándolos con la edad, presencia y/o extensión de lesiones tuberculosas y con el aislamiento e identificación del germen y posterior evaluación genotípica de cepas del M. bovis en una zona de alta incidencia de tuberculosis bovina en el estado Zulia, Venezuela.
MATERIALES Y MÉTODOS
Se realizó un estudio de tipo observacional transversal, cuyo análisis de los resultados estuvo basado en un estudio de tipo analítico. Para caracterizar la respuesta inmune celular en bovinos infectados con tuberculosis, se evaluó una finca de 6.000 animales con antecedentes de tuberculosis bovina por más de 20 años, ubicada en la zona de Santa Bárbara, municipio Colón, estado Zulia, Venezuela, donde se aplica rigurosamente la prueba oficial para el diagnóstico de la tuberculosis bovina, como es la prueba simple de la tuberculina. Se seleccionaron para este estudio 136 animales de dos lotes descartados por el INSAI utilizando el criterio de reactor positivo a la prueba oficial, en los dos períodos climáticos registrados en Venezuela (lluvia y sequía).
Todos los animales evaluados, reactores positivos a la tuberculina aplicada por el INSAI, fueron beneficiados al finalizar el período de pruebas de laboratorio para culminar con la inspección postmorten a nivel de matadero, donde se procedió a observar macroscópicamente las lesiones tuberculoides y posteriormente a tomar las muestras para cultivo bacteriológico utilizando el medio de Stonebrink 6,4 y el medio de Lowestein-Jensen. Para descontaminar la muestra se utilizó el método de Ogawa modificado por Kudoh [42]. Cuando las muestras recolectadas de nódulos linfoides o cualquier tejido con lesión sospechosa a TBC presentaban un foco caseoso, se tomó material de este foco directamente con el asa de platino o con un hisopo estéril, y se sembró en el medio de cultivo, descontaminando la muestra por el método indicado anteriormente, pero cuando la muestra seleccionada no presentaba lesión macroscópicamente aparente, se cortó la muestra en pequeños trozos con un bisturí, para posteriormente colocar dichos trozos en un mortero con arena lavada estéril agregándole de 2 a 3 mL de fosfato trisódico al 10% para proceder al macerado del tejido, luego se procedió a descartar el sedimento para obtener el jugo del macerado, a este jugo obtenido se le añadieron de 4 a 5 mL más de fosfato trisódico al 10% y se dejó en reposo por 24 horas en un tubo de ensayo.
Posteriormente se procedió a la descontaminación por el método de Ogawa modificado por Kudoh, utilizando NaOH al 4% por 2 min. La siembra se realizó por triplicado, inmediatamente después de la descontaminación, utilizando dos tubos de medio de Stonebrink y un tubo de medio de Lowestein-Jensen. Los tubos se incubaron a 37°C durante 8 semanas, evaluando los tubos sembrados diariamente la primera semana y después, una vez a la semana por las restantes 7 semanas. Cuando aparecieron las colonias de crecimiento sobre los medios sembrados, se hicieron frotis, los cuales fueron coloreados con Ziehl Nielsen para poder determinar así la presencia de bacilos ácido alcohol resistente (BAAR). A todos aquellos cultivos donde se observaron BAAR, se les realizaron las siguientes pruebas bioquímicas: catalasa, reducción de nitratos y pirasinamida para identificar M. bovis. Las colonias identificadas como M. bovis fueron confirmadas por PCR [42].
Prueba de PCR confirmatoria: A los cultivos bacterioló- gicos positivos y a los tejidos con lesiones positivas o negativas se les extrajo ADN utilizando 2 µL de proteinasa K (concentración final 0,2 mg/mL), los tubos se incubaron toda la noche a 42°C. La actividad enzimática se detuvo con etanol refrigerado por 10 min. El tejido de residuo se eliminó por centrifugación a 3.000 g por 10 min. El ADN fue aislado del sobrenadante con fenol- cloroformo alcohol isoamil, seguido de una precipitación con etanol, el ADN fue suspendido en 50 µL de agua y una aliquota de 1 µL se utilizó para la prueba de PCR secuencia específica. Una vez obtenido el ADN se procedió a montar la PCR utilizando los iniciadores que detectan el complejo tuberculoso (complejo M. tuberculosis) conformado por las sondas IS6110 cuyas secuencia son: CTCGTCCAGCGCC GCCTTCGG y CCTGCGAGCGTAGGCGTCGG. Los iniciadores utilizados para identificar la bacterias del complejo de M. tuberculosis (M. tuberculosis, M. bovis, M. microti, M. africanum) amplifica un fragmento de 123-pb de la secuencia de inserción IS6110 [12]. Las condiciones de amplificación de los iniciadores incluye una desnaturalización a 94°C por 10 min., 50 ciclos de 60 seg a 94°C, 15 seg a 65°C y 60 seg a 72°C, con una extensión final a 72°C. Los productos de amplificación fueron analizados por electroforesis a razón de 15 µL de muestra en azarosa 1,5% marcada con bromuro de etidium. Todas las muestras que produjeron una banda del tamaño indicado fueron comparadas con el marcador de peso molecular para declararla positiva. Las muestras que revelaron bandas en otra posición o la ausencia de bandas se consideraron negativas.
PPD-B y PPD-A: Al total de animales descartados por el INSAI, utilizando como herramienta la prueba Oficial simple de tuberculina y transcurrido el periodo de desensibilización reglamentario de 60 días, se les aplicó la prueba comparativa de la tuberculina con el PPD avium (Tuberculina PPD-avium 25000 UI/M1) y PPD-bovis (Tuberculina PPD-bovino 50000 UI/M1; CSL Veterinaria, 45 Poplar Road, Parkville) (PPD bovino BIT de BOVIGAN; CSL, Veterinaria División, Victoria, Australia para detectar infección con M. bovis y M. avium subsp. partuberculosis) [40]. La preparación de PPD es similar a la de la tuberculina; la diferencia está que, en lugar de concentrar las proteínas por acción del calor, se les separa por precipitación con agentes químicos, tales como: el sulfato de amonio o el ácido tricloroacético [42]. De esta manera, se logra producir un producto estandarizado y conservar mejor la estructura proteica original. Tanto las tuberculinas como los PPD contienen además de proteínas, otros antígenos de composición bioquímica variable [5, 32].
El PPD tiene dos ventajas principales sobre la tuberculina preparada en medio sintético, es más específico y puede ser normalizado más fácilmente y con mayor exactitud. A todos los animales se les aplicó la prueba comparativa del PPD, la cual consiste en inocular a nivel de la tabla del cuello, específicamente en el tercio medio de la tabla del cuello, de manera simultánea en dos lugares separados y en el mismo lado del cuello PPD bovino y PPD aviar con 12 cm. de distancia entre las dos aplicaciones, para detectar infección con M. bovis o M avium subsp. partuberculosis., rasurando los sitios de inoculación y midiendo el grosor de la piel con un vernier o un micrómetro previo a la inoculación. Una vez inoculados los PPD, se procedió a la lectura de esta prueba a las 48 horas postinoculación midiendo nuevamente el grosor de la piel con el mismo implemento. Con un aumento mayor de 3 mm con respecto a la primera lectura se tomó al animal como positivo a tuberculosis o paratuberculosis, dependiendo de cuál sitio de inoculación resultó con el aumento del grosor [10].
Prueba de interferón IFN-γγ: A todos los animales se les extrajo 5mL de sangre de la vena yugular utilizando el sistema de venoyect y tubos vacutainer estériles tapa verde que contenían heparina sódica (Venton Dikinson, EUA) antes de ser llevados a matadero. Esta sangre se transportó al laboratorio de Zoonosis del Decanato de Ciencias Veterinarias UCLA a una temperatura de 37°C y en un lapso menor de 18 horas después de tomada la muestra, para realizar la prueba de INF- utilizadas en varios países como prueba oficial de diagnóstico de tuberculosis bovina, que consiste en cultivar 1,5 mL sangre completa por triplicado en placas de cultivo de 24 pozos fondo plano estériles, colocando en el primer pozo como antígeno estimulante 100 µL de Buffer Fosfato Salino (PBS), en el segundo pozo 100 µL de PPB bovino y en el tercer pozo 100 µL de PPD aviar. Esta placa se incuba de 24 a 30 horas a 37°C y con 5% de CO2. Posterior a la incubación, las placas se sacaron de la incubadora y se procedió a recolectar el plasma de cada pozo colocándolos en tubos Eppendorf y tomando por lo menos 300 µL de plasma. Una vez obtenido el plasma se procedió a la detección del INF- utilizando el Kit de BOVIGAN (CSL, Veterinary Division, Victoria, Australia) [41]. Los resultados del diagnóstico se calcularon considerando los promedios de DO450 de las muestras incubadas sin antígeno, con PPD bovino y con PPD aviar de cada animal. Los plasmas incubados con PPD bovino se compararon contra el testigo de IFN-γγ negativo de la prueba [41].
Prueba de ELISA para detección de IgG en suero: Para esta prueba de ELISA-TBC se procedió a tomar 5 mL de sangre de la vena yugular a ambos grupos de animales (positivos o negativos a PPD), utilizando el sistema de venoyect y tubos vacutainer estériles tapa roja sin anticoagulante (Venton Dikinson, EUA), antes de ser llevados a matadero. Estos tubos, una vez obtenidas las muestras, se colocaron en forma inclinada con ángulo de 45° para la formación del bisel que facilitó la extracción del suero sanguíneo. Extraído el suero sanguíneo, las muestras fueron transportadas al laboratorio de Zoonosis a 4°C en cava y con geles refrigerantes. Al llegar al laboratorio, las muestras se congelaron a -20°C hasta finalizar el muestreo.
Posteriormente se procesaron estos sueros aplicando una prueba de ELISA para la detección de IgG contra M. bovis diseñada en el laboratorio (ELISA in house), como lo desarrollaron Lilembaum y col. [15], utilizando como antígeno el PPD bovino (Tuberculina PPD-bovino 50000 UI/M1, CSL Veterinaria, 45 Poplar Road, Parkville, Victoria, Australia) BIT de BOVIGAN (CSL, Veterinaria División, Victoria, Australia) y como conjugado IgG bovina con peroxidasa (SIGMA, EUA) como sustrato se utilizó ABTS (SIGMA, EUA). En la primera exploración se realizó un ELISA simple en la que sólo se empleó el PPD-B (M. bovis). En el segundo muestreo se practicó ELISA comparativo, empleando PPD-B y PPD-A (M. avium). La respuesta de anticuerpos a M. bovis se analizó estableciendo como valor de corte la densidad óptica DO492 promedio más dos desviaciones estándar (DS) (P<0,0005), de un grupo de 30 animales sanos, provenientes de una zona de baja incidencia de tuberculosis bovina (El Vigia, Edo. Mérida), a los cuales se les realizó pruebas de tuberculina y seguimiento en matadero, inspección post mortem y análisis bacteriológico. Todas las pruebas empleadas confirmaron la ausencia de tuberculosis o infección de M. bovis. Como testigo positivo se utilizó suero de bovinos con lesiones y en los cuales se demostró mediante histopatología y aislamiento bacteriológico/PCR, la presencia de M. bovis.
Análisis histopatológico: las lesiones histopatológicas macroscópicas encontradas en matadero, se clasificaron según su ubicación de la manera siguiente:
0. Sin lesiones.
1. Lesiones en cualquiera de los linfocentros retrofaríngeo o mediastínico.
2. Lesiones en ambos linfocentros.
3. Lesiones en uno o ambos linfocentros más pulmón y/o hígado.
Análisis estadístico: Los estudios de asociación RR= ad/bc según Wolf y el X2 fueron aplicados a los datos de la TABLA III. Los valores obtenidos en los estudios comparativos de patrones con lesiones histológicas fueron analizados con la prueba de análisis de correspondencia del paquete estadístico SAS [35].
RESULTADOS Y DISCUSIÓN
Las reacciones tipo de hipersensibilidad retardada están mediada por una población de células o linfocitos T sensibilizados [36]; en tales reacciones se considera que existen componentes específicos y no específicos. El componente específico es dependiente de la interacción entre linfocitos T CD4+ y los macrófagos o las células presentadoras de antígenos, que van a presentar a los antígenos del PPD en asociación al complejo mayor de histocompatibilidad clase II (MHCII). El componente no específico está representado por la liberación de citocinas por los linfocitos T (IFN-γ, TNFα e IL-2) y esas citocinas van a ser responsables por los cambios tisulares observados en la reacción que conllevan a la formación del granuloma [21, 31].
TABLA I PRUEBA COMPARATIVA PPD-B/PPD-A EXPRESADA EN NÚMEROS ABSOLUTOS Y PORCENTAJES
Sólo 50 animales de los 136 evaluados (36,75%) resultaron positivos exclusivamente al PPD-B. Se detectaron 17 de 136 animales positivos al PPD-A lo que representó el 12,5%; 33 de 136 (24,27%) resultaron negativos al PPD-B y al PPD-A, TABLA I.
Este resultado muestra claramente que un gran porcentaje de los animales reactores positivos a la tuberculina, utilizada en las pruebas oficiales, corresponden a reacciones cruzadas con el PPD-avium o falsos positivos, los cuales solo pueden ser evidenciados cuando se utilizan reactivos altamente purificados (PPD-B y PPD-A).
Todas las muestras que resultaron positivas al cultivo bacteriológico del M. bovis (FIG. 1), resultaron igualmente positivas a la prueba de PCR, aplicada al ADN extraído del cultivo de las micobacterias o de lesiones sugestivas de tuberculosis, amplificado con iniciadores específicos del complejo Mycobacterium tuberculosis, IS6110 que incluye al M. bovis (FIG. 1). Todas las muestras negativas al cultivo bacteriológico, provenientes de tejidos involucrados en la infección con M. bovis con o sin lesiones tuberculosas, resultaron negativas a la prueba de PCR anteriormente descrita. Ambas pruebas fueron utilizadas como referencia para el resto de las pruebas.
El ensayo inmunoenzimático para el IFN-γ bovino cuando se utilizó conjuntamente con el sistema de cultivo de sangre completa, resultó en un ensayo in vitro rápido (24 horas) y sensible para detectar la reactividad de la inmunidad mediada por células al M. bovis en el ganado infectado [41]. Animales IFN-γ positivos, PPD-B negativos, con o sin lesiones aparentes de tuberculosis a nivel de matadero, exhibieron cultivos bacterianos positivos a M. bovis. Un 86% de los animales positivos solamente al IFN-γ, remonitoreados en la misma finca durante 20 meses, se tornaron reactivos a la intradermoreacción. Aún cuando la intradermoreacción al PPD-B y el IFN-γ se correlacionan positivamente con cambios patológicos post-infección, el fuerte incremento del IFN-γ, solamente, no siempre está acompañado de severos cambios patológicos. No todos los animales PPD-B+ son INF-+ y viceversa, por lo que pueden separarse en dos grupos o patrones diferentes [23].
FIGURA 1. IDENTIFICACIÓN DE M. bovis PROVENIENTE DE MUESTRAS DE CULTIVO BACTERIOLÓGICO Y/O MUESTRAS DE TEJIDO. A) SE EVIDENCIA LA BANDA QUE DETERMINA EL COMPLEJO M. tuberculosis AL UTILIZAR LA SONDA IS6110. B) MUESTRAS NEGATIVAS

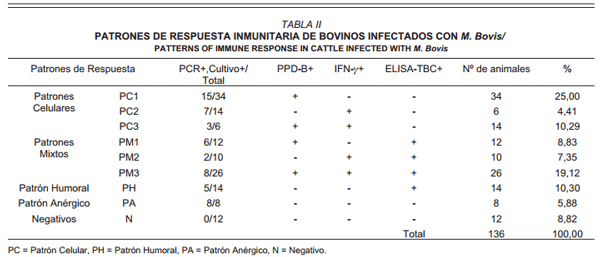
De los resultados obtenidos del total de las pruebas diagnósticas (PPD-B, PPD-A, INF-, ELISA-TBC, cultivo bacteriológico, PCR), realizadas a los diferentes lotes de descarte de la finca, se pudieron evidenciar varios patrones de respuesta inmunitaria. Los patrones observados fueron los siguientes: patrón celular (PC) PPD-B+, INF- correspondiente a una respuesta Th1; patrón humoral (PH), ELISA-TBC+ correspondiente a un patrón Th2; patrón mixto (PM), animales con patrones celulares y humorales en conjunto correspondiente a un patrón Th0. Finalmente, el patrón anérgico (PA) el cual representa los animales positivos a PCR y cultivo bacteriológico, negativos al resto de las pruebas. El PC se dividió en: PC1 exclusivamente PPD-B+, PC2 exclusivamente INF-+ y PC3, PPD-B+ más INF-+, TABLA II.
Las células responsables de la reacción a la tuberculina o al PPD son las células TCD4 inflamatorias, capaces de activar los macrófagos con la secreción de citocinas como el INF- y el TNF formar un granuloma alrededor del inóculo, este corresponde a un patrón de respuesta Th1. El INF-, puede ser producido también por células T y TCD8+ citotóxicas, como lo han demostrado diversos autores en animales infectados con tuberculosis bovina [4, 11, 17, 37].
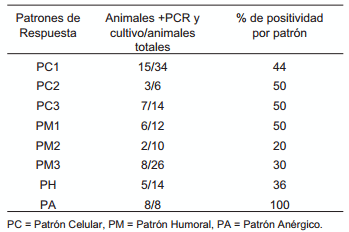
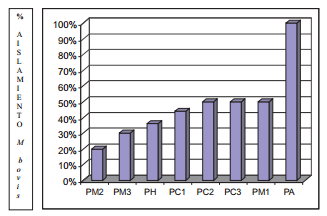
En la totalidad de los patrones de respuesta inmunitaria observados, exceptuando al PA, el porcentaje de positividad en PCR/C TBC osciló entre el 40 y el 50% para los patrones celulares, entre el 20 y el 50% en los patrones mixtos y 36% para el patrón humoral. El patrón anérgico (PA) se refiere exclusivamente a individuos negativos a PPD, IFN-γ y ELISATBC, 100% positivos a cultivo y PCR (TABLA III). Estos resultados, FIG. 2, muestran como los animales con un patrón de respuesta exclusivamente celular, albergan al mayor número de positivos en cultivo/PCR a M. bovis. Aparentemente, los patrones mixtos (humoral más celular) y exclusivamente humorales, contienen el menor número de animales infectados, señalando quizás, que los anticuerpos podrían participan activamente en la eliminación del patógeno. Al contrario de lo reportado, donde se asocian los anticuerpos con progresión de la enfermedad en modelos de laboratorio [18, 38], en condiciones de campo, los patrones que incluyen la presencia de anticuerpos (PH y PM), se encuentran asociados con un RR= 2,22 con ausencia de aislamiento en cultivo del M. bovis, P<0,05.
TABLA II PATRONES DE RESPUESTA INMUNITARIA DE BOVINOS INFECTADOS CON M. bovis
TABLA III RESULTADO DE LAS PRUEBAS CULTIVO/ PCR DE LOS DIFERENTES PATRONES DE RESPUESTA INMUNE
FIGURA 2. EL AISLAMIENTO DEL M. bovis EN CULTIVO, DE LOS DIFERENTES PATRONES DE RESPUESTA INMUNITARIA MUESTRA UNA MENOR CANTIDAD DE ANIMALES REALMENTE INFECTADOS EN LOS QUE INCLUYEN UNA RESPUESTA HUMORAL SOLA O COMBINADA CON UNA RESPUESTA CELULAR. P<0,05 (PM”, PM3 y PH)
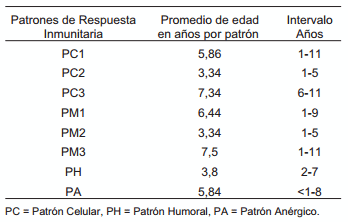
El promedio e intervalo de edades con respecto a cada Patrón de respuesta inmunitaria se muestra en la TABLA IV. Este resultado sugiere que el M. bovis pudiera generar de entrada un Patrón de respuesta Celular (PC2) con producción exclusiva de IFN-γ seguido de uno Humoral (PH), a juzgar por las edades tempranas observadas en ambos Patrones. El patrón de respuesta PC2 con producción exclusiva de IFN-γ, correspondería a una respuesta inicial que involucraría las células T, capaces a su vez de activar la producción de anticuerpos de la clase IgG2a, que pudieran ser utilizados por las células NK para la eliminación temprana de patógenos por intermedio de mecanismos de citotoxicidad celular mediada por anticuerpos [38]. La respuesta inmunitaria pudiera iniciarse, por el contrario, con una respuesta netamente Humoral tipo IgG1, inducida por el patógeno para facilitar su ingreso dentro del macrófago, para luego paralizar su actividad usando mecanismos de evasión propios de bacterias de crecimiento intracelular. Cabe aclarar que el conjugado utilizado fue anti IgG bovino, incapaz de dilucidar entre las sub-clases de IgG [39, 40]. En humanos infectados con Mycobacterium tuberculoso, se observaron individuos PPD negativos, clasificados como Anérgicos (aún cuando no se evaluó la respuesta humoral ni la IL- 10), con altos niveles de IL-4 y muy bajos de IFN-γ, revelando igualmente una fuerte respuesta Th2 [20]. La observación de animales más viejos con patrones PC1 y luego patrones mixtos PM3, que poseen en común la reacción al PPD, indicaría que la infección por M. bovis pudiera dar lugar a una progresión de respuestas que se inicien con patrones celulares TCD4+, hasta activar luego respuestas humorales (IgG1), que finalmente conllevarían a un estado de no respuesta inmunitaria absoluta o anérgia. Estos patrones mixtos celulares y humorales TH0, han sido previamente descritos asociados a cuadros patógenos de tuberculosis [31]. El PA sin embargo, pudiera llegar a instalarse de manera temprana, mediado por algunas cepas altamente patógenas, que bloquearían de entrada, todo tipo de respuesta inmunitaria o por el contrario, corresponder a animales tolerantes, provenientes de vacas positivas, permanentemente infectadas, no detectadas por las pruebas tradicionales. Todo esto, a juzgar por la observación de algunos animales anérgicos, menores de 1 año de edad, con lesiones tuberculosas, positivos en cultivo y PCR al M. bovis (Intervalo años, TABLA IV).
TABLA IV PROMEDIO E INTERVALO DE EDADES DE CADA UNO DE LOS PATRÓN DE RESPUESTA INMUNITARIA
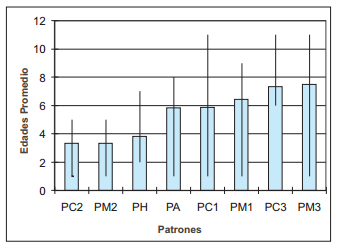
La FIG. 3 permite observar la aparición de los diferentes patrones de respuesta inmunitaria a medida que aumenta la edad de los animales infectados con M. bovis.
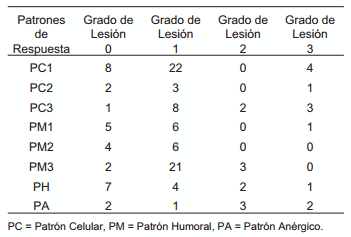
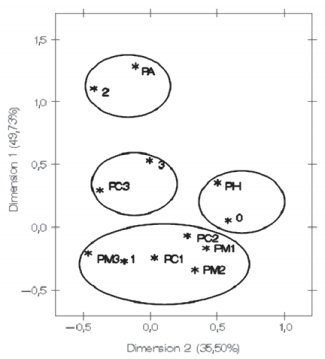
La distribución del número de animales por cada patrón según el grado de lesión histopatológica se visualiza en la TABLA V. Este resultado refuerza lo observado anteriormente cuando se midieron los porcentajes de positividad en cultivo y PCR de los diferentes patrones de respuesta inmunitaria confirmando que, en la defensa inmunitaria frente al M. bovis, participarían, tanto la defensa celular como la defensa humoral. Las lesiones más severas se observaron en los patrones celulares y humorales separadamente, no así en los patrones mixtos (PM) [25]. Los patrones celulares muestran 14,8% de lesiones grado 3 contra 7% del patrón humoral y 2% observado en los patrones mixtos. Esta correspondencia pudo ser demostrada estadísticamente. El análisis de correspondencia mostró una asociación del grado de lesión *1 con la mayoría de patrones mixtos, los grados de lesión *2 y *3 estuvieron presentes en PC3 Y PA (ELISA-TBC -). El Patrón humoral se ubicó más cerca del grado de lesión *0, FIG. 4.
FIGURA 3. LOS PATRONES PC2, PM2 Y PH, TODOS PPD-B(-) SE OBSERVAN A EDADES TEMPRANAS. PC1, PM1, PC3 Y PM3, PPD-B(+) APARECEN EN ANIMALES MAYORES DE 5 AÑOS. EL PA (NO RESPUESTA) PUEDE ENCONTRARSE EN ANIMALES < 1 AÑO HASTA 8 AÑOS
TABLA V DIFERENTES GRADOS DE LESIONES HISTOPATOLOGICAS OBSERVADOS EN ANIMALES INFECTADOS CON DIFERENTES PATRÓNES DE RESPUESTA INMUNITARIA
FIGURA 4. EL ANÁLISIS DE CORRESPONDENCIA MOSTRÓ UNA ASOCIACIÓN DEL GRADO DE LESIÓN *1 CON LA MAYORIA DE PATRONES MIXTOS, LOS GRADOS DE LESIÓN *2 Y *3 ESTUVIERON PRESENTES EN PC3 Y PA (ELISA-TBC -). EL PATRÓN HUMORAL SE UBICÓ MÁS CERCA DEL GRADO DE LESIÓN *0
Las pruebas moleculares no permitieron demostrar diferencias estructurales entre las diferentes cepas de M. bovis aisladas en este estudio. Recientemente, se han logrado agrupar cepas de M. bovis en base a las secuencias nucleotídicas obtenidas por oligotipeajes, específicamente, utilizando las técnica de Spolygotiping. Estas pruebas muestran una variedad importante de cepas de M. bovis en aislamientos realizados en varias fincas ubicadas en una misma región [13, 21]. Esto pudiera dar pie a especular hasta que punto cada una de esas cepas induciría respuestas inmunitarias diferentes, estableciendo los distintos patrones observados en estos rebaños, situación a ser evaluada en posteriores estudios [19].
Aparentemente, la respuesta inmune a la tuberculosis bovina es multifacética y los parámetros diagnósticos pueden ser utilizados para identificar patrones de respuesta inmunitaria y progresión de la enfermedad. La participación de otros factores, tales como el genotipo y la edad del animal así como la presencia de infecciones recurrentes y la virulencia de cepas particulares de M. bovis, pudieran influenciar la respuesta inmunitaria y de igual manera, el rendimiento de las pruebas diagnósticas fundamentadas en la respuesta inmune celular.
CONCLUSIONES
Un gran número de animales positivos a la tuberculina resultaron falsos positivos en las pruebas de cultivo y PCR, probablemente relacionados con reacciones cruzadas a otras micobacterias.
Se pudieron observar varios patrones de respuesta inmunitaria agrupados en: patrones exclusivamente celulares (Th1), mixtos (celulares y humorales) y humorales (Th2).
Igualmente se evidenciaron animales anérgicos, positivos en cultivo/PCR, negativos al resto de las pruebas de respuesta celular y humoral. El patrón anérgico observado en animales menores de 1 año de edad podría corresponder a animales tolerantes, provenientes de vacas infectadas con M. bovis, no detectadas en el rebaño por las pruebas convencionales (anérgicas terminales).
Algunos patrones de respuesta pueden iniciarse a muy temprana edad o ser producto de una progresión de la enfermedad.
Los patrones inmunitarios mixtos parecen resolver la infección mejor que los patrones humorales o celulares por separado lo que confirmaría la participación de los anticuerpos también, en la defensa contra la tuberculosis bovina.
AGRADECIMIENTO
Este estudio fue realizado con recursos provenientes del laboratorio de Tuberculosis, Instituto de Biomedicina, Caracas, Venezuela.
REFERENCIAS BIBLIOGRÁFICAS
[1] ADAMS, L. In vitro diagnosis of Mycobacterium bovis infection. Rev. Sci. Tech. OIE 20: 304-324. 2001.
[2] BLOOD, D.; HENDERSON, J. Mycobacterium tuberculosis, Medicina Veterinaria. 6ta Ed. Editorial Interamericana. México D. F. 691-701pp. 2000.
[3] BOUSSIOTIS, V.; TSAI, E.; YUNIS, E.; THIN, S.; DELGADO, J.; DASCHER, C.; BEREZOVSKAYA, A.; ROUSSET, D.; REYNES, J.; GOLDFELD, A. IL-10 producing T-cells suppres immune responses in anergic tuberculosis patients. J. Clin. Invest. 105: 1317-1325. 2000.
[4] BUKOWSKI, J; MORITA, C; BRENNER, M. Human T-cells recognize alkylamines derived from microbes, edible plants, and tea: implications for innate immunity. Immun. 11:57-65. 1999.
[5] BURRELLS, C.; INGLIS, N.; DAVIES, R.; SHARP, J. Detection of specific T Cell reactivity in sheep infected with Mycobacterium avium subspecies silvaticum and paratuberculosis using two defined mycobacterial antigens. Vet. Immunol. Immunopathol. 45: 311-320. 1995.
[6] CASSISY, J.; BRYSON, D.; CANCELA, M.; FOSTER, F.; POLLOCK, J.; NEILL, S. Lymphocyte subtypes in experimentally induced early – stage bovine tuberculous lesions. J. Comp. Pathol. 124: 46-51. 2001.
[7] CONTRERAS, J. Enfermedad de los Bovinos causada por Agentes Virales, Bacterias, Rickettsiales y Protozoarias: Diagnóstico, Tratamiento y Control. 2a Ed. Editorial Bogue, Barquisimeto-Venezuela: 405-420 pp. 1996.
[8] DABORN, C.J.; GRANGE, J.M. HIV AIDS and its implications for the control of animal tuberculosis, Br. Vet. J.149: 405-417. 1993.
[9] FERNÁNDEZ DE M., I.G; PÉREZ DE LA L. J.M.; AYOUBI, P.; NARANJO, V.; KOCAN, K.; CHRISTIAN, G, C.; DE LA FUENTE, J.; Differential expression of inflammatory and immune response genes in mesenteric lymph nodes of Iberian red deer (Cervus elephus hispanicus). Develop & Compar Immunol. 32(2): 85-91. 2008.
[10] HANNA, J.; NEIL, S.; O´BRIEN, J. Use of PPD and phosphate antigens in an ELISA to detect the serological response in experimental bovine tuberculosis. Res. Vet. Sci. 47: 43-47. 1987.
[11] KENNEDY, H.; WELSH, M.; BRYSON, D.; CASSIDY, J.; FOSTER, F.; HOWARD, C.; COLLINS, R.; POLLOCK, M. Modulation of immune responses to Mycobacterium bovis in cattle depleted of WC1 (+) gamma delta T-cells. Infect. Immun. 70: 1488-1500. 2002.
[12] LIEBANA, E.; ARANAZ, A.; DOMINGUEZ, L.; MATEOS, A.; LLAMAZARES, O.; FERR, E.; DOMINGO, M.; VIDAL, D.; COUSINS, D. The insertion element IS6110 is a useful tool for DNA fingerprint of Mycobacterium bovis isolates from cattle and goats in Spain. Vet. Microbiol. 54: 223-233. 1997.
[13] LIEBANA, E.; ARANAZ, A.; ALDWELL, F.; McNAIR, J.; NEILL, S.; SMYTH, A.; POLLOCK, M. Cellular interactions in bovine tuberculosis: release of active mycobacteria from infected macrophages by antigen- stimulated Tcells. Immunol. 99: 23-29. 2002.
[14] LIGHTBODY, K.; McNAIR, J.; NEILL, S.; POLLOCK, M. IgG isotype antibody responses to epitopes of the Mycobacterium bovis protein MPB70 in immunized and in tuberculin skin test-reactor cattle. Vet. Micro. 75: 177-188. 2000.
[15] LILENBAUM, W.; RIBEIRO, E.R.; SOUZA, G.N.; MOREIRA, E.C.; FONSECA, L.S.; FERREIRA, M.A.; SCHETTINI, J.S. Evaluation of and ELISA – PPD for diagnosis of bovine tuberculosis in field trials in Brazil. Res. in Vet. Sci. 66: 191-195. 1999.
[16] LYASHCHENCO, K.; POLLOCK, J.; COLANGELI, R.; GENNARO, M. Diversity of antigen recognition by serum antibodies in experimental bovine tuberculosis. Immune. 66: 5344- 5349. 1998.
[17] MAK, T.; FERRICK, D. The T-cell bridge: Linking innate and acquired immunity. Nat. Med. 4: 764-765. 1998.
[18] McNAIR, J.; CORBETT, D.; GIRVIN, R.; MACKIE, D.; POLLOCK, J. Characterization of the early antibody response in bovine tuberculosis: MPB83 is an early target with diagnostic potential. Scand. J. Immunol. 53: 365- 371. 2001.
[19] MICHEL, A.; HLOKWE, T.M.; COETZEE, M.L.; MARÉ L.; CONNOWAY, L.; RUTTEN, V.P.M.G.; KREMER, K. High Mycobacterium bovis genetic diversity in a low prevalence setting. Vet. Microbiol. 126(1-3): 151-159. 2008.
[20] MONTIEL, M.; RIVERA, S.; HERNÁNDEZ, R.; HASSANHI, M.; VARGAS, F.; NUÑEZ, J. Respuesta Inmunitaria y Anergia. Estudio en pacientes Tuberculosos del Hospital Universitario de Maracaibo, Venezuela. Acta Científ. Venez. 53(1): 36-43. 2002.
[21] MORRIS, R.; PFEIFFR, D.; JACKSON, R. The epidemiology of Mycobacterium bovis infections. Vet. Microbiol. 40: 153-177. 1994.
[22] NEIL, S.D.; BRYSON, D.G.; POLLOCK, J.M., Pathogenesis of tuberculosis in cattle. Tubercul. 81: 79-86. 2001.
[23] NEILL, S.; CASSIDI, J.; HANNA, J.; MACKIE, D.; POLLOCK, J.; CLEMENTS, A.; WATON, E.; BRYSON, D.; O´BRIEN, J. Detection of Mycobacterium bovis infection skin test-negative cattle with an assay for bovine interferon-gamma. Vet. Rec. 135: 134-135. 1994.
[24] O’NUAALLAIN, E.; DAVIS, W.; COSTELLO, E.; POLLOCK, J.; MONAGAN, M. Detection of Mycobacterium bovis infection in cattle using an immunoassay for bovine soluble interleukin-2 receptor-alpha (sIL-2R alpha) produced by peripheral blood T-lymphocytes following incubation with tuberculin PPD. Vet. Immunol. Immonopathol. 56: 65-76. 1997.
[25] PHILLIPS, C.; FOSTER, C.; MORRIS, P.; TEVERSON, R. The transmission of Mycobacterium to cattle. Res. Vet. Sci. 74: 1-15. 2003.
[26] POLLOCK, J.; ANDERSEN, P. The potential of the ESAT-6 antigen secreted by virulent Mycobacteria for specific diagnosis of tuberculosis. J. Inf. Dis. 175: 1251- 1254. 1997.
[27] POLLOCK, J.; POLLOCK, D.; CAMPBELL, D.; GIRVIN, R.; CROCKARD, A.; NEILL, S.; MACKIE, D. Dynamic change in circulating and antigen- responsive T-cell subpopulations post- Mycobacterium bovis infection in cattle. Immunol. 87: 236-241. 1996.
[28] POLLOCK, J.; WELSH, J.; Mc NAIR, J.Immune response in bovine tuberculosis: Towards new strategies for the diagnosis and control of disease. Vet. Immunol. Immonopathol. 108: 37-43. 2005.
[29] RITACCO, V.; LÓPEZ, B.; DEKANTOR, I.; BARRERA, L.; ERRICO, F.; NADER, A. Reciprocal cellular and humoral immune –responses in bovine tuberculosis. Res. Vet. Sci. 50: 365-367. 1991.
[30] ROTHEL, J.; JONES, S.; CORNER, L.; COX, J.; WOOD, P. The gamma – interferon assay for diagnosis of bovine tuberculosis in cattle: Conditions affecting the production of gamma-interferon in whole blood culture. Aust. Vet. 69: 1-4. 1992.
[31] SCHLUGER, N.; ROM, W. The Host Immune Response to Tuberculosis, Am. J. Respir Crit. Care Med. 157: 679- 691. 1998.
[32] SHIRAKAWA, T.; ENOMOTO, T.; SHIMAZU, S.; HOPKIN, J. The Inverse Association between Tuberculin Response and Atopic Disorder. Sci. 275: 77-79. 1997.
[33] SKINNER, M.; PARLANE, N.; McCARTHY, A.; BUDDLE, B. Cytotoxi T-cell responses to Mycobacterium bovis during experimental infection of cattle with bovine tuberculosis. Immunol. 110: 234-241. 2003.
[34] SMYTH, A.; WELSH, M.; GIRVIN, M.; POLLOCK, J. In Vitro Responsiveness of T Cells from Mycobacterial Bovis-Infected Cattle to Mycobacterial Antigens: Predominant Involvement of WC1 + Cells. Infection and Immun. 69(1): 89-96. 2001.
[35] STATISTICAL ANALISYS SYSTEM INSTITUTE (SAS). SAS/STAT User´s Guide. 8.2 Ed, Cary, NC. 2001.
[36] VORDERMEIER, H.; CHAMBERS, M.; COCKLE, P.; WHELAN, A.; SIMMONS, J.; HEWINSON, R. Correlation of ESAT-6-specific gamma interferon production with pathology in cattle following Mycobacterium bovis tuberculosis. Infect. Immun. 70: 3026- 3032. 2002.
[37] WEDLOCK, N.; ALDWELL, F.; COLLINS, D.; DE LISLE, G.; WILSON, T.; BUDDLE, B. Immune Responses Induced in Cattle by Virulent and Attenuated Mycobacterium Bovis Strins: Correlation of Delayed- Type Hypersensitivity with Ability of Strains To Grow in Macrophages. Infect and Immun. (5)2172-2177. 1999.
[38] WELSH, M.; CUNNINGHAM, R.; CORBETT, D.; GIRVIN, R.; McNAIR, J.; SKUCE, R.; BRYSON, D.; POLLOCK, J. Influence of pathological progression of the balance between cellular and humoral immune response in bovine tuberculosis. Immunol. 114(1): 101-111. 2005.
[39] WHIPPLE, D.; BOLIN, C.; DAVIS, A.; JARNAGIN, J.; JOHNSON, D.; NABOR, R.; PAYEUR, J.; WILSON, A.; WOLF, M. Comparison of the sensitivity of caudal fold skin teste and a commercial -interferon assay for diagnosis of bovine tuberculosis. Am. J. Vet. Res. 56(4): 415-419. 1995.
[40] WOOD, P.; CORNER, L.; ROTHEL, J.; RIPPER, J.; FIFIS, T.; McCORMICK, B.; FRANCIS, B.; MELVILLE, L.; SMALL, K.; DE WITTE, K.; TOLSON, J.; COX, J. A field evaluation of serological and cellular diagnosis test for bovine tuberculosis. Vet. Microbiol. 31: 71-79. 1992.
[41] WOOD, P.; ROTHEL, J. In vitro immunodiagnostic assays for bovine tuberculosis. Vet. Microbiol. 40: 125- 135. 1994.
[42] YZQUIERDO, S.; MEDEROS, L.; DÍAZ, A.; ECHEMENDIA, M.; MONTORO, E. Manual de Procedimientos para el Diagnóstico de la Tuberculosis y otras Micobacteriosis. Laboratorio Nacional de Referencia e Investigaciones e Tuberculosis y Mycobacterias. La Habana, Cuba. 124-212 pp. 1997.