Fisiopatología del Puerperio Bovino
Publicado: 24 de abril de 2012
Por: Dr. De Luca Leonardo, Profesor titular de la Cátedra de Producción Lechera de la Universidad Nacional de Lomas de Zamora (B.A.) (Director Técnico Laboratorios Burnet SA)
Definición de los problemas inherentes al período post parto
Se define al puerperio como el período que comienza después de la expulsión de los anexos fetales y finaliza con la instauración de una nueva ovulación con celo visible, en la cual la preñez puede ser restablecida.
La involución uterina está por supuesto totalmente completa, cuando es posible restablecer una nueva gestación, para ello el eje hipotalámico-hipofisario-ovárico debe funcionar normalmente para conducir al tan esperado celo ovulatorio post parto, con la formación de un cuerpo lúteo de vida media normal y así permitir, no solo la concepción sino también el mantenimiento de la nueva gestación en un medio uterino totalmente sano, esto es imprescindible para desarrollar el fenómeno denominado, "reconocimiento útero maternal", de esta manera el "conceptus" derivará en un embrión y feto normal.
Es sumamente importante conocer todos los fenómenos que se desarrollan con relación a la involución uterina, que es en definitiva, la etapa siguiente al clímax del gran evento que significa el período gestacional para las vacas de alta producción. Entender correctamente este período puede evitar muchos trastornos reproductivos a veces irrecuperables.
Una demora en la recuperación uterina a veces interfiere gravemente con la posibilidad de un servicio temprano en las vacas de leche, alargando enormemente los intervalos parto-parto, que en definitiva, es la consecuencia de un intervalo Parto-Preñez excesivamente largo. Es esta una de las causas más frecuentes que causan las mayores pérdidas económicas en la explotación tambera.
Antes de iniciar a fondo el estudio de la Fisiopatología del puerperio, es conveniente repasar someramente la fisiología del desencadenamiento del parto.
FISIOLOGÍA DEL PARTO
Todas las modificaciones endocrinas que se producen durante la gestación o preñez, tienen por objeto el nacimiento de un feto viable, la expulsión de las membranas fetales, el inicio de la lactogénesis, y por último la involución uterina.
Para que el parto sea factible y normal, deberán producirse a nivel del aparato genital, una serie de modificaciones que permitan la expulsión fetal, a saber: relajación de la vulva, vagina, cuello uterino y transformación de un miometrio sometido a lapasividad en un músculo activo.
Se sabe que 48 horas antes del parto, se producen notables modificaciones en el perfil hormonal del bovino gestante. Durante mucho tiempo se le atribuyó una importancia decisiva a la caída brusca de la progesterona y al ascenso de los estrógenos (inversión de la relación estrógeno/progesterona), con lo cual el desencadenamiento del parto dependía exclusivamente de la gestante.
Sin embargo la acumulación de nuevos estudios, como por ejemplo: el ascenso de los corticoides; el pico de la prolactina, la descarga de oxitocina y de PGF2alfa, llevan indudablemente a la modificación del concepto original.
Mecanismos que intervienen en el desencadenamiento del parto:
1- Eje hipotalámico-hipofisario-ovárico
2- Gestágenos y estrógenos en la unidad feto-placentaria y ovario.
3- Prostaglandinas específicas PGF2alfa.
4- Oxitocina.
Veamos alguna evidencia:
Eje Hipotalámico-Hipofisario Adrenal Fetal
- La hipofisectomía en el feto demora o impide el parto normal.
- La adrenalina en el feto, demora o impide el parto normal.
- Las adrenales en el feto, tanto "in vivo", como "in vitro" son sensibles a la estimulación por ACTH.
- La concentración de cortisol en el plasma fetal antes del parto es más elevada que en el plasma materno, en un momento que en esta se observan niveles basales.
- La infusión de ACTH o cortisol en el feto desencadena el parto.
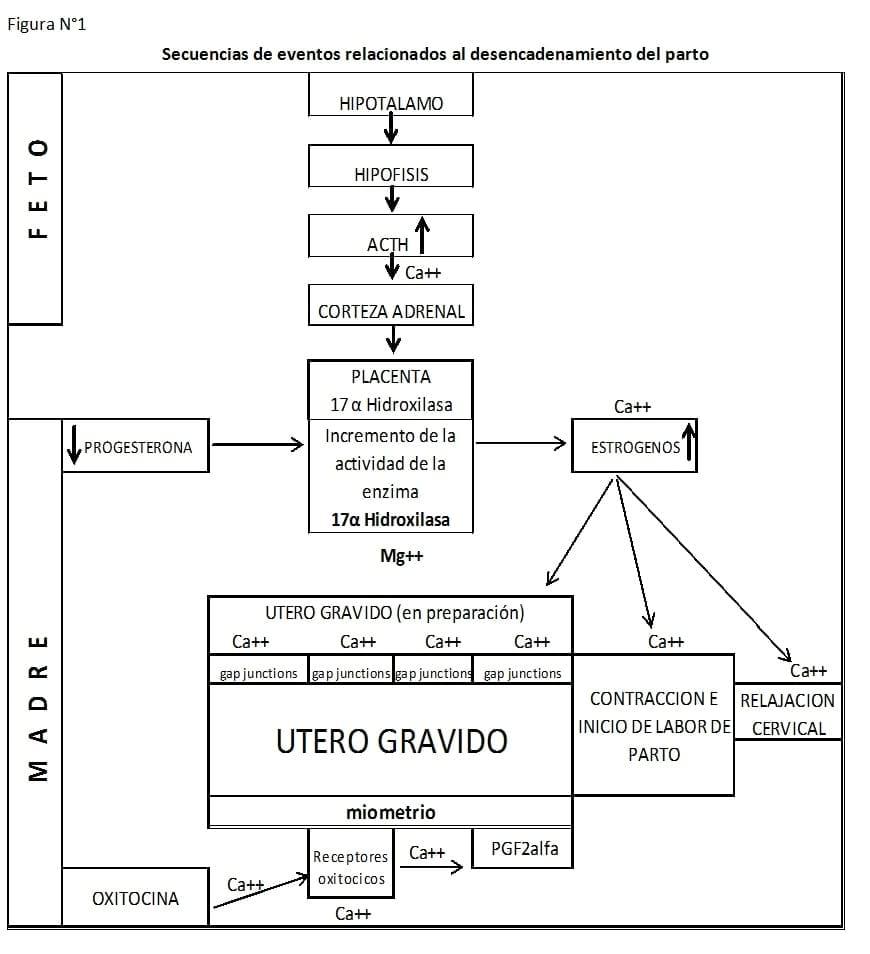
De lo expuesto anteriormente se puede deducir la gran importancia de la integridad del eje hipotalámico-hipofisario-adrenal y la elevación del nivel de corticoides en el plasma fetal para el desencadenamiento del parto.
Gestágenos y Estrógenos en la Unidad Feto Placentaria y en el Ovario
- Caída brusca del nivel de progesterona de 1 a 2 días previos al parto.
- Ascenso rápido del nivel estrogénico, que cae a niveles basales a las 5 (cinco) horas post parto.
- Desaparición del bloqueo progestacional, sobre la contractilidad del miometrio.
- Inversamente "sensibilización" estrogénica del miometrio hacia las sustancias que producen su contracción.
- Luteolisis, sabiendo que el cuerpo lúteo bovino es la principal fuente de progesterona durante la gestación.
Con estos ejemplos podría concluir la constancia de la inversión en la relación progesterona / estrógeno de aparición permanente los días previos al parto.
Prostaglandinas (PGF2 alfa).
- Presencia de sustancias que inducen la contracción del miometrio, en el líquido corio-alantoideo.
- Sustancias que inhiben la contracción uterina en el líquido amniótico.
- Pico de PGF2alfa con relación al descenso brusco de la progesterona.
- Niveles elevados y sostenidos de PGF2 alfa hasta los 10 a 20 días post parto.
- Elevada concentración de PGF2alfa en la membrana corioalantoidea, cotiledones, y miometrio, pero no en el endometrio o Amnios.
Oxitocina
- Aumento de la sensibilidad del miometrio a la oxitocina, en presencia de estrógenos.
- Reacción inversa con los gestágenos.
- Descarga oxitócica por dilatación del cérvix y la vagina (reflejo de Ferguson).
- Niveles bajos de oxitocina, de acción permisiva durante el trabajo de parto.
- Niveles elevados de oxitocina durante la fase de expulsión.
- Niveles elevados de Neurofisina en el plasma fetal.
Con todos estos elementos, se pueden postular una secuencia de eventos endocrinos, que en definitiva conducen al parto. Estos serían los siguientes:
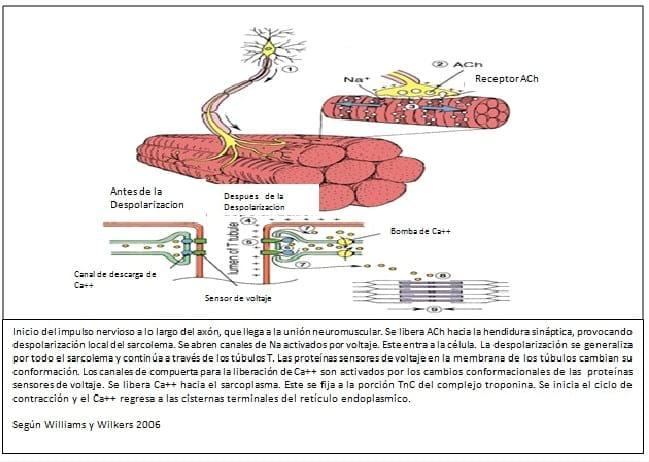
1. Descarga de oxitocina y vasopresina en la neurohipofisis fetal postulado como una secuela de hipoxia a nivel del SNC (Sistema Nervioso Central) del feto.
2. La vasopresina actúa como factor de liberación corticotropa induciendo la descarga de ACTH hipofisaria fetal. Es decir el péptido vasopresina sería específicamente el ACTH RH que es el factor liberador hipotalámico.
3. La ACTH fetal actuaría sobre la adrenal descargando una importante cantidad de cortisol (nivel fetal mayor que el materno).
4. Este cortisol actuando sobre la placenta, aumenta la concentración de la enzima 17 hidroxilasa, fundamental para realizar la conversión de progesterona en estrógenos que es el primer descenso del nivel progesterónico. Esta progesterona es producida inicialmente en el corioalantoides y luego a nivel amniótico. Esta fase de cambio endocrino es fundamental para decidir el día de parto. Si en este momento ocurriese cualquier alteración ya sea en el ámbito materno como fetal el parto no se desencadena, o lo hace tan demorado que pone en peligro al feto en primer lugar, y en muchos casos a la madre. (ver Figura N° 1)
Esta secuencia permite deducir que los casos de partos demorados, o gestaciones excesivamente largas son originados por hipoplasia adrenal fetal de origen genético, inducidas la mayoría de las veces por el toro padre del feto o por un imbreeding muy cerrado, no difícil de hallar cuando los servicios se otorgan sin tomar en cuenta los ancestros.
Además cualquier alteración a nivel placentario del tipo infeccioso, como una placentitis aguda provocada por cualquier agente específico tendría un efecto acelerante del parto, a veces de uno a dos meses. El origen de este adelanto no solo puede ser originado por trastornos en la nutrición materna fetal, sino a síntesis precoz de Prostaglandinas endometriales, causada por diversas endotoxinas bacterianas que tienen específica acción sobre la Adenilciclasa, y así elevar los tenores de Prostaglandin Sintetasa.
5. Simultáneamente los estrógenos y bajos niveles de oxitocina favorecen la descarga de PGF2alfa con efecto luteolítico e iniciación de la labor del parto (Segundo y brusco descenso del nivel progesterónico). (ver Figura N° 1)
Es relevante destacar ahora la importancia de estas sustancias ubicuitarias, denominadas prostaglandinas, que tanta preponderancia tienen en los sucesivos eventos que se precipitan, tales como el parto, la secundinación y el puerperio.
Las prostaglandinas son derivadas del ácido Araquidónico, transformándose éste en un primer paso en Ácido Prostanoico, por la Prostanoico Sintetasa. Este Ácido Prostanoico bajo los efectos de la enzima Ácido Graso Oxigenasa (Zinc y Vit. A dependiente), forma un Endoperóxido, que es el paso fundamental en la formación del ciclo pentagonal característico.
La síntesis uterina de las prostaglandinas es un fenómeno interesantísimo.
Dominado por la progesterona (P4) en la fase luteínica, o durante la gestación; en el endometrio ocurren dos hechos muy significativos:
1. Acumulación de lípidos.
2. Inhibición de los receptores correspondientes al Estradiol 17 Beta.
2. Inhibición de los receptores correspondientes al Estradiol 17 Beta.
Cuando la progesterona actúa durante 10 días en un útero cíclico o sobre el final de la preñez, los receptores al estradiol vuelven a ser estimulados, y los receptores progesterónicos van desapareciendo paulatinamente.
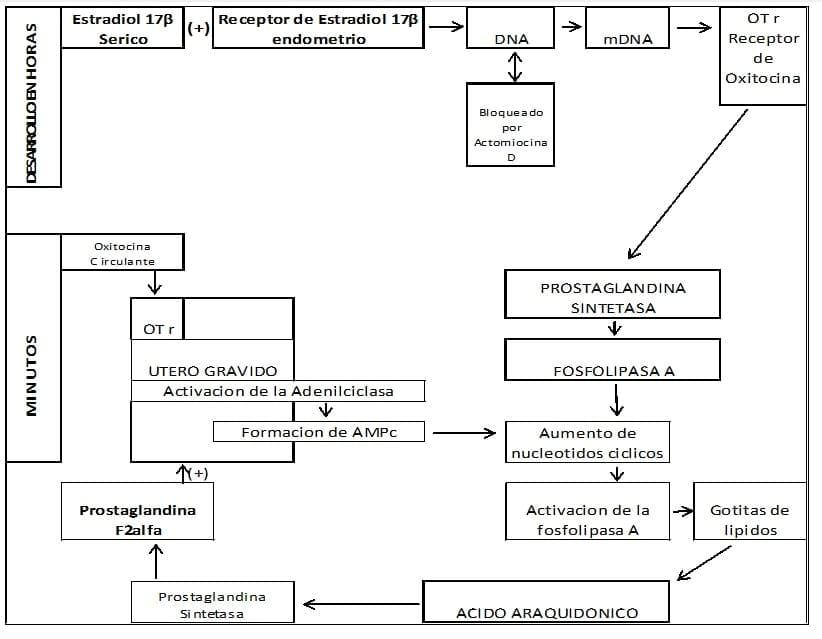
El Estradiol circulante, interacciona con sus receptores citoplasmáticos en las células endometriales y luego de una latencia de 4 a 8 horas, (síntesis proteica del DNA y RNA m) elabora los receptores para la oxitocina, que a su vez interaccionan con la oxitocina circulante, activando la Adenilciclasa y consecuentemente la Fosfolipasa A2.
La Fosfolipasa liberará el Ácido Araquidónico, que por vía Prostaglandin Sintetasa elaborará la PGF2 alfa. (Prostaglandina F2 alfa). (Ver Figura N° 2)
3. En el momento de la expulsión, descarga de niveles elevados de oxitocina y PGF2alfa, responsables entonces de la expulsión fetal y posterior de las membranas fetales en presencia de un medio iónico adecuado. (Niveles de Calcio iónico a nivel del agua intersticial del músculo liso). Se verá la importancia que tienen los niveles de este mineral en la contractilidad miometrial, desprendimiento vellosidades coriales-cotiledones y por fin secundinación.
En definitiva, una vez que las señales del parto han pasado a la madre desde la placenta, el mismo depende de las contracciones rítmicas y coordinadas del músculo liso uterino y de las contracciones involuntarias de los músculos abdominales, como así también de la relajación y apertura del canal cervical.
En la etapa tardía de la preñez el útero no estimulado tiene contracciones asincrónicas, no coordinadas; estas arritmias espontáneas alternan episodios de inactividad, con otros de muy prolongada actividad en el segmento uterino que contiene el feto. Esto es posible cuando el nivel de Ca++ es el adecuado.
Con la proximidad de la etapa de expulsión; la frecuencia, amplitud, propagación y coordinación de los impulsos eléctricos asociados con las contracciones uterinas aumentan, debido al establecimiento de acoplamientos o nexos muy firmes entre las células, denominadas Gap Junction (GJ).
Las Gap Junction aumentan entre las células del músculo liso antes, durante e inmediatamente después de la inducción y el parto. Estos contactos especializados (célula a célula) bajan la resistencia a la corriente del flujo eléctrico, coordinan y sincronizan la actividad muscular uterina en el inicio del parto.
Los esteroides elevados, 17 Beta Estradiol y las Prostaglandinas F2alfa, inician la formación de estas GJ. El constante aumento de los estrógenos y la elevación de la relación Estrógeno/Progesterona estimulan junto a las PG la formación de estas uniones fundamentales en la contractilidad uterina sincronizada.
Es importante estudiar la estructura de los componentes del músculo liso uterino para comprender ciertas patologías, que de otra manera sería difícil definir.
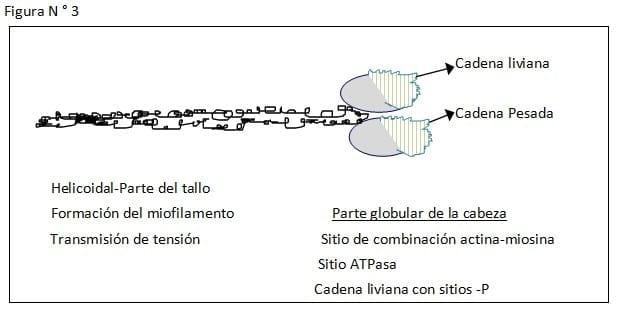
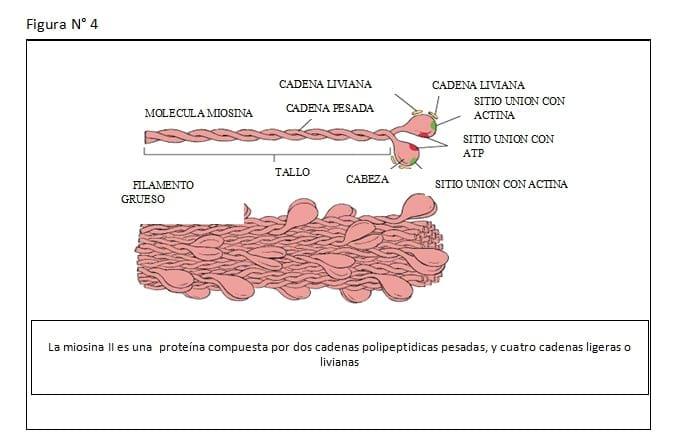
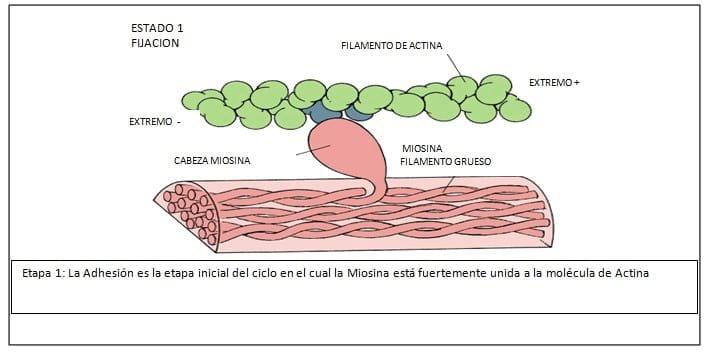
Lo primero sería considerar la estructura de la Miosina, que es la principal proteína de la contracción muscular.
Es una proteína de cerca de 1600 armstrong de longitud, con un peso molecular de aproximadamente 500.000 daltons. El músculo liso está compuesto por dos cabezas pesadas de 200.000 daltons cada una, y dos largas cadenas de 20.000 daltons y 15.000 daltons respectivamente. La Miosina tiene dos partes: cabeza y tallo. La cabeza globular es la localización de tres sitios importantes.
1. El sitio de combinación con la Actina, donde la Miosina y Actina interactúan y generan las fuerzas.
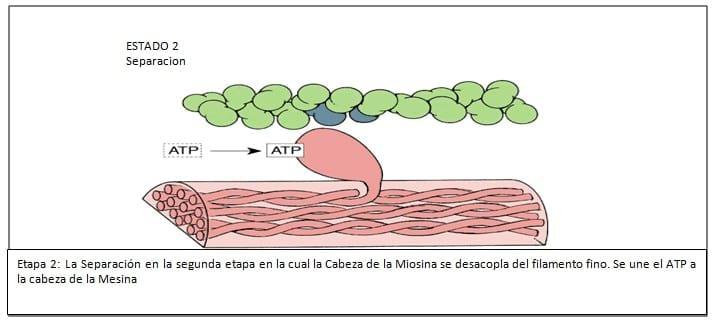
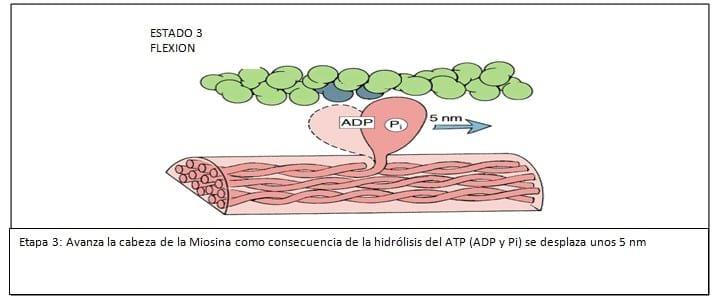
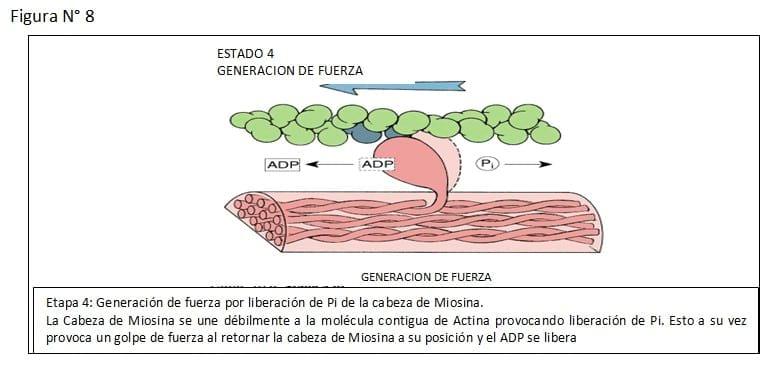
2. El sitio de actividad ATPasa, donde el ATP es hidrolizado y la energía es convertida a fuerza mecánica.
3. La cadena liviana de 20.000 daltons, que cuando es fosforilada, constituye la llave elemental de la regulación contráctil. (interacción actina miosina)
2. El sitio de actividad ATPasa, donde el ATP es hidrolizado y la energía es convertida a fuerza mecánica.
3. La cadena liviana de 20.000 daltons, que cuando es fosforilada, constituye la llave elemental de la regulación contráctil. (interacción actina miosina)
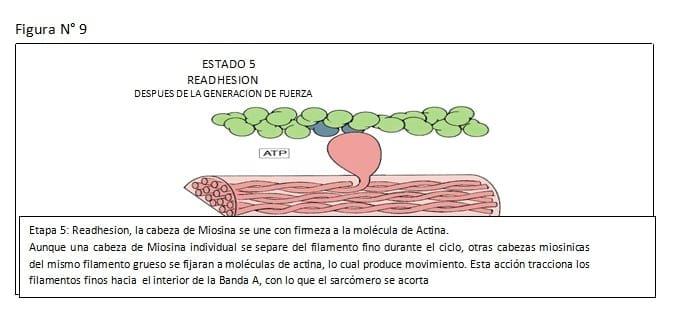
El tallo de la molécula de miosina es helicoidal que provee los miofilamentos y transmite las fuerzas generadas. (Ver Figuras N° 3, 4, 5, 6, 7, 8, 9)
Son distintas las estructuras de la miosina en el estado de útero gestante al no gestante. En el primero, existen nuevas isoenzimas miosinicas específicas, que son sintetizadas durante el último trimestre de la gestación
Calcio y regulación de la interacción actina miosina
El calcio es depositado en las vesículas intracelulares, conocidas colectivamente con el nombre de retículo sarcoplásmico. La acumulación de calcio por la bomba cálcica del retículo sarcoplásmico, es dependiente del proceso enzimático ATPasa.
El calcio es un factor común en la regulación de la contractilidad de los músculos estriados y lisos. En el músculo estriado, el calcio afecta la interacción actina y miosina através de las proteínas reguladoras, troponina y tropomiosina. La interacción actina miosina está bloqueada en ausencia de calcio.
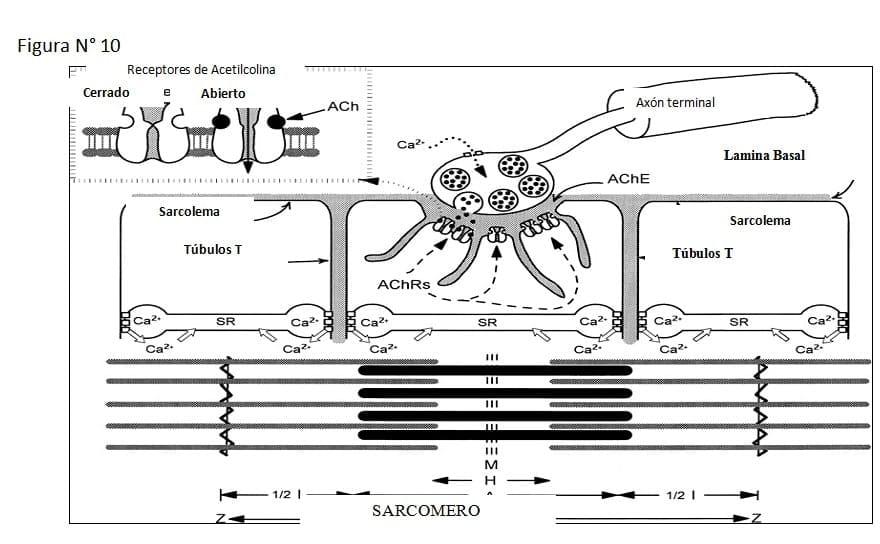
En la regulación de la contracción interviene el Ca++ del retículo sarcoplasmico y el sistema de túbulos transversos. Para la reacción entre la actina y miosina debe haber Ca++ disponible.
Los túbulos T son invaginaciones de la membrana que llegan hasta ubicarse entre las cisternas terminales y contienen proteínas censores de voltaje. Los túbulos T mas las cisternas terminales constituyen las tríadas.
Estas cisternas terminales sirven como reservorios de Ca++ para la liberación de Ca++ hacia el sarcoplasma.
La membrana plasmática de la cisterna contiene abundantes canales de compuerta para la liberación del Ca++. La despolarización de la membrana del túbulo T desencadena la liberación de Ca++ desde las cisternas terminales para iniciar la contracción muscular. (Ver figuras 10 y 11)
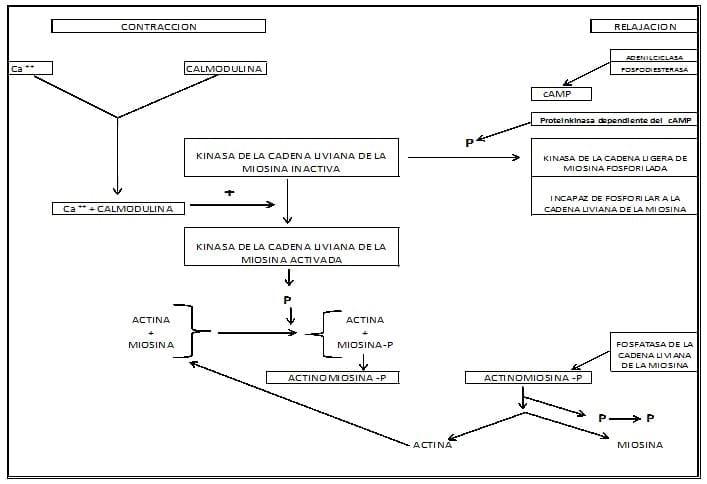
En el músculo liso uterino, la interacción actina y miosina es regulada por la fosforilación o defosforilación de la cadena liviana de 20.000 daltons de la Miosina. La interacción actina miosina puede solo tener lugar si la cadena liviana de la Miosina ha sido fosforilada, lo cual ocurre a través de la acción de la miosin kinasa de la cadena liviana, enzima activada por el Calcio iónico.
La relajación del músculo liso ocurre, cuando otras enzimas, las miosin fosfatasa de la cadena liviana remueven los grupos fosfato, desde la molécula de la miosina. Por lo tanto la actina "no reconoce" la miosina desfosforilada, y la interacción actina-miosina no puede tener lugar. (Ver Figura N° 12)
Es evidente que la miosin kinasa parece ser la llave reguladora de la contractilidad del músculo liso, puesto que la fosforilación de la miosina en la cadena liviana depende de la acción anterior.
La kinasa de miosina de la cadena liviana está influenciada por tres sistemas reguladores celulares:
1) Calcio, en concentraciones de 106 M activa la Miosina.
2) La miosin kinasa de cadena liviana solo se activa si la calmodulina, (un regulador proteico calcio dependiente de 16.500 Daltons) está asociado con la enzima.
3) Se ha demostrado que la fosforilación de la miosina kinasa de cadena liviana por la proteinquinasa AMP cíclico dependiente inhibe la actividad de fosforilación de la miosina. La disminución en actividad es debida a la baja afinidad de la enzima al complejo calmodulina - calcio. (Ver Figura N° 12)
La miosina cadena liviana es desfosforilada por la enzima Miosina Fosfatasa. El miometrio se relaja como consecuencia de la defosforilación de la miosina. La actividad Miosina Kinasa, y Fosfatasa está presuntamente mantenida en balance para un control miometrial correcto.
Evidentemente la interrelación de los tres componentes descriptos, Calcio, Calmodulina y Fosforilación mediada por el AMPc son fundamentales, ya que ellos están sometidos a las acciones de hormonas y agentes farmacológicos.
Como hemos dicho, el retículo sarcoplásmico es un importante regulador del nivel de calcio iónico intracelular. La captación del calcio en el miometrio bovino a nivel del retículo sarcoplasmico está inhibida por las prostaglandinas, la oxitocina, y la acetilcolina (hormonas reconocidas como estimulantes de la contractilidad miometrial). (Ver Figura N° 13)
La progesterona, una hormona que deprime la contractilidad y el AMPc estimulan la captación de calcio, en experiencias in vitro.
Las consecuencias de estas acciones hormonales in vivo, hacen que las PGF2alfa y la oxitocina aumentarían mientras que la progesterona, y el AMPc disminuiría el nivel intracelular de calcio, el rango de fosforilación de la miosina, y el estado de contractilidad del útero. La concentración intracelular de calcio aumenta durante la contracción, y disminuye cuando el músculo esta relajado después de la administración de isoproterenol, o similares agentes Beta bloqueantes. (Ver Figura N° 13)
La inhibición de la cadena liviana de miosina con actividad kinasica por el AMPc, ofrece un modelo excelente para entender la directa regulación de la interacción actina-miosina en el útero. En el músculo liso el AMPc o agentes que aumenten su concentración promueven la relajación del útero. Entonces cuando la actividad del AMPc inhibe la miosina kinasa por fosforilación o baja el nivel intracelular de calcio en el citosol del músculo uterino la fosforilación de la cadena liviana de la miosina disminuye. La reducción de la interacción actina-miosina da una base fisiológica para entender la acción tocolítica del AMPc o de drogas beta adrenérgicas. (Ver Figura N° 13)
Modelo integrado para la regulación de la contractilidad del musculo liso.
1) Fosforilación enzimática de la cadena liviana de Miosina de 20.000 Daltons. Hay diferencias en la isoenzimas en la Miosina de los úteros preñados y no preñados.
2) La Miosina kinasa de cadena liviana es la llave enzimática para el proceso regulador.
3) El calcio es esencial para la actividad de la miosina kinasa de cadena corta.
4) La Miosina Kinasa es activa si está asociada con la interacción Calmodulina-Calcio.
5) El nivel intracelular de Ca++ está activamente regulado por el Retículo Sarcoplásmico.
6) La acumulación de Ca++ por el Retículo Sarcoplásmico es un proceso enzimático mediado por el ATP, y es afectado por agentes farmacológicos y hormonas.
7) La actividad de la Miosina Kinasa de cadena liviana está inhibida por fosforilación por la Proteinquinasa AMPc dependiente, enzima ésta que tiene una gran afinidad con la disminución del calcio. (a bajo calcio, aumento de actividad proteinquinasa)
8) El nivel de AMPc depende de la actividad de dos enzimas, Adenilciclasa, y Fosfodiesterasa. Ambas están influenciadas por varias drogas y hormonas.
9) Para el propósito de la inhibición uterina, es importante saber que las drogas beta adrenérgicas activan la Adenilciclasa, aumentando el nivel celular de AMPc. El aumento de la concentración de este mediador disminuye la actividad Miosina Kinasa por reducción del nivel intracelular de Calcio, a través de un aumento de la unión en el Retículo Sarcoplásmico y por fosforilación de la Miosina Kinasa.
10) Cuando la fosforilación de la miosina está reducida, la interacción actina-miosina disminuye y el miometrio se relaja.
11) El cortisol fetal es fundamental para la síntesis del surfactante pulmonar y su distensión.
12) Oxitocina fetal, estimula el miometrio y produce la contracción de la arteria umbilical (hemostático fisiológico).
13) Los niveles elevados de PGF2alfa post parto, tendrían una real importancia en la involución uterina.
MECANISMO DEL PARTO
Una vez descripta la evolución hormonal y su integración en la inducción de un útero contractil, se puede iniciar la descripción de los mecanismos del parto en forma secuencial.
Primera fase: Prodrómica o de dilatación
Es la fase preparatoria y consiste en la dilatación del cuello uterino o cervix, causado por las contracciones del miometrio que impulsan al feto y a sus membranas repletas de líquidos hacia el conducto cervical.
El período de dilatación abarca, desde la iniciación de una actitud de inquietud por la fuerza del parto, hasta la dilatación completa del cuello uterino.
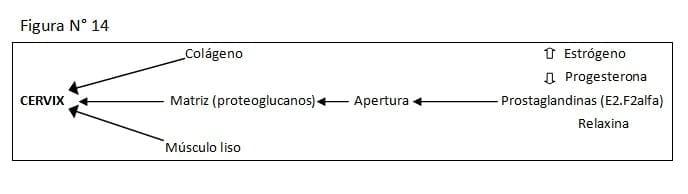
El cérvix presenta un excelente bloqueo para la expulsión del feto hasta que se halle hormonalmente controlado; ablandando y aumentando la distensibilidad del tejido conjuntivo. Algunas hormonas incluyendo estrógenos, prostaglandinas, oxitocina y relaxina, estarían implicadas en la estimulación de la distensibilidad del cervix.
El cervix tiene tres componentes estructurales principales: músculo liso, tejido conjuntivo y colágeno. El tejido conjuntivo, también llamado "sustancia fundamental" contiene los glucosaminoglucanos cervicales (dermatan sulfato, condrointin sulfato y ácido hialurónico).
El primer factor en la apertura cervical, son los cambios que se producen en el colágeno y en la matriz del tejido conjuntivo. La flexibilidad cervical aumenta, mientras que la concentración de proteínas y colágenos declina. La pérdida del colágeno resulta de la digestión proteica y la subsecuente eliminación de los péptidos solubles del colágeno.
Las moléculas del colágeno están ordenadas en forma de fibras impregnadas en la matriz del tejido conjuntivo del cervix. El tropocolágeno, la unidad estructural del colágeno, es una helix de tres cadenas alfa de colágeno de 100.000 Daltons cada una. Las cadenas alfa contienen gran cantidad de prolina y glicina. Aproximadamente 10% de los residuos aminoácidos son prolinas hidroxiladas, virtualmente únicas en el colágeno.
La ruptura enzimática del colágeno es la llave fundamental en el ablandamiento cervical, los fragmentos de tropocolágeno se vuelven solubles y permiten la apertura del tejido cervical. Colagenólisis y proteólisis por colagenasas y otras enzimas caracterizan la maduración cervical.
El ácido hialurónico aumenta y la concentración de colágeno, dermatan sulfato, y condrointin sulfato disminuyen durante la maduración cervical.
Cuando hay un cambio en la relación estrógeno/progesterona al final de la gestación el colágeno y la matriz cervical se rompen por dos eventos:
1) el metabolismo del colágeno cambia, la degradación se hace predominante por el aumento de actividad de las colagenasas (metaloproteinasas zinc dependientes) y otras enzimas, las moléculas del tropocolágeno en las fibrillas se rompen.
2) El dermatan sulfato cervical, disminuye con el colágeno y el cervix se torna hinchado y blando debido al aumento del contenido de ácido hialurónico y agua. En definitiva, el aumento del ácido hialurónico y del contenido del agua hace al cervix blando, mientras que la ruptura y pérdida del colágeno y dermatan sulfato aumentan la flexibilidad y distensibilidad.
Control hormonal de la maduración cervical
La maduración cervical es un proceso celular activo, la relación entre el inicio de la labor de parto y los cambios colágeno -glucosaminoglucanos en el cérvix es un proceso de gran importancia y está influenciado por varias hormonas.
La actividad colagenolítica cervical aumenta cuando la relación estrógeno/progesterona se eleva.
Las prostaglandinas están involucradas en la degradación del colágeno, las prostaciclinas ayudan a esa degradación, activan las colagenasas y junto a la relaxina producen los cambios para la adaptación final del cervix, o sea la maduración pre labor.
La relaxina es un polipéptido de 9.000 Daltons elaborado específicamente por el cuerpo lúteo gestacional, y se mantiene hasta el final de la preñez. La relaxina tiene una síntesis con un alto turnover, bajo rango de síntesis y poco depósito.
Ha sido demostrado que las células de la granulosa luteinica, contienen la mayoría de los gránulos secretores y estos son distintos a los productores de progesterona; por lo tanto, existirían dos líneas celulares de síntesis. La secreción de relaxina está ligada a los cambios en la relación estrógeno/progesterona, acumulando peptidos en el CL (cuerpo lúteo) cuando la relación es baja, y eliminándolos masivamente cuando los estrógenos se elevan. En la vaca la eliminación de relaxina placentaria es mínima, no teniendo importancia en la acción cervical.
La acción de la relaxina sobre la sínfisis púbica es muy importante, alterando como en el cervix la matriz de condrointin sulfato, aumentando la concentración de enzimas de acción colagenasa y cuando los estrógenos han sensibilizado el tejido, hay una significante pérdida de proteoglicanos, como pre-requisito importante para que se produzca la destrucción del cartílago articular y prolifere el tejido conjuntivo fibroso. Todo esto sucede en menos de 4 días. (Ver Figura N° 14)
Con el cérvix ya maduro, la fase prodrómica del parto avanza hacia su fase expulsiva, el tiempo que dura esta fase preparatoria es de 24 horas como máximo. A veces en solo 6 horas el parto se presenta.
En esta etapa el feto gira desde una posición lateral o inferior a una superior con las manos y la cabeza dirigida hacia el cuello.
Segunda fase: expulsiva
Incluye la dilatación completa del cuello y la salida del feto al exterior.
Las contracciones uterinas aumentan de intensidad y frecuencia, siendo su acción reforzada por la prensa abdominal.
Las contracciones de la prensa abdominal aparecen cuando el feto apoya sus manos y su cabeza en la vagina, reflejos espinales producen la fuerza y la imprescindible ayuda de los músculos del abdomen en el parto.
Este período es muy doloroso en todos los animales, por la intensa inervación del "conducto de salida": la vagina, el vestíbulo vaginal y la hendidura vulvar.
En la vaca el período de expulsión puede retrasarse por múltiples uniones cotiledónicas, puesto que aún con pocos cotiledones unidos se mantiene la oxigenación. Una vez que el cordón se ha cortado el feto necesita respirar pronto, porque existe el riesgo de morir por asfixia. Desde que se rompe la bolsa amniótica y al mismo tiempo se desprende la placenta, si no logra respirar pronto, generalmente el ternero muere por asfixia por neumonía de aspiración del líquido amniótico.
El parto es el tiempo de mayor cambio y adaptación para el desarrollo del recién nacido, la respiración, nutrición y excreción, funciones dependientes de la placenta, se han perdido.
El nuevo ser está expuesto a numerosos estímulos del medio ambiente y debe establecer una cerrada relación con la madre para obtener los nutrientes necesarios. Entonces se debe entender que la viabilidad perinatal está influenciada enormemente por los eventos que rodean al parto. La adaptabilidad muchas veces está complicada por la exposición de madre y feto a muchas situaciones de stress, como son los partos distócicos. Las mayores pérdidas perinatales se producen durante el parto desde los primeros momentos, hasta las 72 horas post parto.
El stress del parto incluye: asfixias, trauma, desnutrición gestacional, anormalidades congénitas, etc.; provocando la muerte fetal inmediata, o la disminución de la viabilidad. Los traumas y asfixias son las consecuencias más comunes cuando las vacas paren terneros muy grandes (distocia por ternero absolutamente grande), o cuando las hembras tienen un diámetro pelviano inferior al ternero que debe parir (ternero relativamente grande).
Sea cual fuere la causa de la distocia, es fundamental el mantenimiento de la oxigenación durante la labor. La asfixia es una importante causa de muerte y de reducida viabilidad cuando hay una interferencia en la oxigenación fetal y los mecanismos de adaptación fallan para mantener la homeostasis. Los orígenes de esta asfixia pueden ser por desprendimiento placentario prematuro con ruptura de bolsa amniótica; oclusión del cordón umbilical durante la salida por el canal duro del parto, daño o ruptura del cordón umbilical, todo lo cual conduce a la reducción de la capacidad de captar O2 de la sangre materna.
La resistencia a morir de anoxia es mayor en los recién nacidos que en los adultos, en el feto la falta de oxigeno hace movilizar inmediatamente las reservas de glucógeno del hígado, elevando inmediatamente el nivel de glucosa, con derivación al cerebro para el metabolismo anaerobio. Pero si la anoxia es muy prolongada, la acidosis es más peligrosa ocasionada por la elevación del acido láctico sanguíneo. La muerte se produce por efecto de la alta concentración de hidrogeniones y por el estado hiperosmolar.
Este período expulsivo demora para completarse entre media hora y hasta cuatro horas, por ello es fundamental que el tiempo disponible para intervenir en la ayuda del parto lo impone la ruptura de la bolsa amniótica, siendo este episodio el que nos indica que no hay más que una o dos horas para evitar daños irreparables en el ternero.
TERCERA FASE: SECUNDINACION O ALUMBRAMIENTO
En éste último estadio del nacimiento, tiene lugar la expulsión de las cubiertas fetales, tras haberse aflojado la conexión entre la placenta materna y fetal.
La separación de la placenta bovina requiere los siguientes procesos.
1.- Etapa pre parto: MADURACIÓN DEL PLACENTOMA
El mecanismo de pérdida se inicia histológicamente durante los últimos dos meses de la gestación, cuando los cambios preparatorios toman lugar en el epitelio placentario y en el tejido conjuntivo.
La carúncula se torna progresivamente colagenizada con el avance de la preñez. Esta esclerosis fisiológica de la placenta materna se hace evidente en los márgenes de la carúncula, especialmente a nivel de la implantación de las vellosidades fetales. Hay una hialinización de la pared de los vasos sanguíneos, proliferación de la subóptima y del tejido adventicio, ocurriendo una obliteración del lumen.
El epitelio materno, en la base de la cripta cerca del tallo caruncular se torna blando, con una importante marginación de leucocitos y células gigantes binucleadas, estas se van tornando cada vez con más actividad fagocítica, hasta el momento anterior al proceso de desprendimiento.
El placentoma en sí mismo sufre un proceso de cambio importante bajo el estímulo de los estrógenos; se hincha y ablanda, por captación de agua en las fibras del tejido conjuntivo.
Para una correcta maduración del placentoma es esencial una elevación del 17 beta estradiol, y estrona por lo menos 5 días antes del parto. Una concentración baja de progesterona por varias semanas antes del parto es un importante origen de la falta de maduración.
En definitiva, la desaparición avanzada del epitelio de la cripta materna cerca del tallo de la carúncula, es decisiva para un correcto tiempo de expulsión de la placenta. En casos de retención placentaria la cantidad de células epiteliales corresponde a un período de gestación de 8 meses. La fibrina que se deposita entre las vellosidades coriales y la cripta de la carúncula, es otro factor de desenganche placentario.
2.- Etapa intraparto:
DESPRENDIMIENTO MECÁNICO COMO RESULTADO DE LA PRESIÓN UTERINA
Durante la contracción del útero, hay constantes cambios en la presión uterina, que llevan a condiciones de alternancia anémicas e hiperémicas y a cambios en el área de las vellosidades coriónicas fetales. Como resultado, la unión del epitelio coriónico en las criptas maternales se torna inestable. En la fase expulsiva, la presión del feto sobre las carúnculas es grande, por lo tanto facilita la separación de las vellosidades coriales. El placentoma se expande periféricamente como resultado de su ablandamiento, este cambio de forma es solo posible si ha existido previamente una acción hormonal que relaje el tejido conjuntivo maternal, esto expande el tallo caruncular. Por lo tanto, el cambio de forma es esencial en el desprendimiento final de las vellosidades coriales de la cripta de las carúnculas.
3.- Etapa inmediata posterior al parto: ANEMIA DE LAS VELLOSIDADES FETALES
Un factor esencial después de la expulsión del feto y la ruptura de los vasos umbilicales, es la anemia de las vellosidades fetales; esto resulta por la falta de circulación sanguínea dentro de los capilares fetales. Por encogimiento de los vasos sanguíneos el área del epitelio coriónico se halla muy reducida.
La placenta se expulsa normalmente en la vaca entre las 4 a 6 horas post parto; cuando pasan las 6 horas y hasta las 12 horas es una placenta demorada, y con más de 12 horas, es una placenta retenida.
Tal como se ha descripto, todo el proceso desde el desencadenamiento del parto, hasta el desprendimiento de la placenta y su posterior expulsión, es consecuencia de una cantidad de eventos; tanto hormonales como mecánicos sincronizados. Cualquier alteración en uno solo de los períodos anteriormente detallados conduce a graves consecuencias con secuelas de infertilidad, a veces irrecuperables.
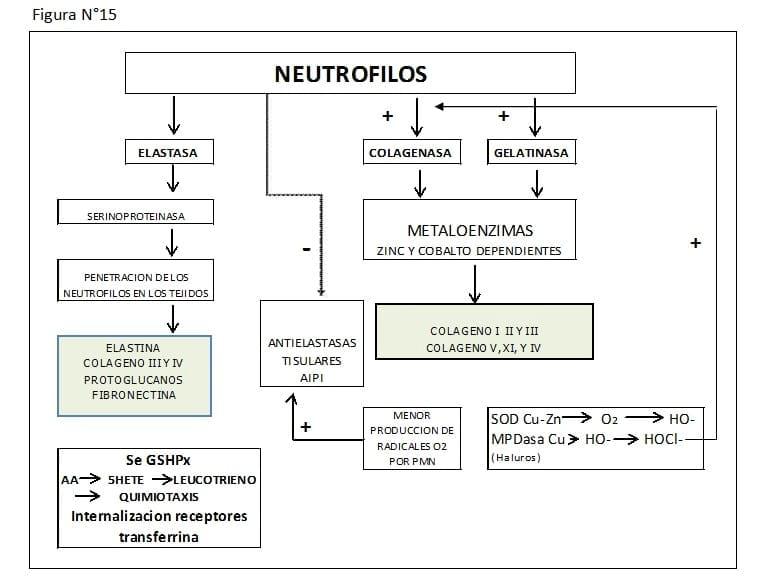
4.- Reacción Inmunitaria: El cotiledón fetal actúa como cuerpo extraño luego del parto, con liberación de sustancias quimiotacticas, lo que determina la infiltración de los placentomas por neutrofilos periféricos, los que digieren la unión carúncula materna - cotiledón fetal.
Posible mecanismo de acción de los neutrofilos en el desprendimiento placentario
Los neutrofilos contienen en sus gránulos más de 20 diferentes enzimas proteolíticas, las que son segregadas al medio al que fueron atraídos. De éstas, la Elastasa, Colagenasa, Gelatinasa, y Catepsina D y E, serían las más importantes, ya que las mismas pueden digerir membranas basales, tejidos elásticos, cartílago, etc.
a. Elastasa: Es una serino-proteasa que actúa sobre distintos tipos de sustratos: elastina, colágeno tipo III y IV, inmunoglobulinas, componentes del complemento, factores de coagulación, proteoglicanos, fibronectinas y células intactas. Esta enzima podría ser importante para la locomoción de los neutrofilos y su penetración en los tejidos.
a.1 Antielastasas tisutares: Existen en los tejidos y en el plasma sanguíneo como mecanismo de defensa distintas moléculas inhibidoras de estas enzimas, las cuales son:
- α1 inhibidor de la proteinasa (Al PI ó α1-antitripsina)
- α2macroglobulina (α2 MG)
- inhibidor secretorio de la leucoproteinasa (SLPI)
El inhibidor más importante y potente, es el Al PI, una glicoproteína de 52 KiloDaltons (kDa) que inactiva irreversiblemente a la elastasa en una reacción excepcionalmente rápida: 0.6 microsegundos (ms) es la vida media de la elastasa "in vivo".
a.1.1 Inactivación de los Inhibidores: La Al PI contiene un residuo metionina en su sitio activo, posición 358, que es crucial para su funcionamiento. La oxidación del Met - 358 causa una dramática disminución de la asociación elastasa-Al PI, aumentando la vida media de la elastasa 200 veces, es decir de 0.6 ms a 1,2 s.
La α2-macroglobulina, proteína plasmática de 725 kDa, y el SLPI (inhibidor secretorio de la leucoproteinasa, 14 kDa), también se inactivan por oxidación.
b. Colagenasa y Gelatinasa: Son dos metaloenzimas dependientes del Zinc y del Cobalto. La colagenasa puede degradar el colágeno tipos I, II y III, mientras que la Gelatinasa ataca al colágeno tipos V, XI, y posiblemente al IV.
Estas dos enzimas se segregan inactivas, y se ha postulado que los mismos neutrofilos las activarían utilizando algún radical oxígeno (posiblemente el HOCl o haluros), pues se comprobó en humanos, que los neutrofilos de pacientes con enfermedad granulomatosa crónica (CGD), contenían cantidades normales de enzimas proteolíticas, pero con una NADPH oxidasa deficiente, produciendo sólo mínimas cantidades de radicales oxigeno (O-, H2O2 y HOCl).
Los neutrófílos normales, pero no los de CGD, pudieron activar sus proteinasas "in vitro"
Es interesante ver que los radicales oxigeno pueden tener una actividad pro digestiva, no sólo por la inactivación de antiproteasas (A1PI), sino también por activación de la colagenasa y gelatinasa. (Figura N°15)
Las enzimas proteolíticas segregadas por los neutrófilos hacia el intersticio de la unión materno-fetal, serían las responsables de la digestión del tejido conectivo que mantiene firme dicha unión, determinando la separación de la placenta. (Figura N°15)
El reclutamiento de los neutrofilos hacia el sitio de una inflamación aguda involucra la acción combinada de múltiples familias de moléculas de adhesión. El proceso incluye una fugaz adhesión entre el leucocito y las células endoteliales de la pared vascular. Esta acción se media por miembros de la familia de las selectinas por las cuales los PMNs rolan sobre la superficie vascular (rolling), seguida por una fuerte adhesión entre la β2- integrinas CD11b/CD18 y las moléculas de adhesión intercelular de las células endoteliales. Esto resulta en una unión a las células endoteliales más poderosa por el leucocito PMN, con una detención del mismo. De esta manera, los leucocitos atraviesan el endotelio y entran en los tejidos periféricos, a través de la interacción CD11/CD18 del PMN y CAM-1 del endotelio.
RETENCIÓN PLACENTARIA
CAUSAS DE LA RETENCIÓN PLACENTARIA
1. Placentomas inmaduros (período gestacional corto).
La duración de la preñez de una raza deriva de dicha capacidad genética específica de los toros. La frecuencia de la presentación de Retenciones Placentarias, depende prioritariamente de la duración de la preñez, y en menor medida, del tiempo de la expulsión del feto.
Los Placentomas inmaduros revelan deficiente preparación hormonal del tejido conjuntivo de la placenta materna (carúncula). Es evidente una baja sensibilización hormonal, por ello la carúncula está poco preparada para el desprendimiento durante el período de expulsión. La maduración caruncular ocurre de 2 a 5 días antes del fin del período gestacional, dependiendo de la duración del mismo según las razas. Un aumento importante en el nivel de andrógenos en los días previos al parto; una disminución de la concentración plasmática de 17 β estradiol y un aumento en la concentración de Estradiol 17 α durante los 6 días previos al parto, son considerados disturbios hormonales característicos de la inmadurez de la placenta.
La ineficacia de la acción sincronizada de las hormonas, y fundamentalmente el desequilibrio de las mismas, lleva a los siguientes disturbios en las fibras del tejido del colágeno de las carúnculas maternales:
1. Placentomas demasiado involucionados (período gestacional largo).
En este caso los Placentomas sufren un proceso proliferativo en los tejidos septales, estos se tornan espesos y las vellosidades fetales quedan atrapadas entre las criptas, complicando el proceso de desprendimiento.
2. Edema de las vellosidades coriales.
Se verifica este edema no infeccioso en las cesáreas, torsiones uterinas y partos largos y/o distócicos. Este edema se extiende hacia el fin de las vellosidades coriales y las membranas fetales se arraigan firmemente en la superficie de la carúncula.
3. Hiperemia de los placentomas.
A veces ocurre cuando antes del parto se produce una proliferación de los vasos sanguíneos, o cuando se produce un rápido cierre de los vasos umbilicales, post parto.
El área de superficie de los capilares fetales aumenta por el resultado de la congestión sanguínea y las vellosidades permanecen enganchadas en las criptas. Cuando la Hiperemia ocurre antes del parto (ruptura prematura del cordón umbilical), la placenta queda fuertemente adherida.
4. Áreas necróticas sin inflamación entre las vellosidades coriales y la pared de la cripta.
Son infecciones que ocurren a veces por enfermedades generalizadas, y es común encontrarlas en vacas con tuberculosis y en afecciones alérgicas. Existe una extravasación sanguínea indicando una diatesis hemorrágica, y ello deriva en severas retenciones placentarias.
5. Placentitis y Cotiledonitis.
Estas alteraciones originadas por diversas infecciones específicas, llevan a una reacción inflamatoria y necrosis de los cotiledones que alteran profundamente el desprendimiento de las vellosidades coriales desde las criptas. Son de difícil tratamiento.
6.Inercia uterina
La inercia uterina está originada por diversas causas: excesiva distensión uterina, degeneración de las fibras miometriales, desordenes metabólicos, (hipocalcemia) o elevadas concentraciones de progesterona el día del parto; todos ellos son un factores negativos, relacionados al mecanismo del desprendimiento.
Una de las causas más comunes en la inercia uterina son los trastornos metabólicos minerales, fundamentalmente la deficiencia de Calcio iónico en el momento del parto. A veces no llegan los animales a tener problemas clínicos de paresias puerperales, y las retenciones placentarias son una advertencia para pensar en que se ha producido una alteración subclínica. Estas enfermedades subclínicas o metabólicas son cada día más evidentes y en el transcurso del estudio del puerperio, se detallará su terapéutica y profilaxis.
7.- Inmunosupresión.
Una disminución en la migración leucocitaria; macrófagos PMN y Linfocitos hacia la base de la cripta caruncular, es frecuente en la fase peripartal, generalmente asociada a cambios hormonales generados en este período, tales como el incremento del tenor de glucocorticoides, progesterona alta pre-parto e hipoestrenismo puerperal. Esto conduce a un estado de inmunosupresión el cual se agrava cuando los animales presentan deficiencias en Cu, Zn, Se, y Vitamina E.
Estas retenciones placentarias se caracterizan por una poderosa adherencia entre las criptas carunculares y las vellosidades coriales. Esta patología está asociada generalmente a mastitis sobreaguda puerperal (colibacilares o estreptococcicas)
PUERPERIO FISIOLÓGICO
La regeneración sexual después del parto, llamada también convalecencia sexual, comprende un período tras del parto de alteraciones biológicas sucesivas, entre las que se destacan principalmente la restauración de órganos sexuales y la regeneración del organismo.
El puerperio comienza después de la eliminación de los anexos fetales y termina con la instauración de un nuevo ciclo sexual ovulatorio donde la preñez es posible.
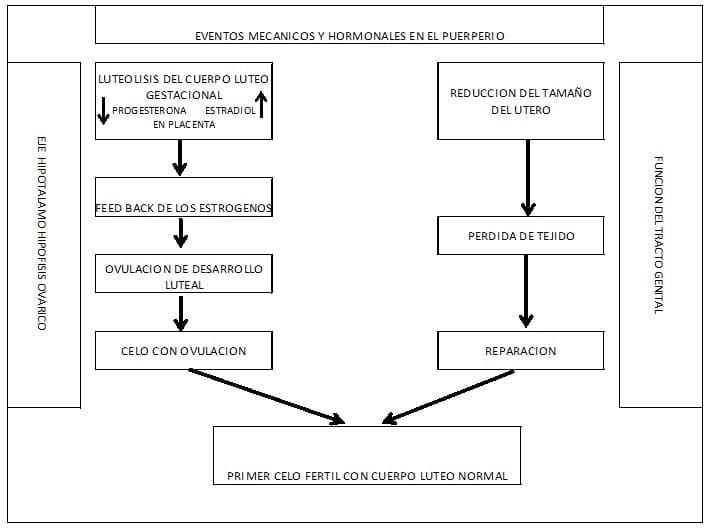
El útero presenta dos tipos de eventos; uno mecánico y otro metabólico.
EVENTO MECÁNICO
Algunos días después del parto, el útero comienza a reducir su tamaño. Las contracciones son las que conducen a la disminución del tamaño uterino. Durante el primer día las contracciones mantienen su ritmo cada 3 minutos, hasta el día 14, donde se producen unas ocho contracciones intensas y regulares en un lapso de 30 minutos.
A los 4 a 5 días posteriores a la eliminación placentaria, el útero se ha retraído a la mitad de su tamaño post parto. La reducción de las células musculares es muy importante las primeras 24 horas; se reduce de 750 a 400 micras. El cierre del conducto cervical en la vaca se produce mucho más rápidamente que la regresión del útero a su tamaño original. Comienza el cierre siempre desde el orificio externo al interno.
Todo depende naturalmente de las contracciones musculares y de la pérdida de tejido y agua en el proceso. La pérdida de tejido (especialmente tejido conjuntivo) está reflejado por un aumento en plasma de glicina e hidroxiprolina durante la primera semana post parto. Existe una degeneración granular y vacuolización a nivel miometrial y aparecen entre las fibras musculares células macrófagicas comprometidas en la remoción de los componentes intercelulares.
Las contracciones uterinas, que se hacen cada vez más fuertes, están sincronizadas hasta los 10 días post parto por la presencia de las Gap Junction, las cuales están activas dos semanas desde la expulsión de la placenta. Es evidente en los casos de retención placentaria el aumento en amplitud y frecuencia de las contracciones, debidas al estiramiento muscular.
Un aumento del número de contracciones abdominales ocurren durante la expulsión placentaria y la concentración de oxitocina plasmática cae a valores mínimos después de la eliminación placentaria. Se puede concluir sobre las contracciones uterinas que hay una gradual caída desde el momento de expulsión del ternero, desde 12-18 ciclos por hora, hasta 0-6 ciclos cada 48 horas.
El peso uterino llega desde los 10 kilos en el momento del parto, a solo 750 gramos a los 45 días; además hay una retracción anatómica palpable, donde a los 30 días se puede localizar el útero íntegramente en la cavidad pelviana.
Los surcos longitudinales, pueden ser palpados en una involución normal solamente hasta los 15 días PP.
El frémito de la arteria uterina media se palpa hasta el día 4 en un parto normal, mientras que en un parto demorado llega a palparse hasta el día 15.
Otra referencia es la ubicación del cervix con respecto al piso de la pelvis (hay diferencias por número de partos, tamaño de los animales, etc.) en general hacia los primeros 7 días se palpa entrando a la cavidad pélvica; a los 10 días se encuentra en la mitad de la cavidad, y a los 30 días totalmente intrapélvico.
El cervix cierra desde la extremidad vaginal y forma un moco que a las pocas horas, actúa como tapón evitando entradas de material externo. Los líquidos (LOQUIOS) y aire se eliminan en las primeras 48-72 horas, si los mismos están demorados por cualquier alteración patológica, el cervix igual sigue su proceso de cierre, pero no se completa en el tiempo necesario para evitar una contaminación, a veces de graves consecuencias.
TIEMPO DE RESTABLECIMIENTO DE LA FORMA DEL CERVIX
4 horas: Sección anular edematizada y prolapsada.
12 horas: Formado. (Pasan 4 dedos)
48 horas: Formado (Pasan de 2 a 3 dedos)
3-4 días: Formado (Pasan de 1 a 2 dedos)
8-10 días: No es franqueable
15 días: Impermeable. Ya está en la cavidad pélvica
25 días: En estado normal
35 días: En estado Progestacional
En casos de retención placentaria toda esta cronología será más prolongada, aún después de haberse solucionado la patología.
CICLO DE LOS LOQUIOS
Están formados por la sangre, el líquido amniótico, los exudados endometriales y los detritus placentarios.
Para evaluar a los loquios lo importante es determinar su olor y consistencia; los normales son semi-viscosos, con olor a sangre.
12 horas: De consistencia acuosa y de color rojizo.
24 horas: Aumenta la viscosidad, color rojizo, volumen uterino de 1,2 a 1,5 litros. No hay fluctuación y se palpan las estrías. Con más de 2 litros hay fluctuación y no se palpan las estrías. Esto evidencia un retraso importante.
3 a 4 días: Está muy denso. Color anaranjado. Volumen de 1 litro.
10 días: Muy denso. De color anaranjado a un rojizo más intenso, mezclado con un mucus transparente. El volumen máximo es de 500 mil
20 días: Disminuye la densidad. Mucus transparente, mezclado con algunos grumos blancos: Poco volúmen uterino.
30 días: Escaso mucus transparente.
FENÓMENO METABÓLICO
En los rumiantes este fenómeno tiene gran importancia, pues no solo tiene lugar la regeneración a nivel muscular, sino a nivel caruncular. Las células musculares, adquieren una degeneración grasa, la cual es poco asimilada.
Entre las células musculares aparecen gotas de grasa y cuando estas se han asimilado y termina el proceso de catabolismo, el puerperio ha terminado.
En el vacuno esta degeneración puede llevar a la denominada "marciditas uteri" en el cual el útero se pone muy seco y se desgarra fácilmente. Esta situación termina después de la sexta semana.
A nivel caruncular se produce una degeneración grasa y su superficie se desprende apareciendo como grumos en el mucus.
Conjuntamente con este proceso de regresión catabólica se suma a nivel de la carúncula, un proceso denominado demarcación. La demarcación caruncular tiene lugar a tres niveles, delimitando el lugar de desprendimiento. La demarcación es un proceso que se opone como barrera a los microorganismos banales vaginales, como un dique leucocitario.
A los tres días ya está completa la primera barrera subepitelial debajo de la mucosa uterina. Si esta barrera no basta y los microorganismos las trasponen, se produce una segunda barrera o segunda zona de demarcación, llamada mucosa que termina a los seis días post parto. Generalmente se produce una tercera demarcación epitelial que posee leucocitos, células del sistema retículo endotelial y fibrina. A los 9 días post parto se completa la demarcación caruncular. Esto demuestra porqué a los 9 días se expulsa la placenta sola si había sido retenida.
Debido a este proceso se observa la expulsión de trozos de tejido color oscuro o verdoso, que son precisamente los tejidos que han quedado fuera de esa zona demarcatoria de reacción.
A este período sigue el de neoformación que reconstituye la carúncula. Este fenómeno termina entre la quinta y sexta semana post parto.
PERIODOS DEL PUERPERIO
Para el estudio fisiopatológico, se dividirá al puerperio en tres períodos:
- Puerperio inicial o temprano.
Este abarca desde el parto hasta que la hipofisis se hace sensible a los factores liberadores GnRH. Dura de 8 a 16 días. Durante esta fase los ovarios producen muy pequeñas cantidades de estrógenos y progesterona. A esta fase la podríamos definir como la recuperación del eje Hipotálamo-hipofiso-ovárico (HHO), al estado pregestacional.
Durante la gestación el sistema se halla fuertemente expuesto a altas concentraciones de estrógenos y progesterona, como así también a hormonas de origen placentario como es el lactógeno placentario, todas hormonas que inhiben el eje antes citado.
Hay dos situaciones conocidas, una es que la hipófisis se halla frenada en la síntesis y eliminación de LH, y otra que la FSH al no estar inhibida, se libera a veces en cantidades anormales. Además el freno en la síntesis y descarga por parte del Hipotálamo de GnRH, que contribuye a la demora en la descarga de LH, conducen a una situación a nivel del eje HHO de tipo gestacional.
Esta situación se debe revertir para iniciar los eventos que desencadenarán la ovulación.
Pocos días después del parto, los niveles de progesterona disminuyen, ya sea por derivación a nivel placentario o por Luteólisis, desencadenada por las prostaglandinas F2alfa.
Los niveles estrogénicos, que están elevados el día del parto, se encuentran en niveles basales 48 horas PP, esto contribuye a la descarga de GnRH de alta frecuencia y de baja amplitud, que actuando a nivel del pool 2 del hipofisotropo LH inicia la síntesis hormonal.
Ya el eje HHO, ha escapado del estado gestacional y está sensibilizado para iniciar las descargas sincronizadas de las hormonas hipofisarias que desencadenarán la ovulación en la etapa siguiente.
El proceso está completo en las vacas lecheras lactando entre los 7 a 10 días y en las vacas amamantando; o en las vacas de carne con cría al pié entre los 15 a 16 días.
Las metritis puerperales agudas que ocurren durante este período, es la etapa de mayor vulnerabilidad uterina, fundamentalmente por la poca concentración de 17B estradiol existente. Cuanto mayor es el tiempo de recuperación en esta etapa, mayores son los riesgos de infecciones puerperales, pues al ser los estrógenos los esteroides que más contribuyen a elevar las defensas a nivel endometrial, cualquier atraso en la recuperación del ciclo sexual, llevará a trastornos a veces graves.
- Puerperio intermedio.
Abarca desde que la hipófisis se hace sensible a la liberación de GnRH, hasta la primera ovulación post parto. Su longitud es muy variable, como lo es la primera ovulación post parto.
Las descargas desincronizadas de FSH y LH, con prevalencia de la hormona Folículo Estimulante, se mantiene hasta las primeras dos semanas PP, según razas, estado corporal, o el tiempo de lactancia; pero a medida que los niveles estrogénicos se elevan, por movimientos foliculogénicos ováricos, el sistema hipotálamo-hipofisario se sensibiliza, entonces las descargas de LH cambian en cuanto a su frecuencia y amplitud, se hacen pulsátiles, primero de baja amplitud, a veces hasta llegar a celos anovulatorios a los 25 a 30 días; o a la formación de un CL de vida media muy corta y luego de mayor amplitud, hacia el estado preovulatorio.
Las infecciones en este período son menores, pero si existen, pasan a ser Endometritis crónicas, a veces inespecíficas intersticiales de muy difícil diagnóstico.
Son muchos los factores que intervienen para que este evento fundamental en el futuro reproductivo sea postergado, (nutricionales, ambientales, infecciosos, stress, etc.)
- Puerperio final, o fase post ovulatoria.
Abarca desde la primera ovulación, hasta que la involución uterina esté totalmente completa.
La involución uterina, puede llegar a ser completa a veces en la fase intermedia, cuando está demorada la primera ovulación Post Parto, hasta los 40 a 60 días. (Ver Figura N° 16)
Endometritis crónicas o Piométras son las patologías más comúnmente diagnosticadas en este período.
Figura Nº2
Figura Nº 5
Figura Nº 6
Figura Nº 11
Figura Nº 12
Figura Nº 13
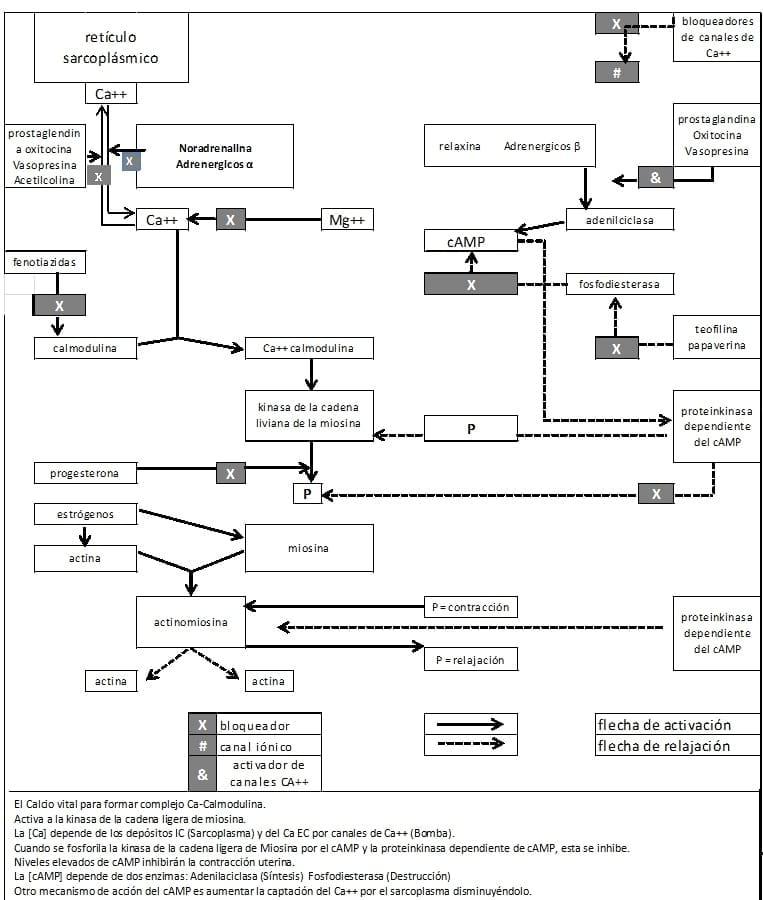
Figura Nº 16
RERENCIAS BIBLIOGRAFICAS
1. La Bato y col. (1988). Steroids.12.
2. Polziu L. y Osborne T. (1985). Steroids. 9.
3. Moreau J. y Lappin E. (1989). Endocrinology. 56.178-123
4. Chew T. y Fenne G. (1986). Endocrinology. 7.
5. Saumande J. y Thimonier L. (1980) Steroid. 7.
6. De Luca Leonardo J. y Capaul E. (1985). Fisiología de la Reproducción Tomo I, Editado por el Centro de Estudiantes UNC.
7. Breazile, J. 1970. The Role of Cations in Neuromuscular Function. Symposium on paresis in Cattle. Journal American Veterinary Medical Association Vol. 151. N° 12 page. 1662
8. Lucy. M.C. Thatcher, W.W: Staples, C.R-1992. Postpartum function: nutritional and physiological interactions. Pp 135-145. In; large Dairy Herd Management, Ed. by HH van Horn American Dairy Science Association, Champaign. IL. USA.
9. McDowell.L.R -1992- Minerals in Animal and Human Nutrition. Pp 524 Academis Press Inc. San Diego. CA. USA.
10. Michel M.C -1974- Apport des profils biochimiques dans la détection des déséquilibres nutritionnels et sanitaries das des troupeaux de bovins In, Journees Nationales G.T.V á SAINT-JEAN-DE-LUZ.
11. Miller,W.J, - 1970- Zinc Nutrition of Cattle. A Rewiew. J. Dairy Sci. 53:1123.
12. Metz, S.H; Van Den Bergh, S.G - 1977 - regulation of fat movilitation in adipose tissue of dairy cow in the period around parturition. Neth. J. Agric. Sci. 25:198.
13. Mc Clure, T.J. Eamens, G.J. -1986- Improved fertility in dairy cows after treatment with selenium pellets, Australian Vet. J. 63 (5) 144.
14. Mc Bride, B.W. Kelly, J.M- 1990 - Energy cost of absortion and metabolism in the ruminant by gastrointestinal tract and liver. Review, J. Anim.Sci. 68:2997.
15. Nakao, T.E.B; Torres E.B; Osawa, T. - 1994- Nutritional states of dairy cows and periparturient complications and reproductive perfomance. J. Japan Vet. Med Ass. 47.322-326.
16. Noceck, J.E - 1995- Nutritional considerations for the transitional cow. pp 121-137. In: Prc. 1995. Cornell Nutrition Conference for Feed Manufacturers. Dep. Animal. Sci. and Division of Nutritional Sciences. NY State College of Agriculture and Life Sciences, Cornell University. Ithaca, NY, USA 1665.
17. Payne, J.M.- 1977- Metabolic diseases in farm animals. Heidemann medical Books. London England
18. Reid,I.M-1980- The patology of post-parturient fatty liver in high- yielding dairy cows. Invest. Cell. Pathol, 3:237.
19. Reinhardt, T.A; Horst, R.L -1988- Calcium, Phosphorus, and Magnesium Homeostasis in Ruminant, pp 331-350 In; Metabolic diseases of ruminant livestock The vet. Clin. Of N. America, Food Animal Practice, Vol 4 (N°4) July 1988. USA.
20. Ramberg, C.F; Johnson, E.K; Fargo, R.D; Kronfeld, D.S - 1984- Calcium homeostasis in cows, with special reference to parturient hipocalcemia. Am. J. Physiol. R 698-R704.
21. Reinhardt, T.A -1988 - Calcium, Phosphorus, and Magnesium Homeostasis in Ruminant. pp 331-350. In: Metabolic diseases of ruminant livestock. The Vet. Clin. Of N. America, Food Animal Practice, Vol 4 (N°2) July 1955, USA.
22. Breazile, J. 1970. The Role of Cations in Neuromuscular Function. Symposium on paresis in Cattle. Journal American Veterinary Medical Association Vol. 151. N° 12 page. 1662
23. Coffman, J. R.: 1983. Metabolism and enzymology exercise physiology. Proceedings of the 29ª Annual Convention of the American Association of Equine Practitioners . Las Vegas, Nevada. 15-20
24. Fox, E.L., and Mathews, D. K.: 1981. The physiological basis of physical education and athletics. Saunders College Publishing
25. Hodgson, D. R.: 1985. Energy considerations during exercise. The Veterinary Clinic of North America Equine Practice. W. B Saunders Company Vol. 1 N°3 447-460
26. Mc Miken, D. F.: 1983. An energetic basic of equine perfomance. Equine Veterinary Journal. 15 (2): 123-133.
27. Rose, R. J. 1984. Energy utilization during exercise and effect of training on equine skeletal muscle. Proceeding of American Association of Equine Practice., 29:337-382
28. Snow, D. H.: 1987. Understanding energy and relationship to perfomance. Equine Fitness. The care and training of the athletic horse. David and Charles. Newton Abbot. London. 71-85.
29. De Luca, l. ; Capaul, E.-1980 "Retención placentaria no específica ;una aproximación profiláctica" Actas del IX Congreso Internacional de Reproducción e Inseminación Animal, Madrid España Vol. I pág. 657
30. De Luca, l ; Capaul, E.-1980 "Retención placentaria no específica, una aproximación profiláctica"Actas del IX Congreso Internacional de Reproducción e Inseminación Animal, Madrid España Vol. I pág. 657
31. De Luca, l 1980. "Enfermedades metabólicas del bovino" Sede Facultad de Ciencias Veterinarias.UBA. Director Dr De Luca L. Capaul E. Colaboradores. Dr. González, G, Carcagno, A.
32. De Luca, L; Capaul, E.-1984."Retención placentaria un método de prevención" Veterinaria Argentina. Vol. II pág. 220 a 226
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicaciónUniversidad Autónoma Agraria Antonio Narro - Mexico
31 de julio de 2012
Dr De lucas, muy buen artículo, sobre todo, lo relacionado con la participación hormonal en la preparación de la vaca para reiniciar un nuevo ciclo estral. MUCHAS FELICIDADES.
DR LEYVA
25 de abril de 2012
Esto no es un trabajo; el articulo es una clase Magistral que todo Medico Veterinario debe dominar; mis felicitaciones por tan excelente revision
Veterinaria Tandil
24 de abril de 2012
Escelente, esclarecedor, e impecable como siempre Dr. De Luca. Muchísimas gracias por compartir su conocimiento.
5 de octubre de 2020
Hace mucho no me impresionaba por leer un soberbio articulo de mi quehacer profesional. Debo aplaudir esta increible y completa revisión actualizada sobre los problemas de esa in reible máquina de producción que son nuestras vacas lecheras. Doctore Luca
Muchas gracias por recordarnos tan5os detallestan valiosos para ser mejores con nuestrs pacientes y bolsillos.
1 de mayo de 2012
Felicitaciones....muy descriptiva la explicacion de este fenomeno fisiologico-metabolico....ayuda en mucho a disernir sobre ciertos problemas presentes ya en la practica y que ciertamente a veces quedan muchas inquietudes flotando en el aire.....en verdad Dr. De Luca su experiencia nos ayuda muchisimo....insisto FELICITACIONES
27 de abril de 2012
Al igual que el amigo Nestor Simon, esta es una excelente catedra, y efectivamente todos deberíamos saberlo, para no comprometer a las vacas y a las crias durante el parto y nacimiento. mis felicitaciones, que bueno que sigan aportando sobre todo estos temas y por tan expertos colegas.
Muchas felicidades. gracias.
Bulmaro valdez