Fermentación in vitro de Nopal Forrajero (Opuntia spp) Genotipo AN-TV6 con un inoculo de levadura Kluyveromyces Lactis
Publicado: 4 de noviembre de 2013
Por: D. Ph. Daniel Díaz Plascencia
INTRODUCCIÓN GENERAL
El nopal es una planta propia del paisaje mexicano y uno de los símbolos más importantes de la nacionalidad Mexicana. El nopal forrajero es una planta muy atractiva como alimento para el ganado, particularmente por su alta eficiencia al convertir agua en biomasa, y por su contenido de energía digestible. El nopal forrajero es útil no sólo porque sobrevive a las sequías, sino también porque es más eficiente que muchas gramíneas o pastos forrajeros de hoja ancha.
En México se llama nopal a varias especies del género Opuntia de la familia Cactaceae, todas ellas endémicas en América. De sus 377 especies reconocidas, 104 se encuentran silvestres en México y de éstas 60 son endémicas (Velázquez, 1998). La importancia del nopal como forraje en el siglo XIX fue reflejo de la necesidad de alimentación del ganado en zonas áridas del país, y en aquellas donde los periodos de sequía son muy prolongados, constituyendo el nopal un excelente alimento para el ganado (Flores y Aguirre, 1979).
Los sistemas de producción de nopal forrajero han cambiado con el tiempo, sobre todo en las nopaleras silvestres, siendo estas las primeras en ser utilizadas y las más abundantemente distribuidas en la República Mexicana, pues se reportan aproximadamente 3, 000,000 de hectáreas, en los estados de Zacatecas, Aguascalientes, San Luís Potosí, Jalisco, Coahuila, Nuevo León, Tamaulipas y Chihuahua (Flores y Aguirre 1992). Se ha comprobado que las plantaciones de Opuntia spp con fines forrajeros son costeables comercialmente, así lo demuestran trabajos realizados en México (Barrientos, 1969, Flores, 1992).
Las zonas áridas y semiáridas en México ocupan más de la mitad del territorio nacional y en estas áreas, las condiciones agroclimáticas dificultan la producción de forraje, por lo que la actividad ganadera enfrenta limitaciones para la alimentación adecuada del ganado. Tal situación ha provocado que los productores ganaderos acudan a la utilización de plantas adaptadas a condiciones adversas.
(Carranza, 2001), indica que el área ocupada de nopal para forraje en la parte norte y centro de México es de 15.84% de la superficie total, donde justifican su uso por ser un forraje fresco, suculento, de buena palatabilidad y susceptible de explotarse durante todo el año.
OBJETIVO GENERAL
Evaluar el efecto de un inoculo de levadura Kluyveromyces Lactis en la fermentación aeróbica en estado sólido del nopal forrajero. Opuntia spp. Genotipo AN-TV6.
Objetivos Específicos
Evaluar el comportamiento de los tratamientos, con el inoculo de levadura Kluyveromyces Lactis en el nopal forrajero. Verificar la funcionalidad del fermentador. Evaluar y monitorear el crecimiento de levaduras en los distintos tratamientos y en los diferentes tiempos de fermentación.
REVISION DE LITERATURA
La Ganadería y el Nopal Forrajero
Cuando México obtuvo su independencia, en 1821, la superficie nacional era de cuatro millones de kilómetros cuadrados, incluyendo los territorios de Texas, Nuevo México, Arizona y California. En estos territorios el nopal se usó como forraje desde 1857, mismo que se le proporcionaba picado o chamuscado al ganado (Flores y Aguirre, 1979), práctica que sin duda también se llevó a efecto en los estados mexicanos colindantes con los EE. UU. Así lo confirma el estudio realizado en México por Kaerger (1986), que tenía por objetivo ver en qué aspectos agropecuarios podían invertir los alemanes, sobre todo tomando en cuenta las facilidades que el gobierno de Porfirio Díaz daba a los extranjeros. Investigación que entre otras cuestiones permite conocer diferentes aspectos de la ganadería en México, y particularmente la utilización de las diferentes variedades del nopal que utilizaban los productores del norte del país para alimentar al ganado.
En el México independiente, la ganadería se desarrolló principalmente en el norte del país, se estableció en enormes ranchos; a tal grado llegó la concentración de la tierra que la familia Terrazas era dueña de casi todo el territorio del estado de Chihuahua. La cría masiva de ganado ovino, a finales del siglo XIX, se llevaba a cabo en el noroeste del país, especialmente en los estados de Zacatecas, Tamaulipas y Chihuahua, donde había haciendas que tenían entre 70, 000 y 80, 000 cabezas cada una (Kaerger, 1986). Las cabras abundaban en Puebla, Zacatecas, Aguascalientes, Tamaulipas y San Luis Potosí. El ganado vacuno se criaba fundamentalmente en el norte de México y en la región costera de Veracruz, donde habían empezado a mejorar la raza nacional con la introducción de toros Durham y Herford. Dentro de los potreros de engorda destacaron los ubicados en la Huasteca, la zona costera del norte de Veracruz y la región sureña de la costa de Tamaulipas, la mayor parte del estado de Tamaulipas se dedicaba a la cría de ganado menor.
En el norte del país los vaqueros, además de recorrer diariamente a caballo una determinada superficie de la hacienda para cuidar al ganado de posibles robos, y para atender animales enfermos, tenían la tarea de conseguirles alimento durante la seca. Lo hacían tumbando el agave conocido como sotol y trozando sus hojas y sobre todo cortando pencas de nopal y quemando sus espinas para que el ganado pudiera fácilmente consumirlas, aún cuando en muchas ocasiones las comían cuando la planta estaba en pie. Las nopaleras se encontraban con más frecuencia en San Luis Potosí, Tamaulipas y Nuevo León, en donde los agricultores distinguían las siguientes variedades (Kaerger, 1986):
Nopal rastrero: cactus que se desarrolla más hacia los lados y no hacia arriba. Es más consumido por las cabras que por el ganado vacuno. Nopal cuyo: cactus delgado con pocas espinas, muy preciado por el ganado vacuno. Nopal cardón (O. streptacantha): especie de tuna, con hojas anchas, cuyas frutas se utilizan para preparar, por fermentación, un tipo de vino mezclado con granos de maíz, manzanas y aguardiente de caña. El ganado vacuno sólo puede consumirlo durante las secas, ya que en las temporadas de lluvias se hincha demasiado (Bazant, 1980). Nopal segador: muy consumido por el ganado, aunque provoca ceguera en caso de que las espinas entren a sus ojos. Cardenche o cojonostle: tiene hojas grandes y cilíndricas (trozos de tronco), comidas con gusto por el ganado. Tasajillo: similar al anterior, aunque sus hojas son más pequeñas y de menor calidad. Las cabras comen mucho sus frutas (Kaerger, 1986).
Del nopal se utiliza: las pencas para alimento del ganado vacuno, cuando están frescas, y cuando están secas son un magnífico combustible, y las tunas, de las cuales se hace una riquísima bebida fermentada que se llama colonche; se hace también exquisita miel de tuna, se hacen melcochas y quesos, pudiéndose extraer también aguardiente de tuna (Márquez, 1986).
Las especies forrajeras más importantes según Flores y Aguirre (1979), son: Robusta (tapona, S.L.P.; Bartolona, Zac.): Aguascalientes, San Luis Potosí y Zacatecas. O. imbricata (nopal blanco): Aguascalientes. San Luís Potosí, Zacatecas, Durango, Coahuila y Nuevo León. O. lindheimeri (cacanapo): Aguascalientes, Tamaulipas, Nuevo León y Coahuila. O. rastrera (rastrero): Zacatecas San Luis Potosí, Nuevo León y Coahuila. O. cantabrigensis (cuijo): Coahuila, Nuevo León y Tamaulipas. O. streptacantha (cardón): Zacatecas y San Luis Potosí, Aguascalientes, Hidalgo y Estado de México. O. leucotricha (duraznillo): Aguascalientes, Durango, Zacatecas, San Luis Potosí.
El ganado también come plantas cubiertas con espinas o aguijones, sin que hayan sido chamuscadas por los vaqueros. A este grupo de plantas pertenece el mezquite, la lechuguilla (Agave lechuguilla), el agave del noreste utilizado para preparar las fibras de ixtle y el huapile, una Bromeliacea que cubre grandes superficies. La lechuguilla es muy nutritiva, aunque tiene la desventaja de volver salvajes a los animales al no necesitar tomar agua por la gran jugosidad de sus hojas (Kaerger, 1986).
El Nopal Forrajero Como Alimento en la Nutrición Animal
Uno de los problemas fundamentales que impiden el desarrollo de la industria ganadera nacional es la escasez de forraje. Esta se acentúa considerablemente en las zonas áridas y semiáridas del país, las que representan en su conjunto el 52% de la superficie total del territorio nacional.
Lo anterior ha originado que los productores de ganado recurran a la utilización de plantas adaptadas a la sequía, entre las que Marroquín, (1964) menciona a considerables especies del género Opuntia. En México se localizan 61 géneros de los 92 que existen en América del norte, esto lo ubica como centro de diseminación (Bravo, 1978). Carranza (2001), indica que el área ocupada de nopal para forraje en la parte norte y centro de México es de 15.84% de la superficie total, donde justifican su uso por ser un forraje fresco, suculento, de buena palatabilidad y susceptible de explotarse durante todo el año.
Es importante conocer la digestibilidad del nopal forrajero (Opuntia spp.) para su utilización como una fuente de alimentación para el ganado, ya que permite conocer la cantidad de alimento que es digerida por el animal. Existen diferentes métodos para la estimación de la digestibilidad de los alimentos, una de las más utilizadas es la bolsa de nylon, que consiste en colocar una muestra de alimento en bolsas hechas de material indigestible (nylon, dacrón o seda) en el rumen de animales fistulados por diferentes períodos de tiempo y se mide por la pérdida de materia seca o contenido de nutrientes después de un período especifico de incubación. Inicialmente esta técnica fue utilizada por Quin et al., (1938) citado por Romero (1990); usando bolsas cilíndricas de seda muy fina para medir la cantidad de alimento digerido en el rumen de ovejas. Posteriormente, la seda fue reemplazada por materiales sintéticos totalmente resistentes a la degradación ruminal; así Schoeman et al., (1972), citado por Hernández (1995) utilizaron bolsas de poliéster, y Meherz y Orskov, (1977) sugirieron la utilización de bolsas de nylon, que junto con las de dacrón, son las más utilizadas actualmente.
Basado en el proceso anterior el presente trabajo tuvo como objetivo: Evaluar el valor nutritivo de cuatro especies de nopal Opuntia lindheimeri Var. Lindheimeri, Opuntia rastrera, Opuntia. megacantha y Opuntia. lindheimeri Var. Subarmatha mediante la determinación de la digestibilidad in-situ r el análisis químico proximal de diferentes variedades nopaleras (Cuadro 1 ).
Felker (1999) reporta un gran número de revisiones regionales de nopal forrajero alrededor del mundo las cuales son técnicamente satisfactorias, por ejemplo para el Norte de África (Monjauze y Le Houérou, 1965), Sudáfrica (Wessels, 1988), México (Flores-Valdez y Aguirre- Rivera, 1992; Fuentes-Rodríguez, 1991), Brasil (Domingues, 1963) y para los Estados Unidos (Felker, 1992). El Nopal (Opuntia sp) se ha dado como alimento al ganado de leche y carne, a bueyes, ovejas y puercos, eliminando las espinas por medio del chamusque). Bajo condiciones de nopaleras silvestres se tiene que el nopal lo consumen los venados, jabalíes, conejos, liebres rata de campo, otros roedores y también pájaros como cuervos y carpinteros.
Cuadro 1. Análisis bromatológico de diferentes géneros, especies y variedades de nopal.
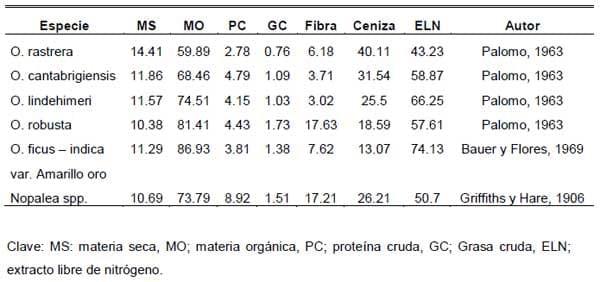
En el Caso del venado cola blanca la Comisión Estatal sobre Flora y Fauna Silvestre del Estado de Nuevo León, reporta que en exámenes de los alimentos consumidos y depositados en el rumen de este animal, se ha podido detectar que hasta un 80% de su dieta está constituida por nopal. Con respecto a las variedades cultivadas de nopal las cuales tienen poca espina, el conejos ejerce una presión extrema sobre los materiales sin espina.
En Estados Unidos especialmente en Texas, Arizona, Nuevo México y en menor proporción California, al nopal forrajero silvestre se le ha considerado de gran valor para el ganado bovino. En la región noroeste semiárida de Brasil se cultivan cerca de 300,000 ha de nopal sin espinas para forraje (Domingues, 1963). En la primavera de 1992, Felker observó que como resultado de la sequía no se tuvo germinación del maíz, pero que cada 10 km había una plantación viva de nopal sin espinas de 2 a 10 ha y en crecimiento.
Las plantaciones de nopal sin espina de Brasil están protegidas con una cerca estándar de alambre o de madera de 1.2 m. En contraste, en Texas y el norte de México las plantaciones de materiales sin espina deben estar muy protegidos (con cerca de alambre de 2.4 m de alto y malla de 5 cm en la base) contra herbívoros como conejos, ratas y animales silvestres (especialmente venados y pecaris), en otros países las ovejas, las cabras y el ganado pueden ser un problema. El uso de cercas eléctricas puede permitir que el ganado coma de una sola hilera a la vez, de la plantación del nopal sin espinas. Mientras que las plantaciones de nopal sin espina necesitan de protección, los tipos con espinas no necesitan de cercas; sin embargo se deben de eliminar las espinas por medio del chamuscadora.
El Nopal en la Alimentación de Ovinos
Delgado y Delgado (1997) evaluaron la composición química de cinco variedades de nopal y encontraron contenidos de proteína de entre 8.8 y 9.6% (base seca) en las variedades Chicomostoc, Esmeralda y San Lorenzo, respectivamente. De acuerdo con Ramírez (2004), el nopal de la región noreste de México contiene entre 4 y 6% de proteína cruda en las diferentes estaciones del año.
La principal causa que limita el consumo de nopal en borregos es su alto contenido de agua, aunque en condiciones de sequía esto puede representar una ventaja, ya que se ha observado que borregos pueden estar consumiendo nopal fresco por varios meses sin tener acceso a agua de bebida. Cuando se quiera que los borregos consuman mayor cantidad de nopal se recomienda deshidratar o marchitar por unas horas el nopal picado para antes de suministrarlo en los comederos.
Flores y Aguirre (1992) muestran claramente en su revisión, que borregos consumiendo nopal con diferentes concentraciones de materia seca ya sea en forma de nopal fresco, oreado o deshidratado, su consumo de agua en bebedero aumentaba considerablemente al disminuir la concentración de agua en el nopal, representando el agua suministrada por el nopal el 99, 77 y 12 %, cuando se ofreció fresco, oreado y seco, respectivamente. Esto es similar en los bovinos, aunque los borregos y cabras son mucho más eficientes para llenar sus requerimientos de agua a partir del nopal por dos razones: las excretas de ovinos y caprinos contienen mayor materia seca, y porque los ovi-caprinos consumen mayor cantidad de alimento en base a su peso vivo que los bovinos.
Para el caso de ovinos, Flores y Aguirre (1992) reportan consumos de nopal fresco de 6.5 a 11 kg/animal/día, lo que equivale a un consumo de materia seca de 0.85 a 1.4 kg/animal/día. Es muy importante señalar que para obtener los consumos máximos de forrajes deficientes en proteína cruda (como es el nopal) resulta indispensable hacer la suplementación correspondiente para evitar así deficiencias de nitrógeno a los microorganismos del rumen, una deficiencia de proteína en el rumen imposibilitaría a los microorganismos a hacer la digestión normal de la fibra. (Hernández, 1995)
El alto nivel de humedad del nopal hace que normalmente no sea posible para el animal consumir la materia seca requerida para lograr mejor comportamiento animal en términos de producción de leche o ganancias de peso. Borregos recibiendo nopal oreado o fresco consumieron un 22 y 32 % menos materia seca que borregos recibiendo nopal deshidratado (507 g/d).
Los altos niveles de humedad, aunados al alto contenido de minerales y baja concentración de proteína cruda, hacen que el ganado recibiendo nopal como única dieta presente diarreas, compactación ruminal y pérdida de peso. Por lo anterior, la estrategia elemental consiste en utilizar las máximas cantidades de nopal en la dieta, siempre y cuando estén presentes fuentes de proteína cruda, fósforo y otros nutrientes que permitan al animal expresar adecuados índices productivos al más bajo costo. (Hernández, 1995).
En general, el uso del nopal en la alimentación del ovino bajo condiciones semi-estabuladas debe de ser para complementar el consumo de forraje que el borrego está realizando directamente a través del pastoreo. Esta práctica puede ser adecuada para el hato de borregas adultas en situaciones de mantenimiento o los primeros 3 meses de preñez. La suplementación de proteína en conjunto con la alimentación del nopal dependerá del estado de madurez del forraje pastoreado por el hato.
Uso Alternativo del Nopal Forrajero
El nopal forrajero es una planta muy atractiva como alimento para el ganado, particularmente por su alta eficiencia al convertir agua en biomasa, y por su contenido de energía digestible. El nopal forrajero es útil no sólo porque sobrevive a las sequías, sino también porque es más eficiente que muchas gramíneas o pastos forrajeros de hoja ancha. La importancia forrajera del nopal Opuntia spp aplica para el ganado, pero también ha sido usado como forraje para cerdos. Aún durante los períodos de sequía en el verano o el invierno, el nopal permanece verde, con buen nivel de vitamina A. Sin embargo, debe ser combinado con otros alimentos para complementar la dieta diaria, debido a que tiene bajo contenido de proteína, a pesar de ser rico en carbohidratos y calcio.
Las variedades sin espinas son preferidas para la producción de forraje debido a su facilidad de manejo y proceso, ya que con estas especies se evita el chamusque cuando se alimenta al ganado. Las variedades de nopal COPENA F1, Liso Forrajero, Pabellón, etc. sin espinas pueden llegar a producir de 200 a 400 t/ha de peso fresco dependiendo de del manejo del cultivo (Vazquez y Gallegos, 1997), por lo que pueden proveer una reserva considerable de alimento para el ganado.
Sin embargo, los costos de establecimiento y manejo de este tipo de variedades de nopal sin espinas no necesariamente lleva a generar sistemas de producción rentables por lo que se requiere continuar observando los usos tradicionales del nopal nativo (chamuscado o no chamuscado) de tal manera que esto contribuya a contar con diferentes opciones para el productor agropecuario. Además, en algunos sitios muy particulares en la zona de los municipios de China, General Bravo y Paras, N. L., el nopal puede llegar a ser considerado como una planta seriamente invasora, y en este caso, con su aprovechamiento no solo se logra obtener recursos forrajeros de alta calidad, sino que además se realiza un mejoramiento de las praderas que tienen pastos introducidos (como el zacate Buffel).
Fermentación del Nopal
La fermentación dirigida de ingredientes de alta digestibilidad como la melaza, pulpa de cítricos, subproductos de frutas etc. ha sido utilizada por muchos años en Cuba (Elías y Lezcano, 1993; Elías, 2007) y recientemente en México (Aranda, 2006). Hasta ahora, la tecnología que ha sido propuesta para su aplicación por investigadores brasileños y mexicanos (Aranda, 2006) involucra una tecnología laboriosa y de alto costo ya que se requiere deshidratar y moler el nopal previo a la fermentación, situación que compromete su aplicación para aquellos pequeños y medianos productores.
Existen ingredientes similares en calidad al nopal como la melaza, subproductos de manzana, cítricos etc que pueden ser mejorados sustancialmente a través de los procesos de fermentación dirigida. Gutiérrez et al., (2007) han estado utilizando este tipo de procesos para producir un fermentado del bagazo de manzana teniendo como objetivo el obtener un producto de mayor calidad debido al aumento en el nivel y calidad de las proteínas. Lo anterior se logra a través de las levaduras y los carbohidratos que posee el bagazo, elementos fundamentales para llevar a cabo el proceso de fermentación aerobia. El proceso es sencillo y económico, ya que solo se necesita del bagazo, una superficie plana forrada de concreto, urea adicionada en una proporción del 1.5 %, sulfato de amonio en 0.4 % y sales minerales en 0.5 % Becerra y Díaz (2006). La fermentación del nopal podría contribuir a mejorar la cantidad y la calidad de la proteína para los animales.
Valor Nutritivo y Propiedades Funcionales del Nopal
Últimamente la tendencia general en el consumo de alimentos es buscar un buen aporte de nutrientes y que además los alimentos sean beneficiosos para la salud. En este contexto existe una nueva gama de alimentos: son los llamados alimentos funcionales, de los que se espera no solo un aporte nutritivo, sino un beneficio para la salud y para la prevención de enfermedades (Saenz, 2004).
Los compuestos funcionales son aquellos que tienen efectos beneficiosos para la salud y tanto los frutos como los cladodios de la tuna son una fuente interesante de tales componentes, entre los que destacan la fibra, los hidrocoloides (mucilagos), los pigmentos (betalainas y carotenoides), los minerales (calcio, potasio), y algunas vitaminas como la vitamina C, buscada entre otros motivos, por sus propiedades antioxidantes; todos estos compuestos son muy apreciados desde el punto de vista de una dieta saludable y también como ingredientes para el diseño de nuevos alimentos (Saenz, 2004). Los contenidos de estos compuestos son distintos en frutos y cladodios, siendo la pulpa de la fruta la parte más rica en vitamina C mientras que los cladodios son más ricos en fibra. Los pigmentos solo se encuentran en los frutos y tanto las betalainas como los carotenoides pueden estar presentes en la cascara y en la pulpa de los diversos ecotipos y variedades.
Estos compuestos forman parte de los alimentos que se conocen como alimentos funcionales, los cuales se definen como un alimento o bebida que proporciona un beneficio fisiológico, que fortalece la salud, ayuda a prevenir o tratar enfermedades, o mejora el rendimiento físico o mental por la adición de un ingrediente funcional, por la modificación de un proceso o por el uso de la biotecnología (Sloan, 2000).
Actividad Antioxidante del Nopal
Actualmente se ha demostrado que extractos de nopal presenta una considerable actividad antioxidante, inhibiendo la producción de especies reactivas de oxigeno como los aniones superoxido (O2.-), radicales hidroxilo (·OH) y otros radicales como los DPPH, peroxinitrito (ONOO-) entre otros. Diversas investigaciones han aislado un gran número de componentes con actividad secuestrante a los radicales libres, lo cual confiere su actividad antioxidante, y utilizando diferentes sistemas de evaluación han podido definir un efecto dependiente de la dosis. Los extractos de nopal y tuna, han mostrado ser efectivos protectores contra el rompimiento de hebras de ADN (Guevara, 2009).
En células corticales de ratón han mostrado actividad neuroprotector al evitar la oxidación de las mismas, mediante el secuestro de radicales oxidativos como el ONOO-. Este efecto neuroprotector se atribuye al poder antioxidante de compuestos presentes en el extracto como la quercetina y derivados. En humanos se ha demostrado que el consumo de nopal y tuna afecta positivamente el balance redox corporal, decrece el daño oxidativo en lípidos y mejora el estado antioxidante general. Estudios in vitro y en animales han mostrado que extractos de tuna al 25% poseen efectos anticancerígenos (inducción de apoptosis), lo cual se ha demostraron en líneas células cancerosas de tejido cervicouterino, ovario y vejiga. Es importante señalar que el extracto de tuna indujo cambios morfológicos y afectó de diferente manera el ciclo celular de las diferentes líneas celulares. Tales efectos se asociaron a su elevada capacidad antioxidante (Guevara, 2009).
Actividad Prebiótica del Nopal
Los probióticos y los prebióticos se definen como microorganismos vivos seleccionados que, al ser ingeridos vivos en cantidades suficientes ejercen un efecto positivo para la salud más allá de los efectos nutricionales tradicionales. Las cuales están siendo estudiados hace más de 30 años.
Además son limpiadores del intestino, eliminan toxinas y las fibras ayudan a mejorar el tiempo de transito, las bacterias de la pared intestinal son despojadas alterando desfavorablemente el equilibrio de las 100 billones de bacterias que son residentes en dicha pared. Adicionalmente, los limpiadores o fibras no hacen nada para ayudar a nuestro cuerpo a vigilar la carga astronómica adicional de bacterias que atraviesan nuestros cuerpos todos los días, que constituye un mínimo del 40% del peso seco de la materia fecal.
Los prebióticos estimulan la activación del crecimiento de otras bacterias buenas en el intestino. Estas no son digeribles. Tales prebióticos serian los oligosacaridos en alimentos que promueve el crecimiento normal, y se encuentran en el colon. También existen otras sustancias en alimentos como almidón, fibras que pueden trabajar como prebióticos. Los probióticos son las bacterias es decir son cultivos activos, tales como las bacterias del ácido láctico y alimentos que lo contengan que ayudan el intercambio de bacterias en el intestino. Lactobacillis y Bifidobacterias están en el yogurt.
Los prebióticos son ingredientes alimenticios que presentan la característica de resistir la digestión en el estomago e intestino delgado y llegan a ser disponibles en el colon, donde son selectivamente fermentados por Bifídobacterias y Lactobacilos, generando ácidos grasos de cadena corta (butírico, acético y propiónico), (Sáenz, 2006).
Estos microorganismos son denominados probióticos y se han asociado con efectos benéficos para la salud, entre los que destacan, el incremento en la resistencia contra la colonización de microorganismos patógenos, estimulación del sistema inmune del hospedero, inducción de la apoptosis de células cancerosas, entre otros. Los pectin-oligosacáridos (PO) presentes en el nopal estimulan el desarrollo de bifidobacterias, por su parte los mucílago-oligosácaridos (MO) generan un incrementó en el desarrollo de Lacto bacilos.
La suplementación MO y PO de nopal generó un incremento de hasta el 35% en la producción de ácidos grasos de cadena corta.
MATERIALES Y METODOS
Esta investigación se llevó a cabo en la Facultad de Zootecnia de la Universidad Autónoma de Chihuahua, en el laboratorio de Nutrición Animal. La precipitación media anual es de 336 mm. La temperatura media anual es de 18.6 ºC, con un periodo libre de heladas de 223 d (INEGI, 2001). Esta investigación se llevo acabo de Septiembre a Octubre de 2009.
TRATAMIENTOS
CUDRO 2.
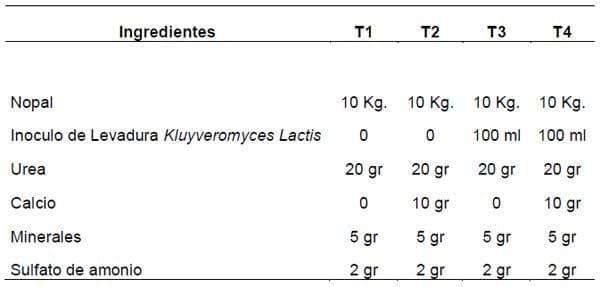
Procedimiento de las Muestras
Se prepararon cuatro tratamientos, (t) para evaluar la fermentación en estado sólido de nopal forrajero. T1) 10 kg de nopal forrajero. T2) 10 kg de nopal forrajero mas 10 gr de calcio. T3) 10 kg de nopal forrajero mas 100 ml de inoculo de levadura Kluyveromyces lactis. T4) 10 kg de nopal forrajero mas 100 ml de inoculo de levadura Kluyveromyces lactis y 10 gr de calcio. Todos los tratamientos contaron con la adición de 20 gr de Urea, 2 gr de sulfato de amonio, 5 gr de minerales traza para favorecer el crecimiento de levaduras. Sus combinaciones fueron evaluadas en 1 fermentador vertical, mecánico eléctrico de 15 kg cada tratamiento consto de 3 repeticiones. Durante el periodo de fermentación se ponía a trabajar el fermentador por 30 minutos antes de cada muestreo, esto con la finalidad de proporcionar el oxigeno necesario en el fermentador para que se desarrollen los microorganismos aeróbicos y tener un producto más homogéneo de las muestras. Fueron tomadas 3 muestras por tratamiento en los diferente tiempos (0, 6, 12, 24 y 48 h). A lo que posterior mente se determinó: temperatura, pH, Amoniaco, Acido Láctico, Conteo de levaduras, Azucares Solubles, Proteína cruda y Materia seca.
Mediciones en muestras líquidas
De la hora 0 a la 48 se tomo una muestra de cada repetición de 200 gr, en frascos de platico y se congeló a -5°C para detener el proceso de fermentación y posteriormente, se descongelaron a temperatura de refrigeración 4°C para determinar Amoniaco, Acido Láctico y conteos de levaduras como se describe a continuación.
pH. Se midió directamente en los frascos de plástico, donde se recolectaron las muestras a la hora mencionada de cada muestreo, se determinó el pH midiéndolo con un potenciómetro digital de una precisión de ±0.1 unidades, se tomo como base la metodología descrita por Rodríguez et al. (2001).
Temperatura. Se midió directamente con la ayuda de un termómetro digital de una precisión de ±0.1.
Azucares Solubles (AS). Se determino por medio de un Refractómetro digital HI 96811, utilizando 3 gotas de muestra de los diferentes tratamientos en las diferentes horas de muestreo para evaluar el contenido de azúcar y lo convierte en unidades Brix % de azúcar en la concentración.
Conteo de Levaduras (CL). Para este análisis se tomó como base, la metodología descrita por Díaz (2006) y Rodríguez et al. (2001). Se realizó en todas las muestras en las diferentes horas de muestreo, las muestras de 30 ml fueron depositadas en frascos de plástico con tapa de 50 ml; en cada muestra, se agregaron dos agotas de solución de formalina al 10% para preservarla en refrigeración hasta realizar el conteo.
El CL se realizó por microscopía; con una pipeta de volumen variable con un rango de 100 a 1000 μl y puntas desechables se tomó 1 ml de muestra líquida y se preparó una dilución serial utilizando agua destilada como diluyente; con una pipeta de volumen variable con un rango de 0.5 a 10 μl y puntas desechables se tomaron 10 μl de la dilución -3 o -4 de cada muestra, y se colocaron en un hematocímetro (cámara de Neubauer) para el conteo.
La solución de muestra más agua destilada preparada inicialmente, se consideró la dilución -1; la cámara de Neubauer se lavó con alcohol etílico desnaturalizado después de cada CL. Cada célula o grupo aglomerado de células identificadas como levaduras se consideró como una unidad formadora de colonias (ufc), se calculó el promedio de ufc por cuadrante y se multiplicó por 10,000 para obtener la cantidad de ufc*ml-1 y por 10-n para obtener las ufc*g-1 de muestra (-n es la dilución con la que se realizó el conteo), los datos se convirtieron al logaritmo base 10 (Log10 ufc*g-1 MS) para su análisis estadístico.
Nitrógeno Amoniacal (N-NH3). De las muestras líquidas obtenidas del la h0 a la h48 se tomaron 30 ml de la solución, se colocaron en recipientes de plástico, se agregaron dos gotas de ácido ortofosfórico y se congelaron (-5°C) para su conservación hasta el momento de la determinación de N-NH3 al momento de la determinación, las muestras se descongelaron a temperatura de refrigeración, (4°C) la concentración de N-NH3 de las muestras líquidas se determinó por colorimetría según el procedimiento de Taylor (1996), en un espectrofotómetro Coleman Junior® II modelo 6|20. Fue necesario diluir las muestras líquidas con agua destilada, a una concentración de 80 μg de la muestra.
La ecuación de predicción para calcular la concentración de N-NH3 en las muestras líquidas, se obtuvo del análisis por triplicado de soluciones estándar con concentraciones de 0, 5, 10, 15, 20 y 25 μg de N-NH3 *ml-1; se utilizó H2Od como blanco (estándar con concentración de 0 μg*ml-1).
El procedimiento para medir la absorbancia de las muestras líquidas diluidas, de las soluciones estándar y de los blancos (0 μg*ml-1), se realizó por triplicado y consistió en lo siguiente: en tubos de ensayo se agrego 920 μg de agua destilada y 80 μg de la muestra concentrada para completar 1 ml, se mezclaron en vórtice (Vortex Genie II) posteriormente se tomo 50 μg de la muestra diluida para cada repetición y se deposito en tubos de ensayo, a lo que se le agrego 2.5 ml de fenol y se mezclo en un vórtice, posteriormente se agrego 2 ml de hipoclorito y se mezclo nuevamente, para el estándar o del blanco, se agrego 50 μg de agua destilada, 2.5 ml de fenol y 2 ml de hipoclorito, las soluciones obtenidas se mezclaron en un vórtice y se incubaron por 5 minutos en baño de agua caliente (temperatura de 95~100°C).
Posteriormente, las muestras se dejaron enfriar por 5 minutos a temperatura ambiente para después tomar la lectura de la absorbancia del contenido de cada muestra, se midió a una longitud de onda de 630 nm; previamente el valor de la absorbancia fue ajustado a 0 utilizando los blancos como referencia. Este procedimiento se describe brevemente por Madrid et al. (1999), ellos utilizaron 6 ml de solución de H2SO4 concentrado y 1 ml de muestra líquida para el análisis, en este trabajo se modificó a 3 ml de H2SO4 y 0.5 ml de muestra debido al tamaño de las celdas del espectrofotómetro. Con los resultados de la absorbancia de las muestras líquidas diluidas, la ecuación de predicción obtenida con las soluciones estándar y el porcentaje de dilución de las muestras líquidas en agua, se calculó la concentración de N-NH3 en miligramos por gramo de muestra (mg*g-1) en base húmeda (BH).
Ácido Láctico (AcL). De las muestras líquidas obtenidas de la h0 a la h48 para determinar pH, se tomaron 30 ml de la solución, se colocaron en recipientes de plástico, se agregaron tres gotas de ácido orto fosfórico y se congelaron (-5°C) para su conservación hasta el momento de la determinación de AcL. Al momento de la determinación, las muestras se descongelaron a temperatura de refrigeración, se centrifugaron a 1,500 g por 15 minutos y permanecieron en refrigeración (no más de 48 h) mientras se procedió con el análisis. La concentración de AcL de las muestras líquidas se determinó por colorimetría según el procedimiento de Taylor (1996), en un espectrofotómetro Coleman Junior® II modelo 6|20. Fue necesario diluir las muestras líquidas con H2Od, a una concentración de entre 3 y 7.5% dependiendo de la muestra.
La ecuación de predicción para calcular la concentración de AcL en las muestras líquidas, se obtuvo del análisis por triplicado de soluciones estándar con concentraciones de 0, 5, 10, 15, 20 y 25 μg de AcL*ml-1; se utilizó H2Od como blanco (estándar con concentración de 0 μg*ml-1).
El procedimiento para medir la absorbancia de las muestras líquidas diluidas, de las soluciones estándar y de los blancos (0 μg*ml-1), se realizó por triplicado y consistió en lo siguiente: en las celdas del espectrofotómetro, se agregaron 3 ml de H2SO4 concentrado y 0.5 ml de la muestra diluida, del estándar o del blanco, las soluciones obtenidas se mezclaron en vórtice (Vortex Genie II) y se incubaron por 10 minutos en baño de agua caliente (temperatura de 95~100°C).
Posteriormente, las celdas con solución se enfriaron en baño de agua a temperatura ambiente para después, agregar 100 μl de solución de CuSO4 al 4% y 200 μl de solución de 1.5% de p-fenilfenol en etanol al 95% en cada celda; las soluciones obtenidas se mezclaron en vórtice nuevamente y se dejaron reposar por al menos 30 minutos a temperatura ambiente (no menos de 20°C).
Por último, la absorbancia del contenido de cada celda se midió a una longitud de onda de 570 nm; previamente el valor de la absorbancia fue ajustado a 0 utilizando los blancos como referencia. Este procedimiento se describe brevemente por Madrid et al. (1999), ellos utilizaron 6 ml de solución de H2SO4 concentrado y 1 ml de muestra líquida para el análisis, en este trabajo se modificó a 3 ml de H2SO4 y 0.5 ml de muestra debido al tamaño de las celdas del espectrofotómetro. Con los resultados de la absorbancia de las muestras líquidas diluidas, la ecuación de predicción obtenida con las soluciones estándar y el porcentaje de dilución de las muestras líquidas en agua, se calculó la concentración de AcL en miligramos por gramo de muestra (mg*g-1) en base húmeda (BH).
Mediciones en las Muestras Deshidratadas
Las muestras de sustrato tomadas de la h0 a la h48 conservadas en congelación, fueron descongeladas a temperatura de refrigeración, después de haber utilizado una parte de estas para obtener las muestras líquidas, se tomo el resto de cada muestra, se registró su peso y se deshidrataron a 60°C por 48 h, de este modo se calculó su contenido de humedad y posteriormente, con estos datos se calculó la proporción y el comportamiento de la MS de los diferentes sustratos (tratamientos) durante el proceso de FES.
Las muestras deshidratadas de la h0, h6, h12, h24 y h48 de cada uno de los tratamientos, se molieron (malla de 1 mm, molino Wiley) y se utilizaron para las determinaciones que se mencionan a continuación.
Materia Seca (MS). Se determinó la MS en las muestras deshidratadas de la h0, de cada unos de los diferentes tratamientos utilizando los procedimientos de la A.O.A.C. (1990); el porcentaje de muestra libre de humedad se multiplicó por el porcentaje de MS de la muestra deshidratada para calcular el porcentaje de MS total.
Proteína Cruda (PC). Se determinó PC utilizando de 0.2 g de las muestras deshidratadas a 60°C y molidas a 1mm obtenidas de las h0, h6, h12, h24 y h48, de cada uno de los diferentes tratamientos evaluados del proceso de fermentación únicamente, el análisis se hizo con el procedimiento Kjeldahl (A.O.A.C., 1990), el resultado se expresó en porcentaje de PC en BS.
RESULTADOS Y DISCUSIÓN
Con la finalidad de estudiar y evaluar el comportamiento de la fermentación del nopal, por medio de la fermentación en estado sólido (FES) y el efecto del calcio y el inoculo de levadura Kluyveromyces Lactis en el nopal forrajero, genotipo AN-TV6; estudiar la funcionalidad del fermentador utilizado, así como monitorear el crecimiento de levaduras y la proteína cruda (PC) en los distintos tratamientos y en los diferentes tiempos de fermentación en condiciones de laboratorio.
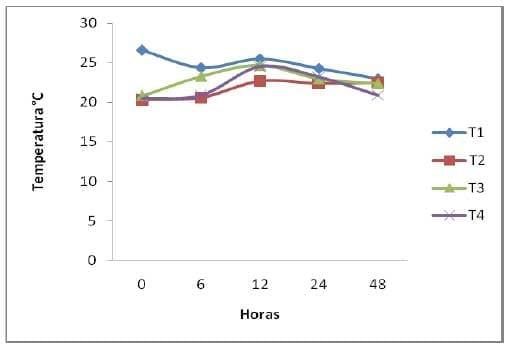
Temperatura (T). Los organismos que consumen oxigeno, producen calor debido a su actividad metabólica, por esta razón esta variable es un indicador de actividad metabólica y es importante en la (FES) ya que indica si existe o no este tipo de actividad biológica. Esta variable tuvo un comportamiento similar para todos los tratamientos entre sí, la temperatura se incremento a partir de la h6 siendo así que a la h12 presento la temperatura más alta de 25.5 °C para el T1; 24.7 para el T4; 24.5 para el T3 y de 22.7 para el T2; posteriormente disminuyo la temperatura de manera gradual para todos los tratamiento hasta mantenerse cerca de la temperatura de incubación a la h6, el calor acumulado en los sustratos fermentados es el resultado de la actividad metabólica de los microorganismos presentes y también puede ser afectada por la conductividad del material biológico fermentado.
En el proceso de obtención de la Saccharina que es (similar al de manzarina), la T interna tiende a mantenerse constante a pesar de los cambios de T ambiental; aun así, esta puede influenciar ligeramente la T del sustrato (Ruiz et al., 2002). Según los datos estimados, en todos los tratamientos, la T se comporto de una manera similar para los tratamientos de nopal en los diferentes tiempos y con el sustrato de levadura, indicando una actividad biológica como lo menciona Ibarra et al., (2002). La fermentación del nopal no fue la excepción ya que este mismo efecto se presento a partir de la hora de incubación a las 6h de haber iniciada la fermentación y alcanzo su pico más alto a las 12h para todos los tratamientos y posteriormente fue disminuyendo de una manera similar y gradual para todos los tratamientos manteniendo una temperatura de 22.5 °C a las 48h de fermentación (Grafica1).
pH. Es una condición química que refleja la concentración de productos acidificantes o alcalinizantes en un medio, este indicador representa una condición química, cuando se encuentra a un nivel bajo, inhibe la proliferación de ciertas bacterias, su nivel alto o bajo es dependiente de la presencia de asidos y otros compuestos como el NH3. La adición de calcio en los tratamientos 2 y 4 se vio reflejada a lo largo de toda la fermentación en comparación con los tratamientos 1 y 3 que no tenían, siendo así que se vio favorecida la producción de levaduras (grafica 2).
Según los valores estimados, de la h 0 a la h 48 de FES, el pH del t1 se vio afectado de 4.91 h0 a 4.67 en la h48. El pH del t2 se incremento de 4.87 h0 a 5.05 en la h12 con la adición del calcio y posteriormente se redujo a 4.55 h48. El t3 puedo mantenerse estable hasta la h6 y se vio afectado a 4.36 h48. El t4 se mejoro de 4.73 h0 a 4.3 h12 con la adición de calcio y posteriormente se vio ligeramente afectado hasta llegar a los 4.45 h48.
Temperatura por tratamiento en las diferentes horas
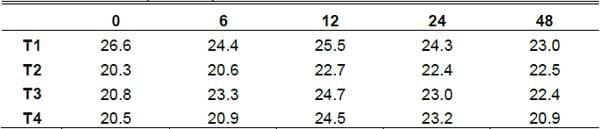
Grafica 1. Comportamiento de la temperatura durante la fermentación.
pH por tratamientos en las diferentes horas
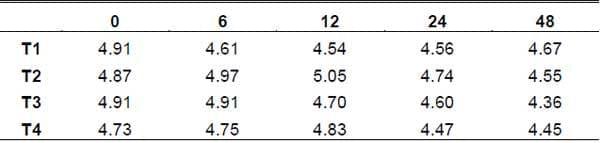
Grafica 2. Comportamiento del pH en las diferentes horas de fermentación.
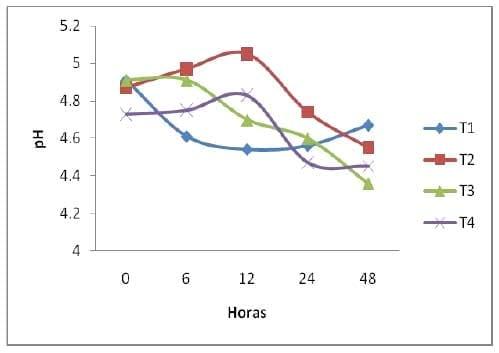
En algunos sustratos, la disminución de pH está relacionada con el incremento de la concentración de ácidos orgánicos; la producción de ácidos orgánicos que es el resultado del consumo de carbohidratos de fácil fermentación (Calderón et al., 2005). El incremento de pH está relacionado directamente con la producción de NH3 y con una menor producción de ácidos orgánicos.
El incremento de pH en los tratamientos 2 y 4 fue favorecido por la aportación del calcio hasta la h12, por lo que hubiera sido conveniente utilizar otra fuente de calcio para mantener estable el pH a lo largo de la fermentación, ya que los tratamientos que no tenían calcio los pH se mantuvieron bajos en comparación con los otros tratamientos, ya que es de vital importancia en este tipo de fermentaciones mantener el pH arriba de 5 para obtener una mejor fermentación.
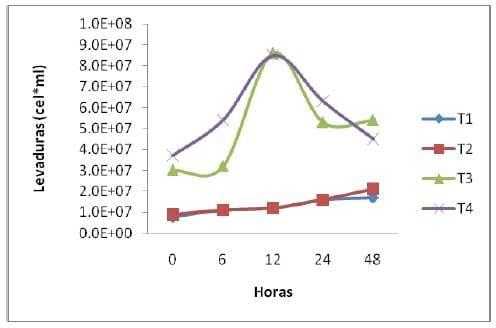
Conteo de Levaduras (CL). La concentración más alta de levaduras se observo en el t3 y t4 que contenían el inoculo de levaduras, siendo de 8.6*107 cel*ml/L en el t3 en la h12 y para el t4 de 8.5*107 cel*ml/L en la h12, mientras que el t1 y t2 que no se le aplico el inoculo fue mucho menor, con 1.7*107 cel*ml/L para el t1 a la h48 y 2.1*107 cel*ml/L en la h48.
El crecimiento de algunos microorganismos que se encuentran presentes de manera natural en diferentes tipos de sustratos, se ve potencializado por la presencia de carbohidratos fermentables, iniciando así con el proceso de FSS cuando hay condiciones de presencia de oxigeno disuelto en el medio y otros nutrientes como el NNP. En este caso las levaduras son más favorecidas por NNP que fue aportado por la urea y el sulfato de amonio (Elías et al., 1990). El calcio también pudo favorecer la fermentación y la producción de levaduras en los tratamientos 2 y 4 ya que los pH fueron más estables que el de los tratamientos 1 y 3 (grafica 3). Cabe mencionar que el aporte del inoculo en los tratamientos 3 y 4 si contribuye a mejorar la fermentación del nopal, aunque hubiera sido mejor si hubiéramos agregado algo de melaza de caña y salvado de trigo para estimular el crecimiento de las levaduras y aumentar la materia seca del nopal.El incremento en la calidad nutritiva de algunos sustratos fermentados, se puede atribuir en gran parte al incremento de la población de levaduras, es conocido desde hace décadas que su valor proteico es alto.
Cabe mencionar que el nopal tiene sus propias levaduras y sus propios microorganismos que ayudarían a fermentar el nopal de una manera natural, por lo que bastaría agregar Urea, Sulfato de amonio y minerales para obtener una fermentación y una producción de levaduras del nopal.
Nitrógeno Amoniacal (NH3). Se observo diferencia entre tratamientos (Graficas 4). En este trabajo, de la h0 a la h48 de la FES, la concentración de NH3 en los tratamientos se incremento de 0.25 a 0.35 mM/ml en el t1, para el t2 de 0.37 a 0.88 mM/ml, para el t3 de 0.45 a 0.42 mM/ml y para el t4 de 0.14 a 0.39 mM/ml indicando actividad de los microorganismos ureoliticos. El NH3 como compuesto puede ser utilizado por ciertos microorganismos que no hidrolizan la urea agregada, como resultado de esto, la cantidad de algunos microorganismos presentes en los sustratos fermentados se puede incrementar (Valiño et al., 2002).La urea añadida a los sustratos en procesos de FES, es transformada a NH3 por efecto de especies microbianas ureoliticas (Valiño et al., 2002; Calderón et al., 2005), si el sustrato tiene un aporte energético bajo, los microorganismos no pueden incorporarlo en la formación de aminoácidos para su crecimiento o lo hacen en una proporción baja. Cuando se tiene un pH bajo, el NH3 producido es retenido en el sustrato (Rodríguez et al., 2001). El NH3 también puede producirse por actividad desaminativa (Calderón et al., 2005).
Levaduras por tratamientos en las diferentes horas
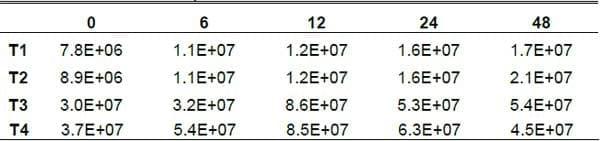
Grafica 3. Producción de levaduras en los diferentes sustratos y con las diferentes levaduras durante el tiempo de fermentación.
Amoniaco por tratamientos en las diferentes horas
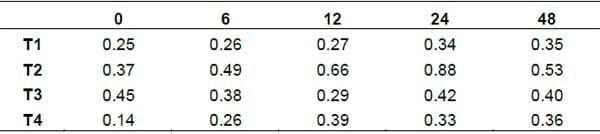
Grafica 4. Comportamiento del Amoniaco por tratamiento a diferentes tiempos de fermentación.
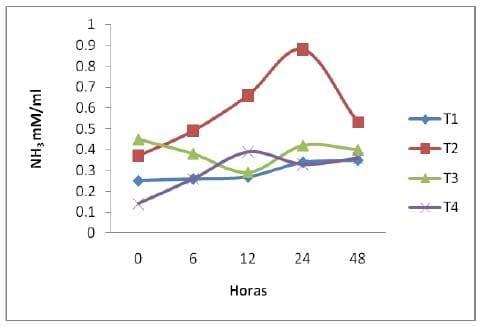
Cabe señalar que el comportamiento del pH es algo similar con el incremento del NH3 en la fermentación del nopal mas no con la producción de levaduras levaduras, al parecer la disponibilidad de NH3 en los tratamientos de nopal se vio afectado por el pH.
Ácido Láctico (AcL). Se observo diferencias por tratamiento sobre la concentración de AcL en BH; su comportamiento fue distinto en cada tratamiento (grafica 5). En el t4 fue mayor la cantidad de AcL en la h12 la concentración de AcL fue similar el comportamiento para el resto de los tratamientos presentando un efecto claro a las 12h de iniciada la fermentación entre tratamientos y similar para el resto de las horas de fermentación. El AcL es producido por la metabolización de carbohidratos (Rodríguez et al., 2001), es un indicador de la fermentación de forrajes en condiciones anaerobias (Madrid et al., 1999) y es un producto común en el ensilaje del BM; en el cual se puede empezar a acumular desde su almacenamiento (Anrique y Viveros, 2002).
En los tratamientos que contenía el inoculo de levadura (t3 y t4), se deben haber creado micro áreas con condiciones de anaerobiosis como sucede en la FES de mezclas de caña de azúcar con boniato (Rodríguez et al., 2001), permitiendo la formación de AcL en los primeras horas de FES.
Acido Láctico por tratamientos en las diferentes horas
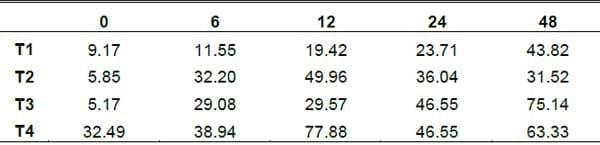
Grafica 5. Comportamiento del Acido Láctico en los tratamientos y en diferentes horas de fermentación.
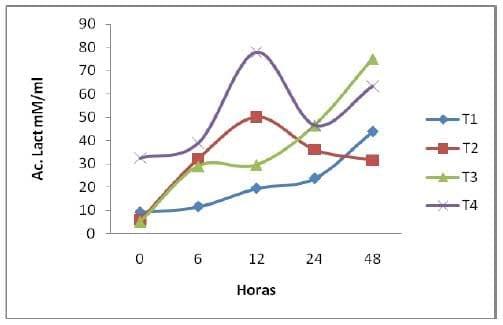
El pH bajo y su reducción, coincide con una mayor producción de AcL en el t3 y t4. Una alta proporción de AcL puede ser tóxica y limitante para el crecimiento de levaduras (Elías et al., 2001), esta condición pudo haber afectado el contenido de levaduras en la fermentación del nopal.
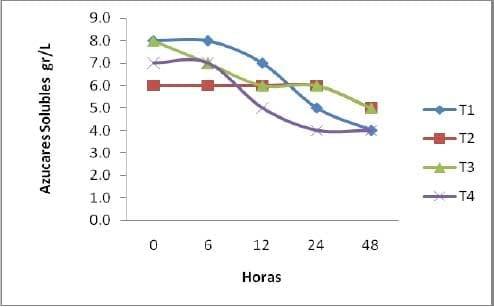
Azucares Solubles (AS). Los grados Brix se miden en el cociente total de sacarosa disuelta en un líquido. Una solución de 25 ° grados brix tiene 25 g de azúcar (sacarosa) por 100 g de líquido o, dicho de otro modo, hay 25 g de sacarosa y 75 g de agua en los 100 g de la solución.
En este trabajo la finalidad de la variable azucares disueltos, nos brinda información muy útil ya que al observar el comportamiento de los azucares disponibles en el medio liquido, entendemos mejor como es el comportamiento de las levaduras en los diferentes sustratos, y en los diferentes tiempos que se multiplican las levaduras (Grafica 8). El comportamiento de los azucares en la fermentación fue distinto por tratamientos, esto coincide con el comportamiento de producción de levaduras, en donde se muestra una clara apreciación de cómo los azucares juegan un papel importante en la producción de levaduras; sien do así que la disminución de azucares se manifiesta a las 12h de fermentación para los tratamiento 1 y 4 mientras que para los tratamientos 2 y 3 tiene una tendencia similar hasta la 48h de fermentación. Este mismo comportamiento está muy ligado en la misma trayectoria que siguió el acido láctico.
Comportamiento de Azucares Solubles
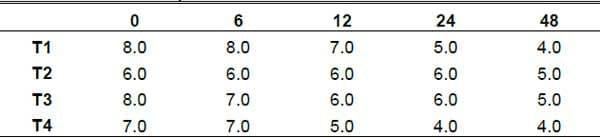
Grafica 6. Comportamiento de la perdida de azucares durante el periodo de fermentación.
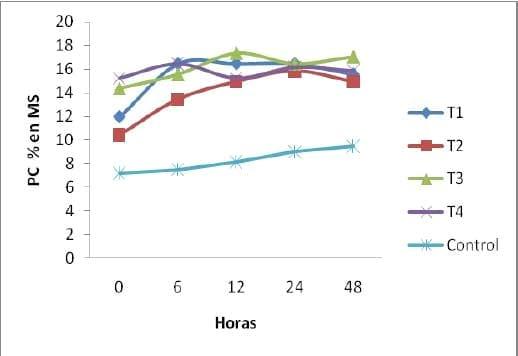
Proteína Cruda (PC) Durante la FES, la PC de los diferentes tratamientos se incremento (Calderón et al., 2005; Ibarra et al., 2002; Joshi y Sandhu, 1996). Esta variable, mostró un comportamiento similar para los diferentes tratamientos durante la FES. El comportamiento para el tratamiento control también fue ascendente iniciando a la h0 con un valor de 7.17 y fue aumentando durante el tiempo de la fermentación hasta llegar a la h48 con un valor de 9.50 de una manera natural utilizando puro nopal y utilizando la aireación para que los microorganismos que contiene el nopal y sus levaduras pudieran desarrollarse.
Los valores de concentración de PC más altos se encontraron en la h12 de FES, en el t3 con un valor de 17.33 mientras que los valores de concentración de PC para los demás tratamientos en la h24 fue de 16.43 para t1, siento este tratamiento el mas estable,15.84 para t2 y para t4 de 16.43 en la h6. La PC en BS puede disminuir ligeramente debido a una pérdida de NH3 por volatilización (Rodríguez et al., 2001), esto pudo haberse en este experimento, ya que la disminución en la concentración de PC, coincide con el incremento de NH3 en BH.
La fermentación del nopal por medio de esta técnica mostro excelentes resultados al incrementar de una manera significativa el valor de proteína en comparación con el tratamiento control que solo fue aireado, la adición del inoculo de levaduras mostro excelentes resultados desde la h0 para los tratamientos 3 y 4 (grafica 9).
PC por tratamientos en las diferentes horas
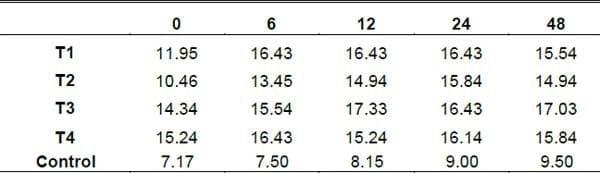
Grafica 7. Comportamiento de la PC durante la fermentación en los diferentes tratamientos y en las diferentes horas.
Materia Seca (MS) La concentración de MS, puede indicar en la FES el tiempo en que se puede obtener un producto fermentado con posibilidad de almacenarse. Al llevar a cabo una FES de nopal para obtener la sopa de nopal a gran escala, el proceso debe ser detenido por deshidratación para poder almacenar el producto; el momento ideal para detener el proceso, puede ser determinado en función a la concentración de PC o PV, ya que este es uno de los mejores indicadores de la síntesis microbiana de proteína (Rodríguez et al., 2001), los resultados de esta variable para el nopal en MS fue de 10.57.
Es conocido que los sustratos pierden MS durante la FES (Hang et al., 1981; Peñaloza et al., 1985; Rolz et al., 1986; Joshi y Sandhu, 1996; Rodríguez et al., 2001b; Ruíz et al., 2002; Calderón et al., 2005) provocando un incremento en la concentración relativa en BS de algunos componentes, como por ejemplo la fibra, proteína cruda (Rodríguez et al., 2001b) y la concentración de cenizas (Peñaloza et al., 1985; Joshi y Sandhu, 1996).
CONCLUSIONES
De acuerdo a los resultados obtenidos en la presente investigación y a los objetivos propuestos se concluye:
El nopal forrajero sometido a la fermentación en estado sólido (FES) incremento significativamente su valor de proteína de un 7.17 a 17.33% de PC, siendo una excelente alternativa para ser usado en la alimentación animal y reducir de una manera importante los consumos de agua.
La sopa de nopal producida bajo este tipo de fermentación contribuirá de una manera significativa en los animales alimentados a base de pasto, ya que contribuirá a reducir costos de producción, utilizando la sopa de nopal como un alimento proteico.
La principal causa que limita el consumo de nopal en borregos es su alto contenido de agua, aunque en condiciones de sequía esto puede representar una ventaja, ya que se ha observado que los borregos pueden estar consumiendo nopal fresco por varios meses sin tener acceso a agua de bebida, por lo que será necesario incrementar en la fermentación del nopal la materia seca para obtener mejores resultados.
El inoculo de levaduras y el calcio favoreció la fermentación del nopal incrementando el valor proteico del nopal y reducir el periodo de fermentación de 48 a 12 horas.
Uno de los problemas fundamentales que impiden el desarrollo de la industria ganadera nacional, es la escasez de forraje por lo que el nopal sometido a un proceso de fermentación puede ser la solución para producir carne y leche a un costo menor y reducir los consumos de agua en las zonas áridas de nuestro país.
Una característica importante en la utilización de las levaduras en la fermentación del nopal y en la nutrición animal, es que estabilice y optimice la función del sistema digestivo del animal, el beneficio directo es que el ganadero logre un mejor comportamiento productivo de su ganado, mientras que las ventajas que se pueden mencionar son: Mayor resistencia a enfermedades infecciosas, mayor aprovechamiento de los pastizales y del potencial genético del animal. Con la fermentación del nopal pretendemos reducir el periodo de engorda y el ganado mejore la conversión alimenticia (menos alimento para lograr el peso deseado).
Sera conveniente seguir trabajando con el nopal y buscar más alternativas que incrementen su valor proteico y mejorar su nivel energético, con la finalidad de conseguir un producto proteico energético que nos permita suplementar animales en agostaderos.
BIBLIOGRAFIA
Alvídrez, A. González, B. E. Martínez, Z. Tendencias en la producción de alimentos funcionales. 2002. Facultad de Salud Publica y Nutrition. Universidad Autónoma de Nuevo León. Vol. 3 No.3 Disponible en http://www.uanl.mx/publicaciones/respyn/iii/3/ensayos/alimentos_funcionales.html accesado el 30/Sep/2009
A.O.A.C. 1990. Official Methods of Analysis. 15ª Edición. Association of Official Analytical Chemists. Arlington, Virginia. Estados Unidos de América.
Anaya, M., Bautista R. 2008. El nopal forrajero en México del siglo XVI al siglo XX. Programa Universitario de Ciencias Sociales y Humanidades. Universidad Autónoma de Chapingo. Volumen 5, Numero 2. Pp. 167-171
Anrique G., R. y M. P. Viveros. 2002. Efecto del Ensilado Sobre la Composición Química y Degradabilidad Ruminal de la Pomasa de Manzana. Arch. Med. Vet. 34(2):189-197. Disponible en http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0301-732X2002000200005&lng=es&nrm=iso. Accesado el 06/Oct/2009.
Aranda, O. G. 2006. Enriquecimiento del nopal para el ganado. V Simposium- Taller sobre Producción y Aprovechamiento del Nopal en el Noreste de México. Marín Nuevo León, México.
Bravo, H. H. 1978. Las cactáceas de México. Tomo I. Universidad Nacional Autónoma de México. Ciudad Universitaria. México, D. F. pp67-71, 147, 334.
Barrientos P., F. 1969. El nopal y su utilización en México. Rev. Soc. Méx. Hist. Nat. 26; México. Pp. 87 – 94.
Bazant, J. 1980. Cinco Haciendas Mexicanas. El Colegio de México. México. 230 p.
Becerra, B. A. 2006. Aprovechamiento de subproductos de manzana mediante la producción de proteína microbiana con fermentación en estado sólido para la alimentación animal. Tesis Doctoral. Facultad de Zootecnia. Universidad Autónoma de Chihuahua. Chihuahua, Chih. Mex.
Calderón A., J. O., A. Elías I. y M. Valdivie N. 2005. Dinámica de la Fermentación en Estado Sólido de las camas de Cascarilla de Café en Inicio de Ponedoras Inoculadas con Vitafert. Revista Electrónica de Veterinaria REDVET. 6(5). Disponible http://www.veterinaria.org/revistas/redvet/n050505/050521.pdf. Accesado el 18/Oct/2009.
Carranza, S. J. A. 2001. Caracterización morfológica del cladodios de Opuntia spp. Del campo experimental de la URUZA. U. A. Ch. Tesis profesional. Chapingo. Mex. Pp 82.
Díaz P., D. 2006. Producción de Proteína Microbial a Partir de Manzana de Desecho Adicionada con Urea y Pasta de Soya. Tesis de Maestría. Facultad de Zootecnia. Universidad Autónoma de Chihuahua. Chihuahua. México.
Delgado H., J. y J. Delgado S. 1997. Evaluación de las cualidades forrajeras de cinco variedades de nopal Opuntia spp. para Aguascalientes. Memorias del VII Congreso Nacional y V Congreso Internacional sobre conocimiento y aprovechamiento del nopal.
Elías, A., O. Lezcano, P. Lezcano, J. Cordero y L. Quintana. 1990. Reseña Descriptiva sobre el Desarrollo de una Tecnología de Enriquecimiento Proteico de la Caña de Azúcar Mediante Fermentación en Estado Sólido (Saccharina). Revista Cubana de Ciencia Agrícola. 24(1):3-12.
Elias, A. y Lezcano, O. 1993. Efecto de la fuente de N y algunos factores de crecimiento en la población de levaduras que se establece en la Producción de Saccharina. Rev. Cubana de Cienc. Agric. 27:227.
Elias, A. 2007. Estrategia para la producción de alimentos para animales a través de procesos biotecnológicos sencillos que protejan el medio ambiente. II Congreso Internacional de Producción Animal Tropical. La Habana, Cuba.
Flores V., C. A., y J. R. Aguirre R. 1979. El nopal como forraje. Universidad Autónoma Chapingo, México. 91 Pp.
Flores V., C.A. y J.R. Aguirre R. 1992. El nopal como forraje. Universidad Autónoma Chapingo. México. 80 p. Segunda Reimpresión
Flores V., C. A., J. R. Aguirre R. 1992. El nopal como forraje. (2ª ed). Universidad Autónoma de Chapingo. Texcoco, Tex. México. 77 p.
Fuentes, R., J. M. Jiménez, C., L. Suárez, G., L. Torres, H., M. Murillo, S., M.E. López, G., J. y Ortiz, D., B. (2003). Evaluación nutricional de cuatro especies de nopal (Opuntia spp) forrajero. 1Universidad Autónoma Agraria Antonio Narro. Buenavista, Saltillo, Coahuila, México.
Guevara-Arauza, J.C., 2009. Tecnología Postcosecha y uso medicinal del nopal y la tuna. Editorial Trillas, México, D.F. En prensa.
Gutiérrez, E., Vázquez, R. 2005. Uso del nopal en la alimentación de ovinos.3er Ciclo de conferencias, La producción ovina en Nuevo Leon. P. 30-33
Gutiérrez, F., C. Rodríguez, H. García, A. García, O. Ruiz y J. Jiménez. 2007. Alimento producto de la FES de subproductos de manzana en dietas para vacas Holstein en producción.
Hang, Y. D., C. Y. Lee, E. E. Woodams y H. J. Cooley. 1981. Production of Alcohol from Apple Pomace. Applied and Environmental Microbiology. 42(6):1128-1129.
Hernández, R.J. 1995. Degradabilidad de la materia seca, proteína cruda, y carbohidratos estructurales de cuatro gramíneas forrajeras. Tesis Profesional. UAAAN. Buenavista, Saltillo, Coahuila, México. Pp 67.
Ibarra, A., Y. García, E. Valiño, J. Dustet, N. Albelo y T. Carrasco. 2002. Influence of Aeration on the Bioconversion of Sugarcane Bagasse by Trichoderma viride M5-2 in a Static Bioreactor of Solid Fermentation. Cuban Journal of Agricultural Science. 36(2):152-158.
INEGI. 2001. Carta topográfica. Anuario estadístico del estado de Chihuahua. Gobierno del Estado.
Joshi, V. K. y D. K. Sandhu. 1996. Preparation and Evaluation of an Animal Feed Byproduct Produced by Solid-State Fermentation of Apple Pomace. Bioresource Technology. 56:251-255.
Madrid, J., A. Martínez-Teruel, F. Hernández y M. D. Megías. 1999. A Comparative Study on the Determination of Lactic Acid in Silage Juice by Colorimetric, High-Performance Liquid Chromatography and Enzymatic Methods. Journal of the Science of Food and Agriculture. 79:1722-1726.
Marroquín, J. S. 1964. Estudio ecológico y dasonómico de las zonas áridas del Norte de México. INIF. Publicación Especial. México, D. F. pp 166.
Márquez, E. 1986. San Luis Potosí. Textos de su historia. México, Instituto de Investigaciones Dr. José María Luis Mora. 548 p.
Merhez, A. Z., E. R. Orskov. 1977. A Study of the artificial fiber bag technique for determining the digestibility of feeds in the rumen. J. Agric. Sci. (Camb) 88:645-650.
Peñaloza, W., M. R. Molina, R. Gómez-Brenes y R. Bressani. 1985. Solid-State Fermentation: an Alternative to Improve the Nutritive Value of Coffee Pulp. Applied and Environmental Microbiology. 49(2):388-393.
Ramirez L. R.G., G.F. Alanis, F. y Ma. Nuñez G. 2000.Dinamica estacional de la digestiónruminal de la materia seca del nopal. Ciencia UANL. 3(3):267-273.
Rodríguez, Z., A. Elías, R. Bocourt y O. Núñez. 2001. Efectos de los Niveles de Nitrógeno Ureico en la Síntesis Proteica Durante la Fermentación de Mezclas de Caña (Saccharum officinarum) y Boniato (Ipomea batata Lam.). Revista Cubana de Ciencia Agrícola. 35(1):29-36.
Rodríguez, Z., R. Bocourt, A. Elías y M. Madera. 2001b. Dinámica de Fermentación de Mezclas de Caña (Saccharum officinarum) y Boniato (Ipomea batata). Revista Cubana de Ciencia Agrícola. 35(2):147-151.
Romero, F. 1990. Utilización de la técnica de digestión in situ para la caracterización de forrajes. Nutrición de Rumiantes. Guía Metodológica de Investigación ALPARISPA. Editorial IICA, San José Costa Rica. pp 100-105.
Rolz, C., R. de León, M. C. de Arriola y S. de Cabrera. 1986. Biodelignification of Lemon Grass and Citronella Bagasse by White-Rot Fungi. Applied and Environmental Microbiology. 52(4):607-611.
Ruíz, C. J., M. Ruíz, G. Ruíz y V. Torres. 2002. Effect of Inclusion of Ammonium Sulfate on the Elaboration of Rustic Saccharina. Cuban Journal of Agricultural Science. 36(2):147-152.
Sáenz, C. 2004. Compuestos funcionales y alimentos derivados de Opuntia spp. p. 211-222. In: Esparza, G.,Valdez, R. y Mendez, S. eds. El Nopal, Topicos de actualidad. Universidad Autonoma de Chapingo, Mexico.
Sáenz C., Corrales, J., Galleti, L., Garcia de Cortázar, V., Higuera, I., Mondragón C., Rodríguez-Felix, A., Sepúlveda, E. y Varnero, M.T., 2006. Utilización Agroindustrial del nopal. Boletín de Servicios Agrícolas de la FAO, No. 162.
Stintzing, F.C. y Carle, R., 2005. Review Cactus stems (Opuntia spp.): A review on their chemistry, technology, and uses. Molecular Nutrition Food Research, 49, 175-194.
Sloan, E. 2000. The Top Ten Functional Food. Food Tech. 54 (4):33-62
Taylor, K. A. C. C. 1996. A Simple Colorimetric Assay for Muramic Acid and Lactic Acid. Applied Biochemistry and Biotechnology. 56:49-58.
Kaerger, K. 1986. Agricultura y Colonización en México en 1900. México, Universidad Autónoma Chapingo-Centro de Investigaciones y Estudios Superiores en Antropología Social. 350 p.
Valiño, E., A. Elias, V. Torres y N. Albelo. 2002. Study of the Microbial Contenton Fresh Sugar Cane Bagasse as Substrate for Animal Feeding by Solid State Fermentation. Cuba Journal of Agricultural Science. 36(4):359-364.
Velázquez, E. 1998. El nopal y su historia. México, Clio, Libros y Videos. 96 p.
Vázquez A., R. E. y C. Gallegos V. 1997. Banco de Germoplasma de Nopal para las condiciones ambientales del estado de Nuevo León. VII Congreso Nacional y V Congreso Internacional sobre el Conocimiento y Uso del Nopal (Memorias). Marín,N.L
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicación



