El citoesqueleto espermático y las alteraciones observadas después del proceso de criopreservación
Publicado: 17 de junio de 2009
Por: Dra. Yazmín Elizabeth Felipe Pérez. Doctora en Ciencias de la Producción y de la Salud Animal. México
El presente trabajo se realizó con la asesoría del Dr. Enrique Hernández-González (Departamento de Biología Celular del CINVESTAV, del Instituto Politécnico Nacional), de la Dra. Ma de Lourdes Juárez Mosqueda (Departamento de Morfología, FMVZ de la Universidad Nacional Autónoma de México) y del Dr. Javier Valencia Méndez (Departamento de Reproducción, FMVZ de la Universidad Nacional Autónoma de México).
Introducción
En las técnicas de reproducción asistida, el uso de semen congelado-descongelado para su aplicación en la inseminación artificial (IA), es actualmente una práctica habitual que ha sido adoptada de manera rutinaria en la mayoría de explotaciones ganaderas a nivel mundial (Cruz et al., 2006; Muino et al., 2008).
Sin embargo los daños ocasionados a las células espermáticas se han enfocado principalmente a realizar estudios a nivel de las membranas (Watson, 1995; Noiles et al., 1997; Neild et al., 2003; Flores, 2005), pero poco se ha estudiado el daño espermático ocasionado por el proceso de criopreservación a nivel de otras estructuras celulares como el citoesqueleto.
Por lo anterior, el objetivo del presente es ampliar el conocimiento de ésta estructura espermática y mencionar algunos hallazgos observados en los espermatozoides de semen criopreservado de bovino.
Citoesqueleto
El citoesqueleto es una estructura tridimensional que forma parte importante en todas las células eucariotas, entre otras cosas proporciona un avanzado nivel de organización intracelular. Está compuesto de una basta red de filamentos proteicos que actúan de manera dinámica y determinan la forma y la organización de organelos dentro del citoplasma (Alberts et al., 2002).
En el espermatozoide, el citoesqueleto está formado por numerosas proteínas, algunas de ellas son iguales a las encontradas en las células somáticas e interactúan formando diversos complejos que les permiten mantener un constante dinamismo.
El citoesqueleto espermático se compone de dos partes, la primera se ubica en la cabeza y la segunda forma el flagelo, cada uno cumple funciones diferentes que en conjunto habilitan al gameto masculino para lograr la fertilización del óvulo.
La teca perinuclear (tp) es la principal estructura citoesquelética de la cabeza espermática, es una cápsula fibrosa que se encuentra a manera de un casco, rodeando casi la totalidad del núcleo, excepto en el sitio de inserción de la cabeza con el flagelo (Courtens et al., 1976). Para su estudio, ha sido dividida en dos regiones, la subacrosomal, que se ubica justo debajo del acrosoma , y la postacrosomal, que se ubica distal a la primera, formando una especie de copa o cáliz, entre ambas se localiza la llamada subestructura de la tp, la cual forma una especie de cinturón que se ubica en la región ecuatorial. La forma en que ésta se presenta depende de cada especie, y es utilizada como un marcador morfológico para evaluar el estado de la tp.
Vista con el microscopio electrónico, la subestructura de la tp del espermatozoide bovino se observa como un anillo calado de pequeñas grecas rectangulares continuas, rodeando al núcleo a manera de un cinturón en la zona ecuatorial, ver figura 1.
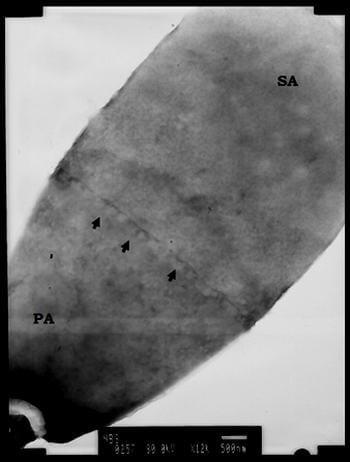
Figura 1.Micrografía electrónica mostrando la región ecuatorial de la cabeza del espermatozoide del bovino desprovisto de membranas, mostrando la teca perinuclear expuesta. Las flechas en la región ecuatorial están mostrando a la subestructura con la típica forma del cinturón de grecas de los espermatozoides maduros. SA: región subacrosomal de la teca perinuclear, PA: región postacrosomal de la teca perinuclear. Barra = 500 nm.
Entre algunas de las funciones atribuibles a la tp se encuentran las siguientes: brindar la forma a la cabeza del espermatozoide, servir como cemento para mantener unidas a las membranas plasmática y acrosomal interna con la envoltura nuclear, conservar los dominios de membrana y proteger al núcleo de agentes descondensantes (Sutovsky et al., 1997, 2000, 2003; Juárez-Mosqueda, 2000). Durante la motilidad es la encargada de brindar la direccionalidad al espermatozoide, además, participa en los procesos de fusión con el óvulo y la descondensación espermática una vez que ocurre la fertilización (Mújica et al., 2003).
Por otra parte el flagelo es la maquinaria motriz del espermatozoide tiene una estructura central, el axonema, compuesto por 9 dobletes de microtúbulos, los cuales se encuentran alineados en un círculo rodeando a un par central. Se encuentran unidos por la proteína nexina y proteínas radiales que se deslizan por medio de brazos de dineína usando ATP (Alberts, et al., 2002).
La motilidad espermática es un factor crítico para que pueda realizarse la fertilización, puesto que le permite al gameto masculino aproximarse al femenino y le facilita atravesar la zona pelúcida del ovocito para lograr su objetivo.
Proteínas del citoesqueleto espermático
Hasta la fecha se han identificado varias proteínas como componentes del citoesqueleto espermático, algunas se ubican solamente en una porción del citoesqueleto, ya sea en la tp o en el flagelo, mientras que otras han sido localizadas en ambas regiones. Cabe hacer notar que existen algunas diferencias entre especies, en cuanto al tipo de proteínas que conforman al citoesqueleto espermático (Mújica et al., 2003). Entre las proteínas más comunes que se han detectado podemos mencionar a la actina, que es de las más abundantes en todas las eucariotas, la calicina, que se encuentra formando el cáliz de la cabeza espermática, la PERF 15, cuya principal atribución es la de dar forma a la cabeza espermática, la tubulina, como el principal componente flagelar, la dineina; que forma parte importante del axonema, la nexina, que brinda soporte a la maquinaria motriz flagelar, y muchas otras proteínas que interactuan con la actina, entre ellas las proteínas asociadas a actina ARP2, ARP3 (por sus siglas en inglés, actin related proteins), WASP (por sus siglas en inglés, Wiskott-Aldrich syndrom protein), Calicina, CP alfa y beta (por sus siglas en inglés, capping proteins) , entre otras (Flaherty et al., 1986; Longo et al., 1987; Von Bülow et al., 1997; Mújica et al., 2003; Weaver et al., 2003; Becker et al., 2007).
Criopreservación del semen
Se sabe que durante el proceso de criopreservación los espermatozoides son expuestos a diferentes concentraciones osmóticas, es decir que las concentraciones de las diferentes sales y demás componentes incluidos en el diluyente cambian durante el proceso de congelación y descongelación. Tales cambios implican que los espermatozoides deben estar luchando constantemente por mantener su volumen celular aún expuestos a los mencionados cambios osmóticos.
Estudios realizados en células somáticas indican que el proceso de congelación-descongelación ocasiona daños en la estructura de las proteínas que conforman al citoesqueleto celular (Petrunkina et al., 2004b).
Hasta ahora existen diversas investigaciones enfocadas al estudio de los espermatozoides que han demostrado que durante el proceso de congelación, el citoesqueleto es el encargado de mantener el volumen celular (Petrunkina et al., 2004a).
Mediante estudios de microscopia electrónica, en semen de bovino descongelado se encontró que existe una correlación directa entre el número de espermatozoides no viables y el número de espermatozoides que presentan daño en la tp (Martínez et al., 2006).
Cuando el semen es sometido al proceso de congelación-descongelación, las alteraciones observadas en la subestructura de la tp incluyen la pérdida; en diferente magnitud, de la continuidad de las grecas, que incluso llegan a desaparecer por completo (Martínez et al., 2006; Felipe-Pérez, 2006, 2009). En el flagelo se observan las estructuras muy delgadas, incluso existe la pérdida de algunos de sus elementos.
Mientras que en un estudio comparativo de semen fresco y descongelado, se encontró que varias de las proteínas que conforman la tp del espermatozoide bovino son más susceptibles a la extracción mediante agentes químicos, después de haber sufrido el proceso de congelación-descongelación, entre ellas se observaron proteínas que se encuentran en el rango de los 11 a los 150 kDa de peso molecular.
Lo anterior indica que existe una clara alteración y/o el posible fraccionamiento proteico de los elementos del citoesqueleto espermático ocasionado por la criopreservación del semen bovino.
Conclusiones
Las evidencias presentadas acerca de las alteraciones observadas en el citoesqueleto de los espermatozoides del bovino, proveen nuevos datos acerca de los daños ocasionados al espermatozoide por el proceso de criopreservación, que claramente demuestran que no sólo se afectan las membranas. Por lo que al alterarse las estructuras citoesqueléticas por la congelación-descongelación, es de esperarse que se vean afectadas las funciones espermáticas tendientes a la fertilización, como lo es la propia motilidad, la capacitación y la reacción acrosomal. El conocer lo anterior dará pie a que se realicen estudios en los que se implementen nuevas y mejores tecnologías enfocadas a disminuir las alteraciones estructurales observadas en las estructuras celulares, incluyendo al citoesqueleto espermático y con ello optimizar los procesos de congelación-descongelación para mejorar las prácticas actuales de reproducción asistida en el ganado bovino.
Referencias
Alberts B, Honson A, Lewis J, Raff M Roberts K, Water P. The cytoskeleton. The molecular biology of the cell. 4th ed. New York: Garland Science, 2002.
Becker WM, Kleinsmithe LJ, Hardin J. El citoesqueleto. El mundo de la célula. 6ª ed. Madrid: Pearson Addison Wesley. 2007.
Courtens JL, Courot M, Flechon JE. The perinuclear substance of boar, bull, ram and rabbit spermatozoa. J Ultrastruct Res 1976; 57: 54-64.
Cruz ZA, Pajan VJ, Puza RR, Cuesta CC. Principales factores que frenan la prolificidad del ganado vacuno en Latinoamérica. Memorias del XXX Congreso Nacional de Buiatría; 2006 agosto 10-12; Acapulco (Guerrero) México. México (DF): Asociación Mexicana de Médicos Veterinarios Especialistas en Bovinos, AC, 2006: 219.
Felipe-Pérez YE. Caracterización bioquímica de las proteínas extraídas de la teca perinuclear antes y después de la congelación del semen bovino (tesis de maestría). México (D. F.) México: Universidad Nacional Autónoma de México, 2006.
Felipe-Pérez YE. Dinámica del citoesqueleto de actina en espermatozoides epididimales, frescos y descongelados de bovino (tesis de doctorado). México (D. F.) México: Universidad Nacional Autónoma de México, 2009.
Flaherty SP, Winfrey UP, Olson GE. Localization of actin in human, bull, rabbit and hamster sperm by immunoelectron microscopy. Anat Rec 1986; 221: 599-610.
Flores H. Efecto del enfriado lento hasta -5°C previo a la congelación sobre la estructura y funcionalidad de la membrana plasmática del espermatozoide porcino (tesis de maestría). México (D. F.) México: Fes C Universidad Nacional Autónoma de México, 2005.
Juárez-Mosqueda ML. Caracterización de una nueva subestructura de la teca perinuclear del espermatozoide maduro no capacitado del cobayo (tesis de doctorado).México (D.F.), México. CINVESTAV- IPN, 2000.
Longo FJ. Basic proteins of the perinuclear theca of mammalian spermatozoa and spermatids: a novel class of cytoskeletal elements. The J Cell Biol 1987; 105: 1105-1120.
Martínez OC, Juárez-Mosqueda ML, Hernández J, Valencia J. Criopreservation of bull sperm results in alteration of the perinuclear theca. Theriogenology. 2006; 66: 1969-1975.
Muino R, Rivera MM, Rigau T, Rodríguez-Gil JE, Pena AI. Effects of different thawing rates on post-thaw sperm viability, kinematic parameters and motile subpopulations structure of bull semen. Anim Reprod Sci. 2008; 109: 50-64.
Mújica A, Navarro FG, Hernández G, Juárez M ML. Perinuclear theca during spermatozoa maturation leading to fertilization. Micros Res Tech. 2003; 61:76-87.
Neild DM, Gadella BM, Cháves MG, Miragaya MH, colenbrader B, Agüero A. Membrane changes during different stages of a freez-thaw protocol for equine semen cryopreservation. Theriogenology. 2003; 59: 1693-1705.
Noiles EE, Tompson KA, Storey BT. Water permeability, Lp of the mouse sperm plasma membrane and its activation energy are strongly dependent on interaction of the plasma membrane with the sperm cytoskeleton. Cryobiol. 1997; 35:79-92.
Petrunkina AM, Gropper B, Trópfer- Petersen E, Gunzel-Apel AR. Volume regulatory function and sperm membrane dynamics as parameters for evaluating cryoprotective efficiency of a freezing extender. Theriogenology. 2004a; 63: 1390-1406.
Petrunkina AM, Hegbel M, Waberski D, Weitza KF, Topfer-Petersen E. Requirement for an intact cytoskeleton for volume regulation in boar spermatozoa. Reprod. 2004b; 127: 105-115.
Stovsky P, Oko R, Hewitson L, Schatten G. The removal of the sperm perinuclear theca and its association with the bovine oocyte surface during fertilization. Dev Biol. 1997; 188: 75-84.
Von Bülow M, Rackwitz HR, Zimbelmann R, Franke WW. Cpβ3, a novel isoform of an actin-binding protein, is a component of the cytoskeletal calyx of the mammalian sperm head. Exp Cell Res. 1997; 233: 216-224.
Watson PF. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reprod Fertil Dev. 1995; 7:871-891.
Weaver AM, Young ME, Lee WL, Cooper JA. Integration of signals to the ARP2/3 complex. Curr Opinion Cell Biol. 2003; 15: 23-30.
Temas relacionados:
Autores:
Recomendar
Comentar
Compartir
16 de febrero de 2017
Efraim González,
Con base a la poca experiencia que tengo, no podría decirte respecto al efecto de la hipóxia y su relación con la membrana plasmática, puesto que en la zona en donde radico, nos encontramos muy cercanos a los tres mil metros sobre el nivel del mar, y no hemos observado una consecuencia directamente sobre los espermatozoides. Considero que más bien, deberías buscar otra alternativa para estudiar el metabolismo con diferente metodología.
Saludos,
Recomendar
Responder
16 de febrero de 2017
Estimado Fernando Cabrera,
Me parece muy interesante su razonamiento y los buenos resultados que ha tenido, realizando la inseminación artificial con semen descongelado. Respecto a mi opinión en cuanto al método de descongelación, me permito comentarle que los dedicados a estudios de criopreservación, hacen mención de que una descongelación ideal, debería seguir una tasa inversa a la de congelación, es decir, si durante la congelación se está bajando la temperatura a razón de 1 grado centígrado por minuto, debería subirse a esa misma velocidad, lo cual es meramente teórico, puesto que no contamos con un aparato capaz de realizar la descongelación bajo esas condiciones. Por otro lado, hemos notado que al realizar la descongelación a 37 grados pero por menos de 20 segundos, y luego se ha observado al microscopio, se han observado los cristales de hielo y varios espermatozoides aún congelados y por supuesto sin motilidad espermática. Por lo que es recomendable que se descongelen las pajillas en baño maría y se mantengan unos 5 minutos a esa temperatura, para luego hacer la evaluación de la calidad seminal. Por otro lado, conocemos que la temperatura corporal de la vaca se encuentra incrementada cuando se encuentran receptivas o en celo, es decir, listas para ser inseminadas, lo cual, efectivamente descongelará el semen depositado en su totalidad, sin embargo, también es posible que el incremento súbito de la temperatura altere la membrana plasmática de los espermatozoides, acelerando su proceso de capacitación y reacción acrosomal, lo cual haría que el proceso se realizara de manera prematura y que llegaran menos espermatozoides a capacitarse en el sitio y momento adecuados, es decir, al ámpula. No obstante, sus resultados hablan por sí mismos, y en el caso del bovino, por ser una especie monótoca, no se ven reflejadas las posibles consecuencias de un manejo poco adecuado en la descongelación. Saludos cordiales.
Recomendar
Responder
16 de febrero de 2017
Hola Guadalupe,
Por supuesto, el citoesqueleto espermático tiene una abundante cantidad de microfilamentos de Actina, la cual se encuentra en una dinámica constante de acuerdo al estado fisiológico del espermatozoide, de hecho es la responsable de los reacomodos a nivel de membrana plasmática durante la capacitación y de que ocurra la reacción acrosomal. Al polimerizarse y despolimerizarse en la porción apical de la cabeza espermática, los microfilamentos de actina permiten que se de la unión de la membrana plasmática y la membrana acrosomal, lo cual provoca que se formen los pequeños poros en ambas membranas y con ello se permite la salida del contenido acrosomal.
Saludos, y gracias por tu interés.
Recomendar
Responder
15 de julio de 2009
MVZ Sergio Fernández Mora,
Las tinciones rápidas que normalmente se emplean nos sirven para ver el daño sobre las membranas plasmática y acrosomal de los espermatozoides, y tales daños son un reflejo de las alteraciones sufridas por el citoesqueleto (después del ciclo de congelación y descongelación), debido a que entre las funciones del citoesqueleto están las de mantener los dominios de membrana. Entre las tinciones más comunes que se utilizan estan la de eosina-nigrosina, la triple tinción, el uso de azul de tripán, y si se dispone de un microscopio de fluorescencia se utiliza la CTC (clortetraciclina), IP (yoduro de propidio), entre otras. Sin embargo para lograr ver el citoesqueleto primeramente se deben retirar las membranas tanto plasmática como acrosomal para exponer la teca perinuclear (que es la que se encuentra en la cabeza espermática)y posteriormente proceder a fijar y teñir las células. Cabe mencionar que existen tinciones que se emplean en células somáticas, las cuales tienen afinidad por las proteínas que forman el citoesqueleto como lo es el azúl de Coomassie, aunque en los espermatozoides, al menos personalmente, no se ha utilizado para observar el citoesqueleto, puesto que la microscopía electrónica brinda la posibilidad de observar ultraestructuralmente al citoesqueleto espermático. Muchas gracias, espero le sea de ultilidad ésta información.
Recomendar
Responder
15 de julio de 2009
Ingeniero Ciro González Ferreira,
Gracias por su comentario.
La foto mostrada es como regularmente se publican las micro fotografías tomadas mediante microscopía electrónica, mediante la técnica de tinción negativa, sin embargo no existe mucha diferencia con la observación real que se ve directamente bajo el microscopio, lo que cambia es el fondo, que se observa de color verde, mientras que las estructuras del espermatozoide se ven negras, así que en realidad no perdemos demasiado, claro que a color es mucho más llamativo.
Recomendar
Responder
30 de junio de 2009
Ing. Mauro V. Guzmán
Gracias por su comentario. Tiene toda la razón, temas como el presente abren muchas inquietudes y creo que eso es muy bueno, puesto que el despertar tantas dudas más que dar respuestas directas no hará ser mucho más cuidadosos en el manejo del semen y sobre todo nos siembra esa semilla de búsqueda de respuestas, lo cual nos hace a todos investigadores, por lo que sugiero que sean revisados varios puntos dentro del proceso de congelación y descongelación. En cuanto a las pajillas o pajuelas se ha observado que las de diámetro menor transmiten de manera más homogénea la temperatura al interior de las mismas, ya sea durante la congelación o la propia descongelación, por lo que los daños a la población espermática contenida es menor que en las pajuelas de mayor calibre, sin embargo es importante monitorear de forma constante y rutinaria la temperatura de almacenamiento, puesto que muchas veces al disminuir el nivel de nitrógeno líquido se están afectando los espermatozoides puesto que se provocan cambios de temperatura. Por último quisiera comentar que valdría la pena utilizar una pajilla para evaluar el semen antes de emplearlo para la inseminación artificial, lo cual sería útil para valorar tanto el proceso de congelación-descongelación como nuestro propio método y de esa forma realizar las modificaciones necesarias para obtener mejores resultados al momento de la inseminación. Por otra parte en cuanto al número de espermatozoides contenidos por pajilla, el examen anterior podría darle la respuesta, puesto que en muchas ocasiones el aumentar la concentración espermática si podría llegar a compensar los daños sufridos y con ello se busca incrementar el porcentaje de sobrevivientes y por consecuencia el índice de fertilidad.
Recomendar
Responder
30 de junio de 2009
MVZ Raúl José Rangel
Gracias por su comentario. efectivamente es un tema interesante y en mi caso diría que apasionante, creo que existe mucho por investigar acerca del manejo adecuado del semen criopreservado y la forma de disminuir las alteraciones celulares, próximamente enviaremos algunas recomendaciones generales respecto a los cuidados básicos que debemos considerar cuando se realiza la inseminación artificial a fin de minimizar el daño, este al pendiente y con un poco de paciencia.
Recomendar
Responder
30 de junio de 2009
MVZ Hernán Javier Arango,
Agradezco mucho su amable comentario, respecto a su duda existen estudios en los cuales experimentalmente alteran al citoesqueleto espermático y al realizar in vitro la inyección intracitoplasmática han determinado que no es posible que se forme el pronúcleo masculino, mientras que en otros se ha observado que al tener el espermatozoide alteraciones graves en el citoesqueleto, éste es incapaz de interactuar con el ovocito y no en consecuencia no se logra la fertilización.
Recomendar
Responder
Trouw Nutrition
19 de junio de 2009
Ante todo hago extensiva mis felicitaciones por la calidad del trabajo que se ha publicado.
Al compañero Campusano y a todos en general, por experiencia propia, y curiosidad he realizado la comparación y el estudio que relaciona la temperatura de descongelación con el porcentaje de preñes de las dosis seminales, cabe recalcar que no es algo para publicar por lo que no simplemente son esos los factores que afectan la estructura y fertilidad de la dosis, pero al tratar de aislar un poco y poner homogéneas las muestras y usando un diseño experimentar aleatorizado encontré como conclusión que la mejor temperatura del agua para la descongelación del semen y proceder a la inseminación es la de 24ºC.
Hago énfasis en esta practica ya que es en este momento después de la congelación muchas veces donde el 70[percent] de los ezpermios no viables, que se observan en las dosis pierden o debilitan enormemente la sección del citoesqueletoTp y tal cual se explica en el articulo, el cito esqueleto, denota el volumen, contribuye en la orientación espermática, ayuda a la penetración del esperma en el ovulo, y por ende, es un esperma con su material genético en buen estado, cuando tiene en buen estado su cito esqueleto, y pudo vencer las barreras para realizar la fecundación.
En cuanto a los embriones, también afecta, muchas veces hemos observado y se que todos lo han hecho, que los becerros obtenidos por inseminación artificial, son mas delicados en los primeros estadios de subida, hablo de las primeras 2 horas, donde se pone de pie, y comienza a beber el calostro, hay diferencia con los animales obtenidos por la monta natural, esto es una observación, que no esta asegurado con la base científica mas bien en la practica, pero muchas veces para realizar un estudio hay que relacionar ambas y obtener resultados cercanos a la realidad.
Att. Ing. Carlos Jiménez Marchan.
Recomendar
Responder
Universidad de Costa Rica
19 de junio de 2009
Me parece bastante interesante el artículo y ojalá sirva como un inicio para mas estudios que determinen de una forma cuantitiva el efecto de la congelación-descongelación sobre la viabilidad del semen y la integridad de los espermatozoides y que además se analice la posibilidad de realizar cambios en los procedimientos actuales con el fin de mejorarlos y aumentar las posibilidades de preñez en estos tipos de manejo reproductivo.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.











