Diagnóstico e Identificación de serotipos de Salmonella a partir de muestras de avicultura: importancia de un buen muestreo.
En el contexto de salud pública la salmonelosis está muy ligada a los productos avícolas (principalmente la carne de pollo y los huevos), no solamente porque son considerados como la fuente más común de esta bacteria; sino porque en la presentación de la enfermedad influyen diferentes factores que se relacionan con hábitos alimenticios y manejo de estos productos por parte del consumidor como son la manipulación inadecuada del producto, manejo deficiente de la cadena de frio, consumo de productos mal cocidos; entre otros. Así cuando se habla de la prevención y el control de la salmonelosis se deben contemplar conceptos integrales que deben basarse en un diagnóstico adecuado, no solo de los serotipos causantes del problema, sino también de la identificación de los factores de riesgo y de persistencia, principalmente a nivel de la producción avícola primaria.
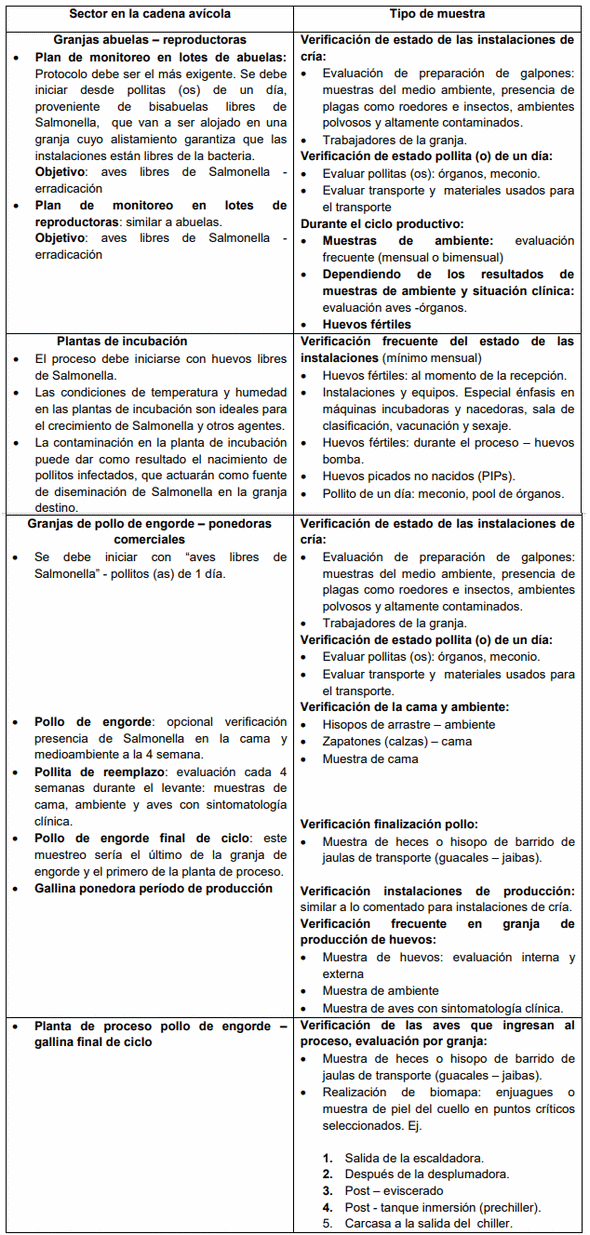
2. Salmonella en la Cadena Avícola
El monitoreo constante de la situación en las producción primaria (granjas, plantas de incubación, plantas de proceso, etc), se hace necesario para poder sugerir medidas de intervención específicas. Teniendo en cuenta que la cadena de producción de pollo o de huevo en la mayoría de los casos está totalmente integrada, se hace necesario establecer medidas de control en cada uno de sus eslabones.
Esto sólo se puede lograr mediante el monitoreo constante realizado bajo condiciones específicas. Sin embargo, debido a la gran variedad de serotipos que pueden estar involucrados en la enfermedad, así como por las múltiples fuentes de infección existentes, la erradicación de salmonela en las explotaciones de aves puede ser un objetivo difícil de alcanzar. Se requiere de un trabajo intenso para llegar a eliminar al menos los serotipos que específicamente pueden estar involucrados como causantes de enfermedades alimentarias o que produzcan enfermedades específicas en las aves.
En síntesis, la contaminación por Salmonella puede producirse en cualquier etapa de la cadena de producción avícola, a partir de diversas fuentes (materias primas para alimentación animal, fabricación de alimento, incubadoras, granjas de producción, hasta el producto y subproductos de origen avícola, entre otros). Por tanto, un plan de control requiere de vigilancia constante en cada uno de los eslabones de la cadena productiva.
El género Salmonella pertenece a la familia Enterobacteriaceae. La clasificación reconocida actualmente incluye dos especies: Salmonella enterica (con seis subespecies) y Salmonella bongori. En al año 2007 el Instituto Pasteur describió 2.557 serotipos a través del esquema Kauffmann-White-Le Minor (KWL) para caracterizar los diferentes serotipos del género con base en sus fórmulas antigénicas (Grimont y Weil, 2007). En el 2010 el suplemento 47 (2003 – 2007) de ese instituto informó de la caracterización de 70 serotipos más para completar 2649 (Guibourdenche et al; 2010). De más de 2600 serotipos identificados hasta 2010, tal vez sólo 100 serotipos de la subespecie enterica producen enfermedades en un número limitado de especies.
El hábitat natural de salmonelas de la subespecie enterica puede ser dividido en tres categorías con base en la especificidad del huésped y el patrón clínico:
- Categoría 1: Altamente adaptadas al hombre incluyendo S. Typhi y S. Paratyphi A, B y C, agentes de la fiebre entérica;
- Categoría 2: Altamente adaptadas a los animales como S. Dublin (bovinos), S. Choleraesuis, S. Typhisuis (porcinos), S. Gallinarum y S. Pullorum, causantes de la tifoidea aviar y la pulorosis, respectivamente.
- Categoría 3: se incluyen la mayoría de los serotipos que afectan al hombre y a los animales, denominadas Salmonelas zoonóticas o paratífoideas, responsables por las enfermedades de transmisión por los alimentos, que son de distribución mundial.
4. Importancia del muestreo para un diagnóstico exitoso:
Un buen programa de monitoreo de Salmonella busca explicar por qué, para qué, cuándo, cómo y qué evaluar; en la base de que el conocimiento del estado sanitario de una explotación, específicamente relacionado con Salmonella, permitirá la formulación de programas de bioseguridad y planes vacunales adecuados, además de la toma de decisiones a tiempo en el manejo de las aves. También buscará contribuir en la implementación de una metodología de evaluación constante de los programas de bioseguridad y planes vacunales instaurados para el control de la salmonelosis. De igual manera aportará elementos de juicio para la evaluación de las medidas de manejo y control instauradas en los casos de lotes positivos.
Muchos países afectados por el marcado aumento de los casos de salmonelosis tanto en seres humanos como en las aves están trabajando en estrategias de control basados en diferentes enfoques de identificación y monitoreo de la infección durante toda la cadena de producción. Los esquemas estratégicos están basados en directrices de diferentes organizaciones (Unión Europea, Oficina internacional de Epizootias, Código Internacional de Salud Animal, entre otras).
Sin embargo, cada país requiere de estudios específicos que consideren cada una de las particularidades propias de la región o la forma de manejo de las aves, que permita identificar las debilidades propias a fin de crear medidas de control adecuadas para cada situación.
Un elemento clave en el diagnóstico es la implementación de técnicas de identificación rápidas y confiables; así el conocimiento de los diferentes serotipos involucrados en las explotaciones avícolas de un país, así como las diferentes fuentes y orígenes de la bacteria permitirán formular estrategias que contemplen acciones preventivas, así como evitar o minimizar los factores de riesgo, la toma de decisiones adecuadas para el control o la erradicación de las enfermedades causadas por Salmonella y en el caso que sea útil, la instauración de tratamientos exitosos.
Los programas de control de Salmonella en la industria avícola deben iniciarse a nivel de las abuelas y las granjas de reproductoras. Todos los esfuerzos de eliminación de esta bacteria deben enfocarse en primera instancia en el control de estos renglones con el fin de obtener carne de ´pollo y huevos libres de Salmonella.
Todo programa exitoso comienza con el establecimiento de un buen esquema de monitoreo, estableciendo puntos críticos en todo el proceso de producción. Sin embargo todo programa que se quiera instaurar deberá contemplar un plan de muestreo racional, que sea sostenible tanto en tipo de muestras, número de muestras y especialmente en frecuencia de muestreo.
La especie Salmonella enterica subespecie enterica incluye bacilos Gram negativos. La mayoría de éstos, por la presencia de flagelos perítricos, muestran motilidad con excepción de S. Gallinarum, S. Pullorum y algunas variedades específicas de S. Typhimurium.
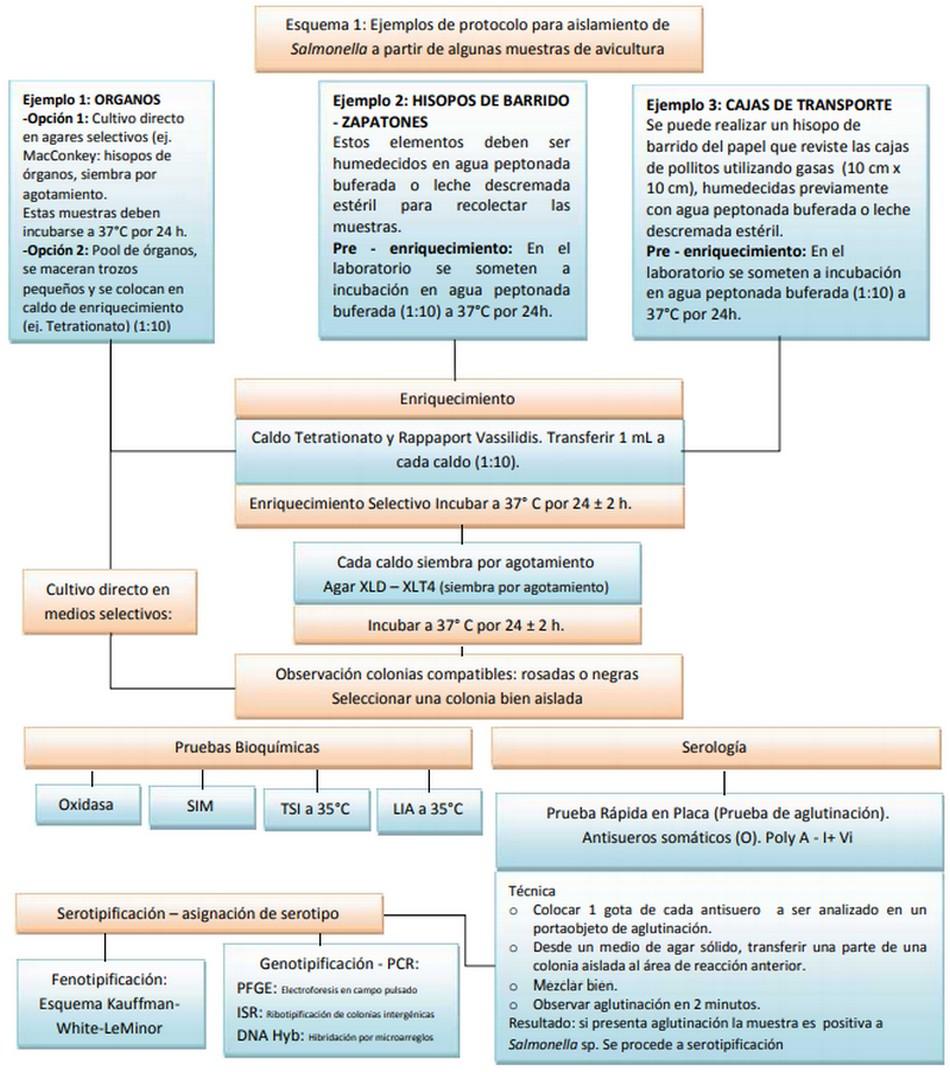
Existen diversos métodos para el aislamiento e identificación de Salmonella. Muchos de los procesos a seguir se basan en recomendaciones de organismos oficiales de control. En el esquema 1 se presentan algunos ejemplos.
Por lo general Salmonella no fermenta la lactosa, es ureasa negativa, fermenta la glucosa con producción de ácido y gas (excepto S. Typhi). También fermentan L-arabinosa, maltosa, D-manitol, Dmanosa, L-ramnosa, D-sorbitol, trehalosa, D-xilosa y D-dulcita. Es oxidasa negativo, catalasa positivo, Indol y voges - Proukauer (VP) negativo, rojo de metilo y citrato de Simmons positivo. Producen H2S (color negro de las colonias), reducen nitratos a nitritos y no desaminan la fenilalanina. La información sobre reacciones bioquímicas dependiendo de la especie y la subespecie de Salmonella se muestra en la tabla 2.
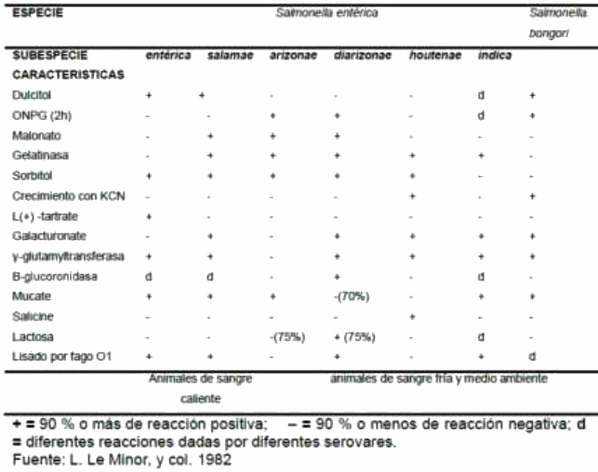
Tomado de: Mantilla, Pulido y Jaime, 2009. Valoración de la situación actual de explotaciones de ponedoras comerciales con cuadros compatibles con tifoidea aviar en Colombia.
- Asignación de serotipo: serotipificación y genotipificación:
Un aspecto importante a destacar es que la mayoría (si no todas) las técnicas moleculares utilizadas actualmente para la asignación del serotipo de Salmonella, se basan en la obtención de una colonia bien aislada. Razón por la cual la bacteriología básica es y seguirá siendo la base de cualquier diagnóstico de Salmonella.
En la experiencia de esta autora, la Ribotipificación de Secuencias Intergénicas (Intergenic Sequece Ribotyping - ISR), es una técnica confiable, de alto poder de discriminación y repetibilidad, de bajo costo. Esta técnica fue desarrollada por el equipo de trabajo de la Unidad de Investigación en calidad e inocuidad del huevo del departamento de Agricultura de los Estados Unidos (Egg Saftety and Quality Research Unit of USDA - ARS). Todos los resultados obtenidos del análisis de varias cepas de Salmonella aisladas de productos avícolas de diferentes países del mundo, indican que la secuenciación de una 10 región de aproximadamente 500 pb entre el gen ribosomal 5S y las regiones vecinas del gen dkgB, puede ser usada para la caracterización de cepas de Salmonella con altas especificidad y sensibilidad.
- Técnicas moleculares como pruebas tamiz (“screening”) para la identificación de presencia de Salmonella:
1. Caffer, M; Terragno, R; Binsztein, N. Manual de Procedimientos Diagnóstico y caracterización de Salmonella spp. Departamento Bacteriología Instituto Nacional de Enfermedades Infecciosas A.N.L.I.S. “Dr. Carlos G. Malbrán”. Centro Regional de Referencia del WHO Global Salm Surv para América del Sur. 2008.
2. CDC (2012) Summary of Notifiable Diseases — United States, 2010. Morbidity and Mortality weekly report - 2010 59, 1-116.
3. EFSA, P.o.B.H., Scientific Opinion on a quantitative estimation of the public health impact of setting a new target for the reduction of Salmonella in broilers EFSA Journal, 2011. 9(7): p. 95.
4. EFSA - European Food Safety Authority, E.P.o.B.H.B., Scientific Opinion on a quantitative estimation of the public health impact of setting a new target for the reduction of Salmonella in laying hens. EFSA Journal 2010. 8(4(4):1546): p. 86.
5. Gast, R. 2013. Paratyphoid infections. In Diseases of Poultry. 13 th Ed. American Association of Avian Pathologist. American Association of Avian Pathologist. Iowa, EUA. Blackwell Publishing
6. Guard, J., et al., Comparison of dkgB-linked intergenic sequence ribotyping to DNA microarray hybridization for assigning serotype to Salmonella enterica. FEMS Microbiol Lett, 2012.
7. Grimont, P ; Weil, F. 2007. Antigenic Formulae of the Salmonella Serovars. World Health Organization WHO Collaborating Centre for Reference and Research on Salmonella, Institut Pasteur. 9th edition. 6 P.
8. Guibourdenche, M; Roggentin, P; Mikoleit, M; Fields, P; Bockemu¨hl, J; Grimont, P; Weill, F. 2010. Supplement 2003e2007 (No. 47) to the White- Kauffmann-Le Minor scheme. Institut Pasteur. Research in Microbiology 161: 26-29.
9. Mantilla, J., Pulido, M. Jaime, J., Prueba de sensibilidad antimicrobiana de cepas de Salmonella grupo D (móviles e inmóviles) aisladas de ponedoras comerciales en Colombia. Revista de Medicina Veterinaria y Zootecnia - Rev. Med. Vet. Zoot., 2010. 57: p. 168-177.
10. Mead, G., et al., Scientific and technical factors affecting the setting of Salmonella criteria for raw poultry: a global perspective. J Food Prot, 2010. 73(8): p. 1566-90.
11. OIE. Salmonella. NB versión adoptada en la Asamblea Mundial de Delegados de la OIE en mayo de 2012. Manual terrestre de la OIE. Manual de las Pruebas de Diagnóstico y de las Vacunas para los Animales Terrestres 2016.
12. Pulido-Landinez, M., et al., Assignment of serotype to Salmonella enterica isolates obtained from poultry and their environment in southern Brazil. Lett Appl Microbiol, 2013. 57(4): p. 288-94.
13. Pulido-Landínez, M., P. Washington, J.K. Thornton, Y. Zhang, R. SanchezIngunza, A. Banda, J. Guard, and V. P. do Nascimento, D. L. Magee, and M.J. Mauel Serotype and Antimicrobial Resistance Patterns of Salmonella Isolates from Commercial Birds and Poultry Environment in Mississippi. Avian Diseases 58:64-70. 2014a.
14. Pulido-Landínez, M., R. Sanchez-Ingunza, J. Guard, and V. P. do Nascimento Presence of Salmonella Enteritidis and Salmonella 12 Gallinarum in commercial laying hens diagnosed with Fowl Typhoid Disease in Colombia. Avian Diseases 58:165-170. 2014b.
15. Pulido-Landínez, M., Banda, A., Guard, J., Do Nascimento, V. Identification of risk factors and causes of persistence of Salmonella Gallinarum in laying hens farms from Colombia. Physiology/Pathology/SCAD I-M15. International Poultry Scientific Forum. US. Poultry and Egg Association. January 28-29. Atlanta, GA. 2014c.
16. Pulido-Landínez, M. Importancia del diagnóstico específico de Salmonella: papel de los serotipos emergentes. Simposio: “Control de Salmonellas en el ámbito de la avicultura”. XXIII Congreso Centroamericano y del Caribe de Avicultura. Federación de Avicultores de Centroamérica y del Caribe (FEDAVICAC). 18 al 20 de Junio de 2014. La Habana, Cuba.
17. Pulido-Landínez, M. Propuesta para un programa de monitoreo de Salmonella en granjas avícolas colombianas basado en autocontrol (MOSAPIP). Cartilla Federación Nacional de Avicultores – FENAVI - FONAV. Septiembre 2014.
18. Scallan, E., et al., Foodborne illness acquired in the United States- unspecified agents. Emerg Infect Dis, 2011. 17(1): p. 16-22.
19. Scallan, E., et al., Foodborne illness acquired in the United States-major pathogens. Emerg Infect Dis, 2011. 17(1): p. 7-15.
20. World Organisation for Animal Health. OIE. 2012. Part 2. Section 2.1, Chapter 2.3.11. Fowl typhoid and pullorum disease. In: Manual of diagnostic tests and vaccines for terrestrial animals. [Internet]. [cited 2013 Aug 8]. Available from: http://www.oie.int/international-standard- setting/terrestrialmanual/access-online
21. World Organisation for Animal Health. OIE, 2013. Prevention, detection and control of Salmonella in poultry. In terrestrial Animal Health Code. URL. http://www.oie.int/fileadmin/Home/eng/Health_standards/tahc/2010/en_ind ex.htm






.jpg&w=3840&q=75)