Evaluación de la resistencia a los antibióticos de las cepas de salmonella spp. aislada de la carne de pollo que se expende en los principales mercados de la ciudad de Guatemala
En la ciudad de Guatemala, a causa de una elevada densidad de población urbana se presentan algunos problemas higiénicos sanitarios en la producción, distribución y venta de alimentos para el consumo humano. Todos los productos y subproductos alimenticios de origen animal, especialmente los distribuidos en los mercados presentan gran demanda en nuestro país.
El principal problema de los productos cárnicos es la contaminación bacteriana ocasionada por la presencia de microorganismos patógenos que se multiplican con rapidez en los alimentos, constituyéndose en un vehículo de transmisión de serias enfermedades gastrointestinales e intoxicaciones alimentarías. Por esta razón los alimentos de consumo humano deben ser manipulados con mucho cuidado e higiénicamente.
Las enfermedades producidas por alimentos contaminados a veces tienen un carácter grave y en algunos casos pueden producir la muerte cuando no se da tratamiento adecuado.
Es importante conocer el comportamiento de los antibióticos ante la Salmonella spp. ya que la resistencia bacteriana, también puede ser adquirida por las aves cuando estas son tratadas inadecuadamente con antibióticos a nivel de granja. Su comprobación implica el fracaso de la terapéutica. Las bacterias naturalmente resistentes frente a determinadas drogas son conocidas desde la producción del fármaco, pero es motivo de interpretación distinta la resistencia adquirida por la bacteria a lo largo del tiempo.
Hoy en día se están cambiando las condiciones de funcionamiento de la industria agroalimentaria en general y más específicamente en la elaboración de productos de origen animal especialmente los avícolas, por su bajo valor económico y alto valor proteico por lo que es necesario tomar en cuenta la inocuidad de los mismos.
El propósito de este estudio es contribuir con información sobre la resistencia antimicrobiana de Salmonella spp. en relación con los antibióticos evaluados. La investigación se realizó con muestras de carne de pollo de los expendios de los principales mercados municipales de la ciudad de Guatemala.
HIPÓTESIS
Las Salmonellas spp. aisladas de la carne de pollo expendida en los mercados municipales para consumo humano presentan resistencia a los antibióticos.
OBJETIVOS
3.1 Objetivo general
Contribuir al conocimiento de la resistencia a los antibióticos de las cepas de Salmonella spp. aislada en carne de pollo que se expende en los principales mercados de Guatemala.
3.2 Objetivos específicos
Determinar el comportamiento de las cepas de Salmonella spp. aislada en la carne de pollo frente a los antibióticos utilizados en el estudio.
Contribuir con información al sistema de vigilancia Global de Salmonella (Global Salmonella Surveillance) sobre situación del comportamiento de las cepas de Salmonella spp. aisladas en la ciudad de Guatemala.
REVISIÓN DE LITERATURA
4.1 Salmonella
Son bacilos gram negativos, móviles, de la familia de las enterobacteriáceas. Existen tres especies: Salmonella typhi, S. Cholerae-suis y S. Enteritidis aunque en esta ultima especie se distinguen más de 2000 serotipos. Son parásitos intestinales de los animales de sangre caliente y fría y pocas veces del hombre, se eliminan por las heces y se diseminan por el medio ambiente, donde pueden sobrevivir durante un tiempo variable según las condiciones de temperatura, pH y humedad. En su mayoría son patógenos para el hombre, los animales o ambos.(16)
La diferenciación de las tres especies de Salmonella, entre sí y de las demás enteróbacterias, se lleva a cabo en función de diferentes propiedades bioquímicas. En general, el género Salmonella está constituido por enterobacterias móviles, que no fermentan la lactosa, glucosa con producción de gas, generan SH2 y no produce desaminasas ni ureasas. Sin embargo S. Tiphy no produce gas y S. paratyphi A no produce SH2, entre otras excepciones a lo anteriormente dicho. (16)
La temperatura óptima para su crecimiento es 37º C, crece bien en alimentos con un pH cercano al punto neutro, pero su crecimiento se inhibe en alimentos ácidos con un pH de 4.5±. (1)
La identificación de los serotipos se basa en un examen antigénico. Estos bacilos poseen un antígeno somático (O), que se trata de un lipopolisacárido termoestable localizado en la pared celular, y un antígeno flagelar (H), que es una proteína termolábil contenida en los flagelos. (16,17)
Alguna cepa aislada presenta además un antígeno capsular termolábil (Vi). Los antígenos Vi y O son los responsables de la virulencia, presentando los anticuerpos anti-Vi un papel protector frente a la infección. (16,17)
4.2 Salmonelosis
Es una enfermedad bacteriana que comúnmente se manifiesta por enterocolitis aguda, de comienzo repentino, que incluye cefalalgia, dolor abdominal, diarrea, nausea y a veces vómito. La deshidratación, especialmente en los lactantes y en los ancianos, puede ser grave.(16)
Casi siempre hay fiebre, con frecuencia anorexia y la diarrea persiste durante días. (14)
Las defunciones son raras, excepto en los niños de muy corta edad y las personas de edad muy avanzada, y en los individuos debilitados, inmusuprimidos. Sin embargo, la morbilidad y los costos concomitantes de la salmonelosis pueden ser altos. (1,14)
La infección puede comenzar en la forma de una enterocolitis aguda y transformarse en septicemia o infección focal. A veces el agente infeccioso se localiza en cualquier tejido del cuerpo presentándose cuadros clínicos específicos:
a). Pulmonar:
La neumonía o el empiema son raros y suelen verse en paciente con alteraciones preexistentes de pulmones o pleura, o cuando hay factores predisponentes, como neoplasias, diabetes, empleo de glucocorticoides, anemia de células falciformes. (16)
La enfermedad de forma sub aguda con fiebre, tos, expectoración purulenta y disnea, acompañada en ocasiones de diarrea; en la radiografía de tórax pueden aparecer imágenes de cavitación. Precisa tratamiento antibiótico prolongado para su curación.
b). Osteoarticulares:
En la artritis séptica por Salmonella el cultivo del líquido sinovial es positivo, hay que distinguirla de la artritis reactiva, en la cual existe una artropatía inflamatoria con cultivo negativo que aparece tras una diarrea invasora en individuos . (16)
Los procesos subyacentes que observamos con más frecuencia en estos pacientes son, tratamiento con glucocorticoides o inmunosupresores, drepanocitosis, prótesis articulares o necrosis aséptica; por la predisposición a desarrollar, son especialmente las infecciones articulares. (16)
Las articulaciones que se afectan con mayor frecuencia son grandes articulaciones como: rodillas, hombros, caderas y sacro ilíacas. (16)
La osteomielitis se suele asociar a drepanocitosis, y afecta generalmente a huesos largos y en individuos jóvenes; en ellos con frecuencia podemos obtener hemocultivos positivos. (16)
c). Aparato urinario:
La orina es la tercera fuente de aislamiento de Salmonella sp en la población general, además de las heces y la sangre; sin embargo, un cultivo positivo no es indicativo de infección urinaria, ya que puede eliminarse por orina en fase bacteremica o ser una contaminación por muestras fecales, por lo que necesitamos criterios clínicos y analíticos para considerar a este microorganismo como agente causal de infección del aparato urinario. (16)
La infección se observa sobre todo en pacientes con urolitiasis, anomalías estructurales o inmunosupresión, pudiendo quedar como portadores urinarios crónicos de Salmonella sp en pacientes con transplante renal, esquistosomiasis o urolitiasis. (16)
d). Cardiovasculares:
Lo que más frecuentemente se ve afectado es el endotelio vascular (valvular o arterial). La endocarditis es rara, pero si ocurre puede producir lesiones destructivas, como perforaciones valvulares y/o abscesos septales o del anillo. El tratamiento debe consistir en antibioterapia adecuada e intervención quirúrgica. (16)
La infección arterial se produce generalmente sobre aneurismas aórticos preexistentes, de origen arteriesclerótico, situados por debajo de la salida de las arterias renales, especialmente en varones de más de 50 años (aneurismas micóticos); a esta localización abdominal le sigue la torácica, siendo excepcional en arterias periféricas. (16)
Además el tratamiento antimicrobiano suele requerir tratamiento quirúrgico. Esta entidad debe sospecharse cuando un varón de edad avanzada presenta fiebre prolongada después de una gastroenteritis, acompañada de dolor abdominal, torácico o de espalda cuando aparece o recidiva la bacteremia después de tratar la enfermedad inicial, o cuando ello ocurre en pacientes con osteomielitis vertebral o individuos con prótesis valvular. (16)
e). Sistema nervioso central:
La meningitis es rara, siendo más prevalente en lactantes, niño y ancianos; asociándose a una alta mortalidad en estos casos, de un 40% a 60% en niños y ancianos respectivamente. (16)
La tinción de gram en líquido sinovial raquídeo suele ser positiva. En los que sobreviven pueden aparecer importantes secuelas, como crisis convulsiva, hidrocefalia, empiema subdural y minusvalías permanentes, retraso mental, paresia, atetosis o trastornos visuales. (16)
El absceso salmonelósico del SNC es más común en adultos y suele estar precedido de meningitis recurrente, traumatismos, hematomas o neoplasia intracraneal. (16)
f). Infecciones intrabdominales:
Puede ser de origen de colecistitis, abscesos esplénicos, hepáticos, peritonitis, etc. Además de S. Typhimurium y S. enteritidis, la S. Tiphy es un importante agente causal. (16)
g). Otras infecciones de Salmonella:
La salmonellosis no tifoidea raramente infecta la piel, tejido subcutáneo y músculo. En pacientes infectados por VIH se ha comunicado algún caso de absceso facial por S.
Enteritidis, y de abscesos subcutáneo en pared torácica por S. Typhimurium, precedidos en ambos casos de diarrea, de abscesos en brazo por S. Enteritidis, en adictos a drogas por vía parenteral, de infección muscular y de arteria humeral por S. Typhimurium secundarios a venopunción. (16)
Igualmente, en seropositivos existe algún caso de tiroiditis supurativa por Salmonella no tifoidea. (16)
4.2.1.Distribución
Se notifica con frecuencia mucho mayor en países de América del norte y Europa por poseer mejores sistemas de notificación. (6)
Se clasifica la Salmonelosis como enfermedad de origen alimentario, pues los alimentos contaminados, principalmente los de origen animal constituyen el modo predominante de transmisión. Solo una pequeña proporción de los casos se identifica sobre bases clínicas y en los países industrializados se calcula que apenas el 1% de los casos clínicos son notificados. (6,15)
La tasa de incidencia de la infección es mayor en los lactantes y en los niños de corta edad. Desde el punto de vista epidemiológico, la gastroenteritis por Salmonella puede seguir en pequeños brotes en la población en general. (6,15)
De 60% a 80% de todos los casos son esporádicos; sin embargo, a veces se producen grandes brotes en hospitales, instituciones para niños, restaurantes y hogares de ancianos, por alimentos contaminados en su origen o, en menor frecuencia, durante su manipulación por una persona enferma o un portador, pero puede deberse a la transmisión de una persona a otra. (6)
4.2.2.Reservorios
Animales domésticos y salvajes de diverso tipo, incluidos porcinos, bovinos, aves de corral, roedores y mascotas caseras tales como iguanas, diversas variedades de tortugas, polluelos, perros y gatos; también el ser humano, es decir, pacientes portadores, convalecientes y en especial, casos leves y no identificados. El estado del portador crónico es raro en los seres humanos. Pero es común en los animales y en las aves. ( 6 )
4.2.3.Modo de transmisión
Por ingestión de los microorganismos en un alimento proveniente de animales infectados, o contaminado por las heces de un animal o persona infectados. Incluye huevos crudos y mal cocidos, y susbproductos; leche cruda y productos lácteos hechos con ella; agua contaminada; carne y sus derivados; aves de corral y productos avícolas. (6)
4.2.4.Período de incubación
Varia entre un rango de 6 a 72 horas. (11)
4.2.5.Período de transmisibilidad
Durante toda la evolución de la infección es muy variable; usualmente de unos días a varias semanas. A veces el estado de portador temporal continúa durante meses, especialmente en los lactantes. Según los serotipos, cerca de 1% de los adultos
infectados y alrededor de 5% de los niños menores de 5 años de edad pueden excretar el microorganismo por más de un año. (6)
4.2.6.Tratamiento
El cloranfenicol constituye el tratamiento clásico de la fiebre tifoidea. Desde su introducción, ha sido el antibiótico de elección en el tratamiento antimicrobiano de esta enfermedad, ya que produce una reacción clínica muy favorable, que se manifiesta generalmente a las 24-48 horas de iniciar el tratamiento a dosis adecuadas (3-4 g/día en adultos o 50-75 mg/Kg/día en niños). (16)
Este fármaco se administra por vía oral durante dos semanas y puede reducirse a la dosis de 2 g/día o 30 mg/Kg/día cuando el enfermo deja de tener fiebre, lo que no suele ocurrir antes del quinto día de tratamiento. Sin embargo, a pesar de su eficacia, existe el riesgo de aparición de anemia aplásica, por lo que en algunos países no ha sido ni es en la actualidad la droga de elección. (16)
Otras pautas por vía oral son la amoxicilina a dosis de 4-6 g/día en cuatro tomas, en adultos, o 100 mg/Kg/día, en niños; el trimetoprim- sulfametoxazol (TMP/SMZ)a dosis 640/3200 mg/día en dos tomas, para adultos, o 185 mg/m2 de superficie corporal de trimetoprim (TMP), para niños. (16)
En el caso de que esté recomendada la utilización de un antimicrobiano por vía intravenosa, una buena opción sería la ceftriaxona, a dosis de 75 mg/Kg/día en niños o de 3-4 g/día en adultos. (16)
Aproximadamente un 25% de las S. enteritidis son resistentes a ampicilina, un 1,4% lo son al cloranfenicol y un 1,5-2% al trimetoprim- sulfametoxazol (TMP/SMZ).
Entre el 42% y el 78% de la S. typhimurium son resistentes a ampicilina y a cloranfenicol, y un 2% al TMP/SMZ. La resistencia a ciprofloxacino y a cefalosporinas de tercera generación es excepcional en nuestro medio. Según este espectro de sensibilidad, TMP/SMZ, fluoroquinolonas y cefalosporinas, constituyen una buena elección para el tratamiento de infecciones por salmonella. Las dosis recomendadas son:
TMP/SMZ: 10/50 mg/Kg/día Ciprofloxacino: 500 mg cada 12 horas(16)
La duración del tratamiento en los casos de enteritis será de 5-7 días. (16)
4.2.7.Medidas preventivas
1. Educar a los manipuladores y preparadores de alimentos respecto a la importancia de:
- Lavarse con cuidado las manos antes, durante y después de preparar alimentos.
- Refrigerar los alimentos en recipientes pequeños.
- Cocer completamente todos los alimentos de origen animal, en especial aves, carne de cerdo, productos hechos con huevos y platillos preparados con carne.
- Evitar la nueva contaminación en la cocina una vez que se ha completado la cocción.
- Conservar la cocina perfectamente limpia y proteger los alimentos preparados de la contaminación por roedores e insectos.(16)
2. Educar al público para que no consuma huevos crudos o cocidos en forma incompleta, tales como ciertos huevos fritos, o los usados en algunas bebidas con huevo o en helados caseros, ni utilice huevos sucios o con el cascarón resquebrajado. (16)
3. Al preparar platillos en los que habría que mezclar muchos huevos antes de la cocción, es conveniente utilizar productos pasteurizados o radiados, al igual que sí el plato preparado luego no es sometido a cocción. (16)
4. Excluir a las personas con diarrea de las tareas que entrañen la manipulación de alimentos y del cuidado de pacientes hospitalizados, ancianos y niños. (16)
5. Orientar con todo detalle a los portadores identificados sobre la necesidad de lavarse minuciosamente las manos después de la defecación ( y antes de manipular alimentos), y prohibirse que manipulen alimentos que consumirán otras personas, durante todo el tiempo en que excreten microorganismos. (16)
6. Se debe reconocer el riesgo de que surjan infecciones por Salmonella en las mascotas. (Los polluelos, patitos y tortugas son particularmente peligrosos para los niños de corta edad). (16)
7. Contar con instalaciones y alentar el uso de la radiación de carnes y huevos. (16)
8. Establecer programas de control Salmonella (control de alimentos, limpieza y desinfección, control de vectores y otras medidas sanitarias e higiénicas. (16)
9. Inspeccionar las condiciones sanitarias y supervisar adecuadamente rastros, instalaciones de elaboración de alimentos, molinos de forrajes, puestos de selección de huevos y carnicerías. (16)
10. Cocer adecuadamente o tratar por medios térmicos, que incluyan la pasteurización la radiación, los alimentos hechos con productos animales y preparados para animales, para eliminar los agentes patógenos, y a continuación emprender medidas para impedir la contaminación. (16)
4.3.DETERMINACIÓN A LA SENSIBILIDAD DE LOS ANTIBIÓTICOS
La administración de antibióticos será más eficaz en el hombre que en los animales ya que se controlará más cuidadosamente tanto el tipo de antibiótico así como la dosis. Sin embargo, pequeñas dosis en los piensos de los animales con fines terapéuticos o profilácticos perpetuarán estirpes resistentes de gérmenes patógenos y no patógenos y mediante mecanismos adecuados pueden ser transmitidos los factores de resistencia entre los microorganismos inocuos en ausencia de antibióticos. Plásmidos que entran y salen de las células bacterianas mediante el bacteriófago son responsables de que de vez en cuando se obtengan y se pierdan los factores de resistencia y de virulencia. ( 2 ).
4.3.1.Método de difusión
El principio del método involucra la aplicación de una cantidad determinada de antimicrobiano en un reservorio ( disco de papel, pastillas con drogas en estado cristalino, etc.) en la superficie del agar sobre la cual se ha distribuido un inóculo del microorganismo en cuestión; formará así por difusión, un gradiente de concentración de antimicrobiano alrededor del reservorio y la sensibilidad del microorganismo estará indicada por el tamaño de la zona de inhibición del crecimiento bacteriano. El diámetro dependerá no sólo de la sensibilidad del microorganismo y la carga del disco, sino también del espesor de la capa de agar, pH y composición del medio de cultivo, de la capacidad de difusión de la droga en ese medio, de la temperatura y atmósfera de incubación de la velocidad de duplicación bacteriana, y el tamaño del inóculo y fase de crecimiento de la bacteria. ( 5 )
4.3.2. Fundamentos para la interpretación de las pruebas de sensibilidad a los antimicrobianos por el método de difusión.
Para cada antimicrobiano se establecen concentraciones críticas o puntos de corte que permiten separar a los microorganismos infectados en tres categorías, sensibles, resistentes o de sensibilidad intermedia, según si la concentración requerida para la inhibición del desarrollo de cada uno de ellos concentración inhibitoria mínima (CIM) es inferior o no a dichas concentraciones.( 5 )
4.3.3. Sensibles
Un microorganismo se considera sensible a un antibiótico cuando se puede esperar que una infección causada por el mismo responda al tratamiento con dicho fármaco a la dosis recomendada. ( 5 )
4.3.4. Resistente
Este término indica que no es probable que la infección causada por el microorganismo responda al antibiótico en cuestión, cualesquiera que sean las dosis y la localización de la infección.( 5 )
4.3.5 Sensibilidad intermedia
Se aplica a dos situaciones. Por un lado, se incluyen en ella las cepas con sensibilidad disminuida a un antibiótico que puede utilizarse con éxito, para el tratamiento en dosis más altas, por ser poco tóxico o porque se concentra en el foco de infección. ( 5 )
4.4. Agar Mueller Hinton
Es considerado como el mejor para las pruebas de sensibilidad de rutina de los microorganismos de rápido crecimiento sin exigencias nutricionales especiales debido a que:
• Muestra buena reproducibilidad entre los distintos lotes.
• Tiene bajo contenido de inhibidores para sulfonamidas, trimetroprim y tetraciclinas.
• Es adecuado para el crecimiento de la mayoría de las bacterias patógenas
• Existen suficientes datos recopilados que avalan la calidad de los resultados de las pruebas de sensibilidad realizadas con este medio. ( 5 )
4.4.1. Composición gr./ litro
| Infusión de carne | 5.0 gr./litro |
| Hidrolizado de caseína | 17.5 gr./litro |
| Almidón | 1.5 gr./litro |
| Agar- agar | 12.5 gr./litro |
4.4.2. Preparación
36.5 gr. del producto se suspenden en 1 litro de agua destilada o desmineralizada fría y se dejan remojar durante 15 minutos. A continuación, se hierve hasta solución total. Se esteriliza en autoclave 10 minutos a 115º C. ( 12 )
El pH del medio de cultivo listo para su uso es de 7.4+/-0.2 a temperatura ambiente y debe determinarse después de su esterilización. Las correcciones necesarias serán realizadas por el agregado de NaOH o HCL 1M: Recordar que en un pH muy ácido hace que las drogas como los aminoglucósidos y macrólidos pierdan potencia mientras que un pH muy alcalino disminuye la actividad de las penicilinas. ( 5,12 )
4.4.3. Interpretación
En las placas destinadas a la determinación de la resistencia, al cabo de 12 horas se miden los diámetros de los halos de inhibición. ( 12 )
4.4.4. Conservación
Han comprobado que el agar Mueller-Hinton, vertido en placa puede ser utilizado todavía para determinaciones de resistencia al cabo de 3 semanas, si se conserva a + 4º C durante este tiempo. ( 12 )
4.5. Preparación del inóculo
A partir de 4 ó 5 colonias bien aisladas y de igual morfología en un medio de aislamiento primario. ( 5 )
El inóculo con solución salina o caldo, hasta alcanzar una turbidez comparable al 0.5 de McFarland por comparación visual con él estándar. Se agitara vigorosamente con vortex o manualmente tanto el tubo con el inóculo como el estándar de Mc Farland. Posteriormente mirar los tubos contra un fondo blanco con una o varias líneas negras como contraste. ( 5 )
4.4.2. Preparación
36.5 gr. del producto se suspenden en 1 litro de agua destilada o desmineralizada fría y se dejan remojar durante 15 minutos. A continuación, se hierve hasta solución total. Se esteriliza en autoclave 10 minutos a 115º C. ( 12 )
El pH del medio de cultivo listo para su uso es de 7.4+/-0.2 a temperatura ambiente y debe determinarse después de su esterilización. Las correcciones necesarias serán realizadas por el agregado de NaOH o HCL 1M: Recordar que en un pH muy ácido hace que las drogas como los aminoglucósidos y macrólidos pierdan potencia mientras que un pH muy alcalino disminuye la actividad de las penicilinas. ( 5,12 )
4.4.3. Interpretación
En las placas destinadas a la determinación de la resistencia, al cabo de 12 horas se miden los diámetros de los halos de inhibición. ( 12 )
4.4.4. Conservación
Han comprobado que el agar Mueller-Hinton, vertido en placa puede ser utilizado todavía para determinaciones de resistencia al cabo de 3 semanas, si se conserva a + 4º C durante este tiempo. ( 12 )
4.5. Preparación del inóculo
A partir de 4 ó 5 colonias bien aisladas y de igual morfología en un medio de aislamiento primario. ( 5 ) El inóculo con solución salina o caldo, hasta alcanzar una turbidez comparable al 0.5 de McFarland por comparación visual con él estándar. Se agitara vigorosamente con vortex o manualmente tanto el tubo con el inóculo como el estándar de Mc Farland. Posteriormente mirar los tubos contra un fondo blanco con una o varias líneas negras como contraste. ( 5 )
La lectura se efectúa por la parte superior habiéndose removido la cubierta de la placa. ( 5 )
4.9. Antimicrobianos seleccionados
Es evidente la imposibilidad de ensayar un gran número de antimicrobianos frente a un microorganismo determinado. La selección final de qué antibióticos deben ser estudiados dependerá del Laboratorio de Microbiología en sintonía con las decisiones del Comité de Infecciones de cada hospital. ( 2 )
4.10. Resistencia bacteriana
La resistencia bacteriana es un tema importante en el estudio de los antibióticos, porque su comprobación implica el fracaso de la terapéutica. Las bacterias naturalmente resistente frente a determinadas drogas son conocidas desde la producción misma del fármaco, pero es motivo de interpretación distinta la resistencia adquirida en el curso de los años o aun en poco tiempo por ciertas bacterias. ( 3 )
4.10.1. Bases bioquímicas de la resistencia
Las bacterias disponen, crean o logran la resistencia mediante diversos recursos biológicos que explican la rapidez de su adaptación a un ambiente desfavorable.
Entre estos recursos se destaca como más importantes:
a.) Disminución de la permeabilidad bacteriana para impedir el acceso del fármaco.( 3 )
b.) Reducción de la afinidad a la enzima blanco de la droga.( 3 )
c.) Modificación de la enzima blanco del antibiótico.( 3 )
d.) Segregación de enzimas inactivadoras del quimioterápico resistencia adquirida en el curso de los años o aun en poco tiempo por ciertas bacterias. ( 3 )
Por esto es conveniente separar para su estudio, la resistencia natural de la resistencia adquirida y de ésta los distintos modos de obtenerla. Cada uno de los procedimientos logrados por distintas bacterias para resistir a los antibióticos tiene bases genéticas y bioquímicas cuyo conocimiento se amplía cada año. ( 3 )
4.10.2. Resistencia natural
Es la ofrecida por las bacterias de una misma especie o cepa frente a determinado antibiótico. Se destaca que esta capacidad de resistencia al fármaco es común a todos los integrantes de la especie. Citamos como ejemplo práctico a Pseudomonas aeruginosa, naturalmente resistente a la penicilina y otros antibióticos. Es la resistencia denominada también como primaria y definida como una insensibilidad de todas las bacterias aisladas de una especie. ( 3 )
4.10.3. Resistencia adquirida
La resistencia de la bacteria a uno o varios antibióticos puede lograrse en el transcurso del tiempo por los mecanismos básicos: por mutación de las características de su cromosoma, la adquisición del material genético con ubicación extracromosómica. La resistencia adquirida se diferencia de la resistencia natural o primaria porque se alcanza de un modo parcial por pocos o muchos integrantes de una misma especie o cepa pero no por la totalidad. Por tanto es fragmentaria, no abarca a toda la especie. ( 3 )
4.10.4. Resistencia cromosómica
La resistencia cromosómica se origina por una mutación espontánea cuya frecuencia ha sido estimada en 10 a la 10ª potencia. Este número potencial adquiere significado a causa del acelerado crecimiento de las especies bacterianas. ( 3 )
Para que esto suceda en términos humanos se necesitan 1.000 años. ( 3 )
La velocidad de multiplicación explica la presencia de una mutante resistente y si la especie está sometida a una droga, se van deteriorando las bacterias y sólo sobreviven aquellas con resistencia cromosómica propia. ( 3 )
En una primera etapa favorece el desarrollo de células resistentes hasta transformarse en cultivo puro antibiótico-resistente. Este modo de adquirir resistencia se califica como espontáneo y discontinuo, con una frecuencia notoriamente menor que la resistencia de origen extracromosómico, ya que no hay propagación a especies diferentes. ( 3 )
La mutación espontánea puede acelerarse por acción de sustancias químicas o agentes físicos mutágenos. ( 3 )
4.10.5. Resistencia extracromosómica
La resistencia adquirida extracromosómica se obtiene por incorporación de material genético que se sitúa por fuera del cromosoma. Se denomina también resistencia transferida o resistencia mediada por plásmidos. ( 3 )
El ingreso del material transferido puede realizarse por mecanismos distintos cuya nominación responde al dispositivo empleado en esta acción bacteriana.( 3 )
4.10.6. Conjugación
Es la transferencia de genes entre bacterias sexualmente diferentes. Requiere contacto de células a célula a través de pelos sexuales para transmitir por factor R, gen extramosómico de la resistencia. Hay un puente citoplasmático de conjugación entre bacterias de distinta especie como E. Coli, Proteus; Klebsiella, Salmonella, Shigella, Pseudomonas.( 3 )
La resistencia así obtenida, se extiende con rapidez porque cada célula recién infectada se transforma en donante de genes de la resistencia. Esta operación ocurre en el plazo de segundos, tanto en el intestino como en la orina.( 3 )
4.10.7. Transducción
Es otro recurso de intercambio genético. Se realiza por intermedio de bacteriófagos, si los plásmidos son de un tamaño reducido, ya que deben transformarse en la estructura cefálica del portador. El fago puede transportar varias resistencias simultáneamente porque el ADN pasa íntegramente de una bacteria a otra. ( 3 )
4.10.8. Transformación
Se ha registrado en medios de cultivo de gérmenes y se produce entre bacterias homólogas. Al sobrevenir la lisis de una bacteria resistente, una porción con el ADN penetra la pared celular de una bacteria susceptible y se combina con el ADN de está. ( 3 )
4.10.9. Transposición
La transposición permite el intercambio entre plásmidos o de un plásmido hacia un cromosoma o hacia un fago sin necesidad de homología entre el donador y el receptor. Los elementos así actuantes se denominan transposones, capaces de decidir su propio sitio de inserción. Los transposones son segmentos del ADN que pueden pasar de la posición en el mismo genoma o hacia un lugar diferente. ( 3 )
4.10.10. Resistencia cruzada
El concepto de resistencia cruzada es de interés médico, porque engloba a los antibióticos con estructura química idéntica. Si el mecanismo de acción de la droga es similar, la bacteria resistente a uno de los integrantes del grupo lo será también a los demás. ( 3 )
El concepto es válido para determinados grupos, como las penicilinas estándar o las tetraciclinas, pero en otros hay mínimas diferencias estructurales que cambian la sensibilidad.( 3 )
Se mencionan los aminoglucosídos o las cefalosporinas cuya acción antibacteriana se altera con modificaciones sintéticas. No obstante, persisten todavía resistencias equivalentes para todos los antibióticos de un grupo, como es Bacteroides para los aminoglucósidos o enterococos para las cefalosporinas. ( 3 )
4.11. AGENTES ANTIMICROBIANOS SELECCIONADOS PARA LA PRUEBA DE SENSIBILIDAD.
4.11.1.Penicilina
4.11.1.1. Actividad antimicrobiana
La actividad antimicrobiana de las penicilinas proviene de la estructura llamada anillo betalactámico que en conjunto con un anillo tiazolidínico y una cadena lateral de ácido 6- aminopenicilínico forman la estructura química básica. Cuando se modifica el anillo betalactámico, la actividad antibacteriana se pierde. Las variables de cadenas laterales en su estructura química convierten a las penicilinas en compuestos con diferentes actividades antibacterianas y con diversas propiedades farmacocinéticas.
Algunas modificaciones de la cadena lateral producen penicilinas resistentes a la hidrólisis producida por diferentes tipos de bectalactamasas tanto de bacterias gram positivas, así como algunas producidas por bacilos Gram negativos. ( 18 )
Las penicilinas pueden dividirse en cinco grandes categorías: penicilinas naturales ejemplo, la penicilina G potásica; penicilinas resistentes a penicilina como oxacilina; aminopenicilinas como ampicilinas; carboxipenicilinas como carbenicilina y ureidopenicilinas como piperacilina. La actividad de la penicilina G, la fenoximetil penicilina, la penicilina procaínica y la penicilina benzatínica está dirigida principalmente hacia cocos Gram positivo no productores de betalactamasas como estreptococos viridans, y algunos enterococos. Las penicilinas naturales tienen actividad frente a Clostridios, y frente a Actinomices sp. La acción contra cocos Gram negativos incluye sólo a N.meningitidis y N. gonorrhoeae no productoras de betalactamasas y finalmente este grupo actúa en espiroquetas. ( 18 )
Las penicilinas resistentes a penicilinazas tienen actividad principalmente para S. aureus y algunos Estafilococos coagulasa negativos. Esta actividad incluye estafilococos productores de penicilinaza y resistentes a las penicilinas naturales.( 18 )
Las aminopenicilinas se originan al añadir un grupo amino al compuesto básico. Este cambio aumenta el espectro para bacterias como, Salmonella sp. ( 18 ) Las carboxipenicilinas tienen una mayor acción para bacilos gram negativos. (18 )
La última de las categorías las llamadas ureido penicilinas tienen un espectro similar de acción que las carboxipenicilinas además de tener actividad contra Klebsiella, Serratia, enterococos y anaerobios ( 18 )
4.11.1.2. Mecanismo de acción
Las penicilinas son agentes bactericidas que inhiben la síntesis de la pared bacteriana induciendo un efecto autolítico. Las penicilinas se unen a enzimas llamadas proteínas que ligan penicilina (PBP) indispensables para la formación e integridad de la pared celular. Esta pared celular consta de peptidoglican para cuya formación se requieren tres etapas. Las penicilinas impiden la tercera etapa o de transpeptidación debilitando el producto final.( 18 )
4.11.1.3. Mecanismo de resistencia
El uso clínico de las penicilinas actualmente es muy limitado, por la emergencia constante de resistencia a penicilinas naturales, S. aureus y estafilococos coagulasa negativa resistentes a meticilina u oxacilina, mucha resistencia en bacilos gram negativos a las aminopenicilinas y otros bacilos gram negativos a las carboxipenicilinas y ureido penicilinas. ( 18 )
La resistencia a las penicilinas puede ocurrir por tres mecanismos principales: degradación enzimática, imposibilidad de penetración a través de la membrana celular y alteraciones del sitio blanco (PBP). La inactivación por betalactamasas es el mecanismo de resistencia más común. Las betalactamasas son mediadas por plásmidos o por cromosomas. Las bacterias gram positivas producen una cantidad de enzimas que son secretadas al espacio extracelular a diferencia de las betalactamasas producidas por bacterias Gram negativas que se localizan en el espacio periplásmico. ( 18 )
Las betalactamasas que inactivan penicilina pueden ser inducidas por la presión de antibióticos betalactámicos o ser constitutivas (producción constante de una betalactamasa sin relación con la presión selectiva. Las betalactamasas pueden ser producidas por mutantes dereprimidas con hiperproducción y finalmente pueden ser betalactamasas de espectro extendido. ( 18 )
4.11.2. Macrólidos
4.11.2.1. Actividad antimicrobiana
La Eritromicina descubierta en 1952, fue el primer macrólido de uso clínico. Los nuevos macrólidos roxitromicina, claritromicina y azitromicina tienen similitudes en la actividad antimicrobiana.( 18 )
Tienen actividad antimicrobiana en especial contra bacterias gram positivas incluyendo. La actividad contra gram negativos. Los macrólidos tienen actividad importante contra algunas micobacterias no tuberculosis.( 18 )
4.11.2.2. Mecanismo de acción
Todos los macrólidos inhiben la síntesis de proteínas actuando sobre la función de los ribosomas. Se unen a la subunidad 50S del ribosoma en el sitio blanco específico que es la molécula 23S del RNA ribosómico. Promueven la disociación de tRNApeptidílico del ribosoma durante la fase de elongación.( 18 )
4.11.2.3. Mecanismo de resistencia
Las bacterias pueden desarrollar tres mecanismos de resistencia contra los macrólidos: alteración del sitio blanco, modificación enzimática del macrólido y mecanismo de transporte defectuoso.( 18 )
El mecanismo de resistencia más común es una modificación del rRNA 23S, con metilación de adenina provocando resistencia cruzada con el resto de los macrólidos, así como resistencia para lincosinamidas y estreptograminas, resistencia conocida como MLS. Esta resistencia puede ser cromosómica, plasmídica e inducible, mediada por genes conocidos como (metilación ribosómica de la eritromicina). La presencia de un nuevo gen, puede así mismo iniciar la producción de enzimas que pueden fosforilan, glicosilar o destruir el anillo lactona de los macrólidos. Finalmente las bacterias resistentes a macrólidos pueden ser resistentes a su ingreso, así como tener un sistema que elimina el antibiótico intracelularmente. ( 18 )
4.11.3. Trimetroprim – Sulfametoxazol
4.11.3.1. Actividad antimicrobiana
La combinación de dos inhibidores de la síntesis de ácido dihidrofólico causan una actividad sinergística contra diferentes microorganismos. La combinación de trimetoprim-sulfametoxazol (TMP-SMX) tiene actividad gram positivos y gram negativos. La resistencia a TMP-SMX en estreptococos es menor a 10%, para S. pneumoniae 10-40%, S. aureus 5-40%, E. coli 10-20%, Proteus sp. 30-50%, Klebsiella 30-50% y Enterobacter 10-60%. Estos porcentajes limitan su uso para el tratamiento de muchos síndromes infecciosos comunes y se reserva su uso en países como México para situaciones especiales. (18 )
4.11.3.2. Mecanismo de acción
SMX inhibe la síntesis de ácido dihidroptérico compitiendo con el ácido paminobenzoico. El TMP se une a la reductasa del dihidrofolato impidiendo la transformación del ácido dihidrofólico en ácido tetrafólico. Este bloqueo enzimático secuencial es lo que le da a TMP-SMX su actividad antimicrobiana. ( 18 )
4.11.3.3. Mecanismo de resistencia
Algunas bacterias resistentes a TMP-SMX tienen disminución en la permeabilidad al compuesto. Junto con este mecanismo de resistencia existe un mecanismo de egreso intracelular. En ocasiones la resistencia es secundaria a una producción excesiva de ácido p-aminobenzoico o cambios mutacionales en la reductasa del dihidrofolato impidiendo la unión de TMP en su sitio blanco. ( 18 )
Las bacterias con resistencia, cifrada por plásmidos, elaboran enzimas evasivas que eluden el bloqueo matabólico efectuado por sulfamidas o trimetroprima mediante pasos secuenciales distintos. Pero también pueden adoptar otros dispositivos para adquirir resistencia, como es el acopio de tiamina o metionina en lugar de ácido paraaminobenzoico. Así mismo, pueden adoptar el reemplazo de la enzima dihidrofolatorreductasa, sensible a estas drogas, por otra enzima 20.000 veces menos susceptibles a la inhibición. ( 18 )
4.11.4. Tetraciclinas
4.11.4.1. Actividad antimicrobiana
Las tetraciclinas tienen actividad contra bacterias gram positivas, gram negativas aeróbicas y anaeróbicas. Las tetraciclinas actúan contra Rickettsiae sp. , Coxiella burnetti, Borrelia burgdorferi, Borrelia sp. , algunas micobacterias no tuberculosis. Las tres tetraciclinas con mejor actividad son: Doxiciclina, Minociclina y Tetraciclina.( 18 )
4.11.4.2. Mecanismo de acción
Las tetraciclinas se unen de manera definitiva a la subunidad 30S ribosómica, provocando inhibición de la síntesis de proteínas. Para llegar a su sitio blanco las tetraciclinas tienen que penetrar la pared celular a través de poros o por un proceso de transporte. ( 18 )
4.11.4.3. Mecanismo de resistencia
La resistencia a tetraciclinas ocurre cuando disminuye la penetración o cuando se forman proteínas que protegen al ribosoma de la unión de las tetraciclinas a su sitio blanco. La disminución de la penetración de tetraciclina dentro de la célula bacteriana puede acompañarse de un mecanismo de egreso activo mediano por proteínas de membrana. ( 18 )
4.11.5. Cloranfenicol
4.11.5.1. Actividad antimicrobiana
El cloranfenicol es un antibiótico bacteriostático, activo contra bacterias aeróbicas y anaeróbicas gram positivas con la excepción de S. aureus oxacilina resistente y enterococos. El cloranfenicol tiene actividad bactericida sólo contra S. pneumoniae, y N. meningitidis. Este antibiótico tiene actividad contra algunos enterococos. Para bacilos gram negativos aeróbicos la actividad del cloranfenicol es diversa; es activo contra Salmonella, tiene buena actividad contra anaerobios gram negativos. ( 18 )
4.11.5.2. Mecanismo de acción
El cloranfenicol interfiere con la síntesis microbiana de proteínas al unirse a la subuni- dad ribosómica 50S. La interferencia también ocurre en células humanas, lo que explica la toxicidad del cloranfenicol. ( 18 )
4.11.5.3. Mecanismo de resistencia
El cloranfenicol puede ser acetilado por la enzima acetiltransferasa del cloranfenicol. Esta enzima es codificada por genes que pueden codificar resistencia para otros antibióticos. Las bacterias que pueden desarrollar resistencia a través de la producción de la acetiltransferasa. Otro mecanismo bacteriano de resistencia a cloranfenicol es la pérdida de la proteína bacteriana de la membrana externa responsable de la penetración intracelular del cloranfenicol. ( 18 )
4.11.6. Cefalosporinas
4.11.6.1. Actividad antimicrobiana
La estructura básica de las cefalosporinas consiste en un anillo de dihidrotiazina unido a un anillo betalactámico. Estos antibióticos betalactámicos se desarrollan a partir del descubrimiento de la cefalosporina C, compuesto con actividad contra E. coli, S. typhi y S. aureus. Múltiples modificaciones incluyendo cambios en el grupo 7-acil, substituciones en la tercera posición del anillo de dihidrotiazina y la introducción del núcleo 2-amino-5-tiazolil, han dado múltiples variantes de cefalosporinas de gran uso clínico incluyendo cefalosporinas orales y cefalosporinas parenterales. ( 18 )
4.11.7. Cefalosporinas parenterales
Las cefalosporinas de uso parenteral pueden dividirse en cefalosporinas de primera generación con una mayor actividad contra cocos gram positivos (cefalotina), de segunda generación con mejor actividad contra bacilos Gram. Negativos, incluyendo anaerobios (cefoxitina), de tercera generación con mayor actividad contra bacilos Gram. Negativos incluyendo P. aeruginosa (cefotaxima, ceftriaxona, ceftazidima) y de cuarta generación con actividad contra gram positivos y gram negativos en especial bacterias productoras de betalactamasas tipo 1 (cefpirome, cefepime). ( 18 )
4.11.7.1. Mecanismo de acción
Como todos los antibióticos betalactámicos, las cefalosporinas impiden la síntesis de la pared celular bacteriana a través de la inactivación de una o varias proteínas que ligan penicilina (PBP). Las cefalosporinas tienen que penetrar la superficie de la bacteria gram negativa para unirse a una PBP. Muchas de las cefalosporinas parenterales en especial las cefalosporinas de tercera y cuarta generación tienen una mayor penetración a través de los canales porínicos, así como una mayor estabilidad para la hidrólisis producida por algunas betalactamasas (cefpirome, cefepime). ( 18 )
4.11.7.2. Mecanismo de resistencia
Los mecanismos principales de resistencia para las cefalosporinas son la disminución de la penetración y la producción de betalactamasas (cefalosporinasas) principalmente por bacterias gram negativas. La resistencia producida por betalactamasas para cefalosporinas parenterales es un fenómeno complejo que incluye la inducción importante por cefalosporinas de primera y segunda generación de betalactamasas, la inducción de betalactamasas tipo 1, las estables dereprimidas y la producción de betalactamasas mediadas por plásmidos (TEM, SHV), que pueden ser de espectro limitado y las de espectro extendido; estas últimas afectan cefalosporinas de tercera generación.( 18 )
4.11.8.Quinolonas
4.11.8.1. Actividad antimicrobiana
Los agentes de primera generación sólo eran activos contra algunas Enterobacteriaceae, no inhibían Estafilococos, Estreptococos ó Pseudomonas aeruginosa no siendo así las de nueva generación que dentro de su espectro incluyen microorganismos resistentes a múltiples fármacos y que también lo son a penicilinas, cefalosporinas y aminoglucosidos. ( 10 )
En términos generales, las fluroquinolonas poseen poca actividad contra especies anaerobias con algunas de bacteroides, Clostridium y otros cocos y bacilos anaerobios. Por tal motivo, cabria considerar que ninguno de los agentes disponibles, generara concentraciones tisulares o en líquidos suficientes para inhibir a los anaerobios.( 8,10 )
Las quinolonas se ligan específicamente a las subunidades A de la girasa ADN, aunque algunos estudios sugiere que también pudiera ligarse a las subunidades B en algunas situaciones y también ADN. ( 10)
Estos agentes muestran un notable efecto inhibitorio - post-antibiótico contra bacterias gram negativas y gram positivas y ello significa que aquellas que han sido expuestas a las fluoroquinolonas y no han sido destruidas, no reanudan su crecimiento durante dos o seis horas, aspecto que pudiera tener importancia clínica porque significa que los fármacos pueden administrarse con menor frecuencia de la que cabria calcular con base a su vida media semejante a la de los compuestos de origen. ( 10 )
4.11.8.2. Mecanismo de acción
El sitio de acción de todas las quinolonas y fluorquinolonas es el DNA girasa o topoisomerasa II, una enzima esencial para la replicación del material genético bacteriano. Contiene dos subunidades A y dos B.( 19 )
La resistencia bacteriana a compuestos como el ácido nalidíxico se generará nivel del locus productor de las fracciones A, de tal suerte que las enzimas que se genera no puede ser inhibida por el ácido nalidíxio, con resistencia cruzada a otras quinolonas de primera generación y algunas de segunda. ( 2 )
No obstante, la acción de agentes 4-quinolínicos con un anillo 6-fluoruro-7- piperazínico, también incluye la subunidad B, haciendo hipersensible a la DNA-girasa. ( 19 )
La función de la DNA-girasa es vital para la replicación de los ácidos nucleicos bacterianos. De manera muy simplificada, se puede decir que dicho material se encuentra apelotonado y que la función de la DNA-girasa consiste en convertir en línea dicho material, y girarlo en sentido contrario a la torsión normal de la doble hélice para permitir que el material genético se replique, transcriba, repare y recombine.( 19 )
Así, la inhibición de estos procesos genera el bloqueo de múltiples funciones celulares, muchas de ellas vitales, de ahí el carácter bactericida de las quinolonas.( 19 )
Es importante señalar que aunque todos éstos agentes tiene efecto sobre la DNAgirasa son variadas las formas en que cada quinolona actúa en particular. Por ejemplo, se sabe de la síntesis de proteínas tóxicas inducidas por el ácido nalidíxico en E: coli (similares a las proteínas del estrés por calor), lo que explique el porqué sé antagoniza su efecto en presencia de inhibidores de la síntesis proteínica como cloranfenicol, tetraciclinas y rifampicina. ( 19 )
También se sabe que el ácido nalidíxico y el oxolínico bloquean la síntesis de proteínas, de ahí que a dosis altas interfieran con su propio mecanismo de acción. Algunas fluorquinolonas actúan además directamente sobre el ácido, desoxirribonucleico como la norfloxacina. Además, las fluoroquinolonas tienen acción dos niveles en el DNA girasa y se cree que matan a las bacterias por un efecto combinado de inhibición metabólica más la destrucción del material nuclear y aun de DNA- girasa. ( 19 )
Las fluoroquinolonas en general son bactericidas a la misma concentración considerada como mínima inhibitoria o cuatro veces más que lo que las hace especialmente atractivas para el uso clínico. En general las fluorquinolonas, y en especial las de tercera generación, no se inactivan en presencia de suero, actúan independientemente del tamaño del inóculo y puede ejercer su efecto antibacteriano a nivel intracelular. ( 19 )
4.11.8.3. Resistencia bacteriana
Poco después de que se comenzara a usar el ácido nalidíxico en los comienzos del decenio de 1960, apareció en forma rápida gran resistencia de las bacterias a él. Se demostró que el mecanismo de tal resistencia era la alteración de la ADN girasa o por alteración de los componentes de la pared externa bacteriana.( 8, 10 )
Hasta 1987 no se había identificado resistencia a quinolonas mediada por plásmidos y hubo un señalamiento. De un plásmido de 240 Kb en una especie de Shigella dysenteriae.( 19 )
La alteración de la girasa ADN hace que aumente las concentraciones inhibitorias mínima (MIC) de bacterias, pero tales incrementos por lo común llegan a niveles de un microgramo por mililitro, niveles que pueden obtenerse en la sangre con quinolonas tales como la Ciprofloxacina y la Ofloxacina, y es mucho menor que las concentraciones de todos los nuevos agentes en orina. ( 10 )
La resistencia a las quinolonas es más rápida que a las fluoroquinolonas. De hecho, se sabe que de manera natural la resistencia a las fluoroquinolonas de tercera generación es notablemente bajo con una frecuencia de mutaciones inferior a 1 x 10a. (19)
Aunque experimentalmente se ha logrado seleccionar a bacterias resistentes, no se ha descrito la inactivación enzimática de las quinolonas y fluoroquinolonas por bacterias. ( 19 )
Se ha referido la resistencia cruzada de las quinolonas con las fluoroquinolonas de segunda generación, como la onoxacina, cinaxacina, ciprofloxacina y norfloxacina. ( 19 )
Como con cualquier antimicrobiano generado a la fecha, el uso indiscriminado de las nuevas fluoroquinolonas puede resultar en la generación de resistencia. Se ha encontrado un aumento notable de resistencia a fluoroquinolonas de especies de Campylobacter en el ser humano, y se piensa que esto se debe al uso de Enrofloxacina en aves y la transmisión casi exclusiva de estas especies. ( 19 )
De cualquier manera, es posible especular que dado el mecanismo de acción tan peculiar de estos compuestos, logrado a tantos niveles en el material genético de la bacteria, la resistencia tardará más en aparecer y lo hará menos extensivamente que con otras glorias pasadas de la quimioterapia antibacteriana. ( 19 )
4.11.9. Aminoglucósidos
4.11.9.1. Actividad antimicrobiana
Los aminoglucósidos se utilizan casi exclusivamente para tratar infecciones causadas por bacterias gram negativas y quedó demostrado que estas sustancias inhibían la multiplicación de los bacilos gram negativos y gram positivos, tanto in vitro como in vivo. ( 8 ).
4.11.9.2. Mecanismo de acción
Este se ha explicado en función de la unión del antibiótico a una proteína receptora en la membrana bacteriana facilitada por la electropositividad de los aminoglucósidos y aminociclitoles, la electronegatividad de la superficie celular. EL antibiótico ingresa a la bacteria por transporte activo, dependiente de oxígeno, relacionado con el transporte de electrones quinolonas respiratorias y, al parecer, esto altera la permeabilidad de la membrana bacteriana, lo que explica el sinergismo que logran estos compuestos con muchos antibacterianos ß-lactámicos. Dentro del citoplasma bacteriano, se unen a la unidad ribosomial 30s y en mucho menor proporción a la 50s y se origina una desigregación de polisomas en monosomas, lo cual provoca la síntesis desorganizada de péptidos. ( 19 )
La combinación del efecto en la membrana y el de la síntesis proteínica induce bacteriólisis, consecuencia poco común para antibacterianos que interfieren con la síntesis de proteínas. ( 19 )
4.11.9.3. Resistencia bacteriana
La inducción de resistencia a los aminoglucósidos es relativamente rápida. Al parecer, la resistencia está mediada por la generación de enzimas inactivadoras, dependientes de plásmidos y, por ende, trasmisibles. La resistencia se manifiesta como una limitación del ingreso de estos antimicrobianos al interior de la bacteria. ( 19 )
4.12. MANIPULACIÓN DE ALIMENTOS
Durante el despiece y transformación de la carne de ave es cuando mayor riesgo de que se contamine de posibles bacterias patógenas especialmente de Salmonella . Uno de los factores más importantes es la retirada del buche, que muchas veces, se rompe en dicho proceso, derramando su contenido (alimento no digerido), dentro y sobre el pollo.( 15 )
La ingestión de toxinas en los alimentos también puede causar enfermedades. Estas substancias nocivas son producidas por los bacterias y muchas son resistentes al calor. En estos casos, el calentar el alimento no evita la intoxicación. (9, 11 )
El riesgo que la manipulación incorrecta del alimento puede ocasionar a la salud del hombre. Estos se derivan de la contaminación de los productos por seres microscópicos (gérmenes), capaces de desarrollarse en ellos, multiplicándose muy rápidamente. En la inmensa mayoría de los casos no se cambia el aspecto ni otras características del alimento, por lo que la alteración no puede reconocerse a simple vista. (9, 13 )
Los gérmenes son pequeñísimos, tanto que en una gota puede haber millones de ellos. ( 13 )
4.12.1. Alteraciones de los alimentos
Un alimento a lo largo de los procesos de manipulación puede alterarse por diferentes causas, para ello es necesario conocer las características organolépticas de la carne de pollo. ( 13 )
A continuación se presenta una cuadro con las características organolépticas deseables e indeseables de la carne de pollo.
Características organolépticas optimas y alteradas de la carne de pollo.
| PROPIEDADES ÓPTIMAS | PROPIEDADES ALTERADAS |
| Superficie brillante. Firme al tacto y piel adherida. Piel de color uniforme, variando De amarillo pálido a más pronunciado Carne rosada y húmeda. Olor característico. | Superficie seca o pegajosa. Blanda, se deshace con facilidad, la piel se desprende. Coloración verdosa, negruzca sanguinolenta, pálida. Olor fétido. (11 ) |
PROPIEDADES ÓPTIMAS
PROPIEDADES ALTERADAS
Superficie brillante.
Firme al tacto y piel adherida.
Piel de color uniforme, variando
De amarillo pálido a más pronunciado
Carne rosada y húmeda.
Olor característico.
Superficie seca o pegajosa.
Blanda, se deshace con facilidad, la piel se desprende.
Coloración verdosa, negruzca sanguinolenta, pálida.
Olor fétido. (11 )
4.12.2. Condiciones que favorecen el desarrollo de los gérmenes en los alimentos
4.12.2.1. Temperatura
Los gérmenes que pueden ocasionar problemas de salud en el hombre crecen en forma óptima a temperatura del cuerpo humano, es decir, 36º C a 37º C. A medida que las temperaturas se separan de este óptimo, tanto en más como en menos, se dificulta su desarrollo.( 11)
Al descender la temperatura, el desarrollo se dificulta y por debajo de los 4º C, los gérmenes dejan de multiplicarse aunque no mueren, incluso auque descienda la temperatura muy por debajo de cero grados. Esto es importante pues un alimento congelado, si estaba contaminado antes de su congelación, lo seguirá estando, y los gérmenes que tuviera volverán a reproducirse en cuanto se encuentren a temperatura adecuada.( 11, 13 )
A medida que aumenta el calor se reduce su reproducción. Por encima de los 65 ºC la mayoría de los gérmenes comienzan a alterarse y a los 100º C ebullición en el agua no pueden subsistir más de unos minutos.
Cuanto más se eleva la temperatura menor es el tiempo necesario para destruirlo. El calor también destruye las toxinas producidas por los gérmenes. ( 7, 13, )
4.12.2.2. Humedad
El agua es indispensable para la vida, por lo que la falta de humedad dificulta el desarrollo de los microorganismos.( 7 )
4.12.2.3.Composición de alimento
Cuanto más ricos sean éstos en sustancias nutritivas, tanto más favorecerán el crecimiento. Hay gérmenes que prefieren los azúcares y otros las proteínas. En general son alimentos especialmente favorables para el desarrollo de los gérmenes.(7 )
4.13. Transmisión de Salmonella en carne
La carne de un animal con Salmonellas puede contaminar a otras durante el transporte o durante la preparación.(7 )
La Salmonella no produce toxinas y se destruye a 65º C en 30 minutos. Como contamina con relativa frecuencia las carnes conviene procurar que al asar grandes piezas esta temperatura se alcance en su interior, lo que se comprueba cuando la carne presenta color gris en todo el corte del trozo asado.(13)
4.14. Como evitar la infección por Salmonella
-Higiene personal, rigurosa y sobre todo lavado de manos antes de tocar los alimentos y siempre después de usar el retrete.(13)
-Mantener los alimentos en refrigerador hasta su preparación.(13)
-No exponer los alimentos a temperatura ambiente, durante su preparación, más que el tiempo imprescindible.(13)
-Cocinar bien las carnes que se asan.(13 )
-Cuando haya que conservar alimentos, después de su preparación, se colocaran en el frigorífico y se calentarán después hasta 80º C por lo menos, inmediatamente antes de servirlos.(13)
4.15. Transporte de carne fresca hasta los puntos de venta
El transporte debe ser en camiones refrigerados. Los canales colgados y la carne despiezada, envasada en cajas. El personal que maneje las piezas para depositarlas en el lugar de venta deberá hacerlo con sumo cuidado y limpieza.(13)
4.16. Tiempo de conservación de la carne
Depende de la frescura inicial del producto que hay que saber reconocer, consistencia firme, brillo del corte, color, olor propio de la carne, etc.(13)
Estará también en función de las facilidades de conservación: congelador, frigorífico, frescura.(13)
Una carne fresca debe consumirse antes de que sus buenas características se alteren y esto puede ocurrir en un plazo de 2-4 días.(13)
4.17. Exposición de carne a la venta
Se colocara a la venta expositores frigoríficos, protegidos del contacto del público, diferenciadas en sus cortes y categorías.(13)
4.18 Instalaciones de las ventas de carne
Deberá escogerse materiales de fácil limpieza en los que pueda utilizarse agua, jabón y detergentes. Nunca se procederá a barrido en seco, por el riesgo de producción de polvo. Las superficies serán lisas, sin ángulos de difícil acceso y mantenerse libres de desconchones, gritas y ranuras donde se acumula la grasa, polvo y la suciedad en general. ( 13 )
4.18.1. Revestimiento de paredes y techo
Revestimientos impermeables, al menos hasta unos dos metros aproximadamente.(13 )
Después puede usarse pinturas plásticas que permitan el lavado. ( 13 )
4.18.2. Ventilación
Si la ventilación no es correcta constituye un medio ambiente adecuado al crecimiento de los gérmenes al mismo tiempo que provoca olores desagradables.( 13 )
La transmisión de gérmenes por el aire hace necesario un cuidado especial de las corrientes de aire que siempre deben ir de la zona limpia a la zona sucia, sobre todo en el caso de que la ventilación de los locales no sea natural. ( 13 )
4.18.3. Agua
Debe existir suficiente dotación de agua caliente y fría para los fregaderos. Porque el personal que realiza las diferentes manipulaciones de los alimentos debe lavarse las manos tantas veces como sea necesario. ( 13 )
4.18.4. La basura
Puesto que siendo productos de desecho y procedentes de distintos tipos de alimentos en diferentes estados-Crudos, cocidos deteriorados –constituyen un foco de contaminación y de mal olor. ( 13 )
Deben pues estar aislados de la zona donde tienen lugar la manipulación de los alimentos.( 13 )
Los basureros deben estar tapados, en cubos, a ser posible de apertura por pedal y provistos de una bolsa de plástico o papel fuerte. Se limpiarán diariamente con detergentes. ( 13 )
4.18.5. Instrumentos y elementos de trabajo
El buen estado de los elementos de trabajo forma parte integrante de la garantía higiénica del proceso de manipulación de alimentos. ( 13 )
Desde los más complicados a los más sencillos deben estar en perfectas condiciones de uso y mantenidos en una limpieza total. No olvidemos que tiene contacto directo con el dinero. ( 13 )
Por otra parte el manipulador puede trabajar más eficazmente y con menos esfuerzo cuando sus elementos de trabajo funcionan bien. ( 13 )
4.18.6. Actitudes
Todo lo anteriormente expuesto puede tener una utilidad muy pequeña si los manipuladores de los alimentos no llegan a al convencimiento y los usuarios de los servicios no valoran los comportamientos en relación con la salud. ( 13 )
Cualquiera de las recomendaciones expuestas llevan consigo unos cambios en la forma de hacer que afectan a nuestros hábitos. La forma de trabajar, nuestros gestos cotidianos, etc. Toda manipulación innecesaria supone un riesgo que se debe evitar. ( 13 )
MATERIALES Y MÉTODOS
5.1 MATERIALES
5.1.1 DESCRIPCIÓN DEL ÁREA DE ESTUDIO
La municipalidad de Guatemala cuenta con dos tipos de mercados registrados, los satélites que no tienen un edificio y los municipales que tienen un edificio. Para este estudio se tomaran los principales mercados municipales de la ciudad de Guatemala.
Mercados municipales de la ciudad de Guatemala
1. “Sur” – 2 6ta. Av. Entre 19 y 21 calle zona 1
2. “Central” 9na Av. entre 7 y 8 calle zona 1
3. “La Presidenta” 2da. Av. Entre 21 y 22 calle zona 1
4. “Colón” 13 Av. Entre 6 y 7 calle zona 1
5. “Cervantes” Avenida Elena y 18 calle zona 3
6. “La Terminal” O Av. Entre 7 y 8 calle zona 4
7. “La Palmita” 16 Av. Entre 26 y 27 calle zona 5
8. “Asunción” 18 calle y 35 Av. Zona 5
9. “Parroquia” Calle Martí y 11 Av. zona 6
10. “San Martín” 18 Av. Entre 1 y 1A calle zona 6
11. “San José Mercantil” 5 calle y 12 Av. zona 7 Quinta Samayoa
12. “La Villa” 14 Av. Entre 18 y 19 calle zona 10
13. “El Guarda” 3 Av. Entre 3 y 4 calle zona 11
14. “La Reformita” 11 Av. Entre 22 y 23 calle zona 12
15. “Santa Fe” 2 calle y 11 Av. Zona 13 Santa Fe
16. “La Florida” 12 Av. Y 5 calle zona 19
17. “Justo Rufino Barrios” Colonia Justo Rufino Barrios zona 21
18. “Candelaria” 15 Av. Y 25 C. zona 6 proyecto 4-3
5.1.2. RECURSOS HUMANOS:
Técnicos de laboratorio de Microbiología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de San Carlos de Guatemala.
Estudiante Investigador.
Asesores de la investigación.
5.1.3. RECURSOS DE LABORATORIO
- Probetas calibradas
- Pipetas calibradas
- Autoclave
- Mechero Bunnsen
- Asas para siembras bacteriológicas
- Crayón graso
- Tubos de ensayo
- Cajas de Petrí
- Incubadora
- Refrigeradora
- Homogenizador
- Tijeras estériles
- Cuchillo estéril
- Pinzas estériles
- Bolsas plásticas estériles
- Hielera
- Hisopos de algodón
- Agua peptonada con amortiguador (AP)
- Agua peptonada concentrada (APC)
- Solución salina con amortiguador de fosfatos (PBS)
- Caldo GN
- Caldo tetrationato
- Caldo Rappaport-Vassiliadis
- Agar XLT4 (xilosa-lisina-tergitol)
- Agar BGSulfa (verde brillante con sulfadiazina)
- Agar TSI (Triple Sugar Iron agar)
- Agar MIO ( Movilidad-indol-ornitina)
- Agar LIA (agar de Hierro-Lisina)
- Agar Citrato de Simmons
- Agar Urea de Christensen
- Agar Mueller Hinton
- Caldo lisina con base Moeller
- Caldo MR-VP (Pruebas de Rojo de Metilo y Voges – Proskauer)
- Aceite mineral
- Reactivo de Kovacs
- Reactivo de KOH para prueba de Voges -.Proskauer
- Reactivo de alfa –naftol para la prueba de Voges – Proskauer
- Reactivo de rojo de metilo
- Discos de sensibilidad antibiótica
5.1.4. RECURSOS BIOLÓGICOS
- Cepa E. Coli ATCC 25922
- Cepa de Salmonella spp
- 90 muestras de carne de pollo
5.1.5. RECURSOS FÍSICOS
- Equipo fotográfico ( cámara y película)
- Equipo de oficina ( computadora, diskettes, papel bond,.)
- Vehículo
- Laboratorio de Microbiología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de San Carlos de Guatemala.
- Fichas de campo
5.2. METODOLOGÍA
5.2.1. UNIVERSO
Mercados municipales registrados en la ciudad de Guatemala
5.2.2. DISEÑO DE ESTUDIO
Se define como un estudio descriptivo de corte transversal para lo cual se realizará un muestreo por conveniencia con asignación sistemática de los expendios, para el aislamiento de Salmonella sp. en muslos de pollo.
5.2.3. RECOLECCIÓN DE MUESTRAS
Se realizo el muestreo en 5 pollerías por cada mercado. De preferencia se utilizo una pieza por expendio (muslo) que se introdujo en una bolsa plástica estéril, y fueron transportadas al laboratorio en una hielera conteniendo hielo para garantizar una temperatura constante y adecuada.
5.2.4. METODOLOGÍA DE LABORATORIO
DIA 1
Se sembró en un medio pre–enriquecimiento no selectivo para recuperar las células lesionadas. La mayoría de los alimentos no estériles o conservados son sometidos a diferente tipos de tratamientos subletales durante su procesamiento, manejo y almacenamiento.
Se coloco el paquete de carne sólida sobre la mesa de trabajo, en un campo estéril .
Con técnica estéril (guantes, tijera) se proceso en una bolsa plástica estéril. • Se agrego 20 ml de solución buffer de fosfatos (PBS) para 1 pieza de pollo. Se giro la bolsa varias veces para cerrarla y se agito vigorosamente de lado a lado 60 veces. Se coloco el enjuague de PBS en una bolsa o contenedor plástico y se agrego un volumen de agua peptonada concentrada (APC) en proporción de 1:9 de APC:
Él enjuague de PBS, incubo a 37º C por 18-24 horas.
DIA 2
Se sembró caldos selectivos de enriquecimiento que tiene compuestos que permitieron la proliferación de Salmonella e inhibierón el crecimiento de otros microorganismos.
A las 24 horas de incubación se sembró 0.1ml. APC a 10 ml. de caldo GN.
Se sembró 0.1 de APC a 10 ml. en caldo Tetrationato, se incubo 48 horas a 37º C.
DIA 3
Se sembró 0.1 ml con una pipeta del caldo GN a 10 ml de Caldo Rappaport- Vassiliadis. (RV1), se incubo por 24 horas a 37º C.
DIA 4
Se sembró 0.1 ml con una pipeta del caldo Tetrationato a 10 ml de caldo Rappaport-Vassiliadis (RV2). Se incubo a 37º C por 24 horas.
Se sembró del caldo RV1 en placas de XLT4 y BG Sulfa, y se incubo a 37º C por 24 horas.
DIA7
Se sembró del caldo RV2 en placas XLT4 y BG Sulfa y se incubo a 37º C por 24 horas.
DIA 9
Se realizó las siembra de las pruebas bioquímicas de las colonias aisladas, las cuales se incubaron por 24 horas a 37° C.
DIA 10
Lectura de las pruebas bioquímicas. (4)
MÉTODO USDA PARA EL AISLAMIENTO DE Salmonella spp EN CARNE SÓLIDA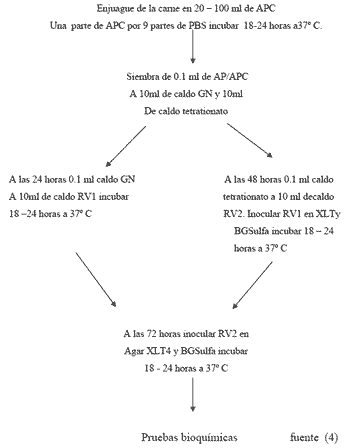
5.2.5. SENSIBILIDAD A LOS ANTIMICROBIANOS
Se realizo el inóculo en solución salina a partir de colonias seleccionadas de una placa de cultivo no selectivo de 18 a 24 horas de incubación. Se realizo una suspensión que fue ajustada a la escala de 0.5 de Mc Farland.
Se ajusto el inóculo, se sembraron las placas de Mueller Hinton con un hisopo estéril. No pasaron más de 15 minutos ajustado el inoculo.
Se presionó el hisopo contra la pared del tubo a fin de escurrir el exceso del inóculo. Se inoculo la superficie seca del agar Mueller Hinton por hisopado en tres direcciones para asegurar una completa distribución del inóculo.
Se colocaron los discos sobre la superficie del agar inoculado con pinza estéril aplicando una ligera presión a una distancia no menor de 24 mm desde un centro al otro. Las placas que se utilizaron fueron de 150mm. Las cuales tienen una capacidad para no mas de 12 discos. Debido a que algunas drogas se difunden casi instantáneamente, un disco no debe ser removido una vez que tomó contacto con la superficie del agar.
Se incubó las placas invertidas a 35º C dentro de los 15 minutos posteriores a que los discos fueron colocados.
5.2.6. INTERPRETACIÓN DE LOS RESULTADOS
Después de 24 horas de incubación se examinó cada placa y se midió el diámetro de la zona de inhibición.
Se interpreto de la siguiente manera:
• Diámetro de inhibición grande como Resistente (R)
• Diámetro de inhibición regular como Intermedio (I)
• Diámetro de inhibición pequeño como Sensible (S)
El diámetro de los halos fueron evaluados según tabla 1.
Los resultados obtenidos se anotaron en la boleta correspondiente ficha 1.
5.2.7. ANÁLISIS DE RESULTADOS
Se determino la resistencia antimicrobiana de Salmonella spp a los diferentes antibióticos estudiados y los resultados se presentaran en cuadros y graficas.
5.2.8. CENTROS DE REFERENCIA
• OPS (Organización Panamericana de la Salud)
• Internet
• Biblioteca de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad
de San Carlos de Guatemala.
• Departamento de Microbiología de la Universidad de San Carlos de Guatemala.
RESULTADOS Y DISCUSIÓN
Se muestrearón 18 mercados municipales, y en cada uno de ellos se obtuvo cinco muestras de carne de pollo al azar lo que sumaron 90 muestras, las cuales fueron analizadas por el método recomendado por USDA para el aislamiento de Salmonella spp. a partir de carne sólida.
El 14.44% de las muestras fueron positivas a la presencia de Salmonella spp. esto evidencia que las fuentes de contaminación en este alimento que se expende en los mercados municipales de la ciudad de Guatemala, puede ser la exposición al medio ambiente, la conservación deficiente y el mal manejo sanitario del alimento por parte de los expendedores o que el pollo llegue ya contaminado a los expendios. (Tabla 2) Se puede concluir que la ausencia de controles higiénico sanitario de los expendios y del propio producto en sí hace que éste se contamine puesto que el mismo se manipula a temperaturas ideales para el crecimiento de Salmonella spp.
El 92.3% de las muestras positivas a Salmonella spp son resistentes a Tetraciclina y el 76.9% al Ácido Nalidixico. La tetraciclina es utilizada en la industria avícola como promotor de crecimiento y esto trae como consecuencia que posteriormente se presenten residuos en la carne de pollo para consumo humano, ya que los niveles presentes pueden ser significativos para que la cepa de Salmonella spp. pueda crear resistencia ante este antibiótico. (Tabla 2)
Se sabe que el Ácido Nalidixico es el primer antibiótico utilizado de la familia de las Quinolonas y Fluorquinolonas, por lo que la resistencia a este antibiótico por tal razón puede originar la inhibición de la síntesis de proteína, en la alteración de la ADN-girasa o por alteración de los componentes de la pared externa de la bacteria.
Investigaciones recientes han dado como resultado que cierta cepa de Salmonella enterica sea resistente al Ácido Nalidixico, lo cual es congruente con los resultados del presente estudio.
EL 92.3% de las Salmonellas spp. son sensibles a Amicacina y el 84.6% lo son al Clorafenicol y Gentamicina en tanto que la Ceftrioxona y Ciprofloxacina mostraron el 23.1% de actividad intermedia. (tabla 2)
El abuso y sobre todo el uso inadecuado de los antibióticos esta llevando a crear resistencia a los mismos lo cual es un problema importante para la salud pública.
CONCLUSIONES
1. De las muestras de carne de pollo colectadas en los expendios de los mercados municipales el 14.44% fueron positivas a Salmonella spp.
2. Según los resultados obtenidos del estudio, se demostró que las cepas de Salmonella spp. presentan la más alta resistencia a Tetraciclina (92.3%) y Ácido Nalidixico (76.9%).
3. Se determinó que las cepas de Salmonella spp. aisladas en el estudio presentaron susceptibilidad a los siguientes antibióticos: Amicacina (92.3%), Gentamicina (84.6%). Ampicilina (76.9%).
4. Las cepas de Salmonella spp. aisladas presentaron un comportamiento de resistencia intermedia a Ceftriaxona y Ciprofloxacina en un (23.1%).
RECOMENDACIONES
1. Establecer un programa de vigilancia sanitaria que regule el uso de antibióticos en la industria avícola.
2. Establecer un programa de buenas practicas de manipulación de la carne de pollo en los expendios de los mercados municipales, por las autoridades competentes.
3. Se recomienda a los médicos hacer uso de estudios de sensibilidad antibiótica, para establecer el antibiótico mas efectivo a los pacientes que presenten problemas por Salmonella spp.
4. Monitorear constantemente la efectividad de los antibióticos que se utilizan en el tratamiento de las infecciones gastrointestinales causadas por Salmonella spp.
RESUMEN
Se muestrearon 18 mercados municipales de la Ciudad de Guatemala, de cada uno de ellos se tomaron 5 muestras de carne de pollo por mercado haciendo un total de 90 muestras las cuales fueron analizadas en el laboratorio de Microbiología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de San Carlos de Guatemala. Las cepas de Salmonella spp. fueron aisladas por el método de recomendado por USDA para carne sólida.
Los resultados obtenidos a partir de las muestra recolectada indican que fueron 13 (14.44%) muestras positivas a Salmonella spp., las cuales fueron susceptibles a los siguientes antibióticos: Amicacina con 92.3%, Gentamicina y el Cloranfenicol con el 84.6% seguidos de Ampicilina, Ciprofloxacina y Ceftriaxona con el 76.9%, Kanamicina y Trimetroprim / Sulfametoxazol con 69.2%.
BIBLIOGRAFÍA
1. Agentes causales más frecuentes y Drogas. s.f. sn.t. 2p. Consultado 10 sep. 2002. Disponible http://www.Diarrea aguda_Deshidratación. htm.
2. Antimicrobianos 2002 10p. Consultado 13 oct. 2002. Disponible en http.//www. Microbiología Coustside-Antimicrobianos. htm.
3. Begoglio. RM. 1993. Antibióticos. 5 ed. Argentina. Editorial Medica Panamerica. 491 p.
4. Curso internacional de entrenamiento sobre vigilancia de Salmonella y resistencia antimicrobiana en patógenos transmitidos por alimentos. ( 2001, MéridaYucatán México). 2001 Manual de procedimientos para el aislamiento e identificación de Salmonella de humanos, alimentos y animales. México, s.n. 33 p.
5. _____. (2001 a., Mérida Yucatán México). Manual de procedimientos para la determinación de la sensibilidad a los antimicrobianos. México, s.n. 68 p.
6. El control de las enfermedades transmisibles. 2001. James Chin, Ed. 17 ed. Washington D.C., U. S. p.552-558.
7. Fusté, O V.. 1994. Cuidado y manejo de los alimentos en el hogar. Washington, Piere county Cooperative Extensión. 14p. Consultado 29 sep.2002 Disponible en http.//www. Cuidado y manejo de los alimentos. htm.
8. Goodman, L.; Gilman, A. 1978. Bases farmacológicas de la terapéutica. 5 ed. México, Nueva Interamericana S.A. 1412p.
9. Hobbs, BC.; Roberts, D. 1993. Higiene y Toxicología de los alimentos. Trad. por Pedro Ducar Maluenda. 3 ed. Zaragoza, España, Acribia, S.A. p 52,53,162,163.
10. Interfarma quinolonas. 1995. s.n.t. Sp. 5p. Consultado 18 Oct. 2002. Disponible en http.// www. la quinolona mecanismo de acción. htm.
11. Manejo de los alimentos, ecología del almacenamiento. 1974. Trad. Por Ramón Palazón. México, Editorial Pax. Tomo I p. 82,83.
12. Manual de medios de cultivos 1994. MERCK 1994. [Edición 1994]. Alemania, MERCK. 364p.
13. Manual para manipuladores de alimento. ¿1998? s.l., Ministerio de Sanidad y Consumo. P. 6-72.
14. Questions and answers about Salmonellosis. 1997. Atlanta, EE.UU., s.n. 2p. Consultado 10 oct.2002. Disponible en http.//www. CDC. Media relationsquestion and answers about Salmonellosis. htm.
15. Reducción de la contaminación por Salmonella en el procesamiento de la carne de ave. 2001. s.n.t. 1p. Consultado 10 oct.2002. Disponible en http.//www. 18.htm.
16. Salmonella. 2002 s.n.t. 10p. Consultado 15 sep. 2002. Disponible en http.//www. Salmonella. htm.
17. Salmonella enterocolitis. 2002. s.n.t. 2002. 2p. Consultado 02 oct.2002. Disponible en http.// www. OK. htm.
18. Scope. 2002. Contenido de antibióticos. Consultado 23 sep. 2002. Disponible en http.//www.drscope.com./pac/ ingecto-1/c3/reference. htm.
19. Sumano López, H S.; Ocampo Camberos, L. 1997. Farmacología veterinaria. 2 ed. México, Editorial McGraw-Hill Interamericana. 690 p.













.jpg&w=3840&q=75)