Introducción
La enfermedad de Marek (EM) es una enfermedad linfomatosa y neuropática de las aves domésticas causada por un virus que pertenece a la familia Herpesviridae, subfamilia Alphaherpesvirinae, género Mardivirus, especie Gallid herpesvirus 2 (8). Son virus envueltos, con cápside icosaédrica, su genoma es ADN, lineal, de doble cadena con una longitud de 175 kb que codifica para alrededor de 103 proteínas, algunas de las cuales están asociados con la oncogenicidad del virus (7). En diagnóstico se basa en observar los signos clínicos y las lesiones macroscópicas y en el laboratorio, se emplean diferentes metodologías que van desde la histopatología, el aislamiento viral, la detección de antígenos virales por inmunohistoquímica o técnicas moleculares y la detección de anticuerpos específicos (5). Mediante la reacción en cadena de la polimerasa (PCR) puede detectarse ADN genómico y antígenos del virus de la enfermedad de marek (VEM) en puntas de plumas de aves infectadas, en órganos (ovario, el hígado, el bazo, los riñones, los pulmones, el corazón, el proventrículo y la piel), y en otras muestras como vacunas. La técnica de PCR presenta ventajas porque es más rápida en comparación con un aislamiento, es sensible, reproducible y hasta de menor costo.
Es importante evitar que las aves se infecten por este virus ya que genera pérdidas económicas en las empresas avícolas, por lo cual es importante la vacunación, así como determinación de su eficacia y el diagnóstico oportuno, para buscar prevenir nuevos casos.
La EM es una enfermedad económicamente importante en la avicultura mundial y es causada por un Herpesvirus oncogénico (12; 14). La infección está reportada en varias especies de aves pero el pollo constituye el hospedero natural más importante seguido por la codorniz; en otras especies su presentación es muy rara y probablemente de poca importancia (4). En los pollos susceptibles y poblaciones no vacunadas afectadas causa tumores en varios órganos viscerales y la piel, pero también produce parálisis e inmunosupresión con elevada morbilidad y mortalidad (10; 6; 8; 9; 1; 13; 14).
Las aves se infectan mediante la inhalación del polvo contaminado procedente de las explotaciones avícolas y, siguiendo un ciclo de vida complejo, el virus se propaga a partir del folículo de las plumas de las aves infectadas (2) .
A partir del aislamiento del virus se han logrado progresos en su virología, patogenia, epizootiología y prevención (11).
En este trabajo se llevo a cabo la prueba PCR en tiempo real a partir de la extracción del ADN de diferentes muestras como órganos, vacunas y folículo de las plumas de aves; utilizando 2 primers (meq) y una sonda controlando las temperaturas en el equipo para que con ello se lograra la detección del virus.
Material y métodos
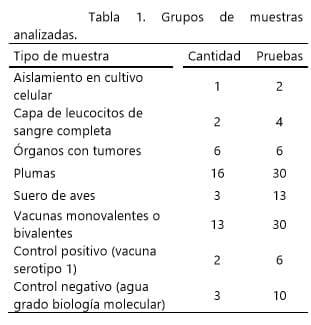
Muestras. Se utilizaron diferentes muestras clasificadas en seis grupos formados de acuerdo a sus características con las que se realizaron varios ensayos como se resume en la tabla 1.
La muestra de aislamiento en cultivo celular provenía de un 3er. Pase de un virus activo asociado a células que fue proporcionado en una alícuota conservada en nitrógeno líquido (126°C) por el área de cultivos celulares para la realización de esta prueba.
Los leucocitos se tomaron de la interface de glóbulos rojos y suero de la muestra; se obtuvieron de dos muestras de sangre de aves,una reproductora comercial y otra de un ave de traspatio.
Los órganos se obtuvieron de aves con lesiones tumorales en hígado y bazo, que habían sido enviadas para el examen de necropsia, las muestras se conservaron en refrigeración (4°C) hasta su amplificación.
También se utilizaron plumas de aves de 8 parvadas de 5, 12, 41 y 54 semanas de edad, de las cuales se extrajo el folículo con pinzas y se depositó en frascos con 3 mL de caldo triptosa fosfato (TPB), posteriormente se homogeneizaron y transfirieron a viales de 1.5 mL.
Las muestras de suero se obtuvieron a partir de sangre de aves comerciales, colectada en tubos sin anticoagulante, los sueros se separaron y se mantuvieron en refrigeración a 4º C. trece vacunas monovalentes o bivalentes contra la EM de diferentes marcas comerciales, fueron utilizaras para la prueba. Tres del serotipo 1, una del serotipo 2, seis del serotipo 3, dos bivalentes de los serotipos 1 y 3, y una bivalente de los serotipos 2 y 3. Todas fueron conservadas en nitrógeno líquido y posteriormente en congelación a -26°C.
La extracción se realizo con el método de perlas magnéticas que purifica el ADN por medio de un equipo automatizado llamado Mag Max Express 96MR de Applied Biosystems (AB) que por medio de 90 µl de muestra en placas con diferentes soluciones de acuerdo al fabricante del kit, al final se obtiene una última placa con la elución que ya contiene el ADN y se guarda en el congelador a -26 °C o en refrigeración a 4°C si se ocupa en el momento. Los primers empleados corresponden a Mkmeqf-1, Mkmeqr-2, la sonda Mkmeqprobe y las condiciones de amplificación descritos por Baigent (2) para amplificar un fragmento de Marek que codifica para el gen meq que está asociado con la oncogenicidad, se amplificaron por PCR tiempo real en un equipo Fast 7500 AB; antes se preparó la mezcla maestra con la muestra y una vez puestas las condiciones se dejó correr la prueba.
Resultados
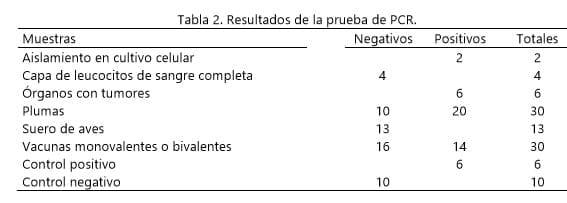
En las 6 corridas amplificadas se obtuvieron resultados positivos con las vacunas que contienen el serotipo 1 y con la vacuna bivalente con los serotipos 1 y 3. Las vacunas que resultaron negativas son las que contienen los serotipos 2 y/o 3., Las muestras de suero y leucocitos resultaron negativas, En el caso de las muestras de plumas se encontraron muestras positivas en edades de 5 y 12 semanas como negativas en aves de diferentes edades de 5, 12, 41 y 54. Todas las muestras de aves con tumores en los órganos analizados resultaron positivas, así como la muestra del virus aislado en el cultivo celular. Muestras de agua de grado biología molecular utilizadas como controles para validar las amplificaciones realizadas resultaron negativas.
Discusión
Los resultados confirman que es una técnica que puede ser útil para detectar aves infectadas o diferenciar la enfermedad de Marek de otras causas de tumores linfoides como leucosis o retículoedoteliosis. La rt-PCR es actualmente una
prueba sensible, rápida y reproducible y los resultados obtenidos fueron de acuerdo a lo esperado. Con el juego de primers o iniciadores Mkmeqf-1, Mkmeqr-2 se detecto elvirus de EM serotipo 1 en las vacunas debido a que están diseñados para la detección de la oncogenicidad del virus; no así los otros dos serotipos, debido a que son secuencias que no están presentes en los otros serotipo 2 y serotipo 3.
Los leucocitos y suero negativos, en el caso de los leucocitos posiblemente serian una muestra adecuada si procedieran de aves infectadas. En suero nos dejan como pregunta si son o no una muestra adecuada para la detección de del virus de marek o podría darnos como resultado falsos negativos. En muestras que presentan tumores como los órganos analizados y que resultaron positivos; dos de estos órganos se trabajaron para descartar Leucosis linfoide y retículoedoteliosis en el que dieron un resultado negativo. Mientras que los resultados negativos de folículos de las plumas obtenidas fueron de muestras de aves libres de patógenos específicos y los resultados positivos del folículo de plumas y lo mencionado por Biarnes (3), nos muestran que son una manera rápida y eficaz de encontrar muestras con patogenia de Marek. Además Baigent (2) con el juego de primer y sonda permitió detectar de una manera clonada y por medio de plásmidos lo esperado en su trabajo mientras que en el resumen se muestran datos reales de muestras analizadas en la pulpa de las plumas. En aves mayores a 5 semanas se pueden encontrar en algunas aves plumas sin folículo o pulpa lo que nos hace hincapié a la hora de tomar nuestras muestras a revisar si la muestra es adecuada o re-muestrear con más cuidado para tomar la muestra adecuada.
Bibliografía
1. Abdul-Careem, M.F., Haq, K., Shanmuganathan, S., Read, L.R., Schat, K.A., Heidari, M. y Sharif, S. 2009. Induction of innate host responses in the lungs of chickens following infection with a very virulent strain of Marek ´s disease virus. Virol., 393:250-257.
2. Baigent, S.J., Peterbridge, L.J., Howes, K., Smith, L.P., Currie, R.J.W. y Nair, V.K. 2004. Absolute quantitation of Mareks disease virus genome copy number in chicken feather and lymphocyte samples using real- time PCR. J. Virol. Methods.
3. Biarnes, M., Blanco, A., Camprubí, Q y Jové, R. 2013. Monitorización de la Vacunación frente a la enfermedad de Marek mediante PCR en tiempo real a partir de la pulpa de la pluma. CESAC, 43206 Reus.
4. Calnek, B.W y Witter, R.L.1997. In: Poultry Diseases, tenthedition, Ch. Neoplastic Diseases/Marek Disease, pp367 Eds. B.W.
5. Davidson, I. 2007. Avian oncogenic viruses: The correlation between clinical signs and molecular virus identification, knowledge adquired from the examination of over 1000 flocks. Vol. 62(2):42-47.
6. Davidson, I. y Borenshtain, R. 2002. The feather tips of commercial chickens are a favorable source of DNA for the amplification of Marek ´s disease virus and avian leukosis virus subgroup J. Avian Pathol., 31:237-240.
7. Karaca, G., Anobile, J., Downs, D., Burnside, J. Y Schmidt, C.J. 2004. Herpesvirus of turkeys: microarray analysis of host gene responses to infection. Virol., 318:102-111.
8. Niikura, M., Dodgson, J.B., y Cheng, H.H. 2006a. Stability of Marek ´s disesase virus 132-bp repeats during serial in vitro passages. Arch. Virol. 151:1431-1438.
9. Niikura, M., Dodgson, J.B., y Cheng, H.H. 2006b. Direct evidence of host genome adquisition by the alphaherpesvirus Marek ´s disease virus. Arch. Virol., 151:537-549.
10. Osterrieder, N. 1999. Sequence and initial characterization of the U L 10 (glycoprotein M) and U L 11 homologous genes Arch Virol. 144:1853–1863.
11. Schat, K.A , y González, J. 2010. La enfermedad de Marek. Departamento de virología, Instituto Nacional de Investigaciones Pecuarias, SAG. México. D.F .pp: 298-300.
12. Tian, M., Zhao, Y., Lin, Y., Zou, N., Liu, C., Liu, P., Cao, S., Wen, X. and Huang. Y. 2011. Comparative analysis of oncogenic genes revealed unique evolutionary features of field Marek ´s disease virus prevalent in recent years in China. Virol. Journal, 8:121.
13. Trapp, S. y Osterrieder, N. 2008. Herpesviruses of Birds, in Desk Encyclopedia of Animal and Bacterial Virology, Cornell University, Ithaca, NY, USA. Elsevier Ltd.
14. Teng, L., Wei, P., Song, Z., He, J., and Cui, Z. 2011. Molecular epidemiology investigation of Marek ´s disease virus from Guangxi, China. Arch. Virol., 156:203-206.





.jpg&w=3840&q=75)