Uso de Enzimas Termoestables en la Alimentación Animal
Con respecto a la producción de pollo de engorda, los parámetros productivos a los 42 días de edad se han aumentado en 4.6 veces el peso corporal, con un una mejora del 23% en la conversión alimenticia, así como un aumento del 72% en el rendimiento de la pechuga (Havenstein et al., 2003 a y b Cuadro 1.).
En el caso de la gallina de postura, los avances logrados por medio de la genética en la producción han sido también asombrosos. Comparando los parámetros de producción de la genética antigua con la gallina moderna, esta produce alrededor de 100 huevos más por ave, con un huevo 14% más pesado y alcanzando la madurez sexual 5 semanas más temprano, lo que se traduce en casi 9 kg más de masa de huevo producido por gallina (Jones et al., 2001 y Bovans white, 2003 Cuadro 2.)
Sin embargo, estas aves altas productoras siguen presentando la limitante de un bajo aprovechamiento de ciertos nutrientes de los ingredientes de origen vegetal, como es el caso del fósforo (P) presente en la molécula del fitato, así como de los carbohidratos presentes en el tejido estructural de los vegetales, mejor conocidos como carbohidratos no almidones (NSP).
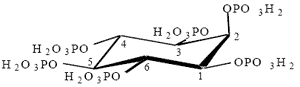
El ácido fítico ó fitato, es una molécula orgánica formada por un anillo inositol y 6 moléculas de fosfato (Figura 1), aproximadamente un 70% del P en los vegetales se encuentra en forma de fitato, y debido a que los animales no presentan una actividad de la enzima fitasa importante en el tracto digestivo, solamente pueden utilizar en promedio un 30% del P presente en la materia prima de origen vegetal y por tanto se debe agregar una fuente de fosfato de origen inorgánico para que el animal pueda obtener el P necesario para la formación del esqueleto y el funcionamiento del metabolismo. Es importante recalcar que cada 0.1% de P liberado del fitato equivale a entre 4.7 a 5.5 kg de fuente de P inorgánico por cada tonelada métrica de alimento, dependiendo del tipo de la fuente de P.
En el caso de los NSP, estos se localizan principalmente en las paredes celulares de las plantas y se encuentran formados por moléculas de carbohidratos más sencillos, conocidos como monosacáridos (las formas más sencillas de los carbohidratos). Tal es el caso de la celulosa (cadena linear de glucosas), la hemicelulosa (cadenas formadas principalmente de glucosa, galactosa, y manosa), B-glucanos (cadenas de glucosa), etc. Todos estos carbohidratos tienen en común en sus estructuras químicas enlaces que no pueden ser digeridos por las enzimas digestivas de las aves, de tal forma que las moléculas de glucosa, galactosa y fructosa se encuentran totalmente indisponibles para las aves. Tomando en cuenta que carbohidratos como la a glucosa tiene un valor energético de 4.1 kcal de energía metabolizable por gramo, se puede inferir que la degradación de estas moléculas puede aportar una cantidad importante de energía para las aves.
Acido fítico
El P es uno de los nutrientes esenciales para mantener la vida de los animales, sus funciones son estructurales (formación y desarrollo del tejido óseo) y metabólicas (forma parte de los nucleótidos, moléculas necesarias para la formación de los ácidos nucleicos y para el transporte de energía en el organismo). Es por tanto necesario que el ave reciba las cantidades adecuadas de P en el alimento, no tan solo para mantener un adecuado nivel de producción sino para sobrevivir.
Las fuentes de P en la ración se pueden dividir en dos grandes grupos, las que proporcionan P inorgánico como los fosfatos y las harinas de hueso y las provenientes de fuentes vegetales. La gran diferencia entre estos grupos es que alrededor del 60 a 70% del P presente en los vegetales no se encuentra libre sino en forma de fitato (Cuadro 3.).
El ácido fítico se forma de la esterificación del alcohol inositol con un máximo de 6 grupos fosfato, llegando a contener hasta 28.2% de P en la molécula. Bajo las condiciones de pH del tracto gastro-intestinal, este compuesto se encuentra ionizado (fitato), presentando cargas negativas que atraen secuestrando moléculas minerales (Ca, Mg, Fe Cu y Zn) y la porción libre de los aminoácidos básicos (Lys, Arg, His) en las cadenas proteicas (Figura 2.).
Es importante mencionar que las enzimas digestivas pancreáticas; lipasa y tripsina (proteasa) tienen en su sitio activo un residuo del aminoácido histidina, el cual al pH del duodeno se encuentra con un 50% de carga negativa. Esto hace surgir la pregunta: ¿Puede el fitato actuar como factor detrimental al disminuir la eficiencia digestiva de estas dos enzimas pancreáticas por medio de su unión al residuo de histidina que se encuentra en el sitio activo?
La forma como se puede degradar el fitato para liberar el P y evitar su acción detrimental es por medio de las enzimas fitasas, que catalizan la liberación secuencial de las moléculas del P. (Figura 3).
Se ha observado que como consecuencia de la degradación del fitato se aumenta la utilización de otros nutrientes aparte del P, esto se debe a que cuando se degrada la molécula del fitato ya no existe la posibilidad de interacciones de esta molécula con minerales como el Ca ni con los aminoácidos básicos.
Fitasa
La forma de uso común en la actualidad para degradar el fitato de los productos de origen vegetal y liberar el P para que este pueda ser utilizado, consiste en la inclusión de la enzima fitasa en los alimentos para animales. Existen varios trabajos demostrando la capacidad de la fitasa para la liberación del P, a continuación se describen algunos de ellos.
Uso de la fitasa en el pollo de engorda
160 pollos Ross (80 machos y 80 hembras) de un día de edad, se distribuyeron totalmente al azar en 16 jaulas de baterías Petersime con 10 pollos por jaula (5 hembras y 5 machos). El periodo experimental fue del día 1 al día 19 de edad.
El agua y el alimento se proporcionaron ad libitum.Los tratamientos fueron 4 (con 4 replicas cada uno) en arreglo factorial 2 x 2; Nivel de Ca y P disponible (1.0% Ca y 0.5% PD vs 0.9% Ca y 0.4% PD) por adición ó no de 750 unidades de fitasa (FYT) de Peniophora Lycii/kg de alimento. Las dietas fueron sorgo+soya, usando Cr como marcador para medir la EM de la dieta.
Las variables analizadas fueron; ganancia de peso, consumo de alimento, conversión alimenticia y la EM de las dietas.
Los resultados pueden observarse en el cuadro 4. La disminución del 0.1% de Ca y PD provocó una disminución en la ganancia de peso, la cual fue recuperada al agregar la fitasa a el tratamiento bajo en Ca y P (P < 0.04). En el caso de la conversión alimenticia, la adición de la fitasa tanto al control positivo como a la ración baja en Ca y PD produjo una mejora en este parámetro (P < 0.04). Finalmente el efecto en la EM de la dieta solo fue detectado para la adición de la fitasa, independientemente de los niveles de Ca y PD, siendo el incremento en EM de alrededor de 110 kcal/kg por efecto de la adición de la
fitasa.
Uso de la fitasa en la gallina de postura
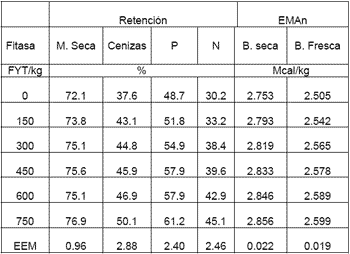
120 gallinas Hy Line W36 de 52 semanas de edad se asignaron al azar a 60 jaulas (2 gallinas por jaula), para tener 10 jaulas por tratamiento. Los tratamientos fueron; 0, 150, 300, 450, 600 y 750 FYT/kg. La fuente de fitasa evaluada fue Peniophora Lycii y se agregó a dietas sorgo-pasta de soya con 15% de Proteina cruda, 2.82 Mcal/kg de EM, 3.8% de Ca y 0.3% de PD. El diseño experimental fue de bloques al zar, siendo el criterio de bloqueo el lugar de la jaula en la caseta experimental. Las aves se adaptaron durante 10 días a la dieta experimental y posteriormente se realizó la colección total de la excreta para medir la retención de nutrientes. El consumo se ajusto a 90 g/gallina/día para evitar desperdicios. Variables evaluadas, retención de materia seca (MS), cenizas, P, nitrógeno (N) y la EMAn en base seca y en base húmeda.
Como se puede observar en el cuadro 5 los resultados indicaron un efecto positivo en la retención de todos los nutrientes evaluados, debido a la adición de la fitasa Peniophora Lycii a la dieta control. A continuación las ecuaciones lineales obtenidas a partir de los resultados experimentales: Ret. de MS % = 0.0058 x + 72.611 R2 = 0.81; Ret. de cenizas % = 0.0157 x + 38.93 R2 = 0.86; Ret. de P % = 0.0177x + 48.853 R2 = 0.94; Ret. de N % = 0.0223x + 30.002 R2 = 0.95; AMEn Mcal/kg BS = 0.0001x + 2.764 R2 = 0.88; AMEn BH = 0.0001x + 2.5154 R2 = 0.88.
Es importante mencionar que la EMA fue calculada en dos formas, antes y después de hacer la corrección a retención cero de N. Esto con la finalidad de comprobar si como mencionan algunos autores, el principal efecto de la fitasa se debe a la retención de N, por tanto al hacer la corrección el efecto en la EMA desaparecería. Bajo las condiciones experimentales del trabajo descrito, el efecto sobre la EMA se mantuvo al hacer la corrección. Se muestran a continuación las dos ecuaciones de regresión para poder observar el efecto mencionado. AME Mcal/kg BS = 0.0002x + 2.816 R2 = 0.90 y AMEn Mcal/kg BS = 0.0001x + 2.764 R2 = 0.88.
Si bien la corrección por la retención cero de N produce valores de EMA menores, el efecto de la adición de la fitasa se mantuvo significativo (P < 0.05).
Recomendaciones para obtener las máximas ventajas cuando se incluye fitasa en las raciones de las aves.
Conocer las necesidades por PD para la genética de las aves que se está manejando, esto para evitar por error estar formulando por debajo de las necesidades nutricionales de las aves.
Hacer pruebas de retención de la actividad de la fitasa en el alimento peletizado para asegurarse que la fitasa esta presente cuando el ave consume el alimento
Carbohidratos no almidones (NSP)
Este es un término muy amplio que se refiere a los polisacáridos no almidones (NSP) así como a los oligosacaridos no almidones. El almidón es el segundo carbohidrato más abundante en el reino vegetal después de la celulosa (Choct y Kocher, 2000). En el caso de los polisacaridos no almidones su función es casi exclusivamente estructural en las plantas (Choct, 1997)
Definición y clasificación de los NSP
Los polisacáridos son polimeros de monosacáridos unidos por medio de enlaces glicosídicos. Existen varios terminos para definirlos como; Fibra cruda, que se refiere únicamente a porciones de NSP insolubles y lignina; fibra de la dieta, NSP + lignina; fibra detergente neutro (NDF), cellulosa, hemicelulosa y lignina; fibra detergente ácido (ADF), celulosa + lignina; hemicellulosa, es un termino no muy claro que abarca los arabinoxylanos, xilanos, B-glucanos, mananos, galactanos, y xiloglucanos; Pentosanos también es otro termino no claro y define a los arabinoxiloanos y xilanos; Pectinas, termino que define los NSP basados en el ácido poligalacturónico; y finalmente las gomas y mucílagos.
Hoy en día existe una clasificación mucho más clara que agrupa los NSP en tre grupos: celulosa, polimeros no celulósicos y polisacaridos pécticos (Choct y Kocher, 2000; Cuadro 6)
En la figura 4 se puede observar la complejidad de estas moléculas.
Papel de los NSP durante la digestión de los alimentos
Estos carbohidratos usualmente dificultan la digestión de los alimentos en dos formas; Por efecto de dilución, formando un obstáculo para que las enzimas alcancen sus respectivos sustratos, estos compuestos también forman capas sobre la pared intestinal, lo que hace más difícil la absorción de los nutrientes ya digeridos. Precisamente esto es lo que explica las diferencias entre la utilización de la pasta de soya entre los cerdos y las aves, precisamente los cerdos aprovechan alrededor de un 40% más la EM de la soya (2.44 Mcal/kg en aves vs. 3.88 Mcal/kg en cerdos. Los cerdos poseen una capacidad fermentativa a nivel del ciego mucho más grande que las aves, lo que permite la acción bacteriana cuyas enzimas si pueden degradar los NSP en monosacaridos que son fermentados a su vez para la producción de ácidos grasos volatiles que son absorbidos a nivel del ciego. Como un ejemplo se puede observar en el cuadro 7 las diferencias en las digestibilidades en algunos NSP en cerdos y aves.
Otra forma de ilustrar este concepto proviene de la información publicada por Choct y Annison (1990), en donde se observa un decremento lineal en la EM de varios ingredientes conform se aumenta la concentración de NSP en los mismos (Figura 5)
Uso de las enzimas para degradar NSP en la formulación de alimento balanceado.
Una de las formas de usar estas enzimas es simplemente agregarla a la ración sin darle ningún valor energético. Si sucede que la formulación se esta haciendo sin ningún margen de seguridad y junto con esta situación se presenta una disminución en el consumo de alimento por cualquier causa que no sea infecciosa, por ejemplo, estrés calórico, se obtendrán buenos resultados, sin embargo, bajo situaciones normales en donde siempre se formula con un margen de seguridad, la adición de la enzima producirá una liberación de nutrientes, principalmente energía y esta situación provocará que el ave reciba un exceso de nutrientes que ya no necesita. Las consecuencias son las siguientes: 1. Al agregar la enzima al alimento sin asignarle ningún valor nutricional producirá de inmediato un aumento en el costo de formulación del mismo. 2. Si el animal esta cubriendo ya sus necesidades nutricionales a partir de la ración, la adición de la enzima al liberar nutrientes indisponibles hasta ese momento produce un exceso de nutrientes para el ave, lo que puede
provocar depósitos de grasa indeseables y también un aumento de materia orgánica de fácil fermentación en las excretas los que se traducirá en más problemas de contaminación.
Es por las razones mencionadas con anterioridad que se recomienda asignarle un valor nutricional a la enzima.
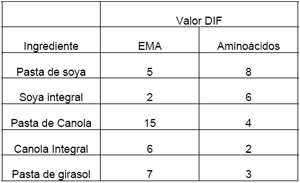
En el caso de la actividad enzimática de Aspergillus aculeatus, la cual posee acciones de B-glucanasa, celulasa y pectinasa, se recomienda el uso de los valores DIF (factores de mejora de la digestibilidad por sus siglas en Inglés), los cuales pueden ser observados en el cuadro 8.
Futuro de las enzimas para NSP
Con base en la complejidad de los NSP de los diferentes ingredientes vegetales ó de origen vegetal para formular se hace necesario trabajar con cócteles enzimáticos, los cuales deberán ser diseñados muy específicamente para cada situación, ya que los contenidos de NSP son muy variados e inclusive son afectados por el estado de madurez de la planta así como a las condiciones climáticas del campo en donde se produjo el ingrediente, situaciones más agresivas hacen que la planta deposite más complejos NSP para protegerse.
Recomendaciones para obtener las máximas ventajas cuando se incluyen enzimas para degradar los NSP en las raciones de las aves.
Asignar siempre un valor nutricional a la enzima para obtener los mejores resultados, comenzando por un costo de formulación más bajo.
Usar la enzima ó el complejo enzimático más adecuado para los ingredientes con los que está formulando, no es lo mismo trabajar con maíz y/ó sorgo y pasta de soya, que incluir canola, ó trigo ó cebada.
Estabilidad de la actividad enzimática durante el proceso de peletizado Debido a que una parte importante de los alimentos para pollo de engorda son sometidos al proceso de peletizado, es necesario asegurarse de que se está trabajando con un producto resistente a las condiciones de alta temperatura y presión a las que se somete el alimento. La resistencia de las enzimas al proceso de peletizado se obtiene de dos maneras; Por medio de la resistencia intrínseca de la proteína enzimática a la temperatura y por medio de la aplicación de una cubierta diseñada para resistir las condiciones extremas de calentamiento. En la figura 3 puede observarse el efecto de la temperatura de peletizado sobre la recuperación de la actividad fitasa en cuatro presentaciones enzimáticas. Como se puede constatar no todas las presentaciones demostraron una eficiente recuperación en el alimento peletizado.
| Conclusiones |
| El uso de las enzimas para liberar el P de la molécula del ácido fítico, así como el uso de las enzimas para degradar los NSP y hacer disponible la energía que contienen estos compuestos es ya una práctica común en la alimentación animal. Y esta práctica ha permitido una mejor utilización de los recursos para la producción de proteína animal. Es importante verificar la estabilidad durante el proceso de peletizado de la enzima a utilizarse para asegurar los resultados esperados. |
Literatura citada
Choct, M. and Annison, G. 1990. Anti-nutritive activity of wheat pentosans in poultry diets. British Poultry Science. 31:809-819
Choct, M. 1997. Feed non-starch polysaccharides: Chemical structures and nutritional significance. Feed milling international. June : 13-26
Choct, M. and Kocher, A. 2000. Non-starch polysaccharides: Digestion and its secondary effects in monogastrics. Proceedings of the 24th annual scientific meeting of the Nutrition Society of Australia, 24: 31-38.
Cortes, A., C., B. Fuente M., S., Fernandez T., M.C. Mojica E., E. Avila G., 2005
Efecto en pollos de engorda de una fitasa microbiana (Peniophora Lycii) en dietas sorgo+soya deficientes en fósforo sobre la digestibilidad ileal de proteína, aminoácidos y energía metabolizable. Veterinaria México (en prensa) F.A.O. 1995. Sorghum and millets in human nutrition. Food and Agriculture Organization of the United Nations. Rome Food an nutrition series: 27.
Gómez, S., C., Mojica, & S.R. Fernández. 2003. Effect several levels of Peniophora lycii phytase on nutrient utilization in laying hens. Poult. Sci. 82 (Suppl.1):50.
Havenstein, G.B., P.R., Ferket, & M.A. Quareshi. 2003a. Growth, livability and feed conversion of 1957 vs. 2001 broilers when fed representative 1957 and 2001 broiler diets. Poult. Sci. 82:1500-1508.
Havenstein, G.B., P.R., Ferket, & M.A. Quareshi. 2003b. Carcass composition and yield of 1957 vs. 2001 broilers when fed representative 1957 and 2001 broiler diets. Poult. Sci. 82:1509-1518.
Jones, D.R., K.E. Anderson & G.S. Davis. 2001. The effects of genetic selection on production parameters of single comb white leghorn hens. Poult. Sci. 80:1139-1143.
Jongbloed, A. W., Everts, H. and Kemme, P. A.1991. Phosphorus availability and requirements in pigs. In Recent Advances in Animal Nutrition 1991, Butterworths, England, pp. 65-80
Cuadro 1. Efecto de la selección genética en los parámetros productivos del pollo de engorda a los 42 días de edad 1 |
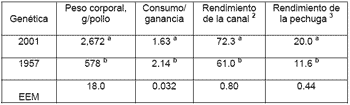 |
| 1 Adaptado de Havenstein et al., 2003 a y b 2 Como % del peso corporal total 3 Como % del peso corporal total a, b Números con diferente literal por columna son estadísticamente (P <0.0001) distintos |
Cuadro 2. Efecto de la selección genética en la respuesta productiva de la gallina de postura a |
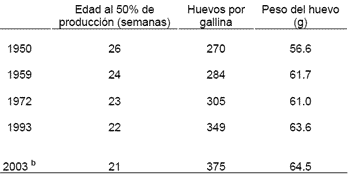 |
| a Adaptado de Jones et al., 2001 b Adaptado del manual de la gallina Bovans blanca, 2003 Aves en producción hasta las 86 semanas de edad (aves sometidas a muda forzada a las 62 semanas) |
Cuadro 3. Contenido de P total y P fítico en algunos ingredientes vegetales1 |
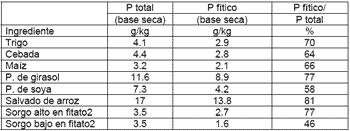 |
| 1 Adaptado de Jongbloed, 1991 2 Adaptado de F.A.O., 1995 |
Cuadro 4. Efecto de la adición de la fitasa de Peniophora Lycii sobre el crecimiento del pollo y la energía metabolizable de la dieta (0 a 19 días de edad) 1 |
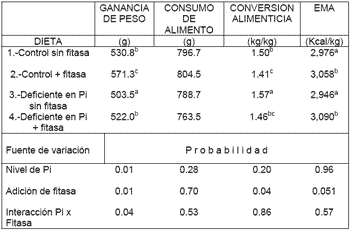 |
| 1 Adaptado de Cuevas et al. , 2005 (en prensa) Medias de 4 réplicas de 10 pollos cada una. Dietas sorgo-pasta de soya Control; Ca: 1.0% y P Disp. 0.5%. Deficiente en P; Ca: 0.09% y P Disp. 0.4%. Fitasa de Peniophora Lycii: 750 FYT/kg Números con diferente literal por columna son estadísticamente diferentes al nivel de significancia indicado en el cuadro |
|
| Figura 1. Estructura del ácido fítico |
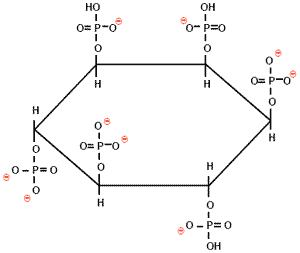 |
| Fitato (ácido fítico en forma ionizada) |
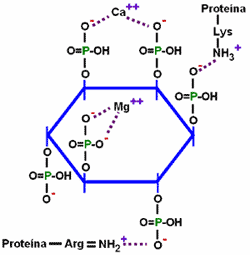 |
| Figura 2. Interacciones fitato-minerales, fitato-aminoácidos |
Cuadro 5. Efecto de varios niveles de la fitasa de Peniophora Lycii en la retención de nutrientes en la gallina de postura. |
 |
| Adaptado de Gomez et al., 2003 En todos los casos efecto lineal significativo de fitasa (P < 0.05) |
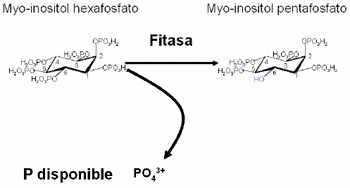 |
| Figura 3. Hidrólisis del ácido fítico |
Cuadro 6. Clasificación de los NSP |
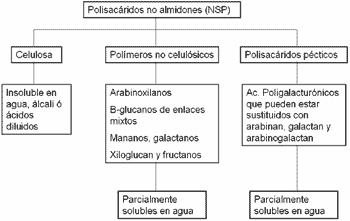 |
Adaptado de Choct Y Kocher, 2000 |
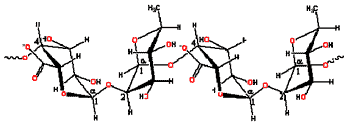 |
| Figura 4. Estructuras de dos NSP / Pectinas (residuos de Ac. Galacturónico) |
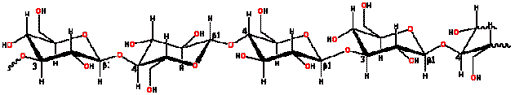 |
| B-Glucanos (polimeros de glucosa, con enlaces B 1-3 y B 1-4) |
| Cuadro 7. Comparación entre las digestibilidades de algunos NSP en cerdos y aves |
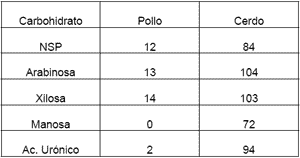 |
| Adaptado de Choct y Kocher, 2000 |
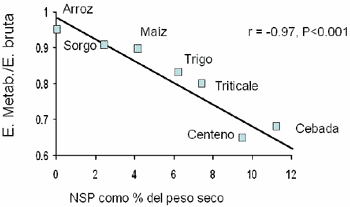 |
| Figura 5. Efecto de la concentración de los pentosanos y B-glucanos en la relación energía metabolizable/energía bruta en varios ingredientes vegetales / Adaptado de Choct y Annison, 1990 |
| Cuadro 8. Valores DIF recomendados cuando se formula alimento con la enzima proveniente de Aspergillus aculeatus |
 |
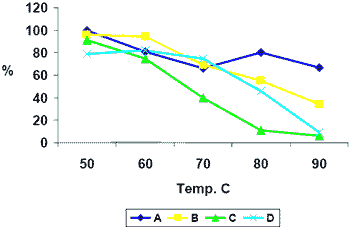 |
| Figura 3. Efecto de la temperatura sobre la recuperación de la actividad fitasa en 4 diferentes productos enzimáticos. |














.jpg&w=3840&q=75)