Introducción
Al igual que otras especies destinadas a la producción, el objetivo de los pollos de engorde es lograr alta producción con el menor costo posible. Teniendo en cuenta que en la producción intensiva, los pollos viven confinados en casetas durante toda su vida, es necesario proporcionarles las condiciones ambientales óptimas, buen manejo y nutrición, para potencializar sus habilidades genéticas (Kocaman et al. 2012).
Dawkins (2003) resume lo concerniente a bienestar animal en dos preguntas:
¿Los animales son saludables? ¿Tienen acceso a lo que necesitan?
Mientras la primera pregunta es relativamente fácil de responder, la segunda es muy compleja, ya que involucra conceptos que no han sido entendidos en su totalidad y adicionalmente no son fáciles de medir.
En la avicultura se tiene en cuenta el comportamiento de las aves y las variables ambientales dentro de las casetas para proporcionar un ambiente confortable y alcanzar el nivel óptimo de rendimiento. La temperatura, la calidad del aire, la humedad y la luz, son factores críticos a considerar para lograr este objetivo, toda vez que las fallas en el suministro de estos elementos se traducen en retraso del crecimiento, pobre conversión alimenticia, y aumento en la incidencia de enfermedades, decomisos y mortalidades (Estrada et. al. 2007).
La temperatura en pollos de engorde es esencial desde la incubación. Decuypere y Michels (1992), establecieron que la manipulación de los parámetros en esta etapa pueden influenciar las respuestas fisiológicas de las aves después del nacimiento, entre ellas se destaca la resistencia al estrés térmico de aves adultas. El manejo de temperatura en granja se diferencia en dos etapas, la crianza durante los primeros 21 días de vida, período en el cual los polluelos no pueden regular su temperatura corporal y dependen de una fuente de calor externo (Pedersen & Thomsen 2000), y la etapa de engorde y finalización, a partir de los 22 días, momento en el cual los pollos pueden controlar su temperatura, proceso acompañado por el crecimiento de plumas (Estrada et. al. 2007).
La calidad del aire dentro de las casetas también tiene un impacto directo en la salud avícola, dado que los contaminantes aéreos, como, gases, olores, polvo, toxinas y microorganismos (Hartung et. al. 1998.), son considerados los principales factores de riesgo para las enfermedades respiratorias (Almuhanna et. al. 2011).
Es esencial conocer los efectos generados por la variación de la temperatura ambiental o la calidad de aire. Por ejemplo, se sabe que durante los episodios de estrés calórico las aves aumentan su consumo de agua y disminuyen el consumo de alimento, lo que eventualmente resulta en disminución del crecimiento y productividad (Kusnadi & Djulardi 2011), la misma consecuencia ocurre cuando el ambiente dentro de la caseta supera el límite tolerable de amoniaco.
El objeto de la presente revisión es compilar la información disponible en las bases de datos de acceso libre, referente al manejo de ambiente de casetas de pollo de engorde, teniendo en cuenta dos factores ambientales; temperatura y calidad de aire. Una vez reunida la información se describe los hallazgos más destacados de cada investigación que generen un impacto en la salud y producción avícola, asimismo se explica los procesos fisiológicos que ocurren en las aves ante los cambios en el ambiente.
Materiales y métodos
Se realizó una revisión de artículos procedentes de revistas internacionales. Como estrategia de búsqueda en las bases de datos se emplearon los siguientes términos incluidos en el Thesaurus CAB: “Pollos de carne”, “Temperatura ambiental” y/o “Calidad del aire, además se incluyó en la búsqueda los términos que guardan relación según el Thesaurus CAB. Se consideraron las publicaciones en inglés, español y portugués, posteriormente se clasifico la información según el tema mediante una lista de chequeo. Finalmente se evalúo cualitativamente cada artículo para incluir la información pertinente en cada categoría: temperatura ambiental y calidad de aire.
Temperatura ambiental en la etapa de crianza
En el período de “Crianza”, durante los primeros 21 días de vida, el pollo no es capaz de controlar su temperatura corporal, toda vez que no regula por completo sus procesos metabólicos, por ello durante esta etapa se les considera heterotermos (Estrada et al. 2007). Como resultado, éstos son dependientes de la temperatura ambiental para mantener la temperatura corporal óptima, es por ello que los sistemas de suplementación de calor juegan un rol importante durante esta etapa. En este sentido, se sabe qué; la temperatura ambiental de confort en pollos de engorde durante la primera semana de vida oscila entre los 31-33°C, temperaturas superiores a éste rango pueden inducir hipertermia y deshidratación, generando bajo consumo de alimento y retardo en el crecimiento (Faria Filho et. al. 2005), en tanto que las temperaturas inferiores, pueden generar hipotermia e inducir hipertensión pulmonar con síndrome ascítico (Maxwell & Robertson 1998).
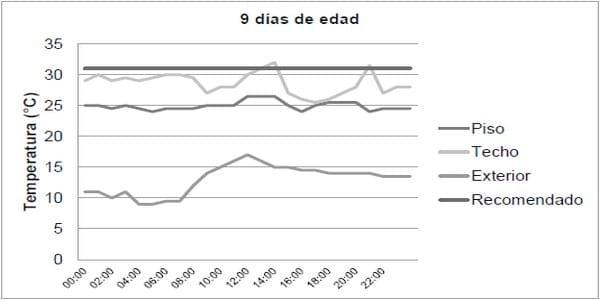
Adicionalmente, el enfriamiento de las aves conlleva a que los nutrientes utilizados para el crecimiento se utilicen para generar calor corporal. El rendimiento de los pollos que sobreviven al enfriamiento es limitado, a causa de la supresión de los sistemas inmunológico y digestivo (Fouda et al. 2013). En la figura 1 se observa la importancia del sistema de calefacción dentro de las casetas en relación con la temperatura externa en clima frío. Utilizando calefacción mediante aire caliente (ventilación forzada), se observó que, se logra aumentar la temperatura ambiental interna, pero la temperatura del piso siempre es menor que la temperatura a la altura del techo, y debe tenerse en cuenta que la temperatura del piso es la más importante para mantener a los pollos en la temperatura confort.
Figura 1. Relación entre temperatura interior y exterior (Tomado de Fouda et al. 2013).
La temperatura influye en la termorregulación del pollo desde la etapa de incubación, se ha descubierto que, una exposición a estrés calórico en éste período induce la síntesis de proteínas de shock calórico (Hsp por sus siglas en inglés) (Lindquist & Craig 1988), proteínas involucradas en la capacidad termorreguladora del pollo. Las Hsp forman parte de los mecanismos de defensa celular responsables de proteger el organismo en condiciones adversas. En las aves la respuesta al estrés calórico depende del tiempo y la severidad del episodio que genera el estrés. Teniendo en cuenta esta premisa, la temperatura de incubación parece ser una buena herramienta para inducir una mejor respuesta de las aves adultas ante el estrés calórico, se ha observado que cuando se maneja bajas temperaturas en incubadora y en granja, la sensibilidad al estrés calórico aumenta, mientras que, las temperaturas altas incrementan la resistencia al estrés calórico del pollo adulto (Givisiez et. al. 2003). Este hecho ha sido atribuido a la aclimatación de las aves sometidas a episodios de estrés calórico en la incubadora, capaces de sintetizar altos niveles de Hsp (Givisiez et. al. 1999), cabe destacar que, existen varios estudios referentes al grado de severidad y duración de los episodios de estrés calórico controlado en la etapa de incubación, pero en términos generales se prefiere la modulación de temperatura en la incubadora, toda vez que en granja se puede afectar el rendimiento y producción. Cuando huevos en incubación fueron expuestos a 40,5°C por 6, 8 o 12 horas en el día 3 o 18 de incubación, se observó una mejoría en la resistencia al calor en las aves de 35 días de edad (Arjona et al. 1990).
Durante las primeras semanas de vida del pollo, su desarrollo es crucial para el desempeño zootécnico a futuro, porque algunos procesos fisiológicos influencian en gran parte el peso corporal y la conversión alimenticia del pollo adulto. Ejemplo de ello son la hiperplasia e hipertrofia celular, la maduración del sistema termorregulador y la diferenciación celular en la mucosa gastrointestinal, procesos fisiológicos que se llevan a cabo durante la etapa de crianza de las aves (Faria Filho et. al. 2005).
Bajo condiciones de estrés calórico, las aves consumen mayor cantidad de agua y reducen el consumo de alimento, esto se traduce en detrimento del crecimiento y productividad (Kusnadi & Djulardi 2011). La disminución de crecimiento se ha asociado a bajos niveles de Triyodotironina (T3) en plasma, puesto que de esta hormona depende el suministro de oxígeno para los procesos metabólicos del crecimiento (Sugito et.al. 2007). Las altas temperaturas ambientales también provocan el aumento de glucosa en plasma debido al proceso de gluconeogénesis generado a partir de lípidos (Kusnadi & Djulardi. 2011).
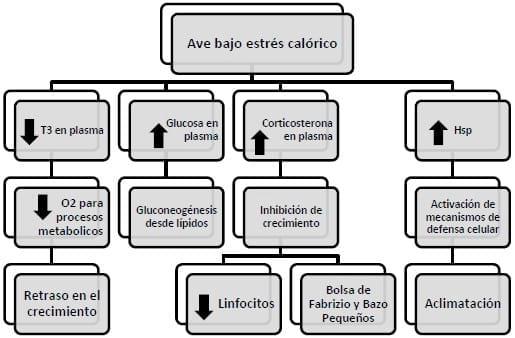
Desde el punto de vista inmunológico, la disminución en tamaño de la Bolsa de Fabricio y del bazo bajo condiciones de estrés calórico, representan un efecto que altera el funcionamiento del sistema inmune, afectando el crecimiento linfoide y reduciendo la cantidad de linfocitos (Kusnadi 2004; Kusnadi et al. 2005; Onbasilar et. al. 2008; Zulkifli et al. 2000). Este efecto se debe a que el estrés calórico estimula la producción de corticosterona en plasma (Yuninato et al. 1997), y ésta a su vez inhibe el desarrollo de los órganos linfoides. En la figura 2 se resumen los eventos fisiológicos durante el estrés calórico.
Figura 2. Eventos fisiológicos de las aves con estrés calórico
Al evaluar tres rangos de temperatura ambiental durante la primera semana de vida de los pollos, se ha encontrado hallazgos concluyentes. Las aves mantenidas a una temperatura inferior (20°C) consumieron menor cantidad de alimento y agua respecto a las aves mantenidas en temperatura neutral (25°C) o superior (35°C), resultado relacionado con el comportamiento de las aves para mantener el calor, ya que en condiciones de frío la parvada se amontona para evitar la pérdida de calor, reduciendo la frecuencia de alimentación y bebida (Moraes et al. 2002). Los pollos sometidos a temperaturas altas también presentaron una disminución significativa en peso corporal (Moraes et al. 2002), se ha observado que polluelos bajo estrés calórico durante los 2 primeros días de vida presentan una pérdida de peso corporal del 12% (Van der Hel et al. 1991).
Durante la primera semana de vida el páncreas y el intestino delgado aumentan 4 veces su tamaño y el hígado aumenta 2 veces su tamaño (Nitsan 1991), sin embargo, cuando la temperatura ambiente es baja se ha observado un crecimiento superior del hígado respecto a las aves mantenidas en temperaturas más altas (Deaton et al. 1969), el menor tamaño del hígado en alta temperatura se asocia a la disminución de las necesidades metabólicas (Moraes et al. 2002). El crecimiento del corazón durante la primera semana de vida es influenciado por la temperatura de la misma forma que lo hace con el hígado, es decir que, el corazón aumenta su tamaño por la alta demanda metabólica y de oxígeno que supone las condiciones ambientales de baja temperatura (Moraes et al. 2002).
La temperatura ambiental en la primera semana también influye en el crecimiento óseo, estudios han demostrado que altas temperaturas disminuyen el crecimiento óseo, en particular de la tibia y el fémur (Moraes et al. 2002). Bajas temperaturas (20°C) también inducen un retraso en el desarrollo de huesos largos (tibia y fémur) con el consecuente bajo peso a los 7 días de edad (Moraes et al. 2002).
Entre los días 7 y 21 también se estudió el impacto de tres temperaturas ambientales, baja, termo-neutral (confort) y alta como se describe en la tabla. Los principales efectos indicaron que, las aves sometidas a una alta temperatura consumieron menor cantidad de alimento (Filho et. al. 2005).
Los requerimientos de energía de mantenimiento disminuyen en estas condiciones, de hecho, la adaptación al estrés calórico incluye la reducción de ingesta en un intento de bajar la producción de calor endógeno (Filho et al. 2005).
En el mismo estudio, también se demostró que la ingesta de las aves, tanto en condiciones de frío, como en condiciones termo-neutrales no fue diferente, lo que puede ser asociado al comportamiento de las aves para conservar el calor (Filho et al. 2005). La ganancia de peso durante el período de 7-21 días se vio afectada por la temperatura ambiental de las casetas, las aves mantenidas en temperatura termo-neutral tuvieron mayor ganancia de peso respecto a las aves en condiciones de frío o calor, y la peor ganancia de peso ocurrió en aves mantenidas en altas temperaturas, también se observó que en aves sometidas a bajas temperaturas ambientales se obtuvo la conversión alimenticia más alta (deficiente), mientras que la temperatura neutral genero la conversión alimenticia más eficiente, en tanto que, en altas temperaturas las aves presentaron conversión alimenticia intermedia (Filho et al. 2005). Estos resultados indican que durante este período, la energía gastada para producir calor en condiciones de frío es mayor que la energía generada para disipar calor en aves con estrés calórico, por ello la conversión alimenticia es peor cuando se maneja bajas temperaturas.
La presencia del saco vitelino es un proceso fundamental en la primera semana de vida de los pollos. El saco vitelino se constituye durante la incubación cuando las membranas extraembrionarias engloban los componentes de la yema, justo antes del nacimiento el saco vitelino es halado de la cavidad del huevo hacia el abdomen del pollo como una extensión del intestino (Khan et al. 2004). Gracias a su contenido proteico y energético permite mantener a los pollos durante tres días después de nacidos (Sell et al. 1991; Reis et al. 1998; Uni et al. 1998). Después de la primera semana de vida el saco Vitelino se absorbe, sin embargo, algunos factores conllevan a su retención, lo que constituye un problema, porque una vez ingresan bacterias a esta estructura se presenta el medio favorable para la multiplicación de ciertas bacterias, tanto por el contenido graso y de agua, como también por la temperatura homogénea mantenida desde la incubación en el huevo hasta después del nacimiento en el abdomen del pollo (Khan et al. 2004).
En búsqueda de los factores asociados a la retención del saco vitelino, varios estudios han buscado una eventual asociación entre la temperatura ambiental y el grado de reabsorción. Leeson & Caston (1978) reportaron aumento en la incidencia de retención del saco vitelino por la fluctuación de temperatura ambiental, tanto en ambiente frío como en ambiente caliente en comparación con la situación control. Thaxton et al. (1974) encontraron que el tamaño del saco vitelino no cambio al disminuir la temperatura ambiental durante la crianza. Moraes et al. (2002) demostraron que del día 1 al día 3 de vida hay una reducción considerable del tamaño del saco vitelino independientemente de la temperatura ambiental a la cual fueron sometidos. También se reportó una disminución de tamaño del saco vitelino similar cuando los pollos fueron alimentados a las 24, 48 y 72 horas después del nacimiento (Moraes et al. 2002). Los últimos datos indican que, la absorción del saco vitelino es independiente de la temperatura ambiental manejada y del tiempo de alimentación después del nacimiento (Moraes et al. 2002; Khan et. al. 2004).
Temperatura ambiental en la etapa de finalización
Una vez cumplida la fase de crianza (21 días), la termorregulación y los procesos metabólicos en los pollos cambian. El rango de temperatura ambiental confort disminuye notablemente, ya que los pollos de engorde logran la capacidad de regular su temperatura plenamente y tienen la posibilidad de conservar la temperatura de sus órganos internos de manera bastante uniforme (Estrada et al. 2007). Los manuales de cada línea genética recomiendan la mejor temperatura ambiental y humedad relativa en cada fase de crecimiento, sin embargo en los estudios revisados se encontró hallazgos interesantes. Harris et al. (1977) reporto que la mejor temperatura ambiental para un óptimo rendimiento en pollos de engorde de 3-8 semanas es una constante de 24°C o ciclos de 18-24°C. Deaton et. al. (1984) reporto que al disminuir la temperatura de 26,7°C a 21°C durante un período de 24 horas, se incrementó significativamente el peso corporal a los 48 días de edad.
Los pollos modernos desarrollados aceleradamente, durante la etapa de finalización consumen altas cantidades de alimento para maximizar la tasa de crecimiento, pero la ingesta y el metabolismo alimenticio tienen un efecto de termogénesis, así que cuando se aumenta la temperatura ambiental se agrava el problema de estrés calórico, porque se suma más calor a un organismo ya estresado calóricamente por el alto consumo. A pesar que en esta edad el metabolismo basal puede ser regulado y la tolerancia al calor es mayor, el ave puede reaccionar disminuyendo voluntariamente el consumo de alimento cuando la temperatura es alta, de esta manera se disminuye el calor extra al ser disipado en el ambiente y limita las pérdidas por termólisis (Olanrewaju et. al. 2010). Las aves con bajo consumo de alimento en la etapa de finalización bajan la tasa de crecimiento, ya que se reduce la energía metabolizable.
Calidad de aire
La calidad de aire es uno de los principales factores ambientales relacionados con la sanidad y el desempeño avícola, toda vez que el confinamiento en un establecimiento cerrado implica la interacción con aire contaminado y variedad de gases. Los mayores contaminantes del aire dentro de las casetas son los gases (amoniaco, dióxido de carbono, sulfuro de hidrogeno y metano), el polvo, los microorganismos y las toxinas (Almuhanna et al. 2011).
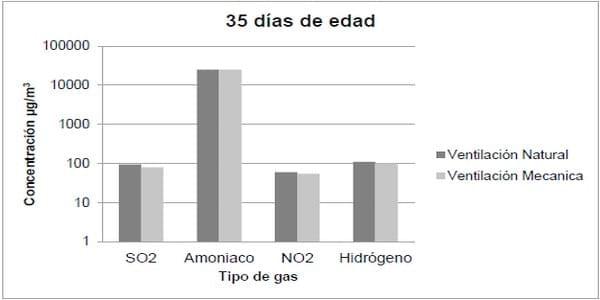
El amoniaco (NH3) es producido por efecto de la descomposición microbiana del nitrógeno orgánico presente en el excremento de las aves (Almuhanna et al 2011). El NH3 es altamente irritante, convirtiéndose en el gas más perjudicial, en los estudios se ha observado una reducción en el peso corporal de las aves sometidas a altos niveles de NH3. Al comparar un grupo control con niveles bajos de NH3 (30ppm) y otro con altos niveles de NH3 (70ppm) no se encontró asociación estadística directa con el bajo rendimiento, lo cual conlleva a atribuir la causa del bajo rendimiento a una reducción de la ingesta de las aves, provocada en la mayoría de casos, por la marcada irritación ocular que causa el amoniaco atmosférico, de esta manera el bajo consumo de agua y alimento sumado a las condiciones de estrés que supone el aire con alta carga de contaminantes produce atrofia y retraso en el desarrollo de la criptas y vellosidades del epitelio intestinal (Wei et al. 2012). Este hecho influye directamente en la absorción de nutrientes y por tanto en una conversión deficiente (Yamauchi & Tarachai 2000). De todos los gases, el NH3 es el que predomina dentro de las casetas, tal como se observa en la figura 3, además, se sabe que su concentración no presenta niveles considerables sino hasta la mitad del ciclo de producción de pollo de engorde.
Figura 3. Medición de gases tóxicos dentro de las casetas de pollo de engorde (Tomado de Almuhanna et al. 2011).
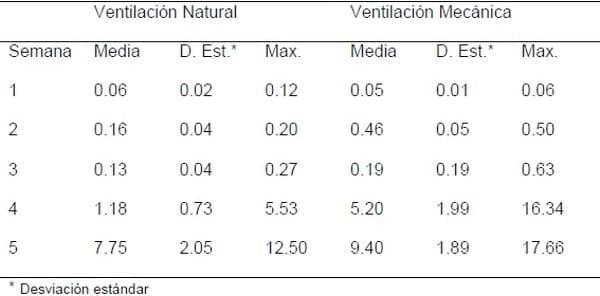
Al medir la cantidad de NH3 semanalmente en el interior de las casetas, como se muestra en la figura 2, y teniendo en cuenta que el valor máximo tolerable de NH3 para animales es de 11ppm, se evidenció valores entre 17,86 y 25,2 ppm dependiendo de las condiciones de ventilación (Almuhanna et al. 2011).
Tabla 1. Concentración de amoniaco (mg/m3) en casetas con ventilación natural y ventilación mecánica (Tomado de Almuhanna et al. 2011).
El polvo dentro de las casetas está compuesto por partículas generadas del excremento, la cama y el alimento. El problema con este contaminante surge tanto por la presencia de partículas no viables que generan distintos tipos de reacción alérgica, como también por partículas viables, conocidas como bioaerosoles que diseminan enfermedades horizontalmente. Al medir la concentración de polvo inhalable dentro de casetas ventiladas naturalmente y casetas ventiladas mecánicamente se encontró valores de 4,25 y 3,64 mg/m3 respectivamente, mostrando que en ambos casos el valor máximo tolerable (3,4 – 3,7 mg/m3) fue superado, y aunque las casetas ventiladas mecánicamente tienen mayor concentración de polvo, la concentración de NH3 fue superior en un 55% durante la 4-5 semana respecto a la ventilación natural (Almuhanna et al. 2011).
Con el propósito de contrarrestar el exceso de contaminantes es necesario una adecuada ventilación de las casetas, ya que además de regular la temperatura, se remueve gases, polvo y olores. El aire fresco se introduce uniformemente, para que se mezcle y circule por todo el galpón. El movimiento de aire dentro de las instalaciones se logra mediante presión negativa, en instalaciones dotadas de ventiladores y extractores, estos generan la presión negativa necesaria para retirar el aire interno y realizar el intercambio con aire fresco exterior. Para el proceso de intercambio de aire se debe tener en cuenta que el aire que ingresa debe hacerlo por la parte superior de las casetas, evitando abrir demasiado las entradas de ventilación y una velocidad de aire demasiado baja, toda vez que el aire frío en exceso y a una velocidad baja tiende desplazarse rápidamente al piso, las consecuencias de esta mala práctica de ventilación se refleja en el enfriamiento de las aves y la formación de zonas frías en las paredes y en el piso, las cuales al entrar en contacto con aire caliente se condensan para finalmente producir humedecimiento de la cama y mayor producción de amoniaco (Fairchild 2012).
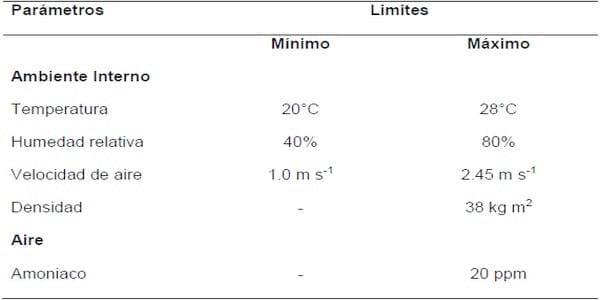
En referencia al control de la calidad de aire, ésta se ha dirigido a controlar dos puntos críticos en el ambiente de las casetas. El primero que se relaciona directamente con el aire es la velocidad de aire (m s-1) que tiene un nivel de tolerancia mínima de 1 m s-1 y tolerancia máxima de 2,45 m s-1, la baja velocidad de aire asociada a un incremento de temperatura es un punto crítico de control, ya que se asocia a un aumento de la mortalidad (Owada et al. 2007). El otro punto de control en relación directa con el aire es el nivel de NH3, que como se mencionó previamente a niveles superiores de 11ppm se perjudica la salud de los animales, sin embargo para efectos de control en granja el límite que se considera aceptable es 20 ppm (CIGR 1994; Sampaio et al. 2005; Owada et al. 2007). La calidad de aire también se relaciona indirectamente con parámetros ambientales, como, temperatura, humedad relativa y densidad de aves por metro cuadrado (Tabla 2).
Tabla 2. Límites críticos mínimos y máximos de tolerancia adoptados en la producción de pollo de engorde (Tomado de Menezes et al. 2010).
La ventilación es una de las mejores formas de mantener a las aves en su temperatura de confort y de esta manera evitar pérdidas de energía para compensar las temperaturas bajas o altas (Abreu et al. 2011). Bajo condiciones de calor en las casetas, cuando la temperatura es alta, el movimiento de aire es esencial para mejorar el ambiente, actuando fisiológicamente de dos formas. Al aumentar la velocidad de aire a una temperatura inferior a la temperatura corporal de las aves, el calor se disipa por convección y también se favorece la evaporación, además, el aire se renueva, remplazando el aire contaminado por aire fresco y seco. Mediante estos mecanismos se promueve la transferencia de calor desde las aves al medio ambiente, se aumenta el nivel de oxígeno y se reduce el nivel de CO2 y NH3 (Abreu et al. 2011).
La cantidad de aire necesaria para cumplir las funciones mencionadas es variable, ya que, depende de las condiciones climáticas, el ambiente interno y la edad de las aves (Abreu et al. 2011). Los dos principales objetivos de la ventilación se basan en; mantener la temperatura confort y controlar la calidad de aire. Es por tanto esencial determinar los parámetros ambientales de temperatura de aire y humedad relativa, toda vez que la producción de NH3 se logra reducir cuando la humedad relativa se mantiene entre 50–70%, objetivo que se logra con el control de ventilación como se resume en la figura (Fouda et al. 2013).
Figura 4. Efectos de la ventilación en el ambiente.
En tanto que la temperatura óptima del aire oscila entre 23°C y 26°C en las primeras dos semanas de edad, 20°C y 23°C en la tercera semana y 20°C en la cuarta y quinta semana de edad. (Abreu et al. 2011). Cuando se supera estas temperaturas, se ha comprobado que afecta negativamente el rendimiento de las aves (lotes desiguales) desde el día 1 al día 49 de edad y este efecto se intensifica en la medida que la humedad relativa aumenta (Oliveira et al. 2006).
Para determinar los parámetros ambientales se debe tener en cuenta la variabilidad de instalaciones de las casetas y su sistema de ventilación, la ventilación por presión positiva se basa en un sistema de ventiladores de circulación de aire y la mayoría cuenta con cortinas. Las casetas con ventilación por presión negativa usan ventiladores de extracción y algunos cuentan con cortinas, y otros pueden ser completamente cerrados. Estas diferencias deben ser consideradas cuando se evalúa la relación entre ventilación y ambiente de las casetas, toda vez que este conocimiento permite realizar mejoras en la calidad de aire para reducir problemas sanitarios, evitar decomisos en planta de beneficio y mejorar la calidad del producto en general (Lima et al. 2011).
Las casetas con ventilación por presión negativa presentan mayores tasas de emisión de NH3, respecto a las casetas que manejan presión positiva. El clima y las características de regiones tropicales facilitan el uso de sistemas de presión positiva, ya que no existen condiciones extremas que exijan sacrificar la ventilación con el propósito de mantener el confort térmico de las aves, en consecuencia la ventilación manejada por presión positiva genera menor impacto ambiental. (Lima et al. 2011).
Desde el punto de vista ambiental, las tasas de emisión de NH3 se aumentan con la edad de las aves debido al incremento de la excreción de nitrógeno durante el período de engorde, es decir que, dejando de lado la ventilación, el otro factor determinante en la emisión de NH3 es la composición de la cama, ya que, el uso de cama nueva en cada lote de encasetado reduce significativamente la emisión de NH3 (Lima et al. 2011).
En la actual industria avícola con el propósito de controlar la humedad de las camas y a su vez las emisiones de NH3, con frecuencia se utiliza aditivos como el sulfato de aluminio o el bisulfato de sodio. Estos productos son efectivos controlando la liberación de NH3, aunque solamente trabajan durante las primeras tres semanas de edad, después de este período el nivel de NH3 y el pH comienza a aumentar (Moore et al. 1999). Últimamente se ha utilizado los polímeros súper absorbentes (SAP) con el mismo propósito de los productos mencionados, éstos polímeros son capaces de reducir la volatilización de NH3, aunque su modo de acción es incierto, se ha comprobado que cuando se trata las camas con SAP al 6%, la volatilización de NH3 se reduce en 33% respecto a camas sin tratar, además, el pH encontrado en las camas tratadas con SAP es más bajo respecto a las camas sin tratar, lo cual podría explicar la menor volatilización de la cama, sin embargo, otros factores estarían involucrados en su mecanismo de acción de largo plazo, toda vez que con una sola aplicación del producto se cubre el tratamiento de la cama para dos lotes consecutivos (Timmons & Harter-Dennis 2011).
Conclusiones
La revisión realizada sobre el manejo de temperatura ambiental en casetas de pollo de engorde permite diferenciar este proceso en dos etapas, crianza y finalización.
En la primera etapa, comprendida entre los días 1-21 de edad se debe priorizar el mantenimiento de la temperatura confort, debido a que las aves presentan la condición de heterotermos. El desequilibrio en la temperatura ambiental influencia directamente el rendimiento del pollo no únicamente durante esta fase, sino que también influye en la etapa de finalización, ya que tanto por estrés calórico como por estrés por frío una de las principales consecuencias es el retraso en el desarrollo de órganos. Cuando el tracto gastrointestinal no se desarrolla adecuadamente se perpetúa durante toda la vida del pollo la atrofia de vellosidades y criptas del epitelio intestinal produciendo un déficit en la absorción de nutrientes. El sistema inmunológico se afecta por la liberación de corticoides que implica el estrés térmico, lo cual atrofia los órganos linfoides. Otro evento relevante durante esta etapa es la absorción del saco vitelino, en los estudios revisados no existe unificación de criterios en relación a la influencia de la temperatura ambiental y el grado de reabsorción del saco, parece ser que si bien no existe relación directa entre temperatura y reabsorción de saco, es claro que cuando los pollos mantienen su conducta normal de alimentación los primeros 5 días de vida sin ser alterados por estrés térmico se reduce las complicaciones de una mala absorción como, onfalitis o colibacilosis.
En el período de engorde y finalización, de los 21 días en adelante, se concluye que el manejo de la ventilación debe priorizarse, por dos aspectos esenciales; el primero está relacionado con la temperatura corporal del pollo, en esta etapa las aves pueden controlar por completo su termorregulación, sin embargo, en la medida que aumenta el consumo de alimento se aumenta la generación de calor endógeno, es por ello que la temperatura ambiental de las casetas debe disminuir y la ventilación es una forma de alcanzar este objetivo; el segundo aspecto a tener en cuenta es la renovación de aire dentro del galpón ya que a partir de tercera semana se aumenta considerablemente el nivel de NH3.
“El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses que ponga en riesgo la validez de los resultados presentados”














.jpg&w=3840&q=75)