Elementos requeridos para un diagnóstico de Laboratorio
Publicado: 21 de junio de 2010
Por: MVZ MC Juan Carlos Valladares de la Cruz, Asesoría Avícola Independiente. Nuevo León, México
El Laboratorio de Diagnóstico es un recurso esencial para el manejo adecuado de una empresa avícola, ya que proporciona una gran cantidad de información que puede incrementar de manera significativa la eficiencia productiva de la empresa. Los métodos de diagnóstico disponibles en la actualidad pueden detectar lesiones microscópicas, cantidades mínimas de anticuerpos, toxinas, residuos químicos, microorganismos, antígenos o ácidos nucleicos las aves, insumos o en el medio ambiente, lo que permite controlar de manera eficiente la sanidad y la productividad de las aves y la calidad e inocuidad de los productos avícolas. El objetivo de esta presentación es analizar las técnicas y los criterios de interpretación de los resultados de laboratorio para el diagnóstico de las enfermedades de las aves de producción comercial.
INTRODUCCION:
El incremento en la tecnificación de la industria avícola moderna ha modificado los sistemas de producción, manejo y alimentación de las aves destinadas a la producción comercial, para hacer a ésta industria más eficiente y competitiva. La modernización se ha debido a la integración de grandes compañías de producción y a la globalización de la economía y la comercialización de los productos agropecuarios. Factores inherentes a temas como la seguridad alimentaria, la protección al medio ambiente, el cuidado del bienestar animal y las restricciones en el uso de antibióticos en la alimentación animal han modificado las características de los sistemas de Producción. La industria avícola ha generado la necesidad de una metodología de diagnóstico precisa, confiable, rápida, oportuna e integral.
Un Diagnóstico Integral es un procedimiento mediante el cual se analizan todos los factores involucrados en la presentación de una o varias enfermedades, incluyendo: 1) factores inherentes a las aves afectadas como edad, sexo, función zootécnica, estado de producción, signos lesiones, respuesta a las terapias; 2) posibles agentes involucrados como agentes infecciosos, toxinas, antimetabolitos, deficiencias o imbalances nutricionales, factores genéticos o hereditarios y 3) las condiciones medioambientales en las que se presenta el cuadro, incluyendo a la región o zona donde se encuentra la explotación, la situación epidemiológica de la misma con respecto a las enfermedades de las aves, los antecedentes sanitarios de la explotación, el clima, la estación del año, las condiciones de producción como humedad, temperatura, ventilación interna de las casetas, el manejo de las aves, los sistemas de bioseguridad y control de enfermedades en la granja, los programas de vacunación, las terapias de prevención y/o tratamiento de las aves, los programas de nutrición y alimentación, así como los parámetros productivos de la explotación (Figura 1)
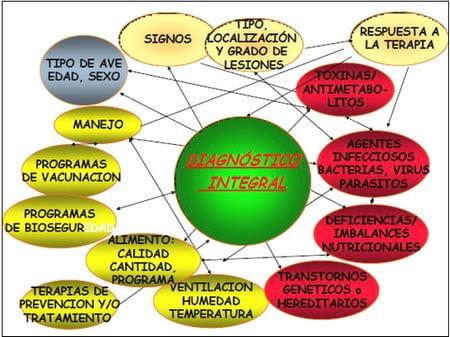
Figura 1.- Factores a considerar para la obtención de un Diagnóstico Integral en aves de producción comercial.
Los sistemas de diagnóstico en aves comerciales están enfocados a la detección de las enfermedades que afectan la salud y la productividad de las aves, a la detección de los padecimientos que afectan la calidad de los productos avícolas y a la detección de los agentes que afectan a la salud de los consumidores. La interpretación correcta de un resultado de laboratorio permite evaluar de manera oportuna las medidas de bioseguridad, manejo, nutrición y sanidad utilizadas. Por medio del laboratorio se puede determinar el estado de salud de una parvada, detectar problemas sanitarios subclínicos e inaparentes, evaluar la eficacia de los programas de inmunización, cuantificar el grado de microbismo ambiental y evaluar la calidad de los insumos y de los productos obtenidos.
1.- RECOMENDACIONES PARA EL USO DEL LABORATORIO DE DIAGNOSTICO
Para que los resultados de los estudios de laboratorio sean útiles, los análisis deben estar incluidos dentro de un programa de trabajo constante y permanente como parte del sistema de producción. El uso constante del laboratorio permite crear un historial de pruebas y resultados cuya interpretación es más fácil y adecuada; la interpretación de un solo grupo de resultados es difícil y puede conducir a conclusiones erróneas. En ocasiones los cambios en el comportamiento de las parvadas tras un cambio de manejo, del calendario de vacunación o de un tratamiento se establecen en forma gradual y progresiva y no de manera drástica e inmediata y esto sólo podrá ser detectado en el laboratorio mediante estudios seriados.
CARACTERISTICAS DE UN LABORATORIO DE PRUEBAS.
Un laboratorio de pruebas debe contar con instalaciones adecuadas que permitan el establecimiento de medidas de contención y bioseguridad que eviten la contaminación entre el medio ambiente y el laboratorio, para evitar que este se contamine del exterior o bien que se vuelva un foco de contaminación al medio ambiente; las instalaciones deben garantizar la seguridad del personal y debe prevenir la contaminación cruzada entre las muestras. El Laboratorio debe de contar con una plantilla de personal capacitado, constante y suficiente para la realización de las pruebas y para minimizar las variaciones atribuibles a la realización del procedimiento. El laboratorio debe de contar con equipos e instrumentos de medición confiable y suficiente, que este sujeto a un programa permanente de mantenimiento y calibración, con patrones de medición adecuados para garantizar la trazabilidad de las mediciones.
El Laboratorio debe tener definida su política de Calidad y todas sus políticas y procedimientos deben estar documentadas en un Manual de Calidad, un Manual de Procedimientos Técnicos y un Manual de Aseguramiento de Calidad y debe poseer toda la evidencia documental que sustente que el sistema de calidad se está llevando adecuadamente. En México los laboratorios de diagnóstico en materia zoosanitaria deben contar con una autorización oficial para su funcionamiento de acuerdo a la NOM-003-ZOO1994: Criterios para la operación de laboratorio de pruebas aprobado en materia zoosanitaria.
Es preferible usar el mismo laboratorio y que se usen las mismas técnicas, los mismos reactivos y personal constante para minimizar los errores atribuidos a los procedimientos utilizados.
CARACTERISTICAS DE LAS PRUEBAS DE LABORATORIO
Las técnicas usadas en un Laboratorio de Diagnóstico de Enfermedades de las Aves deben estar estandarizadas, científicamente validadas y universalmente aceptadas, considerando su sensibilidad, especificidad, repetitividad y reproducibilidad.
La Validación de una Prueba es un proceso que sirve para determinar si la prueba es adecuada para un uso particular. Un análisis validado genera, de manera consistente, resultados que identifican a animales como positivos o negativos a la presencia de un analito o de un proceso particular (ej. presencia de anticuerpos o induración de la piel), y por inferencia, la prueba predice adecuadamente el estado de infección de un animal, con un grado predeterminado de certeza estadística. El proceso de validación de un análisis debe ser continuo durante el período en el que la prueba se utiliza y puede requerir ajustes en las condiciones de realización conforme la prueba se va utilizando de manera masiva. Es importante hacer notar que existen muchas pruebas de laboratorio tradicionales que son usadas ampliamente y que nunca han sido sujetas a un proceso completo de validación.
Las variables que pueden afectar el resultado de una prueba de laboratorio pueden ser atribuidas a: 1) características de la muestra (la cual es producto de la interacción agente-hospedador), 2) características del ensayo (factores físicos, químicos, biológicos y/o técnicos de la prueba) y 3) características del resultado de la prueba para predecir con exactitud el estado del hospedador con respecto al analito evaluado.
La sensibilidad diagnóstica de una prueba es la capacidad que tiene ésta para detectar los casos positivos aún a un nivel mínimo; una prueba altamente sensible no deberá dar resultados falsos negativos (resultados negativos a partir de muestras positivas). La especificidad diagnóstica de la prueba es la capacidad que tiene ésta para detectar los casos negativos y distinguirlos de los positivos; una prueba altamente específica no debe dar resultados falsos positivos (resultados positivos a partir de muestras negativas). La sensibilidad y especificidad de cada técnica no necesariamente están correlacionadas entre sí, existen pruebas muy sensibles y poco específicas ó muy específicas y poco sensibles.
La repetitividad de la prueba se refiere a su capacidad de dar resultados similares en las mismas muestras; mientras que la reproducibilidad se refiere a la capacidad de la prueba de dar resultados similares en diferentes laboratorios. Generalmente las técnicas de laboratorio deben tener índices de repetitividad y reproducibilidad mayores al 95% bajo condiciones similares de realización.
La prevalencia de la enfermedad es el otro factor que afecta la precisión de un resultado de laboratorio, la validación de una prueba diagnóstica se aplica a una población donde se ha conocido la prevalencia de la enfermedad.
Las pruebas de Laboratorio además deben ser prácticas, accesibles y no ser demasiado costosas; las ventajas que se obtienen con su uso deben ser superiores al costo de los análisis. Los resultados de las pruebas deben ser relevantes y de preferencia deben ser cuantificables para poder ser analizados de forma comparativa.
Una consideración importante se refiere al usuario del Laboratorio de Diagnóstico; El Médico Veterinario, propietario y/o, administrador debe estar convencido de la importancia y la utilidad del uso de las pruebas de Laboratorio. El usuario del Laboratorio debe estar consciente de que los resultados de las pruebas tienen que ser interpretados racionalmente.
2.- PROCEDIMIENTOS DE MUESTREO
En el caso de las aves de producción comercial, debido a la gran cantidad de animales que son explotados de manera simultánea en espacios relativamente pequeños, los procedimientos de análisis de la información tienen ciertas particularidades. La medicina que se practica se clasifica como Medicina de Poblaciones, usualmente se muestrea una proporción muy reducida de la población total a estudiar y los resultados obtenidos en esa pequeña proporción de muestras se infiere que son válidos para toda la población, por lo tanto la representatividad de las muestras se convierte en un factor esencial para la confiabilidad de los resultados.
El primer factor que determina la validez de un resultado de Laboratorio es la representatividad de las muestras seleccionadas. Los resultados obtenidos con las pruebas de Laboratorio únicamente representan las características de las muestras sometidas a su análisis. Estos resultados pueden o no representar el estado general de una parvada o de un lote de ingredientes o alimentos, dependiendo de la precisión con la que las muestras fueron seleccionadas. En ocasiones se tiene la impresión que la variación en los resultados depende de la variación analítica de las pruebas o de errores en su realización por parte del Laboratorio y esto puede no ser correcto. La variabilidad analítica (variabilidad de la prueba) no es la principal fuente de error en un resultado de Laboratorio; la variabilidad más importante en los resultados de Laboratorio se debe a errores en las técnicas de muestreo.
Los tipos de muestreo utilizados con mayor frecuencia en la Industria Avícola son el Muestreo Confirmatorio y el Muestreo Exploratorio.
1. Muestreo Confirmatorio: es el muestreo que se realiza para confirmar y/o descartar un Diagnóstico Clínico. Cuando las aves son muestreadas para confirmar un diagnóstico clínico, es usual obtener las muestras de un "porcentaje representativo del problema" seleccionando aves con el cuadro clínico desarrollado; Los resultados obtenidos serán válidos para las aves seleccionadas en ese momento en particular y la validez de los resultados depende de la representatividad de los animales muestreados. En el caso de las aves es necesario conocer a profundidad la historia natural de la enfermedad que se desea detectar, incluyendo los índices de morbilidad y mortalidad, así como el curso y la duración del proceso, para determinar el momento más adecuado para realizar la toma de las muestras, por ejemplo, en el caso de las enfermedades infecciosas, el aislamiento del agente causal es más probable en los estadíos iniciales de la enfermedad, mientras que la demostración de la respuesta serológica hacia dicho agente requerirá de un muestreo en los estadíos avanzados de la misma o en período de convalecencia, es muy frecuente que se requieran por lo menos dos muestreos serológicos consecutivos con un intervalos de 10 a 15 días para demostrar la seroconversión o el incremento en los títulos de anticuerpos contra un agente en particular.
Este tipo de muestreo puede ser aplicable a muestras de diverso origen, como los insumos e ingredientes usados en la fabricación de los alimentos o bien para determinar la calidad y la inocuidad de los productos avícolas, como carne, huevo o subproductos.
2.-Muestreo Exploratorio: es el muestreo que se realiza sin que existan evidencias detectables de la presencia de un problema en particular. El objetivo de dicho muestreo es la detección de problemas antes de que estos se manifiesten, y usualmente son utilizados para conocer de manera
permanente el estado sanitario de las aves, alimentos, ingredientes, insumos o productos y subproductos. Debido a que no existen indicios que orienten la selección de las muestras, el muestreo exploratorio es un proceso complicado. La literatura científica menciona que para garantizar la representatividad de las muestras colectadas, la selección de estas debe ser completamente al azar. El tamaño y número de muestras colectadas dependen del tipo de muestras y de los exámenes de laboratorio que se desean realizar. En el caso de las enfermedades infecciosas, el número de muestras requeridas depende de la prevalencia esperada de la enfermedad en cuestión en una zona determinada. En el caso de los ingredientes y de los alimentos, el tamaño y el número de muestras depende del volumen total del material para muestrear.
En el caso de la industria avícola, es común utilizar este tipo de Muestreos Exploratorios, para realizar exámenes de laboratorio rutinarios y preestablecidos, estos exámenes se conocen como "Monitoreos" (del inglés: "monitoring": revisión, inspección) y tienen como objetivo principal evaluar de manera permanente el estado de salud general de la parvada.
Su uso continuo incrementa la posibilidad de la detección temprana de un problema, con lo que se pueden establecer medidas correctivas rápidamente. Estos estudios se pueden realizar a partir de muestras de aves vivas seleccionadas específicamente para tal fin, de la mortalidad, del alimento, los insumos del equipo y de las instalaciones en general (Figura 2).

Figura 2.- Ejemplos de diferentes procedimientos de muestreo
Para la evaluación de un programa de Sanidad Avícola no es necesario hacer un monitoreo extensivo a un gran número de animales, pero sí es muy importante que las aves a analizar sean representativas del estado general de la parvada. La metodología del muestreo debe ser constante. La selección de las aves a muestrear debe ser completamente aleatoria, para garantizar la representatividad del estado general de la parvada. Generalmente un número de entre 10 y 20 aves de las mismas características son suficientes para obtener resultados confiables. Entre mayor sea el número de muestras la representatividad será mayor pero los costos de la evaluación se incrementan proporcionalmente.
Existen Monitoreos serológicos, microbiológicos, parasitológicos, patológicos ó químicos, con objetivos muy particulares en cada caso. Existen también "Monitoreos Integrales" que evalúan en cada muestreo una serie de parámetros en varias pruebas. Los Monitoreos serológicos y microbiológicos has sido esenciales para el funcionamiento de las campañas Oficiales para el Control y la Erradicación de la Influenza Aviar, la Enfermedad de Newcastle y la Salmonelosis Aviar en nuestro país.
Los Monitoreos de Laboratorio para evaluar los programas de Sanidad Avícola pueden variar en el tipo y número de muestras colectadas, así como en los tipos de pruebas que se realicen en cada caso, son adaptables a las necesidades particulares de cada empresa.
Una consideración importante en los programas de Monitoreo de Laboratorio es la frecuencia del procedimiento. No existen reglas que determinen cual es la periodicidad del muestreo que puedan aplicarse en todos los casos. Cada empresa debe establecer un criterio propio de acuerdo a sus necesidades y posibilidades. Sin embargo, se debe recordar que la eficacia del procedimiento depende de su ejecución y evaluación constantes. En el caso de los Monitoreos Integrales de aves vivas, un criterio importante es establecer la edad de las aves a muestrear, ya que los resultados obtenidos y su interpretación varían dependiendo de la edad y de la función zootécnica de aves analizadas.
3.-SELECCIÓN, CONSERVACIÓN Y ENVIO DE LAS MUESTRAS PARA ESTUDIOS DE LABORATORIO
El segundo factor que determina la validez de un resultado de Laboratorio es el procedimiento para la conservación de las muestras que serán sometidas a análisis. Los métodos de conservación tienen como objetivo preservar las características físicas, químicas y microbiológicas originales de las muestras, por lo menos durante el período comprendido entre su selección y su recepción en el Laboratorio. En algunos casos estos métodos también permiten la preparación de las muestras para su procesamiento en el Laboratorio.
Los métodos de conservación dependen del tipo de análisis que se va a realizar y del tipo de muestra enviada; el período en el que las muestras conservan sus características originales también depende del tipo de método utilizado, sin embargo, es recomendable que las muestras sean trasladadas al Laboratorio lo más rápido posible después de ser colectadas, preferentemente en plazo no mayor de 24 horas.
Cuando se envían aves vivas para su análisis de Laboratorio, éstas deben de enviarse en contenedores adecuados para su transporte, que garanticen un trato humanitario, que no comprometan su viabilidad, que no causen lesiones y que no induzcan períodos innecesarios de tensión durante el transporte. Es importante no mezclar aves que se van a enviar a estudios diferentes, por ejemplo casos clínicos y monitoreos rutinarios, ya que se corre el riesgo de contaminación cruzada durante el transporte. También es importante enviar a las aves directamente de la granja al Laboratorio, cumpliendo con las medidas de bioseguridad que eviten que las aves transportadas representen un riesgo de contaminación para otras aves. El envío de aves vivas al Laboratorio permite colectar muestras para diversos estudios bajo condiciones controladas y reduce la probabilidad de que dichas muestras se alteren antes de su procesamiento, sin embargo, puede ser complicado sobre todo cuando la distancia entre la granja y el Laboratorio es muy grande; El transporte de aves vivas para estudios de Laboratorio debe también respetar los lineamientos vigentes descritos en las Campañas para el Control y la Erradicación de la Influenza Aviar, la Enfermedad de Newcastle presentación Velogénica y Salmonelosis Aviar.
En ocasiones, debido al número de muestras, a la distancia entre la granja y el Laboratorio y al tipo de muestras remitidas, es más práctico colectar las muestras en la granja y enviarlas al Laboratorio, lo cual requiere ciertas consideraciones. Uno de los errores principales es la identificación de las muestras. El método de identificación debe ser permanente aun bajo los efectos del sistema de conservación.
Las muestras para estudios de Histopatología deben conservarse en una solución de formalina al 10% amortiguada, pH 7.0-7.5, con una relación 1:10 muestra formalina. Las muestras para estudios de Serología deben de conservarse en refrigeración del suero, es importante no refrigerar ni congelar las muestra con coágulos sanguíneos ya que se corre el riesgo de que el coágulo sufra hemólisis que interfiere con la realización de las pruebas. Las muestras para estudios de Microbiología y de Biología Molecular deben conservarse en refrigeración ó en congelación, evitando su contaminación externa; en el caso de las muestras de hisopos, estos deben conservarse sumergidos en medio de transporte específico para el análisis que se desea realizar (medios selectivos, adicionados con antibióticos, etc.). Las muestras para estudios de Parasitología deben conservarse en refrigeración para evitar la fermentación de la muestra; el uso de dicromato de potasio K2Cr2O7 está siendo cuestionado debido a la toxicidad de la solución. Las muestras para estudios de Toxicología pueden variar en su conservación, dependiendo del estudio que se desea realizar, sin embargo, en estos casos es muy importante que los recipientes contenedores de las muestras tengan cierre hermético para evitar contaminación externa (Figura 3)...
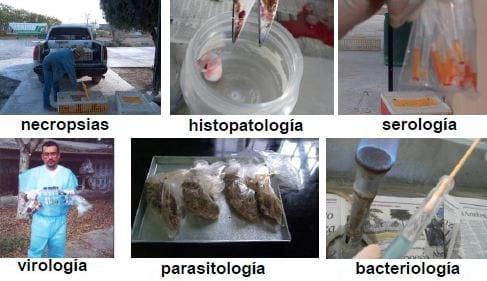
Figura 3.- Procedimientos recomendables para la conservación y el envío de muestras para análisis de laboratorio.
4.- TIPOS DE ANALISIS DE LABORATORIO E INTERPRETACION DE RESULTADOS
Los tipos de pruebas usadas rutinariamente en un Laboratorio de Patología Aviar son:
1.- Pruebas de Patología: Las pruebas de patología tienen como objetivo identificar y cuantificar las lesiones morfológicas de los tejidos, especificando los tipos de lesiones, su distribución, curso y grado de severidad; las pruebas más utilizadas son las necropsias y la histopatología.
Las necropsias pueden ser realizadas tanto en el campo como en el laboratorio, pueden realizarse de aves específicamente seleccionadas y sacrificadas para tal fin o bien utilizar las aves de la mortalidad. En las necropsias se pueden identificar las lesiones macroscópicas en general y también se utilizan con fines más específicos como para evaluar lesiones en distintos órganos, tal es el caso de la técnica de J. Johnson y W. Reíd para evaluar las lesiones producidas por coccidias ó la técnica de Rountree que sirve para la evaluación del desarrollo del sistema inmunológico. El resultado de la necropsia se emite como un "Diagnóstico Morfológico Post Mortem" donde las lesiones observadas son ordenadas de acuerdo a su importancia; el resultado es sugestivo de un padecimiento, aunque rara vez es concluyente a cerca de la causa de enfermedad (Figura 4).
Cuando la necropsia se realiza inmediatamente después del sacrificio las aves no presentan cambios post mortem, cuando se realiza en aves procedentes de la mortalidad natural es común que los cadáveres presenten cambios post mortem avanzados que impidan una observación adecuada de las lesiones.
Los tipos de pruebas usadas rutinariamente en un Laboratorio de Patología Aviar son:
1.- Pruebas de Patología: Las pruebas de patología tienen como objetivo identificar y cuantificar las lesiones morfológicas de los tejidos, especificando los tipos de lesiones, su distribución, curso y grado de severidad; las pruebas más utilizadas son las necropsias y la histopatología.
Las necropsias pueden ser realizadas tanto en el campo como en el laboratorio, pueden realizarse de aves específicamente seleccionadas y sacrificadas para tal fin o bien utilizar las aves de la mortalidad. En las necropsias se pueden identificar las lesiones macroscópicas en general y también se utilizan con fines más específicos como para evaluar lesiones en distintos órganos, tal es el caso de la técnica de J. Johnson y W. Reíd para evaluar las lesiones producidas por coccidias ó la técnica de Rountree que sirve para la evaluación del desarrollo del sistema inmunológico. El resultado de la necropsia se emite como un "Diagnóstico Morfológico Post Mortem" donde las lesiones observadas son ordenadas de acuerdo a su importancia; el resultado es sugestivo de un padecimiento, aunque rara vez es concluyente a cerca de la causa de enfermedad (Figura 4).
Cuando la necropsia se realiza inmediatamente después del sacrificio las aves no presentan cambios post mortem, cuando se realiza en aves procedentes de la mortalidad natural es común que los cadáveres presenten cambios post mortem avanzados que impidan una observación adecuada de las lesiones.
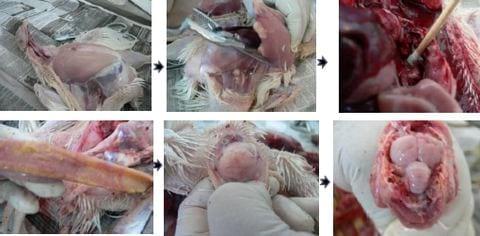
Figura 4.- Procedimiento para la realización de una necropsia.
La histopatología tiene como objetivo identificar y describir las lesiones microscópicas de los tejidos. Los errores más comunes en la conservación de las muestras incluyen: exceso en el volumen de las muestras y / o falta de volumen del fijador, derramamiento del fijador por falta de cierre hermético en el recipiente, falta de penetración del fijador por muestras excesivamente gruesas y refrigeración o congelación de la muestras, antes de fijarse o durante el proceso de fijación. El congelamiento de las muestras cristaliza el agua intracelular causando ruptura de las membranas celulares y destrucción de los tejidos.
El estudio histopatológico usualmente ayuda a orientar el diagnóstico, la interpretación puede ser descriptiva, identificando las lesiones microscópicas de los tejidos. El resultado puede ser concluyente en algunos casos, por ejemplo, en las enfermedades neoplásicas es esencial para determinar el tipo de tumor (Enfermedad de Marek, Leucosis Linfoide, Leucosis Mieloide y Reticuloendoteliosis); en algunas enfermedades virales la presencia de cuerpos de inclusión es patognomónica, como en los casos de Viruela Aviar, Laringotraqueítis Infecciosa, Hepatitis con Cuerpos de Inclusión y Síndrome de Baja de Postura; en otros casos se puede observar el agente en las lesiones, como en la coccidiosis o en la aspergilosis (Figura 5). .Finalmente en algunas ocasiones la histopatología sirve para cuantificar el grado de daño que las aves están teniendo en algunas enfermedades como en las micotoxicosis y en la Infección de la bolsa de Fabricio, donde incluso se puede determinar sí las aves están o no protegidas contra los desafíos de campo; en este caso se han desarrollado varios sistemas para cuantificar el grado de lesión bursal como un sistema indicador de protección.
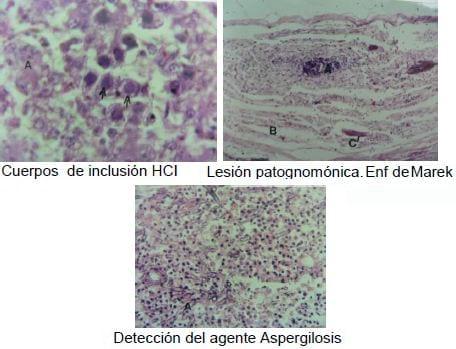
Figura 5.- Lesiones microscópicas con valor diagnóstico concluyente.
2.- Pruebas de Serología: las pruebas de serología sirven para detectar la inmunidad humoral contra diferentes antígenos; las pruebas usualmente detectan anticuerpos séricos (de ahí su nombre de Serología) pero eventualmente pueden ser utilizadas para detectar anticuerpos en yema o en cualquier líquido corporal. Una prueba positiva indica que el ave posee anticuerpos contra el antígeno evaluado, lo que puede tener significados diversos.
Las pruebas de serología pueden ser cuantitativas o cualitativas. En las pruebas cualitativas, como la aglutinación en placa y la inmunodifusión en gel de agar, el resultado se expresa como positivo ó negativo, suelen ser poco sensibles y el suero no se diluye para ser procesado. Las pruebas cuantitativas permiten detectar la cantidad de anticuerpos que hay en la muestra, en este caso los sueros se diluyen en diluciones dobles seriadas y el resultado usualmente se expresan como el "título de la muestra", que indica la dilución mayor en la que se observa una reacción positiva, el titulo es directamente proporcional a la cantidad de anticuerpos que hay en la muestra, tal es el caso de la inhibición de la hemaglutinación, la micro aglutinación y la virus suero neutralización; el resultado se expresa como la dilución, ej. 1:256 o su inverso ej. 256, también se pueden expresar en Logaritmo base 2 ej. 1:256 = Log 2 8. En otros casos, como en las pruebas de ELISA, el suero sólo es diluido una vez antes de ser procesado y el titulo del mismo es calculado matemáticamente haciendo una comparación con los títulos de los controles positivos y negativos de la prueba.
Las pruebas más comunes en avicultura son la aglutinación en placa para Mycoplasma y Salmonella; la micro aglutinación para S pullorum, inmunodifusión en gel de agar para Adenovirus, Encefalomielitis, Infección de la bolsa de Fabricio, Reovirus e Influenza Aviar; inhibición de la hemaglutinación para Enfermedad de Newcastle, Influenza Aviar, Síndrome de Baja de Postura, Mycoplasma, Bronquitis Infecciosa y Coriza Infecciosa; virus suero neutralización para Infección de la bolsa de Fabricio, Adenovirus Aviar, Enfermedad de Newcastle, Reovirus, y otros agentes y finalmente la técnica de ELISA (ensayo inmunoenzimático) que actualmente es de las más utilizadas debido a su alta sensibilidad, facilidad de realización, disponibilidad de reactivos estandarizados, rapidez de los resultados y a que fácilmente se adapta a un sistema computarizado para hacer la evaluación estadística de los resultados, existen estuches comerciales para un gran número de enfermedades aviares como Enfermedad de Newcastle, Infección de la bolsa de Fabricio, Bronquitis Infecciosa, Reovirus, Mycoplasma gallisepticum, Mycolasma synoviae, Pasteurella multocida, Salmonella enteritidis, Encefalomielitis Aviar, Influenza Aviar, Pneumovirus Aviar, Leucosis Linfoide tipos A-B y J, Laringotraqueítis Infecciosa, Anemia Infecciosa Aviar, etc.
En las pruebas de ELISA el suero se diluye una sola vez, y se utiliza un antisuero marcado con una enzima, el resultado se basa en una reacción colorimétrica que es medida con un espectrofotómetro, cuya intensidad es proporcional a la cantidad de anticuerpos de la muestra, los resultados son además clasificados en "grupos o perfiles" en un histograma, que puede ser 3, 14 o 18 perfiles dependiendo del estuche comercial y del tipo de antígeno evaluado; la expresión gráfica de los resultados facilita en gran medida su interpretación.
Generalmente en las pruebas de serología se evalúa un grupo de muestras, usualmente un mínimo de 10 para que la evaluación sea confiable y los resultados obtenidos son individuales de cada muestra. En los resultados se expresa el título de cada suero; para una interpretación adecuada de los resultados es necesario conocer el título de cada suero y el promedio del grupo, generalmente expresado como media geométrica, lo que indica el comportamiento general del grupo. En la interpretación de los resultados también es necesario considerar la uniformidad de los resultados, por lo que se hace, sobre todo en las pruebas de ELISA, con un análisis estadístico de los resultados, mostrando la media aritmética, la media geométrica, la desviación estándar y el coeficiente de variación. Los valores de las medias indican la cantidad de anticuerpos, los valores de la desviación estándar y del coeficiente de variación indican la uniformidad de los resultados. En general se piensa que títulos altos con variaciones pequeñas indican una protección adecuada y que títulos bajos y desviaciones altas indican falta de protección o exposición de campo, sin embargo en este tema las generalizaciones son difíciles de establecer. La interpretación variará dependiendo del tipo de antígeno, del tipo y edad de las aves analizadas y del calendario de vacunación que se está utilizando.
En aves recién nacidas la presencia de anticuerpos es un reflejo de los anticuerpos maternos, esto puede indicar protección (Infección de la bolsa de Fabricio, Enfermedad de Newcastle) o infección materna y muy probablemente infección de la progenie (Mycoplasma, Salmonella). En aves mayores a dos semanas la presencia de anticuerpos contra antígenos no incluidos en el programa de inmunización indica exposición de campo a dicho agente y casi seguramente infección (Pneumovirus Aviar, Influenza Aviar, Anemia Infecciosa Aviar, Micoplasmosis, etc.); en el caso de las enfermedades donde existe un programa de vacunación la interpretación de los resultados de serología es más complicada, ya que se debe diferenciar el efecto de la vacunación del efecto de las exposiciones de campo; las vacunaciones deben generar un título de anticuerpos homogéneo y moderado; sí el promedio es muy alto y la variación entre las muestras es excesiva los resultados sugieren protección inadecuada y exposición de campo no controlada. Actualmente se han desarrollados algunos sistemas conocidos como "DIVA" que sirven para diferenciar los anticuerpos de aves vacunadas y aves infectadas. Se debe ser muy cuidadoso al evaluar el coeficiente de variación, ya que por efectos matemáticos, los títulos muy bajos y con valores negativos en algunos de ellos resultan en coeficientes de variación muy elevados (hasta mayores del 100%) mientras que títulos promedio muy elevados pueden resultar con coeficientes de variación bajos (menores al 50% aún con gran variación entre las muestras), la graficación de los resultados de ELISA en forma de histogramas facilita en gran medida la valoración de las variaciones entre las muestras. En algunos estuches comerciales para Anemia Infecciosa Aviar y Salmonella enteritidis se utiliza una técnica de ELISA llamada "de competencia" o "por bloqueo" donde la cantidad de anticuerpos es inversamente proporcional a la intensidad de la reacción colorimétrica y los valores altos indican ausencia de anticuerpos, mientras que las lecturas bajas indican la presencia de los mismos. En las pruebas de virus suero neutralización la evaluación lleva implícita la capacidad del anticuerpo para neutralizar el efecto del antígeno homólogo, desafortunadamente estas pruebas son más lentas, costosas y no permiten evaluar un gran número de muestras de manera simultánea.
Sin embargo ninguna de las pruebas de serología por sí mismas indica grado de protección, todas indican el nivel de anticuerpos específicos contra un antígeno en particular, este nivel de anticuerpos debe ser racionalmente interpretado para poder decir si indica protección, exposición de campo o infección activa. La evaluación rutinaria y periódica del título de anticuerpos deberá correlacionarse con los calendarios de vacunación, el comportamiento clínico y el desempeño productivo de la parvada para establecer los parámetros esperados de acuerdo a la edad y a la función zootécnica de las aves para establecer los niveles considerados "normales" e interpretar adecuadamente las variaciones de la "normalidad" como inmunidad insuficiente, exposición de campo no controlada o enfermedad clínica aparente. Las llamadas "líneas de base" indican el nivel normal esperado de anticuerpos en una parvada a una edad determinada, permiten identificar con facilidad los cambios en el nivel de anticuerpos debidos a cambios en las vacunaciones o a exposiciones de campo y se pueden correlacionar con los objetivos de rendimiento productivo, para establecer estas líneas de base se sugiere muestrear semanalmente un mínimo de 10 parvadas.
En el caso de las pruebas de serología, es frecuente que se requiera de un muestreo seriado de la parvada para detectar seroconversión o bien, un incremento en el título de anticuerpos de las aves, lo cual es muy sugestivo de una exposición de campo hacia el agente evaluado (Figura 6).
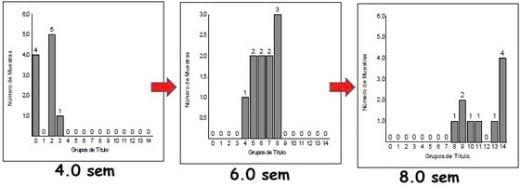
Figura 6.- Incremento en el título de anticuerpos contra Bronquitis Infecciosa, indicando exposición de campo hacia el virus.
3.- Pruebas de Parasitología: Las pruebas de parasitología identifican el tipo y el número de parásitos existentes en las aves, ya sea externos y/o internos. Las técnicas utilizadas en avicultura son flotación, McMaster y observación microscópica. Su aplicación depende de la función zootécnica de las aves a analizar. Para la detección y cuantificación de los endoparásitos más frecuentes de las aves domésticas la muestra de elección es de heces.
Las evacuaciones de las aves pueden consistir en heces fecales y heces cecales; las heces fecales son eliminadas junto con los desechos del tracto urinario. En el análisis de las evacuaciones aviares es necesario conocer el tipo de evacuación, sus características físicas como color y consistencia, la cantidad de líquido de las excretas y la presencia de materiales extraños, como sangre o restos de alimento semi digerido o no digerido. El análisis más frecuente es para la detección de coccidias por la técnica de McMaster. Si las muestras son remitidas al Laboratorio inmediatamente después de su colección es recomendable enviarlas en condiciones de refrigeración sin ningún otro conservador adicional.
En el caso del pollo de engorda la parasitosis más importante es la coccidiosis y en la mayoría de las empresas se utiliza un programa continuo de control de la enfermedad, basándose en el uso de medicamentos preventivos y/o vacunas. La prueba más usada es la de McMaster y debe incluir además la diferenciación de las especies de Eimeria involucradas, las que se identifican con criterios morfológicos convencionales (Figura 7). La prueba detecta al parásito es su fase de oocisto y puede realizarse a partir de heces, contenido cecal o cama. Las muestras de heces reflejan la cantidad de coccidias que los pollos están eliminando en ese momento, se requiere de una técnica de muestreo constante en un programa permanente; se prefiere usar muestras de heces frescas colectadas a todo lo largo de la caseta y las muestras suelen trabajarse por caseta; es importante no mezclar nuestras de aves de diferentes edades ya que la eliminación de oocistos puede variar enormemente de una semana a otra; un control intensivo requiere de un muestreo semanal por lo menos desde la 2° o 3° semana de edad. Los resultados se emiten como el número de oocistos por gramo de muestra (o/gh), especificando además el porcentaje de cada especie.
Bajo un programa de uso continuo de anticoccidianos en el alimento, un conteo de 0 a 5,000 o/gh se considera normal, un conteo entre 6,000 y 70,000 o/gh no indica riesgo de brote sí el conteo de la semana anterior no tiene marcadas variaciones con relación al presente; los conteos cercanos a 100,000 o/gh indican riesgo inminente de brote clínico, las heces pueden estar acuosas u manchadas con sangre y el grado de pigmentación se verá afectado en un 5-10%; los conteos superiores a 100,000 indican brote de la enfermedad. Hay que tomar en cuenta algunas consideraciones en la interpretación de estos resultados. E acervulina se es la coccidia de replicación más abundante y los conteos generalmente son más altos que los de E tenella, por otro lado E máxima es de replicación escasa y puede generar problemas con conteos superiores a 10,000; la eliminación masiva de oocistos ocurre entre 4 y 7 días después de que se desarrollaron las lesiones intestinales más severas; los conteos en cama no reflejan la cantidad de oocistos eliminados en un momento determinado, generalmente los oocistos están esporulados y la diferenciación de especies es más difícil y una cantidad excesiva de amoniaco en la cama puede destruirlos. El contenido cecal es una muestra adecuada pero refleja sólo lo que está ocurriendo en el ave muestreada. En el caso de las reproductoras, el uso de las vacunas es común y el alimento no contiene coccidiostatos, es importante analizar la eliminación de oocistos una y dos semanas después de la vacunación; en aves mayores de 12 semanas los problemas más frecuentes se asocian a E necatrix.
En aves de vida prolongada, como reproductoras y gallinas de postura, es posible encontrar infestación por cestodos y nematodos cuyos huevos se pueden detectar en heces por la prueba de flotación, aunque la evaluación del grado de parasitosis es más confiable si se observa la cantidad de parásitos adultos a la necropsia. Con los ectoparásitos la situación es similar, estos se identifican morfológicamente con el microscopio y el grado de infestación puede interpretarse como leve, moderado o severo dependiendo del número de parásitos y de los signos que provoquen en las aves.
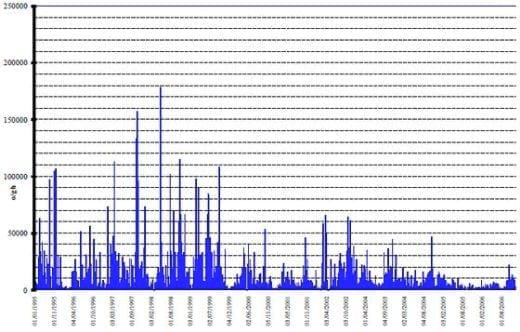
Figura 7: Ejemplo de una evaluación semanal del programa de control de coccidiosis durante 12 años por medio de la prueba de McMaster en heces
4.- Pruebas de Microbiología: estas pruebas detectan bacterias, hongos o virus, ya sea por medio de su aislamiento, identificación y tipificación o bien por la demostración de sus antígenos; usualmente se realizan a partir de tejidos de aves seleccionadas específicamente para tal fin, pero también se pueden hacer estudios a partir de alimento, agua, ingredientes, cama, instalaciones, equipo, etc. Los métodos más utilizados para la conservación son la refrigeración y la congelación, particularmente en aquellas muestras que por su naturaleza posean una flora bacteriana normal, ya que el sobre crecimiento de dicha flora puede inhibir el crecimiento de los agentes patógenos. El aislamiento bacteriano o micótico requiere de muestras en refrigeración mientras que para el aislamiento viral la congelación es el método más recomendable; en este caso, el uso de sustancias crio protectoras, como la glicerina, puede prolongar la vida útil de las muestras. Existen medios de cultivo especialmente diseñados para la conservación y el transporte de las muestras y en algunos casos tiene propiedades de inhibición de microorganismos comensales y propiedades selectivas de protección para algunos microorganismos, particularmente bacterianos. El hecho de que algunas muestras de tejidos que se utilizan para el aislamiento microbiológico pueden contener cantidades importantes de bacterias saprófitas, restos celulares, anticuerpos, enzimas, índices extremos de pH o algunas otras sustancias que inhiben el crecimiento de algunos microorganismos patógenos, en ocasiones es más práctico colectar la muestra mediante la utilización de un hisopo estéril y luego conservar este en un medio de transporte adecuado. Por ejemplo, las muestras para aislamiento de Salmonella pueden ser adecuadamente conservadas en medios de transporte como agua peptonada o selectivos como el caldo tetrationato o el caldo selenito. Las muestras para aislamiento viral son conservadas adecuadamente en un medio protector como el caldo triptosa de fosfato adicionado de un amortiguador para evitar cambios bruscos de pH, la adición de una mezcla de antibióticos de amplio espectro evita la contaminación bacteriana de la muestra. Además de la utilización de los medios de conservación, las muestras deben ser transportadas en refrigeración. El error más común en el envío de muestras para estudios microbiológicos es la contaminación bacteriana de las muestras, el origen de esta contaminación está influenciado por la técnica de muestreo y por la conservación inadecuada de las muestras en cuanto a la temperatura en el transporte.
El aislamiento de un microorganismo a partir de una muestra implica que este esta viable ("vivo") en dicha muestra (Figura 8). Sin embargo, la interpretación de las pruebas de aislamiento microbiano deben ser interpretadas con cautela. El aislamiento de un microorganismo no implica necesariamente su papel como patógeno en un proceso de enfermedad, puede eventualmente tratarse de flora saprofita o un agente vacunal. El microorganismo aislado puede requerir de una tipificación posterior, como una tipificación antigénica, la demostración de factores de virulencia, etc. Así mismo, la falta aislamiento del microorganismo no implica necesariamente que éste no sea la causa de la enfermedad, En bacteriología se usan medios enriquecidos y selectivos artificiales, pruebas bioquímicas y en algunos casos identificación por medio de antisueros. Los resultados se expresan como género y especie bacteriana aislada y en ocasiones su cantidad relativa (crecimiento abundante, moderado o escaso). La interpretación de estos resultados depende del tipo de ave analizada, el tipo de bacteria aislada y el órgano o tejido donde se aisló la bacteria. En condiciones ideales todas las muestras deben ser negativas a Salmonella pullorum, Salmonella gallinarum y Salmonella enteritidis, en todos los tipos de aves (progenitoras, reproductoras, postura, engorda), en ingredientes, alimentos, agua, cama e instalaciones, particularmente de la planta incubadora y de la planta de procesamiento. Una característica de calidad de las aves recién nacidas es la bacteriología del saco vitelino y la micología del pulmón, que deberían de ser estériles, ocasionalmente se aíslan coliformes y cocos de saco vitelino así como Aspergillus y Penicillium de pulmón, lo que refleja la higiene de la planta incubadora y eventualmente la salud de las reproductoras. Salvo el tracto digestivo y la piel, el resto de los tejidos aviares en condiciones normales debe ser bacteriológicamente estéril, así que el aislamiento bacteriano a partir de cualquier órgano fuera del tracto digestivo es relevante, particularmente si la bacteria aislada es causa conocida de enfermedad, como en los casos de Escherichia coli, Salmonella sp, Avibacterium (Haemphilus) paragallinarum, Pasteurella multocida, Ornitobacterium rhinotracheale y Staphylococcus aureus. En aves mayores se recomiendan estudios bacteriológicos del tracto respiratorio (tráquea, pulmón, sacos aéreos) donde se pueden aislar Escherichia coli y organismos similares con relativa frecuencia y pueden representar los organismos complicantes de las enfermedades virales respiratorias aunque la literatura no los reconozca como patógenos primarios, como Gallibacterium anatis (Pasteurella haemolytica), Bordetella avium y algunos cocos gram positivos. En las plantas de procesamiento el interés principal es el aislamiento de bacterias potencialmente patógenas para el consumidor, como Escherichia coli, Salmonella sp, Campylobacter sp, Listeria monocytogenes y Staphylococcus aureus.
Las pruebas de virología más frecuentemente usadas en avicultura utilizan el aislamiento en embrión de pollo, para virus como Influenza Aviar, Enfermedad de Newcastle, Bronquitis Infecciosa, Laringotraqueítis Infecciosa y Viruela Aviar; la presencia de anticuerpos en embriones de parvadas que no son libres de patógenos específicos (LPE ó SPF por sus siglas en ingles) puede dificultar el aislamiento viral en embrión, particularmente en los casos de Adenovirus, Reovirus e Infección de la bolsa de Fabricio. Existe también el sistema de cultivos celulares primarios, líneas celulares establecidas o cultivo de órganos para cierto tipo de virus de crecimiento difícil. Las pruebas de aislamiento viral usualmente se realizan a partir de tejidos de aves seleccionadas para tal fin, pero también pueden realizarse a partir de hisopos traqueales o cloacales, alimento, equipo o instalaciones. El aislamiento viral de algún agente en parvadas que no se vacunaron contra dicho agente usualmente es de elevado valor diagnóstico (salvo en el caso de algunos Reovirus, Enterovirus y Adenovirus no patógenos); en parvadas vacunadas en condiciones normales el virus vacunal desaparece en un período de 8 días, sí el aislamiento es positivo después de éste período es probable que el aislamiento sea den virus de campo y/o que la cepa vacunal no ha podido ser controlada por la parvada. Es necesario identificar y tipificar los aislamientos virales para conocer el serotipo y/o subtipo de virus aislado, generalmente este proceso se hace con pruebas de virus suero neutralización utilizando antisueros mono específicos monoclonales y posteriormente usando embriones de pollo o cultivos celulares; en el caso de los aislamientos del virus de la Enfermedad de Newcastle, por ejemplo, es necesaria la caracterización del aislamiento mediante las pruebas de tiempo de mortalidad embrionaria, índice de patogenicidad intracerebral en pollos de un día e índice de patogenicidad intravenosa en pollos de 6 semanas. En general, para la mayoría de los virus aviares es difícil de determinar sí el virus aislado tiene o no un origen vacunal.
En la Figura 8 se presentan algunos ejemplos de los resultados de aislamiento de microorganismos.
El aislamiento de un microorganismo a partir de una muestra implica que este esta viable ("vivo") en dicha muestra (Figura 8). Sin embargo, la interpretación de las pruebas de aislamiento microbiano deben ser interpretadas con cautela. El aislamiento de un microorganismo no implica necesariamente su papel como patógeno en un proceso de enfermedad, puede eventualmente tratarse de flora saprofita o un agente vacunal. El microorganismo aislado puede requerir de una tipificación posterior, como una tipificación antigénica, la demostración de factores de virulencia, etc. Así mismo, la falta aislamiento del microorganismo no implica necesariamente que éste no sea la causa de la enfermedad, En bacteriología se usan medios enriquecidos y selectivos artificiales, pruebas bioquímicas y en algunos casos identificación por medio de antisueros. Los resultados se expresan como género y especie bacteriana aislada y en ocasiones su cantidad relativa (crecimiento abundante, moderado o escaso). La interpretación de estos resultados depende del tipo de ave analizada, el tipo de bacteria aislada y el órgano o tejido donde se aisló la bacteria. En condiciones ideales todas las muestras deben ser negativas a Salmonella pullorum, Salmonella gallinarum y Salmonella enteritidis, en todos los tipos de aves (progenitoras, reproductoras, postura, engorda), en ingredientes, alimentos, agua, cama e instalaciones, particularmente de la planta incubadora y de la planta de procesamiento. Una característica de calidad de las aves recién nacidas es la bacteriología del saco vitelino y la micología del pulmón, que deberían de ser estériles, ocasionalmente se aíslan coliformes y cocos de saco vitelino así como Aspergillus y Penicillium de pulmón, lo que refleja la higiene de la planta incubadora y eventualmente la salud de las reproductoras. Salvo el tracto digestivo y la piel, el resto de los tejidos aviares en condiciones normales debe ser bacteriológicamente estéril, así que el aislamiento bacteriano a partir de cualquier órgano fuera del tracto digestivo es relevante, particularmente si la bacteria aislada es causa conocida de enfermedad, como en los casos de Escherichia coli, Salmonella sp, Avibacterium (Haemphilus) paragallinarum, Pasteurella multocida, Ornitobacterium rhinotracheale y Staphylococcus aureus. En aves mayores se recomiendan estudios bacteriológicos del tracto respiratorio (tráquea, pulmón, sacos aéreos) donde se pueden aislar Escherichia coli y organismos similares con relativa frecuencia y pueden representar los organismos complicantes de las enfermedades virales respiratorias aunque la literatura no los reconozca como patógenos primarios, como Gallibacterium anatis (Pasteurella haemolytica), Bordetella avium y algunos cocos gram positivos. En las plantas de procesamiento el interés principal es el aislamiento de bacterias potencialmente patógenas para el consumidor, como Escherichia coli, Salmonella sp, Campylobacter sp, Listeria monocytogenes y Staphylococcus aureus.
Las pruebas de virología más frecuentemente usadas en avicultura utilizan el aislamiento en embrión de pollo, para virus como Influenza Aviar, Enfermedad de Newcastle, Bronquitis Infecciosa, Laringotraqueítis Infecciosa y Viruela Aviar; la presencia de anticuerpos en embriones de parvadas que no son libres de patógenos específicos (LPE ó SPF por sus siglas en ingles) puede dificultar el aislamiento viral en embrión, particularmente en los casos de Adenovirus, Reovirus e Infección de la bolsa de Fabricio. Existe también el sistema de cultivos celulares primarios, líneas celulares establecidas o cultivo de órganos para cierto tipo de virus de crecimiento difícil. Las pruebas de aislamiento viral usualmente se realizan a partir de tejidos de aves seleccionadas para tal fin, pero también pueden realizarse a partir de hisopos traqueales o cloacales, alimento, equipo o instalaciones. El aislamiento viral de algún agente en parvadas que no se vacunaron contra dicho agente usualmente es de elevado valor diagnóstico (salvo en el caso de algunos Reovirus, Enterovirus y Adenovirus no patógenos); en parvadas vacunadas en condiciones normales el virus vacunal desaparece en un período de 8 días, sí el aislamiento es positivo después de éste período es probable que el aislamiento sea den virus de campo y/o que la cepa vacunal no ha podido ser controlada por la parvada. Es necesario identificar y tipificar los aislamientos virales para conocer el serotipo y/o subtipo de virus aislado, generalmente este proceso se hace con pruebas de virus suero neutralización utilizando antisueros mono específicos monoclonales y posteriormente usando embriones de pollo o cultivos celulares; en el caso de los aislamientos del virus de la Enfermedad de Newcastle, por ejemplo, es necesaria la caracterización del aislamiento mediante las pruebas de tiempo de mortalidad embrionaria, índice de patogenicidad intracerebral en pollos de un día e índice de patogenicidad intravenosa en pollos de 6 semanas. En general, para la mayoría de los virus aviares es difícil de determinar sí el virus aislado tiene o no un origen vacunal.
En la Figura 8 se presentan algunos ejemplos de los resultados de aislamiento de microorganismos.
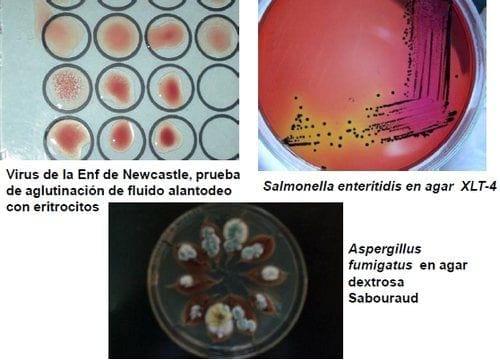
Figura 8: Ejemplos de los resultados de aislamiento viral, aislamiento bacteriano y aislamiento micológico.
Es posible detectar la presencia de microorganismos sin que se lleve a cabo su aislamiento, demostrando sus antígenos en tejidos, improntas, líquidos corporales o macerados de órganos. La presencia de antígenos puede realizarse con antisueros específicos marcados con sustancias que después pueden ser visualizadas en un microscopio, como en los casos de la inmunofluorescencia y la inmunoperoxidasa (Figura 9); estas técnicas son cualitativas y la especificidad de los antisueros utilizados permite identificar con certeza subtipos antigénicos o cepas variantes, como en los casos de Bronquitis Infecciosa e Infección de la bolsa de Fabricio. Existe una técnica de ELISA llamada "de captura" que detecta antígenos a partir de muestras de líquidos corporales o de macerado de órganos, como la detección del antígeno p-27 de los virus del grupo Leucosis - Sarcoma o de los antígenos del virus de la Infección de la bolsa de Fabricio.
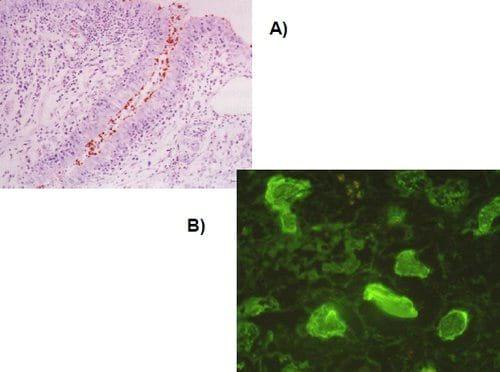
Figura 9: Detección de antígenos en las muestras por Inmunoperoxidasa (A) y por Inmunofluorescencia (B)
RELACION ENTRE VARIAS PRUEBAS: AISLAMIENTO MICROBOLOGICO Y SEROLOGIA
Existen ocasiones en que los resultados de dos pruebas para la detección de un mismo agente no son concordantes, estos es especialmente frecuente entre las pruebas de aislamiento microbiológico y las pruebas de serología. En los estadíos iniciales de la enfermedad (7 días) es mas factible obtener un aislamiento microbiano y no detectar presencia de anticuerpos en las mismas aves; conforme transcurre la enfermedad (después de 14 días) es mas probable detectar seroconversión y la probabilidad de obtener un aislamiento microbiano se reduce, ya que la concentración del microorganismo en los tejidos tiende a disminuir. Existe un período crítico, conocido como "periodo de ventana" donde es muy probable que tanto las pruebas de aislamiento microbiano como las pruebas de serología sean negativas, en animales realmente infectados (Figura 10). Es en estos casos donde es vital conocer la naturaleza de la enfermedad y la etapa de la infección en la que las muestras son obtenidas para interpretar los resultados con precisión.
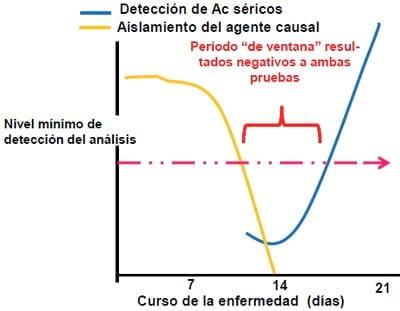
Figura 10: Relación entre el aislamiento del agente y la detección de serología positiva en un proceso de enfermedad.
5.- Pruebas de Biología Molecular: Los métodos más modernos para la detección de patógenos aviares utilizan la tecnología de la biología molecular y se basan en la detección del material genético (ácido desoxirbonuleíco ó DNA y/ó ácido ribonucleíco o RNA) del agente. Para poder realizar la identificación se requiere tener una cantidad suficiente de material genético, la reacción en cadena de la polimerasa (PCR por sus siglas en ingles) permite amplificar la cantidad de DNA hasta niveles detectables, posteriormente la identificación específica del material genético se puede realizar por diferentes técnicas. Estas técnicas se basan en la detección de una porción altamente específica del genoma de los microorganismos. Las ventajas de estas técnicas incluyen su rapidez, su alta sensibilidad y la posibilidad de tipificación de los microorganismos. Las desventajas de estas técnicas incluyen su costo, su elevado nivel de tecnología, la complejidad en la conservación de las muestras, y el requerir del conocimiento previo del material genético de los microorganismos. Con estas técnicas no pueden determinar la viabilidad del microorganismo detectado. Existen pruebas para la detección y pruebas para la tipificación de los microorganismos. Las pruebas de detección incluyen PCR, RT-PCR, PCR en Tiempo Real y PCR Anidada.
En las pruebas clásicas de PCR, un fragmento conocido del DNA se amplifica e identifica. La identificación se realiza por tamaño y peso molecular en geles de agarosa teñidos con bromuro de etídio; se han desarrollado sistemas de detección para una gran cantidad de agentes infecciosos como los virus de la Enfermedad de Marek, Laringotraqueitis Infecciosa y Adenovirus Aviar (Figura 11). La identificación del fragmento de DNA amplificado también puede hacerse por hibridación con una sonda marcada fácilmente identificable ("dot-blot"), por ejemplo para Mycoplasma. En la prueba de RT-PCR el genoma de los virus RNA es convertido en DNA con una enzima Retrotranscriptasa (RT), para posteriormente ser amplificado, por ejemplo, para Influenza Aviar, Enfermedad de Newcastle, Bronquitis Infecciosa, Infección de la bolsa de Fabricio y Reovirus. En la Prueba de PCR en Tiempo Real, la prueba es cuantitativa, tiene mayor sensibilidad y la detección de los fragmentos amplificados es inmediata, sin el uso del paso de separación e identificación en geles de Agarosa, por ejemplo para el virus de Influenza Aviar. La prueba de PCR Anidada ("nested" PCR ó nPCR) es una doble prueba de PCR, donde la segunda reacción de PCR usa como patrón el producto amplificado de la primera reacción de PCR ("amplicón"), lo que aumenta la sensibilidad y puede hacer la prueba cuantitativa; la prueba de PCR Anidada puede utilizarse para tipificar algunos virus y se ha utilizado para la detección del Pneumovirus Aviar y para la identificación de los subtipos A y B del mismo.
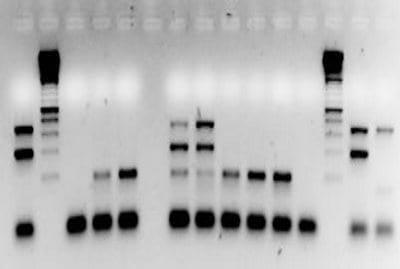
Figura 11: Prueba de detección por PCR y separación de los segmentos amplificados en gel de agarosa teñidos con bromuro de etidio, la identificación de los fragmentos se hace por peso molecular.
Las pruebas de tipificación molecular son capaces, además de identificar al microorganismo, de tipificarlo y clasificarlo. En la prueba del Análisis del Polimorfismo de la Longitud de los Fragmentos de Restricción (PCR-RFLP), el DNA amplificado es cortado con diferentes enzimas de restricción y el patrón de los cortes se compara con un patrón conocido de un agente en particular, esta técnica ha sido muy utilizada para identificar las cepas variantes de los virus de Bronquitis Infecciosa e Infección de la bolsa de Fabricio. En la prueba de Análisis de DNA Polimorfo Ampliado al Azar (PCR-RAPD) el DNA es ampliado en pequeños fragmentos que también son separados por electroforesis para obtener un patrón de bandas que se compara con un patrón conocido; se utiliza para microorganismos con DNA más complejo, por ejemplo, para diferenciar M gallisepticum de M synoviae.
La secuenciación genética es la prueba más específica, En esta prueba el material genético es amplificado y posteriormente es analizado para identificar el orden de los nucleótidos que lo componen, utilizando nucleótidos marcados con fluoro cromos. Posteriormente estas secuencias son comparadas con secuencias conocidas del microorganismo para determinar qué grado de similitud genética existe entre ellos y así poder clasificar al microorganismo identificado; generalmente la comparación se hace con secuencias conocidas publicadas en Internet, como el banco de secuencias NCBI (National Center for Biothecnology Information).
Que permiten comparar la secuencia obtenida con secuencias de todo el mundo de manera rápida y sencilla (Figura 12). Para realizar estas comparaciones es necesario el uso de programas bio- informáticos que comparan y agrupan estas secuencias en función de sus similitudes. La forma gráfica más sencilla de representar las similitudes de todas las cepas comparadas es un árbol filogenético (Figura 13).
La secuenciación genética es la prueba más específica, En esta prueba el material genético es amplificado y posteriormente es analizado para identificar el orden de los nucleótidos que lo componen, utilizando nucleótidos marcados con fluoro cromos. Posteriormente estas secuencias son comparadas con secuencias conocidas del microorganismo para determinar qué grado de similitud genética existe entre ellos y así poder clasificar al microorganismo identificado; generalmente la comparación se hace con secuencias conocidas publicadas en Internet, como el banco de secuencias NCBI (National Center for Biothecnology Information).
Que permiten comparar la secuencia obtenida con secuencias de todo el mundo de manera rápida y sencilla (Figura 12). Para realizar estas comparaciones es necesario el uso de programas bio- informáticos que comparan y agrupan estas secuencias en función de sus similitudes. La forma gráfica más sencilla de representar las similitudes de todas las cepas comparadas es un árbol filogenético (Figura 13).
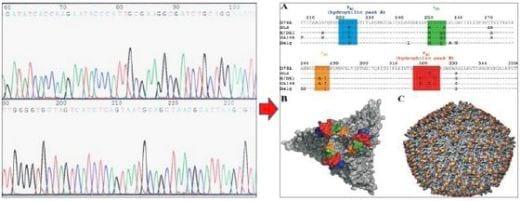
Figura 12: Secuenciación de la región hipervariable del gene de la Proteína VP-2 del Virus de la infección de la Bolsa de Fabricio para la clasificación de las cepas del virus
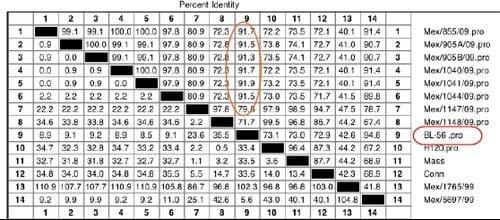
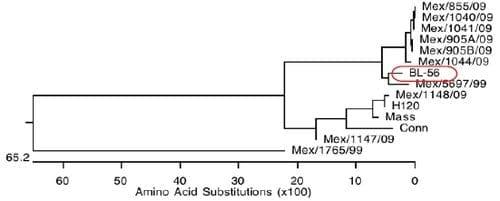
Figura 13: Relación filogenética de aislamientos del virus de Bronquitis Infecciosa por comparación de las secuencias del gene S-1
5. Pruebas de Bromatología y Análisis Químicos: un programa de Sanidad Avícola debe incluir el control de la calidad de los alimentos y de los ingredientes usados en su elaboración; este control también debe ser periódico y constante. Cada empresa deberá fijar sus propios parámetros de calidad que deberán ser respetados en la planta de alimentos (Figura 14).
Es importante la selección adecuada de las muestras para análisis, así como su volumen. Un muestreo representativo implica la colección de varias muestras en forma seriada; posteriormente todas las muestras son mezcladas y homogeneizadas y se colecta una sub muestra, pudiéndose repetir el proceso hasta reducir la muestra hasta un volumen adecuado para el análisis, que puede requerir de unos cuantos gramos de muestra final. El análisis bromatológico usualmente incluye los porcentajes de proteína cruda, grasa cruda, cenizas, humedad, elementos libres de nitrógeno, calcio, fósforo y sal y los resultados obtenidos en el análisis del alimento deben coincidir con los valores teóricos formulados para cada ración; las pruebas de mezclado se hacen con un componente de la ración de baja concentración, como cenizas, cloruros, fósforo o algún aditivo o medicamento, el coeficiente de variación en la concentración del componente deberá ser inferior al 10%. En el caso de los granos, se deben especificar sus características para ser utilizados, el porcentaje de humedad deberá ser menor al 14%, un peso específico de 0.76-0.78, el porcentaje de grano quebrado debe ser menor al 3% y el porcentaje de impurezas debe ser menor al 1%; además la muestra debe estar libre de contaminación con plaga viva y en el caso del sorgo, la cantidad de taninos debe ser menor a 0.6%.

Figura 14: Determinación de la concentración de proteína y del perfil de aminoácidos con el Sistema de Espectroscopia de Reflactancia del Infrarrojo Cercano (NIR).
6.- Pruebas de Toxicología: Los análisis toxicológicos se utilizan para garantizar la inocuidad de los ingredientes para la fabricación de alimentos, en los alimentos para las aves y en los productos avícolas destinados al consumo humano, particularmente carne de pollo y huevo. Existe una gran cantidad de análisis toxicológicos que pueden detectar concentraciones muy pequeñas de residuos tóxicos, del orden de picogramos o nanogramos, como las espectrometrías de masas, la espectrometría infrarroja y la espectrometría de absorción atómica, así como las cromatografías de gases y de líquidos de alta resolución. Con el uso de estas técnicas se obtiene mayor sensibilidad, mayor precisión y mayor repetitividad, para garantizar la inocuidad alimentaria y las exigencias del comercio internacional. Son especialmente importantes para la detección de micotoxinas, metales pesados, dioxinas, hormonales, beta agonistas y residuos de antibióticos, para que los productos agropecuarios puedan cumplir con las especificaciones descritas en el Codex Alimentarious para la comercialización internacional de los mismos.
Un factor de calidad importante es la concentración de micotoxinas y debido a que la concentración de las mismas puede ser muy variable dentro de un mismo lote, se requiere de un sistema de muestreo y mezclado de las muestras que garantice la representatividad de los resultados. Las técnicas actuales para el "monitoreo" de micotoxinas en granos y alimentos incluyen el uso de columnas de inmunoafinidad y fluorometría, ELISA y cromatografía en capa fina o cromatografía líquida de alta resolución (HPLC por sus siglas en inglés) (Figura 15). El establecimiento de los valores máximos permitidos para cada micotoxina es un asunto que aún es motivo de controversia y únicamente existe legislación oficial para aflatoxinas, por lo que también en este caso cada empresa, por medio de análisis constantes y secuenciales, deberá establecer sus propios parámetros de acuerdo a sus necesidades y posibilidades; para sorgo y maíz se han sugerido los siguientes valores como máximos permisibles en una muestra: 20 ppb de aflatoxina total, 100 ppb de ochratoxina total, 150 ppb de Toxina T-2, 500 ppb de Zearalenona, 1500 ppb de Vomitoxina (DON) y negativo a la presencia de esclerocios por flotación y de alcaloides de Ergotamina en prueba cualitativa.
Un factor de calidad importante es la concentración de micotoxinas y debido a que la concentración de las mismas puede ser muy variable dentro de un mismo lote, se requiere de un sistema de muestreo y mezclado de las muestras que garantice la representatividad de los resultados. Las técnicas actuales para el "monitoreo" de micotoxinas en granos y alimentos incluyen el uso de columnas de inmunoafinidad y fluorometría, ELISA y cromatografía en capa fina o cromatografía líquida de alta resolución (HPLC por sus siglas en inglés) (Figura 15). El establecimiento de los valores máximos permitidos para cada micotoxina es un asunto que aún es motivo de controversia y únicamente existe legislación oficial para aflatoxinas, por lo que también en este caso cada empresa, por medio de análisis constantes y secuenciales, deberá establecer sus propios parámetros de acuerdo a sus necesidades y posibilidades; para sorgo y maíz se han sugerido los siguientes valores como máximos permisibles en una muestra: 20 ppb de aflatoxina total, 100 ppb de ochratoxina total, 150 ppb de Toxina T-2, 500 ppb de Zearalenona, 1500 ppb de Vomitoxina (DON) y negativo a la presencia de esclerocios por flotación y de alcaloides de Ergotamina en prueba cualitativa.

Figura 15: Detección de aflatoxinas con la técnica de Cromatografía de Liquidos de Alta Resolución (HPLC)
SISTEMA DE ASEGURAMIENTO DE CALIDAD
Todos los laboratorios deben de contar con un Sistema de Aseguramiento de Calidad que constate la confiabilidad de los resultados, incluyendo Políticas de Calidad, Control de Calidad en insumos, equipos y procesos, uso de patrones de referencia y trazabilidad de los sistemas de medición y procedimientos de reconfirmación de resultados. Puede haber discrepancias entre los resultados obtenidos y los esperados, eventualmente pueden presentarse errores en los análisis.
El procedimiento de reconfirmación de resultados tiene cuatro pasos que pueden realizarse de manera secuencial o simultanea, y son los siguientes:
a) Repetición del análisis con la misma muestra y la misma técnica.
b) Realización del análisis con la misma muestra y con una técnica alternativa (confirmatoria)
c) Realización del análisis con la misma técnica y con muestras nuevas (usualmente se incrementa el número de muestras)
d) Realización del análisis con una técnica alternativa y con muestras nuevas (usualmente se incrementa el número de muestras).
No existe ninguna prueba que sea 100% infalible.
Los errores en un resultado pueden ser atribuidos a los procedimientos del análisis, a las características de la muestra o al sistema de muestreo utilizado. La mayoría de los investigadores coinciden en señalas que el procedimiento de muestreo es el factor más importante que afecta la confiabilidad de un resultado de laboratorio.
Un Resultado Falso Negativo, es decir, un resultado erróneamente negativo en una muestra positiva puede ser debido a los siguientes factores: La prueba usada tiene una sensibilidad baja; error en el tiempo de muestreo (un muestreo precoz o un muestreo tardío); muestra no representativa: número inadecuado de muestras, selección inadecuada de las muestras; concentración baja del agente en la muestra; inactivación del agente en la muestra.
Un Resultado Falso Positivo, es decir, un resultado erróneamente positivo en una muestra negativa puede ser debido a los siguientes factores: La prueba usada tiene una especificidad baja; contaminación cruzada de la muestra durante el muestreo; contaminación cruzada entre las muestras; contaminación de la muestra en el laboratorio; reacciones cruzadas por agentes similares; reacciones inespecíficas.
RECOMENDACIONES FINALES
- Use el Laboratorio de manera preestablecida, periódica y rutinaria Correlacione los resultados con los antecedentes sanitarios y epidemiológicos de la empresa; con el comportamiento clínico y productivo de las aves; con las medidas de bioseguridad, manejo, alimentación y nutrición utilizadas y con la calidad genética de las aves.
- Forme un banco de información de resultados y establezca los "parámetros normales o esperados" de acuerdo a las características de la explotación.
- Evalúe periódicamente los programas de Sanidad Avícola utilizados en su empresa.
- Use el Laboratorio cuando lo considere necesario.
- Seleccione, tome y conserve las muestras para análisis de acuerdo a las recomendaciones de su Laboratorio.
BIBLIOGRAFIA RECOMENDADA
1) - A Laboratory Manual for the Isolation and Identification of Avian Pathogens, Fourth Edition, 1998. Edited by D. Swaine, J. Glisson, M. Jackwood, J. Pearson and W. Reed. Published by The American Association of Avian Pathologist, University of Pennsylvania, USA.
2) - Avian Histopathology, Third Edition, 2008. Edited by O. Fletcher. Published by the American Association of Avian Pathologist, University of Pennsylvania, USA,
3)- Diseases of Poultry, eleventh edition 2003, editor in Chief Y.M. Saif, Iowa State Press, USA
4) - Grain Inspection Handbook. U. S. Department of Agriculture. Grain Inspection, Packers and Stockyards Administration. Federal Grain Inspection Service, 1997.
5) - Long, P., B. Millard, L. Joyner and C. Norton: A guide to laboratory techniques used in the study and diagnosis of avian coccidiosis. Folia Veterinaria. Latina VI: 200-217, 1976 6) - Manual de Procedimientos Técnicos de Laboratorio, 5° Edición 2007. Editado por MVZ J.C. Valladares, 2007, Laboratorio de Control de Calidad y Patología Aviar, PAPSA, 7) - NCCLS. Performance Standars for Antimicrobial disk and Dilution Susceptibility Test for Bacteria Isolated from Animals; Approved Standard. NCCLS Document M31A (ISBN 1-56238-37739), 1999. NCCLS, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087 USA.
8). NOM-003-ZOO-1994. Criterios para la operación de laboratorio de pruebas aprobado en materia zoosanitaria.
9)- NOM-056-ZOO-1995, Especificaciones técnicas para las pruebas diagnósticas que realicen los laboratorios de pruebas aprobados en materia zoosanitaria.
10) - Officials Methods of Analysis of A.O.A.C. International, 17ª Ed.2002. Edited by Dr. William Horwitz. AOAC International, USA
11) - OIE Manual of Diagnostic Test and and vaccines of terrestrial Animals 5TH Edition, 2004
12)- Tejada, I.: Control de Calidad y análisis de alimentos para animales, Ed. Trillas. México, 1992.
13) - United States Pharmacopeia, the National Formulary, USP 27 NF22, 2004 the United States Pharmacopeial Convention, Inc, USA
PRESENTADO EN EL CURSO DE INTEGRACION DEL DIAGNOSTICO EN LA INDUSTRIA AVICOLA Y CURSO DE PATOLOGIA COMPARADA DE AVES COMERCIALES Y ESPECIES NO CONVENCIONALES DE LA ASOCIACION NACIONAL DE ESPECIALISTAS EN CIENCIAS AVICOLAS DE MEXICO (ANECA) EL 02-02-2009
Temas relacionados
Autores:
Únete para poder comentar.
Una vez que te unas a Engormix, podrás participar en todos los contenidos y foros.
* Dato obligatorio
¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
Crear una publicaciónUniversidad Nacional de Lujan
14 de julio de 2018
No son muchos los elementos requeridos para realizar un buen diagnóstico de laboratorio. Creo que el personal bien capacitado es fundamental, refiriendome con esto no sólo a la capacidad técnica para realizar el análisis sino a la interpretación de los resultados y su utilidad en el campo. somos veterinarios y no magos o adivinos, y mediante la confirmación del diagnóstico mediante herramientas de laboratorio se pueden elaborar medidas preventivas.
Hipra
21 de julio de 2011
Muchas gracias por su articulo, me parece muy interesante, y me gustaría preguntar a usted y a los compañeros foristas, desde el punto de vista practico, para hacer un análisis de Síndrome de Baja Postura (EDS) ¿Cuál es su recomendación para elegir la mejor prueba de laboratorio y por qué?
Apreciaría mucho sus comentarios. Gracias
Grupo Melo
23 de junio de 2010
Excelente articulo, bastante detallado de lo importante que es el Laboratorio de diagnóstico para Confirmar o detectar algún problema de salud sanitaria en las aves.
Mis sinceras felicitaciones, y se que muchos que lean este articulo aprenderan algo nuevo y de utilidad de él.
Asociación Ecuatoriana de Bienestar Animal
22 de junio de 2010
Felicitaciones por el articulo, tengo casi 15 años de experiencia en Laboratorio de Diagnóstico de Patología Aviar en la empresa privada y considero que ha hecho una muy buena explicación de la importancia de nuestro trabajo para la industria avícola, le agradezco su contribución al respecto.
Slds. cordiales,
22 de junio de 2010
Juan Carlos
te felicito por el articulo y por hacer notar la importancia del uso del laboratorio de diagnostico en nuestra profesion, esta manera de trabajar demuestra el profesionalismo y la etica de un buen MVZ, debemos usar todas las herramientas disponibles para diagnosticar y tomar las desiciones necesarias para prevenir, erradicar o evitar la propagacion de las enfermedadez infecciosas o virus dentro del sector agricola de produccion animal
20 de julio de 2018
para hacer un diagnostico de laboratorio se tiene que tener la experiencia y el conocimiento para poder interpretar los resultados de los análisis realizados y poder aplicarlos en la salud de los animales
Laboratorio Veterinario del Sur LABVETSUR
15 de julio de 2018
Efectivamente en la medicina de la producción, referida a poblaciones, los diagnósticos de laboratorio, son esenciales para el mantenimiento de la salud animal, sobretodo en los casos su clínicos que significan menos pérdidas económicas
Laboratorio Veterinario del Sur LABVETSUR
13 de julio de 2018
Muy buen artículo y me gustaría saber sobre la importancia de la observación de oocistos en la mucosa del duodeno, yeyuno, ileon y ciegos.
2 de septiembre de 2016
Muy buen análisis de la importancia de mantener un sitema de gestion de calidad en un laboratorio y de la importancia de esta herramienta para un diagnótico preciso de las enfermedades, no solo en ave, ino en todos los ambitos productivos y de salud pública.
Felicitaciones
8 de julio de 2015
Hola, soy bioanalista y tengo el deseo de abrir mi laboratorio de aves en la República Dominicana, si hay alguien que me pueda enviar información de los requerimientos básicos para el diagnóstico aviar les agradezco su colaboración nanave28@hotmail.com es mi mail