Introducción
El momento de la eclosión se caracteriza por una serie de sucesos fisiológicos como la maduración del tracto gastrointestinal (crecimiento físico y funcional debido al aumento de las vellosidades, polarización de los enterocitos y actividad enzimática) y desarrollo del sistema inmune (maduración de órganos linfóides primarios y secundarios, establecimiento de la inmunidad pasiva) (Willemsen et al., 2010).
Las prácticas de manejo adoptadas por la industria avícola durante la fase inicial de la vida del ave pueden representar desafíos adicionales para el desarrollo del pollo de engorde. Factores como la genética, la edad de las reproductoras, las condiciones nutricionales, el tamaño y el peso del huevo, y la demora en el acceso a agua y alimento afectan directamente el desarrollo inicial y pueden tener consecuencias sobre el rendimiento final. Dentro de una misma incubadora pueden existir pollos con diferencias en el tiempo de eclosión de 36 a 48 horas, lo que forma la ventana de nacimiento (Vieira et al., 2005). Después de la apertura estándar de las máquinas, factores operativos de la planta como sexado, vacunación y/o transporte a las granjas pueden aumentar el tiempo de ayuno y causar mermas del peso del pollo de hasta 10% (Cançado y Baião, 2002). Los animales sometidos a ayuno pueden caer en deshidratación, cetosis, daños en la mucosa intestinal, apoptosis celular y daños en la musculatura pectoral (Yamauchi et al., 1996), mal aprovechamiento de la yema (Maiorka et al., 2006) y retraso en el desarrollo del sistema inmune (Friedman et al., 2003) además de inmunosupresión por estrés (Handy et al., 1991). A pesar de que en la literatura existe vasta información sobre los efectos del ayuno posteclosión sobre el desarrollo de la aves, existen pocos trabajos sobre lo que les sucede a los animales que nacen precozmente y permanecen dentro de la nacedora.
El objetivo del presente trabajo fue evaluar la presencia de células CD3+ en el tejido linfoide de los animales procedentes de huevos de dos pesos distintos, con eclosión a diferentes tiempos dentro de una misma incubadora.
Material y Métodos
Se incubaron 1,152 huevos de reproductoras Cobb® de 38 semanas de edad. Antes de la incubación estos huevos se almacenaron por 2 días a 15°C y 75% de humedad relativa, se pesaron y se calculó la media y la desviación estándar (65.4 ± 4.6 g), para luego clasificarlos como livianos y pesados. Después de este proceso, todos los huevos se identificaron y se incubaron a temperatura y humedad controlada (37.8°C y 60%, respectivamente) en incubadoras Casp CMg 125R® hasta el día 19. Durante la transferencia a la nacedora se intercalaron aleatoriamente grupos de 5 huevos livianos y pesados en compartimientos específicos de las bandejas experimentales, de manera uniforme y aleatoria.
Los pollos se distribuyeron bajo un diseño experimental factorial 2 x 3, con 2 pesos del huevos (livianos y pesados) y 3 períodos de eclosión (antes de las 472 horas de incubación; entre 472 y 488 horas; y entre 488 y 504 horas de incubación), que se denominaron pollos sometidos a más de 32 horas de permanencia en la nacedora después de la eclosión (ventana de nacimiento [VN] de +32 h), entre 32 y 16 h de permanencia en la nacedora posteclosión (32 h VN) y entre 16 y 0 horas de permanencia en la nacedora posteclosión (16 h VN).
En cada período de eclosión, la nacedora se abrió y se identificaron 20 pollos nacidos en cada período y de cada peso, dejándolos en la máquina hasta el momento estipulado para la cosecha, de acuerdo con el procedimiento estándar de la planta de incubación.
En el momento estándar de cosecha, los animales se sacrificaron y se realizó la necropsia de inmediato. Se tomaron muestras de timo y bazo para someterlas a inmunohistoquímica con el fin de contar las células CD3+. Se analizaron 20 campos de timo y bazo (aumento de 100X). Los resultados se sometieron a análisis de varianza y, cuando existieron diferencias (P<0.05) los factores se desglosaron y las medias se compararon bajo la prueba de Tukey al nivel de 5 % de probabilidad de error.
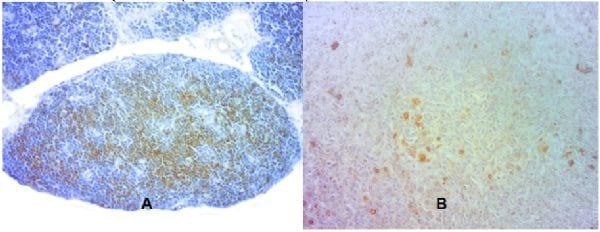
Figura 1. Microfotografía de timo (A) y bazo (B) para la identificación de células CD3+ por inmunohistoquímica (aumento: 40X).
Resultados y Discusión
El conteo de células CD3+ en el timo tuvo influencia sobre el factor ventana de nacimiento (P<0.05) pues se observó que a mayor período de permanencia en la nacedora después de la eclosión (+ 32 h VN), menor fue el número de estas células en dichos órganos. En el bazo, con respecto al conteo de células CD3+ se observó interacción entre los dos factores (P<0.05) (Cuadros 1 y 2).
Cuadro 1. Media y desviación estándar del número de células CD3+ por inmunohistoquímica en timo (100X) y bazo (100X) en aves sometidas a 3 ventanas de nacimiento, procedentes huevos de 2 pesos distintos, en el tiempo estándar de cosecha
a-b: Las medias (columnas) seguidas de letras distintas son estadísticamente diferentes (P<0.05).
Cuadro 2. Interacción de las ventanas de nacimiento (+ 32, 32 y 16 h VN) y pesos del huevo (livianos y pesados) sobre el número de células CD3+ en el bazo, al momento estándar de la cosecha
A-B: comparación entre las mismas ventanas de nacimiento; a-b: comparación dentro de cada peso. Las medias seguidas de letras distintas son estadísticamente diferentes (P<0.05) para los factores período y peso del huevo.
Los órganos linfoides primarios, como el timo y la bolsa de Fabricio, comienzan a desarrollarse en la etapa embrionaria. El timo, lugar de desarrollo y maduración de las células T, tiene sus propias células marcadoras CD3, CD4 y CD8 durante la fase embrionaria (Mast y Goddeeris, 1999). Después de la eclosión se presentan ondas de migración de estas células hacia los órganos linfoides secundarios, como el bazo, que está todavía inmaduro al memento de la eclosión. Este transporte del timo a otros órganos puede justificar los hallazgos de este estudio, pues se observó una reducción en la presencia de células CD3+ en el timo de las aves con mayor tiempo de permanencia en la nacedora después del nacimiento.
Al estudiar esta línea de población del organismo con células CD3+, Mast y Goddeeris (1999) explicaron que el bazo proporciona un microambiente de interacción entre células linfoides y no linfoides y es responsable principalmente de almacenar y transportar linfocitos a la circulación y a los tejidos. En el presente trabajo se observó interacción entre el peso de los huevos y el período de permanencia en la nacedora después de la eclosión sobre la población de células CD3+ en el bazo. Los animales procedentes de huevos livianos, que permanecieron más de 32 horas en la nacedora después de la eclosión, presentaron mayor proporción de células CD3+ en el bazo, en comparación con los pollos procedentes de huevos pesados, que permanecieron ya nacidos por el mismo período en la nacedora. Podemos sugerir que los animales de huevos pesados nacidos precozmente transportan más células CD3+ del bazo a otros tejidos que los livianos. Los animales que nacieron en el período de 32 a 16 horas antes del momento estándar de cosecha (32 h VN) no presentaron diferencia en la cantidad de células CD3+ en el bazo con relación al peso de los huevos, demostrando que tal vez en este período no existan diferencias en el transporte de estas células a otros tejidos entre los pollos procedentes de huevos livianos o pesados. En los animales que nacieron cerca del momento de la cosecha (16 h VN) se observó que los pollos procedentes de huevos livianos presentaron una mayor cantidad de células CD3+ que los de huevos pesados, lo que una vez más sugiere mayor eficiencia en el transporte de estas células del bazo a otros tejidos.
Según Handy et al. (1991) las aves que permanecieron por un tiempo superior a 12 horas en la nacedora después de la eclosión, están de por sí sujetas a procesos de estrés a causa de la mayor producción de calor corporal y la temperatura excesiva de la incubadora, respondiendo con una mayor liberación fisiológica de corticosterona. La permanecia prolongada de esta hormona puede causar atrofia del tejido linfoide en timo, bolsa de Fabricio y bazo, por apoptosis, así como supresión de la respuesta inmune celular (Rogausch et al., 1999). Sin embargo, la evaluación microscópica de los tejidos de timo y bazo de las aves de este experimento, no mostró evidencia de apoptosis, lo que no impide que este fenómeno podría ser observado en períodos superiores a los aquí estudiados.
Conclusión
Las aves que nacen precozmente y que permanecen más tiempo en la nacedora muestran menor presencia de células CD3+ en timo y bazo.
El ayuno en la máquina nacedora parece no afectar negativamente el desarrollo de los órganos evaluados; sin embargo, es necesario continuar estudiando el desarrollo tisular de animales nacidos en diferentes períodos y sometidos a diferentes condiciones antes y después del nacimiento, como situaciones de estrés, temperaturas inadecuadas, ayuno y desafíos de campo.
Bibliografía
Cançado SV & Baião NC. 2002. Effects of fasting period between hatching and housing andaddition of oil to the feed on performance of broiler chicks and digestibility of the ration.Arquivo Brasileiro de Medicina Veterinária e Zootecnia 54:630-635.
Friedman A, Bar-Shira E, Sklan D. 2003. Ontogeny of gut associated immune competence in the chick. World's Poultry Science Journal 59:209-219.
Handy AMM, Henken AM, Vander Hel W. 1991. Effects of incubation humidity and hatching time on heat tolerance of neonatal chicks. Growth performance after heat exposure. Poultry Science 70:1507-1515.
Maiorka A, Dahlke F, Morgulis MSFA. 2006. Adaptações pós-eclosão em frangos. Ciência Rural 36:701-708.
Mast J & Goddeeris BM. 1999. Development of immunocompetence of broiler chickens. Veterinary Immunology and Immunopathology 70:245-256.
Rogausch H, del Rey A, Oertel J, Besedovsky HO. 1999. Norepinephrine stimulates lymphoid cell mobilization from the perfused rat spleen via-b-adrenergic receptors. American Journal of Physiology 276:R724-R730.
Vieira SL, Almeida JG, Lima AR, Conde ORA, Olmos AR. 2005. Hatching distribution of eggs varying in weight and breeder age. Brazilian Journal of Poultry Science 7:73-78
Willemsen H, Debonne M, Swennen N, Everaert N, Careghi C, Han H, Bruggeman V, Tona K, Decuypere E. 2010. Delay in feed access and spread of hatch: importance of early nutrition. World's Poultry Science Journal 66:177-188.
Yamauchi K, Kamisoyama H, Isshiki Y. 1996. Effects of fasting and refeeding on structures of the intestinal villi and epithelial cells in White Leghorn hens. British Poultry Science 37:909-921.