El uso de inoculantes biológicos incorporados como tratamientos de semilla con microorganimos promotores del crecimiento vegetal tales como Pseudomonas sp. Azospirillum sp., Micorrizas u otros muestra un creciente interés no sólo en estudios de investigación sino también en evaluaciones extensivas y en usos comerciales en diferentes cultivos. Efectos como una más rápida implantación, mayor crecimiento de raíces, tolerancia mejorada a patógenos, fijación biológica no simbiótica de nitrógeno y solubilización de nutrientes son habitualmente reportados en estas experiencias (Caballero Mellado et al. 1992).
Dado el crecimiento en los costos de producción, las mejoras derivadas de una mayor eficiencia de uso de los nutrientes y otros recursos a partir de los aportes de estos tratamientos biológicos serían de relevancia (Ferraris et al., 2008).
El objetivo de este artículo es realizar una revisión sobre la información generada sobre los efectos de los principales microorganismos considerados como PGPM (microorganismos promotores del crecimiento vegetal) en cultivos de gramíneas, y evaluar su interacción con las prácticas agronómicas utilizada bajo un criterio de agricultura sustentable en la Región Pampeana Argentina.
Azospirillum spp
El Azospirillum es por lejos el PGPM más estudiado en gramíneas, reportándose las primeras experiencias hace más de treinta años (Döbereiner et al. 1977). En la actualidad, se han identificado 12 especies de Azospirillum spp, aunque en la producción de inoculantes comerciales se han utilizado A. brasilense y A lipoferum,siendo la primera la más común a nivel mundial, y la preferida en Argentina (Puente y Perticari, 2006).
Algunos antecedentes muestran efectos en la fijación libre del nitrógeno atmosférico, la producción y liberación de hormonas promotoras del crecimiento radical (ej. auxinas, giberelinas, citoquininas), y de enzimas tales como las pectinolíticas, distorsionando la funcionalidad de células de las raíces y el aumento en la producción de exudados (Okon y Labandera-González, 1994). Asimismo, de manera indirecta, la inoculación con Azospirillum spp podría promover la proliferación y establecimiento en la rizósfera de otros microorganismos favorables para el cultivo (Russo et al. 2005).
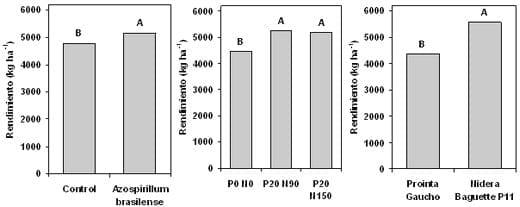
El Área de Desarrollo Rural de INTA Pergamino realizó entre 2003 y 2007 18 ensayos bajo condiciones habituales de producción, utilizando inoculantes de diferentes marcas comerciales. Como resultado, se obtuvieron diferencias significativas en ocho experimentos P<0,10. La respuesta media alcanzó a 283 kg ha-1, representando un 6,4 % de incremento. Si bien no se pudo establecer una función que relacione la respuesta a la inoculación con Azospirillum y las variables de suelo o cultivo evaluadas, un análisis a través de un gráfico biplot nos permite definir marcadas tendencias (Figura 1). El eje horizontal (1) discrimina variables de suelo, clima y los rendimientos. El eje vertical (2) por su parte, discrimina la respuesta a la práctica (abajo) de las precipitaciones (arriba). Por otra parte, los puntos azules representan cada uno de los dieciocho experimentos, y los vectores a las variables analizadas. Los vectores orientados en un mismo sentido indican parámentos asociados de manera positiva, siendo la correlación mas fuerte cuanto más cerrado sea el ángulo entre ambos vectores. En cambio, los orientados en sentido contrario indican una asociación fuerte pero inversa. Cuando dos vectores forman un ángulo recto, las variables que representan no están asociadas. De esta manera, se observa que la respuesta absoluta expresada en kg ha-1 (Rta kg/ha), se relacionó en forma estrecha e inversa con las lluvias totales y las ocurridas entre octubre y noviembre, más que con ninguna variable. El incremento de respuesta asociado a menores precipitaciones se basa en la ventaja competitiva para la adquisición de agua y nutrientes que tendrían los tratamientos inoculados, otorgada por un mayor crecimiento aéreo y radicular inicial temprano. Por otra parte, en este grupo de ensayos no se observó relación alguna entre respuesta y el contenido de materia orgánica (MO), N (kg h/ha) o P (P) en suelo (Figura 1) o los niveles de nitrógeno (N) y fósforo (P) agregados por fertilización, evidenciando un comportamiento aditivo ante diferentes condiciones de cultivo. En la mayoría de estos experimentos, la respuesta fue similar bajo diferentes niveles tecnológicos, dosis de fertilizante o genotipo (Díaz Zorita et al., 2004; Díaz Zorita y Fernández Caniggia, 2008, Ferraris et al., 2008) (Figura 2).
Tabla 1:Descripción de un grupo de ensayos de respuesta a Azospirillum spp en Trigo, en el centro-norte de Buenos Aires y Sur de Santa Fe entre los años 2003 y 2007. En la primer columna se expresa la localidad de ensayo: Bo (Bolivar), Ln (Lincoln), SA (San Antonio de Areco), Pe (Pergamino), Arr (Arrecifes) y Ww (Wheelwright).
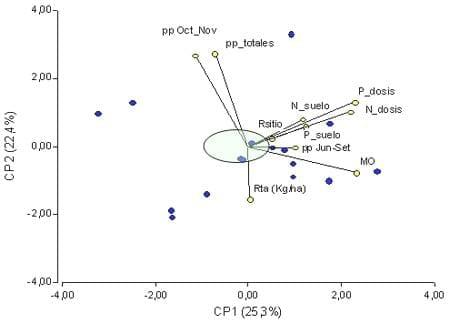
Figura 1: Respuesta absoluta a la inoculación con Pseudomonas fluorescens (Rta kg/ha) y su asociación negativa con las precipitaciones durante el período junio-noviembre y octubre-noviembre
Figura 2: Producción media de trigo según tratamientos de semillas con Azospirillum brasilense, estrategias de fertilización NP y genotipos en Pergamino. En cada figura, letras distintas sobre las columnas muestran diferencias significativas (p<0,05).Tomado de Ferraris et al., 2008
Pseudomonas spp
Las Pseudomonas son otro amplio género bacteriano, en el cual se encuentran especies con potencialidad para ser considerados PGPM. Han sido utilizadas con fines agronómicos en nuestro país P. fluorescens y P. chlororaphis, en ese orden de importancia.Los efectos atribuidos a este grupo bacteriano pueden resumirse en una acción de biocontrol, la secreción de sustancias inductoras y la solubilización de nutrientes.
La capacidad de ser agentes de biocontrol (Haas & Défago, 2005), se produce a través de la secreción de antibióticos (i.e. pirrolnitrina, pioluteorina), la inducción de resistencia sistémica en la planta y el agotamiento de elementos esenciales para el crecimiento de hongos y bacterias patogénicas, producida por la liberación al medio de pigmentos fluorescentes que actúan como agentes quelantes, cuando estos elementos se tornan escasos en la rizósfera.
El control biológico no es sólo dependiente de las capacidades bacterianas, sino también de la especie vegetal y la práctica de cultivo. En trigo, se ha estudiado el efecto de decaimiento del pietín ("take-all decline") por monocultivo, descripto exhaustivamente por grupos del USDA (Cook, 2007). A lo largo de décadas de estudio de las poblaciones de Pseudomonas asociadas a lotes de trigo, se ha establecido una firme correlación entre la supresión del pietín y la preponderancia de poblaciones de Pseudomonas productoras de los antibióticos diacetilfloroglucinol y fenazinas (Cook, 2007). En nuestro país, todavía no disponemos de datos sobre el efecto del cultivo y de las rotaciones sobre las poblaciones de Pseudomonas y su posible correlación con la incidencia de enfermedades.
Otro de los efectos favorables residiría en la producción de fitohormonas como auxinas y giberelinas, a la vez que se reducirías niveles de etileno producido ante situaciones de estrés moderado, especialmente estrés hídrico.
Por último a las Pseudomonas se les atribuye la capacidad de producir enzimas fosfatasas, ácidos orgánicos (i.e. acido glucónico, cítrico) e inorgánicos (i.e. ácido sulfhídrico, nítrico, carbónico) que por medio de la rotura de enlaces y la acidificación del medio, incrementarían la recuperación del fósforo nativo del suelo y la adquisición del aportado por fertilización.
Ensayos pioneros realizados con Pseudomonas en las localidades de Pergamino y Chivilcoy durante los años 2000, 2001 y 2002, mostraron incrementos medios de rendimiento de 310 kg ha-1 (García y Bach, 2003). En este grupo de seis ensayos, los resultados más consistentes se observaron cuando la inoculación fue acompañada de una adecuada fertilización con N y P. En el mismo sentido, en un grupo de 11 experimento realizados durante 6 campañas agrícolas en el centro-norte de Buenos Aires y Sur de Santa Fe, se cuantificó una respuesta media a la práctica de inoculación con Pseudomonas de 294 kg ha-1, lo cual representa un incremento de 8,4 % (Figura 3). Cada uno de estos sitios representa a su vez, el promedio de diferentes estrategias de fertilización, con o sin agregado de NP. En estos ensayos, como promedio, la eficiencia de uso de N (EUN) pasó de 47 a 51 kg trigo/ kgN y la EUP de 181 a 195 kg trigo/ kgP, para tratamientos testigo e inoculado, respectivamente.
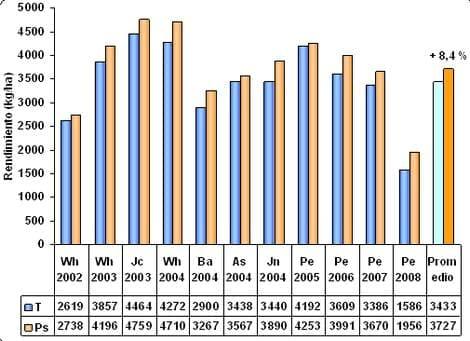
Figura 3: Rendimiento (kg ha-1) de tratamientos testigo e inoculados con Pseudomonas fluorescens en trigo entre los años 2002 y 2007 en el centro-norte de Buenos Aires y sur de Santa Fe. Las abreviaturas representan localidades Wh (Wheelwright, Santa Fe), Jc (Juncal, Santa Fe), Ba (Baigorrita, Buenos Aires), As (Ascensión, Buenos Aires), Jn (Junín, Buenos Aires), Pe (Pergamino, Buenos Aires) y el promedio de todas las localidades (Prom).
La asociación entre respuesta agronómica y variables de suelo y cultivo muestra condimentos interesantes (Figura 4) Así, en el eje 1 (horizontal) se observa que la respuesta relativa (%) se asocia de manera positiva a los rendimientos y la dosis de fertilizante fosforado, y negativamente con parámetros químicos de suelo como el nivel de P (Bray I), nitratos y MO. En el eje vertical se visualiza una relación directa entre respuesta y dosis de N aplicado, e inversa con las lluvias durante el ciclo. Considerando estos resultados, la respuesta a la inoculación con Pseudomonas spp sería más probable en ambientes empobrecidos, con bajo nivel de P y otros nutrientes, pero que comienzan a ser mejorados por buenas prácticas de cultivo y adecuada fertilización. Condiciones de estrés hídrico acentuarían estos efectos.
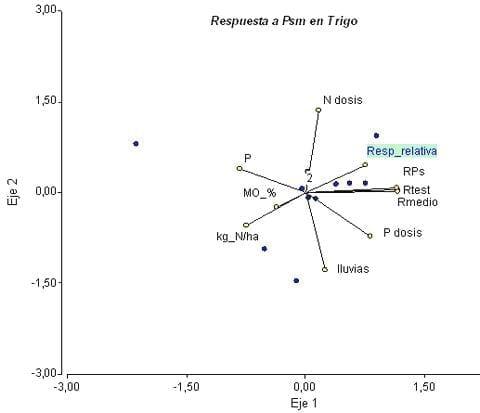
Figura 4: Respuesta relativa (%) a la inoculación con Pseudomonas fluorescens en trigo y su asociación positiva con los rendimientos del sitio (Rmedio), y negativa con las lluvias junio-noviembre (lluvias) y la fertilidad inicial del suelo (kg N/ha, P, MO%).
Micorrizas:
Las micorrizas son hongos ampliamente distribuídos en el suelo, capaces de establecer asociaciones mutualistas con los vegetales. En la naturaleza, el 95 % de las plantas las poseen (Trappe, 1977). Desde hace tiempo se conoce su efecto favorable en especies perennes y forestales, pero últimamente se ha indagado su utilidad en cultivos anuales.
Se reconoce de las Micorrizas su capacidad para mejorar la estructura del suelo gracias al crecimiento del micelio y la secreción de glomalinas (Faggioli et al., 2008). Asimismo, actuan como una prologación del sistema radicular (Peterson et al, 2004)(Figura 5), facilitando la adquisición de agua y nutrientes de baja movilidad como potasio (K), zinc (Zn) y especialmente P. Al incrementar el flujo de P a la raíz, de manera indirecta se mejoran otros procesos fisiológicos en que participa este nutriente. Por su menor diámetro, las micorrizas tienen mayor superficie de absorción que las raíces del vegetal. Si bien utilizan P bajo las mismas formas que las plantas, tienen mayor afinidad por P y una concentración crítica en solución más baja para lograr su absorción (García et al., 2006).
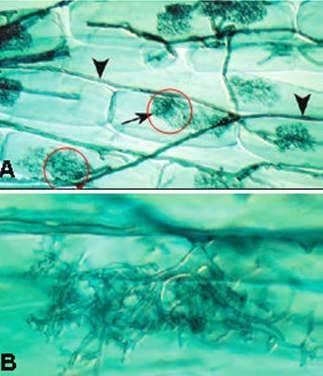
Figura 5: Proliferación de Micorrizas en células radiculares (Tomado de Peterson et al., 2004)
La proliferación e importancia agronómica de las micorrizas es más relevante en suelos deficientes de P (Covasevich et al., 1995). Ante situaciones de carencia, contribuyen con la síntesis de proteínas de estrés en planta. El estrés conduce a la expresión diferencial de la información genética, produciendo cambios en la síntesis de nuevas proteínas, llamadas micorrizinas, las cuales posiblemente dotan a las plantas con la capacidad de adaptación al estrés. La respuesta agronómica en rendimiento podría estar asociada a suelos con baja disponibilidad de P, pero no se ha visto afectada por la dosis de fertilizante agregado (Ferraris y Couretot, 2008).
Las Micorrizas necesitan oxígeno para vivir, por ello las poblaciones son muy bajas en suelos de drenaje pobre y anegables. También en suelos salinos y/o sódicos (Abbot y Robson, 1991). En cambio un suelo poroso y bien estructurado las favorece. Cultivos de cobertura aumentan mucho la micorrización, lo mismo que la siembra de maíz y sorgo, que tienen alta dependencia micorrítica e incrementan su población (Faggioli et al., 2008). Las labranzas rompen el entramado de micelios del hongo, destruyendo el efecto benéfico sobre la estructura del suelo (Schalamuk et al., 2006). Dosis medias de fertilizante no afectan a las micorrizas, al igual que insecticidas y herbicidas, a dosis normales, (Coyne, 1999). Se ha mencionado que los funguicidas aplicados sobre semilla pueden ser muy tóxicos para las micorrizas. En Argentina se han difundido inoculantes comerciales con micorrizas en su formulación. Algunas variantes tecnológicas de utilización están siendo estudiadas (Figura 6).
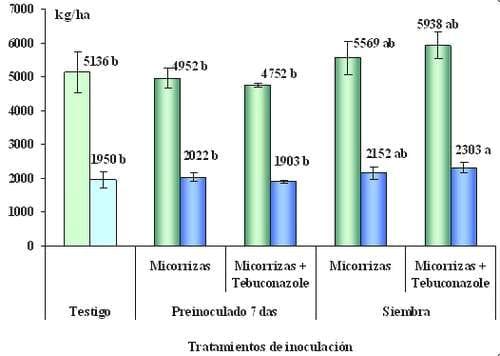
Figura 6:Materia seca a cosecha y rendimiento de grano de parcelas testigo o inoculadas con micorrizas. Se evalúan momentos de inoculación y el uso conjunto de fungicidas curasemillas. Pergamino, año 2008.
Bibliografía citada
Abbot L.K y A.D. Robson. 1991. Factors influencing the occurrence of vesicular-arbuscular mycorrhizas. Agriculture Ecosystems and Environment. 35:121-150.
Caballero-Mellado, J., M.G. Carcano-Montiel, M.A. Mascarua-Esparza. 1992. Field inoculation of wheat (Triticum aestivum) with Azospirillum brasilense under temperate climate. Symbiosis, 13: 243-253.
Covasevic, F., H. Echeverría y Y. Andreoli. 1995. Micorriación vesículo-arbuscular espontánea en trigo en función de la disponibilidad de fósforo. Ciencia del Suelo 13:47-51.
Cook, R.J. 2007. Tell me again what it is that you do. Annual Reviews of Phytopathology, 45:1-23.
Coyne M. 1999. Soil Microbiology: An exploratory approach. Delmar Publishers. 462 pag.
Díaz-Zorita, M., M.V. Fernádez-Canigia. 2008. Field performance of a liquid formulationof Azospirillum brasilense on dryland wheat productivity, Eur. J. Soil Biol. doi:10.1016/j.ejsobi.2008.07.001
Díaz-Zorita, M., R.M. Baliña, M.V. Fernández-Canigia, A. Perticari. 2004. Field inoculation of wheat (Triticum aestivum L.) and corn (Zea mays L.) with Azospirillum brasilense in the Pampas region, Argentina. RELAR, Rio de Janeiro (Brasil).
Döbereiner, J., I. Marriel and M. Nery. 1976. Ecological distribution of Spirillum lipoferum Beijerinck. Can J Microbiol 22: 1464-1473.
García, F.O.; L.I. Picone y A. Berardo. 2006. Fósforo. Pág. 99-121. En: H.E.Echeverría y F.O. García (eds.) Fertilidad de Suelos y Fertilización de cultivos.Editorial INTA, Buenos Aires, Argentina. 521p.
Faggioli, V., G. Freytes y C. Galarza. 2008. Las micorrizas en trigo y su relación con la absorción de fósforo del suelo. Publicacción Tecnica INTA EEA Marcos Juárez. Disponible on line http://www.inta.gov.ar/MJUAREZ/info/documentos/Suelos/trigo_ micorrizas08.pdf
Ferraris, G. y L. Couretot. 2008. Evaluación de la inoculación con Micorrizas bajo diferentes ambientes de fertilidad. pp 48-52. En: Trigo. Resultados de Unidades Demostrativas. Proyecto Regional Agrícola.
Ferraris, G., L.. Couretot y M. Díaz Zorita. 2008. Respuesta de trigo a tratamientos con Azospirillum sp. según niveles tecnológicos. CD Rom. VII Congreso Nacional de Trigo.V Simposio Invernal de Cereales de siembra Otoño -Invernal.I Encuentro del Mercosur.
García, R. y T. Bach. 2003. Efecto de la inoculación con Pseudomonas sobre el rendimiento de trigo. Informe técnico 324, INTA - INSTITUTO NACIONAL DE TECNOLOGÍA AGROPECUARIA. Centro Regional Buenos Aires Norte Estación Experimental Agropecuaria Pergamino. 19 pp.
Haas D, Défago G. Biological control of soil-borne pathogens by fluorescent pseudomonads. Nat Rev Microbiol. 2005 Apr;3(4):307-19. Review.
Okon Y. and C. Labandera-Gonzalez. 1994. Agronomic applications of Azospirillum: An evaluation of 20 years worlwide field inoculation. Soil Biol. Biochem. Vol 26 (12):1591-1601.
Peterson R.L., H.B. Massicotte y L.H. Melville . 2004. Arbuscular mycorrhizas. En: Mycorrhizas: Anatomy and Cell Biology. NRC-CNRC. Research Press.Otawa. Canada. Chap.3: 57-79
Puente, M. y A. Perticari. 2006. Inoculación de trigo con Azospirillum. Trigo en Siembra Directa. 97-99. Revista Técnica de la Asociación Argentina de Productores en Siembra Directa, AAPRESID.
Russo A, Felici C, Toffanin A, Götz M, Collados C, Barea JM, Moënne-Loccoz Y, Smalla K, Vanderleyden J, Nuti M (2005) Effect of Azospirillum inoculants on arbuscular mycorrhiza establishment in wheat and maize plants. Biol Fertil Soils 41:301-309
TRAPPE, J. M. (1977). Selection of fungi for ectomycorrhizal inoculation in nurseries. Ann. Rev. Phytopathol., 15: 203-222.
Schalamuk S, S. Velásquez, H. Chidichimo y M. Cabello. 2006. Fungal spore diversity of arbuscular mycorrhizal fungi associated with spring wheat: effects of tillage. Mycologia 1: 22-28.