¿Cómo ajustamos la dosis de nitrógeno durante el ciclo del trigo?
Publicado: 4 de octubre de 2013
Por: Nahuel Reussi Calvo, Hernan Sainz Rozas, Hernán Eduardo Echeverria, Angel Berardo y N. Diovisalvi. Laboratorio de suelos FERTILAB y la Unidad Integrada Balcarce (INTA). Argentina
INTRODUCCIÓN
La metodología más difundida para el diagnóstico de nitrógeno (N) se basa principalmente en la determinación del contenido de N de nitratos (N-NO3 -) en el suelo (0-60 cm) al momento de la siembra (Calviño et al., 2002; Barbieri et al., 2012). Para su empleo, se han propuestos distintos umbrales de disponibilidad de N (suelo+fertilizante), los cuales varían según la zona, sistema de labranza y el rendimiento objetivo del cultivo (Barbieri et al., 2012; Garcia et al., 2010). En general, este tipo de modelos simplificados no contemplan de forma directa el aporte de N por mineralización, el cual representa una de las principales fuentes de N para los cultivos (Rice y Havlin, 1994), particularmente en suelos con altos contenidos de materia orgánica (MO) (Echeverría y Ferrari, 1993). Para el sudeste bonaerense, Reussi Calvo et al. (2013) determinaron que la incorporación del nitrógeno incubado en anaerobiosis (Nan), al modelo de N-NO3 - en pre-siembra, contribuye a explicar las variaciones de rendimiento y permite estimar con mayor exactitud la disponibilidad de N para el cultivo. En la actualidad las dosis de N empleadas en el sudeste bonaerense varían desde 70 hasta 160 kg N ha-1 según las características del ambiente y el rendimiento objetivo. Considerando que dicha zona se caracteriza por tener una muy baja probabilidad de déficit hídrico (menor al 5%) desde la siembra hasta la espigazón del cultivo de trigo (Reussi Calvo y Echeverría, 2006), es factible considerar el fraccionamiento de la dosis de N con el objetivo de maximizar el rendimiento y la eficiencia de uso de N (EUN). Además, es válido recordar que la mayor acumulación de N se produce a partir de fines de macollaje y durante la encañazón del trigo, momento en el cual se obtendría la mayor EUN (Howard et al., 2002). Barbieri et al. (2008) reportaron mayores rendimientos y eficiencias de recuperación de N en grano (ERNg) para aplicaciones al macollaje respecto de aplicaciones a la siembra. Además, Velasco et al. (2012) determinaron incrementos en rendimiento y en la ERNg por el fraccionamiento de la dosis de N entre macollaje y hoja bandera. Por lo tanto, surge la necesidad de contar con herramientas que permitan monitorear el estatus nitrogenado del cultivo y, por ende, ajustar la dosis de N definida a la siembra según las características climáticas del año.
En la actualidad, existe una amplia gama de sensores remotos y espectrales los cuales permitirían caracterizar, de forma rápida y no destructiva, el estatus nitrogenado durante el ciclo del cultivo. El medidor de clorofila Minolta SPAD® 502 es una alternativa para el monitoreo, y se basa en que existe una estrecha relación entre el índice de verdor (IV) de la hoja y el contenido de clorofila y, entre ambos y la concentración de N en hoja (Schepers et al., 1992; Waskom, 1996). No obstante, el IV presenta el inconveniente de estar afectado por numerosos factores tales como el genotipo, el estado de crecimiento del cultivo, las enfermedades, la disponibilidad hídrica, otros nutrientes, etc. (Blackmer y Schepers, 1995; Gandrup et al., 2004). Por lo tanto, para minimizar los errores ocasionados por dichos factores se recomienda calibrar las mediciones de SPAD con áreas de referencia sin limitaciones de N. A partir de las lecturas de SPAD en las áreas de referencia se determina un índice de suficiencia del nutriente (ISN), que surge del cociente entre la lectura del lote y el IV del área sin limitaciones nutricionales. Gandrup et al. (2004) determinaron estrecha asociación entre el IV y/o ISN con el rendimiento del cultivo a partir de fines de macollaje y encañazón del trigo. Además, otros autores observaron que la medición del IV en la hoja bandera en floración es un buen estimador del contenido de proteína del grano a cosecha (Echeverría y Studdert, 2001). Otra alternativa es el empleo de sensores remotos multiespectrales dentro de los cuales uno de los más difundidos a nivel mundial es el Green Seeker (Ntech Industries, Inc., Ukiah, CA.). A partir de los valores de refractancia de este sensor es posible calcular índices de vegetación que permiten caracterizar el canopeo de los cultivos, siendo el más utilizado el índice de vegetación diferencial normalizado (NDVI, por sus siglas en inglés). El NDVI han demostrado ser una herramienta útil para obtener en forma indirecta valores de eficiencia fotosintética, potencial de productividad y rendimiento potencial de los cultivos (Raun et al., 2001; Bonfil et al., 2005; Melchiori et al., 2007). Al igual que para el IV, algunos autores recomiendan la relativización de las lecturas de NDVI con zonas de referencia (Barker y Sawyer, 2010; Clay et al., 2012).
Si bien existe información sobre el empleo del medidor de clorofila SPAD y Green Seeker para el monitoreo del estatus nitrogenado del cultivo, no hay información nacional que presente los algoritmos que permitan ajustar la dosis de N a utilizar con el objetivo de maximizar el rendimiento y la eficiencia de uso del fertilizante. Por lo tanto, el objetivo de este trabajo fue evaluar la utilidad del SPAD y el Green Seeker para monitorear el estatus nitrogenado del trigo y desarrollar modelos que permitan ajustar la dosis de N durante el ciclo del cultivo.
MATERIALES Y MÉTODOS
Durante la campaña 2011 se realizaron 5 ensayos bajo siembra directa en lotes con diferente historia agrícola del Sudeste Bonaerense (Localidades de Gral. Madariaga, Maipú, Miramar, Pieres y Lobería). El diseño experimental fue en bloques completos aleatorizados con tres repeticiones. Se evaluaron seis dosis de N (testigo, 50, 100, 150, 200 y 300 kg N ha-1), aplicadas al voleo bajo la forma de Urea (46-0-0) en el estadio de dos hojas del trigo (Z12, según la escala de Zadocks et al. (1974)). Para que el fósforo (P) y el azufre (S) no sean limitantes se aplicó a la siembra una dosis de 30 y 20 kg ha-1 de P y S, respectivamente. El tamaño de la unidad experimental fue de 30 m2 (3 m de ancho por 10 m de largo).
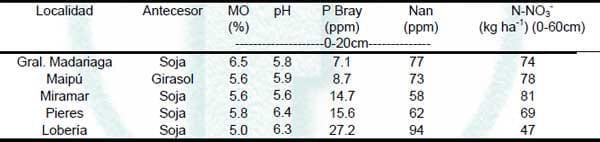
A la siembra del cultivo se realizaron muestreos de suelo en superficie (0-20 cm) para determinar el contenido de MO, pH y Nan, y en el perfil (0-20, 20-40 y 40-60 cm) para N-NO3 -. La concentración de NNO3 - se extrajo con KCl y se determinó por colorimetría (Keeney y Nelson, 1982). Para poder estimar la disponibilidad de N (kg ha-1) en los primeros 60 cm de profundidad se empleo una densidad promedio de 1.2 Mg m-3 (Fabrizzi et al., 2005). La MO se determinó por el método Walkley y Black (Nelson y Sommers, 1996) y el pH en relación 1:2,5 (suelo-agua). Además, el Nan se obtuvo según la metodología descripta por Echeverría et al. (2000). En la Tabla 1 se presentan algunas características de suelo de los sitios experimentales.
Durante el ciclo del cultivo se realizaron lecturas de IV y de NDVI en los estadios de dos y cuatro macollos, un nudo y hoja bandera (Z22, Z24, Z31 y Z39, según Zadocks et al., 1974). Para el SPAD, se promediaron 15 lecturas realizadas en la última hoja expandida (lígula totalmente visible), aproximadamente a la mitad de la distancia entre el tallo y el ápice, y a la mitad de la distancia entre el borde de la hoja y la nervadura central. A partir de las lecturas de SPAD y NDVI, y para cada momento de medición, se determinó el ISN y NDVI relativo (NDVIr) como el cociente entre la lectura de la parcela problema y la de referencia (300 kg N ha-1). En el estadio de Z31, se realizaron refertilizaciones con N en función de similares algoritmos a los desarrollados por Raun et al. (2001).
A la cosecha se determinó el rendimiento del cultivo mediante el corte de plantas de 9 surcos al azar de 1m de longitud (1.8 m2) y las espigas fueron desgranadas en una trilladora estacionaria. El rendimiento se expresó al 14 % de humedad. La concentración de N total en grano se determinó por el método de combustión seca de Dumas, utilizando un analizar TruSpec CNS (LECO, 2008).
Se realizó análisis de varianza utilizando el programa estadístico SAS (SAS Institute, 1988). Cuando las diferencias entre tratamientos fueron significativas se empleó el test de la diferencia mínima significativa (LSD), con un nivel de significancia de 5 % (SAS Institute, 1988).
Tabla 1. Cultivo antecesor y análisis de suelo a la siembra del trigo en diferentes sitios del Sudeste de Buenos Aires. Campaña 2011. MO= materia orgánica; P Bray = fósforo extractable; Nan = nitrógeno anaeróbico; N- NO3 - = nitrógeno de nitratos.
RESULTADOS Y DISCUSIÓN
Las precipitaciones durante el ciclo del trigo fueron de 355, 350, 450, 420 y 450 mm en el sitio Gral. Madariaga, Maipú, Miramar, Pieres y Lobería, respectivamente. Este nivel de precipitaciones sumado al adecuado contenido de humedad a la siembra del cultivo indicaría que la disponibilidad hídrica no habría limitado mayormente el rendimiento del cultivo.
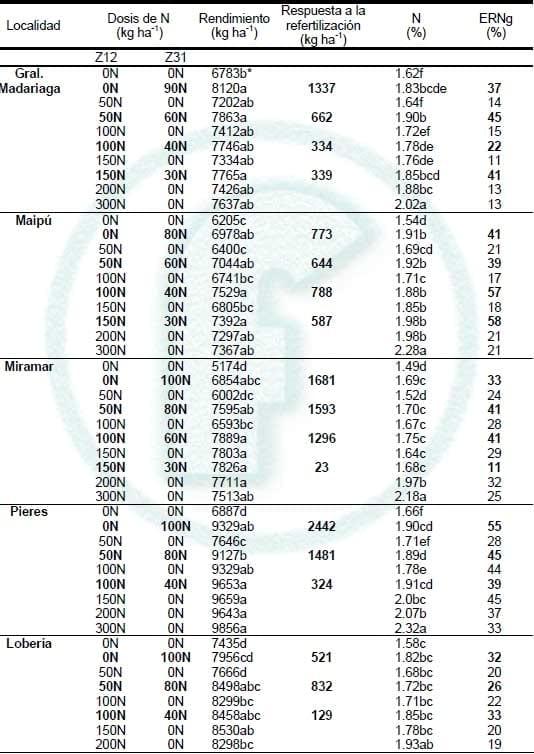
En todos los sitios experimentales se determinaron respuestas (p<0,05) en rendimiento por la aplicación de N en dos hojas (Tabla 2). El rendimiento promedio fue de 7529, 6976, 7096, 9014 y 8234 kg ha-1 para Gral. Madariaga, Maipú, Miramar, Pieres y Lobería, respectivamente, lo cual pone de manifiesta la potencialidad de la campaña 2011. La máxima respuesta en rendimiento (diferencia de rendimiento entre el tratamiento 300N y 0N) para aplicaciones de N en dos hojas fue de 854 kg ha-1 en Gral. Madariaga, 1162 kg ha-1 en Maipú, 2340 kg ha-1 en Miramar, 2969 kg ha-1 en Pieres y 1563 kg ha-1 en Lobería (Tabla 2). La mayor respuesta a N en Pieres se explicaría en parte por los bajos niveles de N-NO3 - y Nan a la siembra sumado a la alta potencialidad del sitio (Tabla 1). Similares respuestas fueron determinadas por otros autores en el sudeste bonaerense (Calviño et al., 2002 y Barbieri et al., 2012).
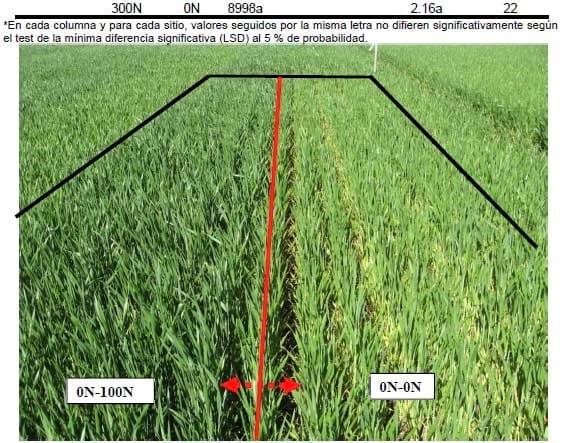
Al igual que en dos hojas, se obtuvieron incrementos significativos en rendimiento por la aplicación de N en un nudo (Tabla 2, Fotografía 1). La máxima respuesta a la aplicación de N fue de 1337, 778, 1681, 2442 y 832 kg ha-1 en Gral. Madariaga, Maipú, Miramar, Pieres y Lobería, respectivamente (Tabla 2). La menor respuesta a N en los sitios Maipú y Lobería se podría explicar por la presencia de enfermedades y el alto Nan, respectivamente (Tabla 1). En cuatro de los cinco sitios experimentales la aplicación de N en un nudo en el tratamiento testigo permitió alcanzar similar rendimiento (p>0.05) que con dosis máxima de N (Tabla 2). Lo mencionado pone de manifiesto, para ambientes como los del sudeste bonaerense, la factibilidad de realizar aplicaciones complementarias de N durante el ciclo del trigo. Además, se determinaron una mayor ERNg para las aplicaciones en un nudo respecto a las de base (Tabla 2). La ERNg para las aplicaciones tardías fueron en promedio de dosis de 36.3, 48.5 31.4, 46.4 y 30.2% para Gral. Madariaga, Maipú, Miramar, Pieres y Lobería, respectivamente. Otros trabajos han determinado mayores incrementos de rendimiento y de ERNg por aplicación de N al macollaje (Melaj et al., 2003; Videla et al., 2004; Barbieri et al., 2008). Similar comportamiento fue determinado respecto a la concentración de N en grano, ya que a similar dosis de N total, el fraccionamiento de la dosis logró un mayor nivel de dicho nutriente en grano (Tabla 2). Velasco et al. (2012) determinaron incrementos en el contenido de proteína en trigo por efecto del fraccionamiento de la dosis de N entre mitad de macollaje y hoja bandera del trigo.
Tabla 2. Rendimiento de trigo, nitrógeno en grano (N) y eficiencia de recuperación de N del fertilizante en grano (ERNg) para los diferentes sitios experimentales en el Sudeste de Buenos Aires. Campaña 2011. Z12= dos hojas y Z31= un nudo detectable.
Fotografía 1. Efecto de la re-fertilización con nitrógeno (N) en un nudo del trigo (Sitio Miramar). El recuadro indica la dosis de N (kg ha-1) en Z12-Z31.
En las Figuras 1 y 2 se observan las relaciones entre el ISN y NDVIr con el rendimiento relativo del trigo para los diferentes momentos de medición. Para ambos sensores se observó una mayor capacidad predictiva del rendimiento con el avance del ciclo del cultivo, lo cual se vió reflejado en el mayor coeficiente de ajuste (r2). Para el ISN, otros trabajos en diferentes cultivos han determinado mejores ajustes con rendimiento frente al avance de la estación de crecimiento (Sainz Rozas y Echeverría, 1998; Gandrup et al., 2004). Con respecto a las lecturas de NDVIr, a diferencia de ISN, es generalmente aceptado que el ajuste entre el rendimiento y dicho índice sea elevado en los primeros estadios de desarrollo del cultivo, debido que al avanzar el ciclo del cultivo la sensibilidad del sensor disminuye (Raun et al., 2001; Girma et al., 2006). No obstante, los resultados de esta experiencia muestran aumentos en el r2 con el avance del ciclo del cultivo (Figura 2), lo cual se podría explicar por fuerte estrés de N. El ISN mostró mayor capacidad predictiva de rendimiento respecto al NDVIr (Figuras 1 y 2), lo que se explicaría en parte por la estrecha asociación entre las lecturas de IV y el contenido de clorofila y, entre ambos y la concentración de N en hoja (Schepers et al., 1992). No obstante, para el estadio de un nudo se observo una estrecha asociación entre las lecturas de ISN y NDVIr (r2= 0.76, datos no mostrados).
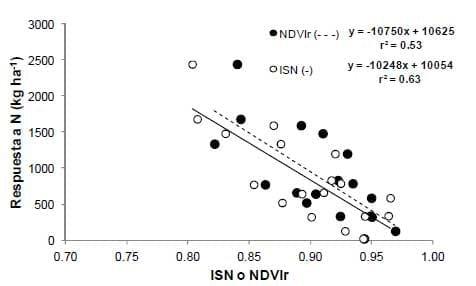
Según Howard et al. (2002) la EUN es maximizada cuando el N es aplicado previo al momento de máximo consumo de dicho nutriente por el cultivo. Considerando que el máximo consumo de N para el trigo comienza en un nudo (Borghi, 2001), se relacionó la respuesta en rendimiento por efecto de la aplicación demorada de N con el ISN y NDVIr (Figura 3). Se obtuvo estrecha asociación entre dichas variables, por lo tanto, ambos sensores podrían ser empleados para el monitoreo del estatus nitrogenado del cultivo y el ajuste de la dosis de N en el estadio de un nudo. Además, la relación es independiente del sensor empleado (p>0.05 entre sensores; y = -10 299x +10 157, r2= 0.58), lo cual representa una ventaja práctica debido a la flexibilidad del Green Seeker para ser incorporado en diferentes fertilizadoras. Por último, empleando la ecuación mencionada es posible estimar con un 58 % de confianza la dosis de N aplicar en un nudo. A modo de ejemplo, si el ISN o NDVIr del lote en dicho estado es de 0.90 la respuesta probable a N es de 890 kg ha-1. Si consideramos un requerimiento de N de 30 kg tn-1 (Barbieri et al., 2012) y una eficiencia de recuperación de N del 50-60% (Velasco et al., 2012) la dosis a aplicar sería de 45 kg N o 97 kg Urea ha-1 (Dosis de N = 0.89 ton ha-1*50 kg N ha-1).
Figura 1. Rendimiento relativo del cultivo de trigo en función del índice de suficiencia de nitrógeno (ISN) para los diferentes momentos de muestreo.
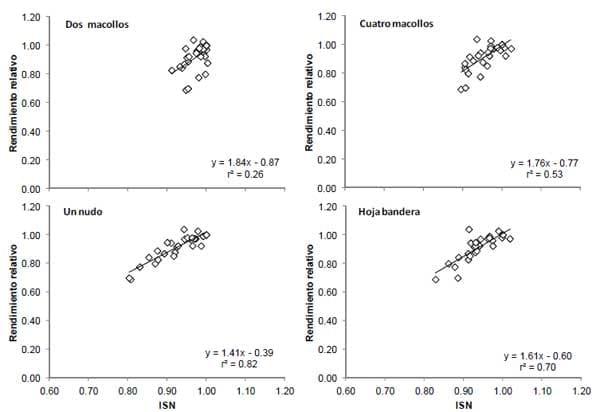
Figura 2. Rendimiento relativo del cultivo de trigo en función del NDVI relativo (NDVIr) para los diferentes momentos de muestreo.
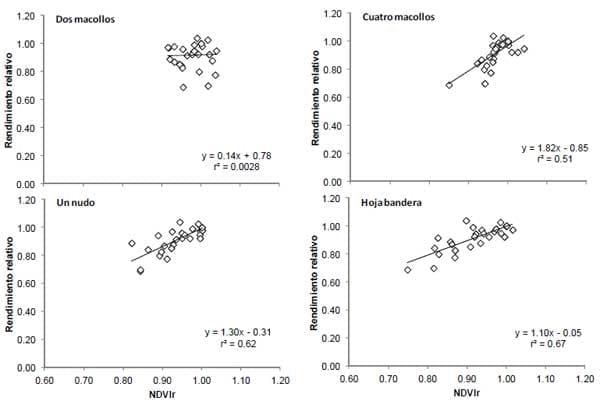
Figura 3. Relación entre la respuesta en rendimiento a la re-fertilización con N y el ISN o NVDIr determinados en el estadio de un nudo del trigo.
CONCLUSIÓN
Las mediciones relativas de SPAD y Green Seeker pueden ser empleadas para el monitoreo del estatus nitrogenado del trigo desde mediados de macollaje hasta hoja bandera del trigo en ambientes de alta potencialidad de rendimiento y/o con escasa probabilidad de déficit hídrico. Además, se desarrolló un modelo que permitió estimar con un 58% de confianza la respuesta a N en el estadio de un nudo. Esto permitirá maximizar el rendimiento y la eficiencia de uso del N, minimizando el riesgo de impacto ambiental negativo de la fertilización nitrogenada.
BIBLIOGRAFÍA
Barbieri, P.A., H.E. Echeverría, y H.R. Sainz Rozas. 2008. Time of nitrogen application affects nitrogen use efficiency of wheat in the humid pampas of Argentina. Can. J. Plant Sci. 88: 849-857.
Barbieri, P.A., H.E. Echeverría, y H.R. Sainz Rozas. 2012. Alternatives for Nitrogen Diagnosis for Wheat with Different Yield Potentials in the Humid Pampas of Argentina. Commun. Soil Sci. Plan. 43: 1512-1522.
Barker, D.W., y J.E. Sawyer. 2010. Using Active Canopy Sensors to Quantify Corn Nitrogen Stress and Nitrogen Application Rate. Agron. J. 102:964-971.
Blackmer, T.M. y J.S. Schepers. 1995. Use of chlorophyll meter to monitor nitrogen status and schedule fertigation for corn. J. Prod. Agric. 8:56–60.
Bonfil, D.J., A. Karnieli, M. Raz, I. Mufradi, S. Asido, H. Egozi, A. Hoffman y Z. Schmilovitch. 2005. Rapid assessing of water and nitrogen status in wheat flag leaves. J. of Food Agric. Enviromental. 3 (2):148- 153.
Borghi, B. 2001. Nitrogen as determinant of wheat growth and yield. Pp. 67-77. En: EH. Satorre & GA. Slafer (eds). Ecology and physiology of yield determination. Editorial Food Products Press.
Calviño P., H.E. Echeverria & M. Redolatti. 2002. Diagnóstico de nitrógeno en trigo con antecesor soja bajo siembra directa en el sudeste bonaerense. Cien. Suelo 20:36-42.
Clay, D.E., T. Prasad Kharel, C. Reese, D. Beck, C. Gregg Carlson, S.A. Clay, y G. Reicks. 2012. Winter Wheat Crop Reflectance and Nitrogen Sufficiency Index Values are Influenced by Nitrogen and Water Stress. Agron. J. 104:1612-1617.
Echeverría, H.E., y J.L. Ferrari. 1993. Relevamiento de algunas características de los suelos agrícolas del sudeste de la provincia de Buenos Aires. Boletín Técnico Nº 112. EEA INTA Balcarce, Balcarce, Buenos Aires. 18 pp.
Echeverría, H.E., y G.A Studdert. 2001. Predicción del contenido de proteína en grano de trigo (Triticum aestivum L) mediante el índice de verdor de la hoja bandera. Ciencia del Suelo 19:67-74.
Fabrizzi, K.P., F.O. García, J.L. Costa, y L.I. Picone. 2005. Soil water dynamics, physical properties and corn and wheat responses to minimum and no-tillage systems in the southern Pampas of Argentina. Soil Till. Res. 81: 57-69.
Gandrup, M.E., F.O. García, K.P. Fabrizzi, y H.E. Echeverría. 2004. Evolución de un índice de verdor en hoja para evaluar el status nitrogenado en trigo. Revista de Investigaciones Agropecuarias (RIA), 33(3):105-121.
García, F.O., M. Boxler, J. Minteguiaga, R. Pozzi, L. Firpo, I. Ciampitti, A. Correndo, F. Bauschen, A. Berardo, y N. Reussi Calvo. 2010. La Red de Nutrición de la Región CREA Sur de Santa Fe: Resultados y conclusiones de los primeros diez años 2000-2009. 62 p.
Girma, K., K.L. Martin, R.H. Anderson, D.B. Arnall, K.D. Brixey, M.A. Casillas, B. Chung, B.C. Dobey, S.K. Kamenidou, S.K. Kariuki, E.E. Katsalirou, J.C. Morris, J.Q. Moss, C.T. Rohla, B.J. Sudbury, B.S. Tubana, B.S., yW.R. Raun. 2006. Mid-season prediction of what-grain yield potential using plant, soil, and sensor measurements. J. Plant Nutr.. 29:873-897.
Howard, D. D., Newman, M. A., Essington, M. E., y W.M. Percell. 2002. Nitrogen fertilization of conservationtilled wheat. II. Timing of nitrogen application of two nitrogen sources. J. Plant Nutr. 25: 13291339.
Keeney, D.R., y D.W. Nelson. 1982. Nitrogen inorganic forms. In: Page, A.L. et al. eds. Methods of soil analysis. Part 2. Agron. Monog 9 ASA and SSSA, Madison, WI. pp. 643-698.
Melaj, M.A., H.E. Echeverría, S.C. López, G. Studdert, F. Andrade, y N.O. Bárbaro. 2003. Timing of nitrogen fertilization in wheat under conventional and no-tillage system. Agron. J. 95: 1525-1531.
Melchiori, R.J.M.; O.P. Caviglia, N. Faccendini, y S.M. Albarenque. 2007. Utilización de sensores remotos para manejo de nitrógeno en trigo. Actualización técnica, Cultivos de Invierno. Ediciones del Instituto Nacional de Tecnología Agropecuaria 32- 38.
Nelson, D.W., y L.E. Sommers. 1996. Total carbon, organic carbon, and organic matter. In Methods of Soil Analysis, Part 3, Chemical Methods, ed. D. L. Sparks, 961–1010. Madison, WI: ASA-SSSA.
LECO. 2008. Organic application notes. Disponible en http://www.leco.com/, verificado 18/02/2008.
Raun, W.R., G.V. Johnson, M.L. Stone, J.B. Solie, E.V. Lukina, W.E. Th omason, y J.S. Schepers. 2001. Inseason prediction of potential grain yield in winter wheat using canopy refl ectance. Agron. J. 93:131-138.
Reussi Calvo, N.I., y H.E. Echeverría. 2006. Estrategias de fertilización nitrogenada en trigo: balance hídrico para el sur bonaerense. Ciencia del Suelo. 24 (2): 115-122.
Reussi Calvo, N.I.; H. Sainz Rozas; H.E. Echeverría, y A. Berardo. 2013. Contribution of anaerobiosis incubated nitrogen to the diagnosis of nitrogen status in spring wheat. Agron. J. 2: doi:10.2134/agronj2012.0287.
Rice, C.W., y J.L. Havlin. 1994. Integrating mineralizable nitrogen indices into fertilizer nitrogen recommendations. In: Havlin J L, Jacobsen, J S (eds) Soil testing: Prospects for improving nutrient recommendations. SSSA Sp. Pub. 40. Soil Sci. Soc. Am., Madison Wisconsin, EEUU. pp. 1-13.
SAS INSTITUTE INC.1988. SAS/STAT Users Guide. Version 6.03 Edition. Cary, NC.
Schepers, J., T. Blackmer, y D. Francis. 1992. Predicting N fertilizer needs for corn in humid regions: Using chlorophyll meters. In B. Bock y K. Kelly (ed). Predicting fertilizer needs for corn in humid regions. NFERC, Bull. Y-226. Muscle Shoals, AL, EE.UU. pp. 105 - 114.
Velasco, J.L., H. Sainz Rozas, H Echeverría, y P. Barbieri. 2012. Optimizing fertilizer nitrogen use efficiency by intensively managed spring wheat in humid regions: Effect of split application. Can. J. Plant Sci. 92: 1-10.
Videla, C.J., H.E. Echeverria, S. Lopez, M. Melaj, y N. Barbaro. 2004. Recuperación del 15N-urea aplicado a la siembra o al macollaje en trigo en un suelo somero. Cien. Suelo 22 (2): 83-91.
Waskom, R. M. 1996. A review of use of chlorophyll meters to assess crop N status in the Great Plains. Proceedings Great Plains Soil Fertility Conference. J. Havlin (ed.). Kansas State University, Manhattan, KS, EEUU. pp. 36 - 43.
Zadoks, J.C., T.T. Chang y C.F. Zonzak. 1974. A decimal code for the growth stages of cereals. Weed Res. 14: 415-421.
Temas relacionados:
Autores:
Instituto Nacional de Tecnología Agropecuaria - INTA
Fertilab, Laboratorios de Suelos
CONICET Argentina
Instituto Nacional de Tecnología Agropecuaria - INTA
Mostrar más
Recomendar
Comentar
Compartir
7 de octubre de 2013
Señores investigadores, si la mayor acumulación de N se produce a partir de fines de macollaje y creo lo aprovechan mejor como también en elongación y hoja bandera, entonces ¿por qué no se aplican las dosis de N en esta fase fenológica de macollaje, en vez de a la siembra?, hemos visto que a la siembra, quienes mejor aprovechan el N son las malezas. Favor de respondernos esta inquietud.
Recomendar
Responder
Profertil
18 de febrero de 2014
Muy buen trabajo para informarse sobre otras Herramientas de Diagnóstico para conocer el estado de salud de los cultivos.
Recomendar
Responder

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.






