Identificación de Malezas Hospederas de Geminivirus del Tomate
Publicado: 31 de diciembre de 2014
Por: Orlando Osorio Burgos, M.Sc. En Protección Vegetal.
Introducción
Las malezas constituyen una fuente de inóculo de suma importancia para la transmisión de epifitias y una de sus consecuencias es que ocasiona significativas pérdidas a la industria tomatera en Panamá. Para contrarrestar estos problemas, el productor ha venido incrementando el número de aplicaciones de insecticidas por período de cultivo, lo cual refleja la desesperación e inequívoca solución del productor. Desafortunadamente, debido a la eliminación de los enemigos naturales se cree que las prácticas realizadas han provocado el aumento de la población del vector (mosca blanca: Bemisia tabaci) aunado a los cambios climáticos frecuentes que se dan en la zona. La sintomatología que se ha observado en el campo para el tomate es encrespamiento de las hojas u hojas rizadas, mosaico amarillo, achaparramiento, clorosis, aborto de flores, reducción de la producción y maduración irregular de frutos. Varios autores coinciden en que las plantas silvestres pueden ser reservorio de vectores y virus de importancia agrícola (Duffus, 1971; Bos, 1981).) B. tabaci por ser de hábito polífago, tiene un amplio rango de hospederos en diferentes familias. El objetivo de este trabajo fue identificar las posibles malezas portadoras de geminivirus tanto en plantas con síntomas como asintomáticas y determinar la importancia relativa de cada una, como reservorio del virus durante el período en que no se cultiva tomate.
Materiales y Métodos:
Localización:
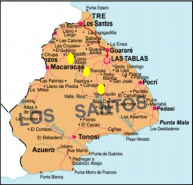
La recolección de malezas se realizó en: Los corregimientos de La Villa de Los Santos, Guararé y La Espigadilla, ubicadas en la Provincia de Los Santos.
Figura 1 Localización geográfica del estudio
Colecta de malezas:
En cada localidad se recolectaron muestras de malezas invasoras y de contorno en parcelas de tomate. Se tomaron plantas completas y ápices de malezas posiblemente infectadas de geminivirus. Los ápices se secaron sobre sílica gel para no degradar el ADN de la planta.
Identificación de malezas:
Todas las muestras colectadas, una vez codificadas, fueron identificadas por los especialistas: M.Sc. Carmen Vergara (Universidad de Panamá), PhD. Rafael Rincón (UNACHI) , Ing. Alberto Moreno (MIDA) y quien suscribe.
Colonización de las malezas por la mosca blanca (B. tabaci):
Las malezas colectadas se plantaron en potes y se separaron por familia botánica. El grupo de cada familia se aisló en una jaula con mallas de organza a prueba de insectos junto a tomate infectado con Virus del Mosaico Amarillo de la Papa (PYMV-Pa) y una colonia de moscas blancas virulíferas, permaneciendo así hasta que las moscas blancas colonizaron cada especie de malezas
Observación de síntomas de geminivirus en tomate:
Un mes después de realizada la prueba de transmisión de geminivirus de las malezas al tomate se verificó la presencia de virus mediante la observación de síntomas en tomate susceptible (variedades T6, T7 y Tropic). Los síntomas observados coinciden con los producidos por geminivirus.
Análisis de las muestras de malezas y tomates:
Estas se realizaron mediante la prueba de “Southern blot” y PCR con iniciadores específicos para el geminivirus de Panamá ( PYMV-Pan), utilizado el ADN extraído de los ápices de malezas previamente colectadas. Estas pruebas fueron realizadas por el Dr. Thomas Frischmuth (Universidad de Stuttgart, Alemania y colaboradores).
Resultados y Discusión:
El análisis del ADN mediante “Southern blot” de 16 malezas colectadas reveló que siete de ellas estaban infectadas naturalmente con geminivirus, el resto dio resultados negativos posiblemente porque eran muestras asintomáticas. Algunas de estas malezas son conocidas como hospederos de geminivirus como Sida spp. Rhynchosia minima y Euphorbia heterophylla. (Duffus, 1987). En cambio, la Asteraceae Eleutheranthera ruderalis, la Tiliaceae Corchorus orinocensis y la Malvaceae Herissantia crispa se reportan como hospederas de geminivirus por primera vez en nuestro país.
Fig.2. Escobilla (Sida spp )

Fig. 3 Bejuquilla(Rhynchosia minima)

Fig.4. Flor de pascua (E. heterophylla.)

Fig. 4 Oreja de ratón (E. ruderalis)

Fig.5 (C. orinocensis)

Fig.5 Guacimillo (H. crispa)

Conclusiones:
-En los campos de cultivos de la región conocida como “Arco Seco” (La Villa de Los Santos, Guararé, La Espigadilla) de la Península de Azuero, existen hasta el momento 14 especies de malezas hospederas de diferentes geminivirus del tomate, los cuales pertenecen a 4 familias de plantas que se han estudiado hasta el momento (Euphorbiaceae, Malvaceae, Solanaceae y Asteraceae). Estas malezas son reportadas por primera vez en nuestro país como hospederas alternas de geminivirus
- Otras especies de malezas presentan síntomas de virus pero no es transmitido por B. tabaci a tomate. Estas son Rhynchosia minima, Mucuna pruriens y Desmodium scorpiurus.
-Todas las malezas positivas en la transmisión del geminivirus son hospederas de B. tabaci.
Recomendaciones:
Continuar la caracterización de los geminivirus que infectan al tomate y definir completamente el complejo que afecta este cultivo.
Eliminar la malezas hospederas de los geminivirus, tanto aquellas invasoras (dentro de las parcelas), o de contorno antes de siembra para retrasar la tasa de desarrollo de la epifitia.
Una vez terminada la cosecha eliminar los rastrojos del tomate para reducir las fuentes de inóculo primario en siembras posteriores.
Combinar la eliminación de los hospederos alternos con otras prácticas de manejo como son el uso de mallas para proteger los semilleros, el uso de cultivos trampas, de coberturas reflectivas y de cultivos rompe vientos.
Determinar otras malezas sospechosas que puedan ser hospederas alternas de los geminivirus, especialmente de aquellas familias positivas a geminivirus en países vecinos (Rubiaceae, Boraginaceae y Verbenaceae) y en nuestro país (Tiliaceae).
Alternar el cultivo de hortalizas (pimentón, tomate, cucurbitáceas) con otros cultivos que no son infectadas por la mosca blanca y los geminivirus como maíz, sorgo y cebolla.
Evaluar la importancia de cada maleza como reservorio natural de geminivirus; en este sentido hay que determinar la abundancia de cada especie en los campos de cultivo y la frecuencia de infestación de cada una de las malezas con cada geminivirus. Esto permitiría conocer mejor la epifitiología de los geminivirus y desarrollar mejores estrategias de control.
Utilizar los Inductores De Resistencia (IDR) para contrarrestar el efecto del complejo mosca blancageminivirus.
Bibliografia
Abouzid. A. M.; J. E. Polston and Hirbert.1992. The nucleotide sequence of tomato mottle virus, a new geminivirus isolated in tomatoes in Florida. J. Gen. Virol. 73, 3225-3229.
Asiático, J.M. 1991. Control de Bemisia tabaci (Gennadius) en tomate con insecticidas biológicos, botánicos y químicos. Tesis M.Sc. Turrialba, Costa Rica. CATIE 77pp.
Blanco, J.; Hilje, L. 1995. Efecto de cobertura al suelo sobre la abundancia de B. tabaci y la incidencia de virosis en tomate. Manejo Integrado de Plagas (Costa Rica) 35:1 - 10.
Bos, L. 1981. Wild plants in the ecology of virus diseases. In Plant Diseases and epidemiology. K. Maramorosch y K. F. Harris (eds.). New York, Academic Press.p.1-33.
Brown, J.K.; A.M. Idris and D. Fletcher. 1993. Sinaloa tomato leaf curl virus, a newly described geminivirus of tomato and pepper in west coastal Mexico. Plant dis 77:1262.
Brown, J. K.; J. Bud; G. Banks M.; Sosa, K. Kiesler I. ; Cabrera and G. Fornaris. 1995. First report of a epidemic in tomato caused by Two Whitefly-Transmitted Geminiviruses in Puerto Rico. Plant Dis. 79:1250.
Brown, J.K and M.R. Nelson. 1988. Transmission, host range and virus-vector relationship of chino del tomate, a whitefly-transmitted geminivirus from Sinaloa, Mexico. Plant Dis. 72:866-869.
Chen, A.; Guerra, J. A. 1996. Manejo Integrado del Cultivo del Tomate.(Inédito) IDIAP, Panamá. Cohen, S. 1990. Epidemiology of Whiteflies: their Bionomics, Pest Status and Management. Ed. by Dan Gerling. Intercep Ltd., Andover, Hants. pp. 221-226.
Costa, A. S. 1965. Three Whitefly - transmitted virus diseases of beans in Sao Paulo, Brazil. FAO Plat. Prot. Bull. 13: 121 - 130.
Davies, J. W. and J. Stanley. 1989. Geminivirus genes and vectores. Trends Genet 5: 77 - 81.
Dry, I. B.; J. E. Rigden; L. R. Krake; P. M. Mullineaux and M. A. 1993. Nucleotide sequence and genome organization of tomato leaf curl geminivirus. J. Gen. Virol: 74: 147 - 151.
Duffus, J.E. 1971. Role of weeds in the incidence of virus diseases. Ann. Rev. Phytopath. 9:319-340.
Duffus, J. E. 1987. Whitefly transmission of plant viruses. En. Current Topics in Vector Research. 4:73-91. Editor K.F. Harris. NY. Springer-Verlag.
Engel, M., O. Fernández, H. Jeske and T. Frischmuth. 1998. Molecular characterization of a new whitefly-transmissible bipartite genome geminivirus infecting tomato in Panama. J. Gen Virol. In Press.
Fernández, Orencio. 1995. Evaluación de progenitores y líneas de tomate para resistencia a geminivirus. IDIAP, Panamá. Informes de investigación.(Inédito).
Frischmuth, T; M. Engel, s. Lauster and H. Josbe. 1997 Nucleotide sequence evidence for the ocurrence of thee distinct whiteflly-transmitted, Sida-Infecting bipartite geminiviruses in Central America. J.Gen. Virol. 78 (Jul).
Frischmuth, T. & J. Stanley. 1991. African Cassava mosaic virus DI DNA interferes with the replication of both genomic componentes. Virology 183:539-544.
Gálvez, G. E. and M. J. Castaño. 1976. Purification of the whitefly - bean golden mosaic virus. Turrialba (Costa Rica).26:205-207.
Garrido-Ramírez. E. R. and R. L. Gilberston. 1998. First report of tomato mottle geminivirus infecting tomatoes in Yucatán, México. Plant. Dis. 82:592.4
Gilbertson, R. L.; J. C., Faria; S. F., Hanson; F. J., Morales; P. Ahlquisti; D. P. Maxwell and D. R. Ruseel. 1991 Cloning of the complete DNA genomes of four bean-infecting geminiviruses and determining their infectivity by electric discharge particle acceleration. Phytopathology 81: 980-985.
Goodman, R.M.; J. Bird and P. Thongmeearkom. 1977 An unusaul viruslike particicle associated with golden yellow mosaic of beans. Phytopathology 67:34-42.
Guzmán, P.; C. R. Arredondo, D. Emmatly, R. J. Portillo and R. L. Gilberton. 1997. Partial Characterization of Two Whitefly-Transmitted geminiviruses infecting tomatoes in Venezuela Plant Dis. 81:312.
Hamilton, W.D.O., D. M. Bisaro, R. H. A. Coutts and K.W. Buck. 1983. Demostration of the bipartite nature genome of a single - stranded DNA plant virus by infection with the cloned DNA componet. Nucleic Acids Res. 11:7387-7396.
Höfer,P., Engel,M., Jeske, H. and Frischmuth,T. 1997. Nucleotide sequence of a new bipartite geminivirus isolated from the common weed Sida rhombifolia in Costa Rica. Journal of General Virology 78: 1785-1790.
Ioannu, N. 1987. Cultural management of tomato yelow leaf culr virus in Cyprus. Plant Pathology 36:367-373.
Kheyr-Pour, A. M., V. M. Bendahmane, G. P. Accoto, S. Crespi and B. Gronenbron. 1991. Tomato yellow leaf curl virus from Sardinia is a whitefly-transmited monopartite geminivirus. Nucleic Acids Res. 19: 6763-6769.
Lazarowitz, S. G. 1992. Geminiviruses: Genome structure and gene funtion. Crit. Rev. Plant. Sci. 11:327-349.
Markham, P.G, I.D. Bedford, S. Liw, D.F. Frolic, R. Rosell and J.K. Brown. 1995. The transmission of geminiviruses by biotypes of Bemisia tabaci (Gennadius). En Bemisia: Taxonomy, Biology, Damage, Control and Management pp 69-75. Editado por D. Gerling and R.T. Mager. Intercept, Andover, U.K.
Martínez, Y.; C. de Blas, I. Zabalgogeazcoa, M. Quiñonez, C. Castellanos, E. L. Peralta and J. Romero. 1997. A bipartite geminivirus infecting tomato in Cuba. Plant Dis. 78:1215.
Mc Glashan, D.; J. E.; J.E. Polston and D. Bois. 1994. Tomato Yellow Leaf and geminivirus in Jamaica. Plant Dis. 78:1219.
McGovern, R. J.; J.E. Polston, G. M. Danyluk, E. Hierbert, A. M. Abbouzid and P. A. Stansly. 1994. Identification of a natural weed host of Tomato Mottle Geminivirus in Florida. Plant Dis 78:1102-1106.
Mejía, L. 1997. Virus gemini transmitidos por mosca blanca infecciosas del tomate en Guatemala. En memorias VIII Congreso Guatemalteco de Manejo Integrado de Plagas. Nov. 10-14, pp 72-74.
Moctezuma, E. V. ; Kahl, G. 1997. Análisis del genoma vegetal: Amplificación de las huellas del ADN. Tercer Curso Internacional de Biotecnología Aplicada al Mejoramiento Genético Vegetal. Chapingo, México. Módulo I:30-31p.
Nakhla, M.K., D.P. Maxwell, R.T. Martínez, M.G. Carvalho and R.L. Gilbertson 1994. Two geminiviruses associated with tomatoes in Central America. Phytopathology 84:1155.
Nakhla, M.K.; D.P. Maxwell; R. T. Martínez; M. G. Carvalho and R. L. Gilbertson 1994. Wide spread occurrence of the eastern mediterranean strain of tomato yellow leaf curl geminivirus in the Dominicanan Republic Plant Dis. 78:926.
Navot, N.; R. Pichersky; M. Zeidan, D. Zamir and Czonek. 1991. Tomato yellow leaf curl virus: A whitefly-transmitted geminivirus with a single genomic component. Virology 185:151- 161.
Nestlé-Panamá, 1997. Informe final. Campaña de Tomate Industrial 1996-97.
Polston, J. E. and Anderson, P.K. 1997. The Emergence of White Fly-Transmitted Gemeniviruses in Tomato in the Western Hemisfere. Plant Disease 81:1358-1367.
Polston, J. E.; Chellemi, D. O., Scherser, D. J.; Mc Govern, R. J. and Stansley, P.A.1996. Spatial and temporal dynamics of tomato mottle geminivirus and B. tabaci in Florida tomato fields. Plant Dis 80:1022-1028.
Polston, J.E.; D. Bois; C.A. Serra and S. Concepcion. 1994. First report of a tomato yellow leaf curl-like geminivirus in the western hemisphere. Plant Dis. 78:831.
Polston, J. E.; D. Bois, G. Ano F. Poliakoff and C. Urbino. 1998. Ocurrence of a Strain of potato yellow mosaic geminivirus infecting tomato in the eastern caribbean. Plant Dis 82:726.5
Polston, J.E., Hiebert, E. McGovern, R.J., Stansly, P.A., and Schuster, D.J. 1993. Host range of tomato mottle virus, a new geminivirus infecting tomato in Florida. Plant Dis. 77:1181- 1184.
Polston, J.E.; McGovern, R.J.; Stansly, P. A. 1994. Tomato yellow leaf curl virus University of Florida. Cooperative Extension Service. Ifas. Cirucular 1-4 1143 pp 1-4.
Ramírez, Pilar y Rivera B., Rafael. 1996. Metodologías para el Estudio y Manejo de Moscas Blancas y Geminivirus. Centro Agronómico de Investigación y Enseñanza (CATIE) Turrialba, Costa Rica. Manejo Integrado de Plagas (Costa Rica)38:37-39.
Ramos, P.L.; O. Guerra; R. Peral; P. Oramas; R.G. Guevara and R. Rivera Bustamante 1997. Taino tomato motle virus, a new bipartite geminivirus from Cuba. Plant Dis. 81:1095.
Ramos, P.L; O. Guerra, V. Dorestes, N. Ramírez, R. Rivera Bustamente nd P. Oramas 1996. Detection of TYLCV in Cuba. Plant Dis 78:1219.
Rivas, G.; Ramírez, P.; Cubillo, D.; Hilje, L. 1995. Detección de virus en plantas silvestres asociadas con el tomate y chile dulce en Costa Rica. Manejo Integrado de Plagas(Costa Rica)38:37-39.
Rojas, M.R., R.L.Gilberton, DR. Russell and D.P. Maxwell. 1993. Use of degenerate primers in the polymerase chain reaction to detect white- fly-transmitted geminiviruses. Plant Dis. 77:340-347.
Roye, M.E. 1997. Genetic diversity and phylogeny of whitefly transmitted geminiviruses from Jamaica Ph. D. Thesis. University of the West Indies.
Roye, M.E.; Mc Laughlin; W.A; Nakla, M.K. and Maxwell. D. 1997. Genetic diversity among geminivirus associated with the weed species Sida pp., Macroptiliun lathyroides and Wissadula amplissima from Jamaica Plant Dis. 81:1251-1258.
Ruíz, R. Y Lázaro, E. 1994. Bemisia tabaci (Genn) (Homoptera: Aleyrodidae y sus plantas hospederas silvestres en la península de Azuero, Panamá. Tesis. Licenciatura en Biología. Facultad de Ciencias Naturales y Exactas. Universidad de Panamá.
Saikia, A.K. and Muniyappa, V.1989. Epidemiology and control of tomato leaf curl virus in southen India Trop. Agric. (Trinida) 66:350-354.
Serra, C.A.; Polston, J.E.; Concepción, S.; Ortíz, M.; Nuñez, J. 1995. Hospederos potenciales del complejo “Virus del Rizado Amarillo de Hojas de Tomate” (TYLCV)-Bemisia tabaci (Homoptera:Aleyrodidae) y estrategias para su control en zonas tomateras dominicanas. Memorias IV Taller Latinoamericano sobre moscas blancas y geminivirus. Ceiba Honduras. Vol. 36(1):107.
Stanley, J. 1983. Infectivity of the cloned geminivirus genome requires sequences from both DNAS. Nature (London) 305 : 643 - 645.
Terri Cacao, R. E.; Palmieri L. Mejía 1994. Detección e identificación de geminivirus transmitidos por mosca blanca, por medio de serología e hibridación de DNA. En Memoria VIII. Congreso guatemalteco de Manejo Integrado de Plagas. 10-14 Nov., pp 69-71.
Torres Pachucho, I; J.A. Garzón Tiznado; J.K. Brown; A. Becerra and R.F. RiveraBustamante. 1996. Detection and distribution of geminivirus in Mexico and the Southern United States. Phytopatology 86:1186-1192.
Vásquez, L. L.; Gonzáles, G.; Paredes, E.; Ichemedia, A. 1996. Potencialidades de las malezas en la manifestación del complejo mosca blanca-geminivirus en el tomate. Memorias del V Taller Latinoamericano sobre mosca y geminivirus. Acapulco, México. pág. 194.
Temas relacionados:
Autores:
Recomendar
Comentar
Compartir

¿Quieres comentar sobre otro tema? Crea una nueva publicación para dialogar con expertos de la comunidad.
