INTRODUCCIÓN
El cultivo de cacao (Theobroma cacao) es una de las mejores alternativas económica en Ecuador, debido a que su producción es muy reconocida en el mercado internacional por las características organolépticas que posee; esta condición representa un gran desafío ya que existen principales enfermedades que azotan a este cultivo entre ellas M. roreri., ocasionando pérdidas del 60 % de la producción. Solís y Carmen (2006), lo que se procura controlar empleando fungicidas de síntesis químico que incrementan los costos y el deterioro al ambiente.
Ante ello, la utilización de agentes microbiológicos o biocontrol es, una de las opciones para la protección de los cultivos atacados por patógenos fúngicos del suelo y foliares. Microrganismos antagónicos del género Trichoderma spp., están entre los más estudiados, por tratarse de un hongo fácilmente cultivable en diferentes medios, tener crecimiento rápido y producción de antibióticos que atacan una amplia gama de hongos fitopatógenos (Yánez, 2003). Entre los cuales figuran los hongos del suelo Phythium spp, Rhizoctonia spp, Fusarium spp y Sclerotinia spp y los del follaje Botrytis spp y Peronospora spp, entre otros. El hongo Trichoderma también actúa mediante la producción de antibióticos, por medio de los cuales inhibe el desarrollo de otros hongos o bacterias que compiten por nutrientes y espacio, como ocurre en flores y frutos con Botrytis y Monilia. Villegas, (2005), Además Stefanova, et al (1999) mencionan que la eficiencia del biocontrol realizado por Trichoderma está asociada con la producción de antibióticos no volátiles y con otros mecanismos tales como el micoparasitismo, en el cual posee gran importancia la excreción de quitinasa y proteasas.
El efecto antagónico de Trichoderma ha sido observado por Torres et al. (2008), en diferentes cultivos. Varias especies del mismo género han sido ampliamente ponderadas a nivel in vitro como eficaces biocontroladores de M. roreri y ha sido propuestas como una opción futura para su biocontrol en el campo (Krauss y Soberanis, 2001; Hoopen et al., 2003; Suárez y Cabrales, 2008), Además, Mejía et al. (2008), registran que los integrantes del género Trichoderma son habitantes naturales de los suelos cultivados con cacao.
El objetivo de esta investigación fue aislar cepas nativas del género Trichoderma a nivel in vitro, determinar la velocidad de crecimiento de cada cepa aislada para posteriormente establecer capacidad antagónica frente a M. roreri de acuerdo a las clases y zonas de antagonismo.
MATERIALES Y MÉTODOS
Este trabajo constó de dos etapas; de campo, en la que se realizó el muestreo para el aislamiento de Trichoderma spp., y el hongo fitopatógeno M. roreri., y de laboratorio; donde se realizó el aislamiento de las cepas de Trichoderma spp., y el aislamiento de M. roreri, para posteriormente evaluar la velocidad de crecimiento de las cepas aisladas y determinar la capacidad antagónica al quinto día de evaluación.
PREPARACIÓN DEL MEDIO DE CULTIVO PDA.
Para este trabajo de investigación se utilizó el medio de cultivo PDA, así mismo se realizó un bioensayo utilizando PDA enriquecido con el 10 % de mucilago de cacao previamente esterilizado, esto se utilizó para dar las condiciones al hongo fitopatógenos en estudio y pudiera desarrollarse con mayor rapidez.
AISLAMIENTO DEL FITOPATÓGENO M. roreri.
Se realizó un recorrido en el jardín clonál de cacao de la ESPAM-MFL, para recolectar las muestras del fitopatógeno, se colectaron mazorcas infectadas con un 10% de daño visual, se colocaron en fundas plásticas estériles, y se enviaron al laboratorio de Microbiología del Área Agropecuaria de la ESPAM MFL.
Para el aislamiento M. roreri se tomaron esporas directamente de las mazorcas infectadas y se colocaron en las cajas petri con PDA enriquecido con mucilago de las almendras maduras al 10 % y se dejaron a temperatura ambiente. La comprobación de la autenticidad del patógeno se basó en la observación al microscopio y de sus características externas comparadas con el experimento realizado por Santander s.f., y Agrios (1995). Posteriormente las cepas del fitopatógeno se colocaron en cuñas con PDA enriquecido y en agua destilada, a 4 °C de refrigeración.
AISLAMIENTO DE CEPAS in vitro DEL HONGO ANTAGONISTA Trichoderma spp.
Se tomaron las muestras de suelo a 20 cm de profundidad en el área de clones de cacao y se trasladaron al laboratorio de Microbiología del área agropecuaria de la ESPAM MFL, para realizar el aislamiento de las cepas de Trichoderma spp. Así mismo se tomaron muestras de tejidos vegetales para el aislamiento del fitopatógeno M. roreri., y la preparación del medio de cultivo (PDA).
Se mescló 10 gramos de suelo en 90 ml de agua destilada estéril, realizando diluciones seriales tomando 1 ml de cada dilución y se vertieron en las cajas petri con medio PDA, de cada dilución se realizaron tres siembras, este proceso se lo realizo varias veces, posteriormente se colocaron las placas petri en la estufa a 22º C y se monitorearon de 1 a 9 días.
Luego se purificaron las cepas y se colocaron individualmente para observar ciertas características y una particularidad específica del género como son las fiálides estructurales observadas mediante el microscopio lente 40 X.
VELOCIDAD DE CRECIMIENTO DE LAS CEPAS DE Trichoderma spp., AISLADAS.
En este bioensayo se utilizaron las cepas de Trichoderma spp., seleccionadas para evaluar la velocidad de crecimiento de cada una, utilizando un Diseño Completamente Aleatorizado (DCA), con cuatro réplicas, siendo el factor en estudio las cepas del hongo antagonista Trichoderma spp. (C), realizando el análisis funcional mediante Tukey al 0.05 de probabilidad.
MANEJO DEL EXPERIMENTO.
Se utilizaron discos de micelio de las cepas del género Trichoderma spp., extraídos con un sacabocado de 5 mm de diámetro y colocados individualmente en cajas petri con medio de cultivo PDA enriquecido, luego se incubaron las cepas a una temperatura de 19º C, a partir de allí se midió: el diámetro de crecimiento de las colonias expresados en mm/día empleando una regla estandarizada, la lectura se realizó cada 24 horas por 3 días.
CAPACIDAD ANTAGÓNICA DE Trichoderma spp., VS FITOPATÓGENO M. roreri).
En este bioensayo se realizó un cultivo dual, tomando discos de micelio de 5 mm de diámetro del hongo fitopatógeno M. roreri., colocados a un extremo de la caja petri, luego se tomaron discos de micelio de 5 mm de diámetro de las cepas de Trichoderma spp., los cuales se enfrentan en posiciones opuestas, a 2 cm del borde de la caja petri, equidistantes a 5 cm, de tal modo que el hongo fitopatógeno quedara en contraposición con el hongo Trichoderma spp., los resultados del crecimiento se evaluaron en mm durante tres días. Al cuarto y quinto día se determinó la capacidad antagónica del Trichoderma spp., frente al hongo fitopatógeno de acuerdo a las clases de antagonismo descritas en la escala de Bell, Well and Markham (1982) que consta de cinco clases:
Clase 1. Antagónico cubriendo por completo al patógeno y a la superficie de medio de cultivo.
Clase 2. Antagónico cubriendo al menos el 75% de la superficie del medio de cultivo.
Clase 3. Antagónico cada uno coloniza el 50% de la superficie del medio de cultivo.
Clase 4. Agentes patógenos colonizan al menos el 75% de la superficie del medio de cultivo y parece resistir la invasión del antagónico.
Clase 5. Agentes patógenos cubriendo completamente la superficie del medio de cultivo.
A su vez la zona de antagonismo se evaluó con la escala propuesta por Punja y Grogan (1983), citado por Solís (1999), que consta de los siguientes niveles.
0. No hay zona de antagonismo
1. Aversión ligera (Zona de antagonismo de +/- 1 mm de ancho)
2. Aversión moderada Zona de antagonismo de 2 a 4 mm de ancho)
3. Aversión fuerte (Zona de antagonismo de más de 4 mm de ancho)
RESULTADOS Y DISCUSIÓN
El muestreo se lo realizó en la rizósfera del cacao sitio ideal para encontrar cepas de este género corroborando lo expuesto por Mejía et al. (2008), donde registran que los integrantes del género Trichoderma son habitantes naturales de los suelos cultivados con cacao.
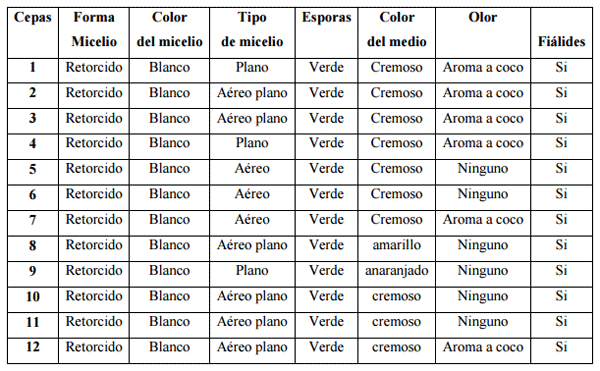
Se aislaron 28 cepas de las cuales de acuerdo a sus características físicas cualitativas de este género se seleccionaron 12 cepas de Trichoderma spp., codificadas de C1 a C12, (cuadro 1). Así mismo se aisló el hongo fitopatógeno que fué identificado por las características morfológicas externas comparadas con estudios realizados por Santander. s.f., y Agrios (1995), y mediante observaciones al microscopio.
Entre las características más relevantes de las 12 cepas encontradas, se observa adquirieron en la fase de multiplicación una esporulación de coloración verde, lo cual corresponde a una característica para hongos del genero Trichoderma spp., coincidiendo con Rifai, (1969), quien menciona que las esporas emitidas son de coloración verde, En cuanto a la percepción del olor a coco que emite este género, 6 de las cepas seleccionadas emitieron este aroma, corroborando con lo expuesto por Dennis y Webster, (1971); citado por Biocontrol, (2005), en que una de la características de Trichoderma spp., es el pronunciado aroma a coco que emite el medio. Las cepas que no emitieron el característico olor a coco se las mantuvo dentro del grupo seleccionado porque al realizar las observaciones microscópicas en placas se determinó que tenía las fiálides que son estructuras únicas de género Trichoderma, como lo manifiesta Rifai.
Cuadro 1.- Características de las 12 cepas aisladas de Trichoderma spp.
VELOCIDAD DE CRECIMIENTO DE LAS CEPAS DE Trichoderma spp., AISLADAS.
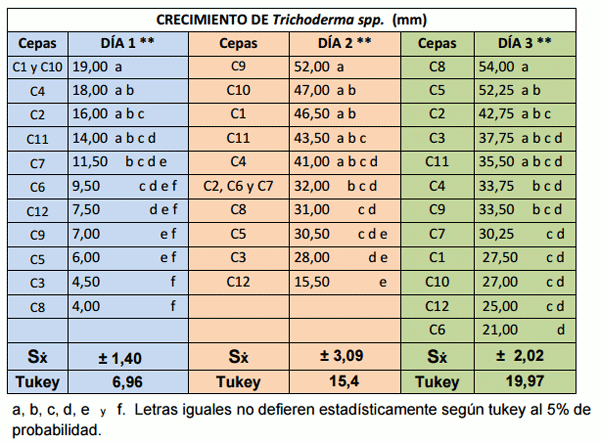
En el día uno de acuerdo al análisis de varianza se encontró diferencias altamente significativas entre los tratamientos, sobresaliendo las cepas C1 y C10, con 19 mm de crecimiento, (cuadro 2). En el segundo día de evaluación se encontró diferencias altamente significativas entre los tratamientos, destacando la cepa C9, con 52 mm, compartiendo esta igualdad estadística con las cepas C10, C1, C11, con promedios de 47, 46.5 y 43.5 mm respectivamente, (cuadro 2).
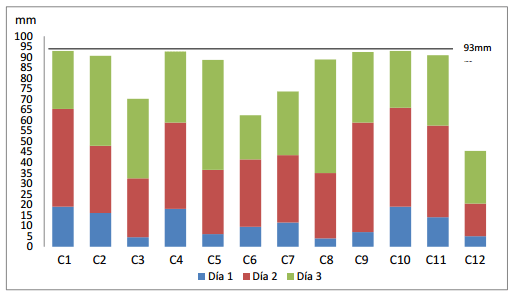
Finalmente en el tercer día de evaluación se encontró diferencias altamente significativas entre los tratamientos, despuntando la cepa C8, con 54 mm, compartiendo esta igualdad estadística con las cepas C5, C2, C3 y C11, con promedios de 52.25, 42.75, 37.75 y 35,50 mm (cuadro 2). Las cepas C1, C10, C4 y C9 completaron el espacio de la caja petri en tres días, coincidiendo con la investigación de Villamil et al 2012, donde el Hongo H20: aislado del suelo, cubrió el medio a los tres días de incubación a 25 °C. Siendo esta una característica de especies del genero Trichoderma. Corroborando con Dennis y Webster (1971) quienes manifiestan que un carácter ventajoso de Trichoderma spp., es colonizar el área de crecimiento rápidamente. (Gráfico 1)
Cuadro 2.- Crecimiento de las 12 cepas de Trichoderma spp., aisladas de un banco clonal de cacao de la ESPAM MFL.
Gráfico 1.- Crecimiento de las 12 cepas de Trichoderma spp., durante los tres días de evaluación.
CAPACIDAD ANTAGÓNICA DE Trichoderma spp., vs FITOPATÓGENO Trichoderma spp., frente a M. roreri
a. Crecimiento
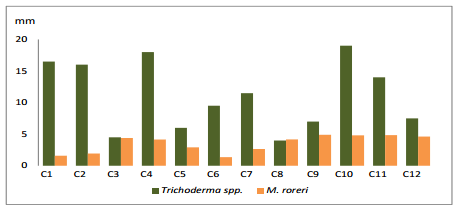
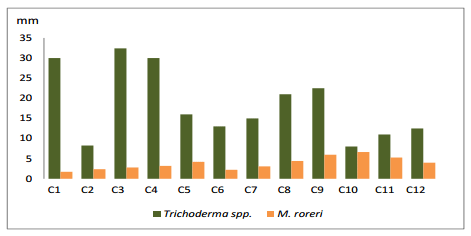
En el (gráfico 2), se presenta el efecto de la confrontación sobre el crecimiento en (mm/día) de las 12 cepas de Trichoderma spp, confrontadas con M. roreri. En el primer día de evaluación sobresalieron las cepas C10 y C4, logrando los mejores crecimientos con 19 mm. El fitopatógeno M. roreri tuvo un crecimiento promedio de 3.53 mm.
Gráfico 2. Crecimiento de Trichoderma spp., frente a M. roreri, en el primer día.
En el segundo día de evaluación (gráfico 3), la cepa de Trichoderma C3, obtuvo el mejor promedio con 32.4 mm seguida de las cepas C1 y C4, que alcanzaron un crecimiento 30 mm; mientras que las cepas de M. roreri crecieron en promedio de 3.81 mm.
Gráfico 3. Crecimiento de Trichoderma spp., frente a M. roreri, en el segundo día.
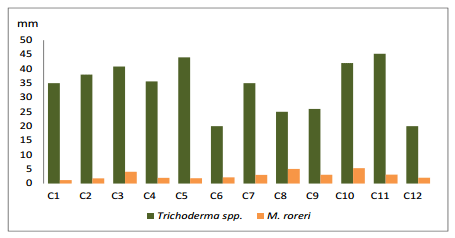
En el tercer día de evaluación (gráfico 4), las cepas C11, C5, C10 y C3, lograron los mayores crecimientos con promedios de 45.25, 44, 42 y 40.8 mm, respectivamente corroborando lo expuesto por Dennis, y Webster, (1971), quienes manifiestan que un carácter ventajoso de Trichoderma spp., es colonizar el área de crecimiento rápidamente. Disminuyendo el crecimiento del fitopatógeno M. roreri alcanzo un promedio de promedio de 4.33 mm, siendo este muy lento en comparación con el antagónico.
Gráfico 4. Crecimiento de Trichoderma spp., frente a M. roreri, en el tercer día.
b. Antagonismo
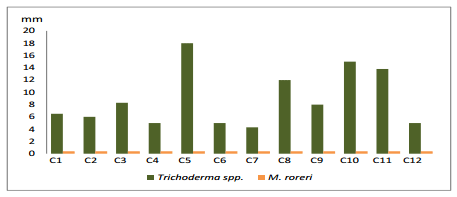
En el cuarto día de evaluación (gráfico 5), las cepas de Trichoderma spp. C5, C10 y C11 crecieron en promedios 18, 15 y 13.8 mm, respectivamente; por lo cual reprimieron considerablemente el crecimiento del fitopatógeno, corroborando lo expuesto por Biocontrol, (2005) que Trichoderma spp., produce una gran cantidad de enzimas inducidas por la presencia del fitopatógeno, que inhibe el crecimiento del mismo.
Gráfico 5. Crecimiento de Trichoderma spp., frente a M. roreri en el cuarto día.
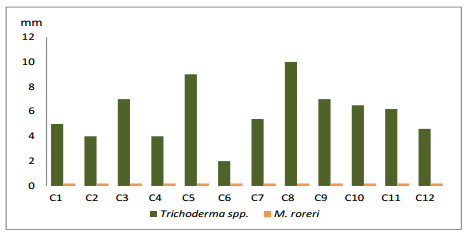
Al quinto día de evaluación (gráfico 6), las cepas C8, C5, C3 y C9 obtuvieron el mejor crecimiento con promedios de 10, 9, 7 y 7 respectivamente, mientras que las cepas de M. roreri disminuyeron totalmente su crecimiento.
Gráfico 6. Crecimiento de Trichoderma spp., frente a M. roreri en el quinto día.
Trichoderma spp., FRENTE A Moniliopthora roreri DE ACUERDO A LAS CLASES Y ZONAS DE ANTAGONISMO.
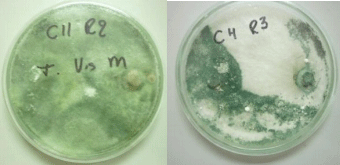
Al confrontar las 12 cepas de Trichoderma spp., con M. roreri, se obtuvieron reacciones antagónicas definidas, lo que permitió agrupar las 6 mejores cepas C1, C3, C4, C5, C10, C11, según la escala de Bell, Well and Markham (1982), en la (Clase1), cubriendo por completo a M. roreri y a la superficie del medio de cultivo. De acuerdo con la escala Punja y Grogan (1983), citado por Solís (1999), las C1, C3, C4, C5, C10, C11, presentaron zona 3, existiendo una aversión fuerte, reprimiendo el avance de la colonia establecida de M. roreri, corroborando lo que dice Krauss y Soberanis (2001), que existen especies de Trichoderma spp., capaces de controlar M. roreri.
Cepa 4 y 11 de Trichoderma spp., ejerciendo antagonismo in vitro frente al fitopatógeno M. roreri
CONCLUSIONES
Del muestreo realizado en el área de clones de cacao de la ESPAM MFL a 20 cm de profundidad, se aislaron en el laboratorio 12 cepas de Trichoderma spp, identificadas cualitativamente de acuerdo a sus características físicas.
Las cepas de Trichoderma spp (C1, C10, C4, y C9), fueron las más veloces en crecer completando el espacio de la caja petri de 93 mm de diámetro en tres días.
Las cepas C1, C3, C4, C5, C10, C11, de Trichoderma spp., se ubicaron en la Clase 1 y Zona 3, puesto que cubrieron por completo a M. roreri, y a la superficie de medio de cultivo, existiendo una aversión fuerte de antagonismo in vitro.
El medio de cultivo PDA enriquecido al 10 % con mucilago, brindo las condiciones para que el hongo Fitopatógeno se desarrolle y sin interferir en el desarrollo de las cepas de Trichoderma spp en estudio, esto podría deberse al que el mucilago es un polisacárido celulósico y los hongos entre mas azucares mejor responden.
LITERATURA CITADA
Agrios, G.N. 1995. Fitopatología. 2a.ed. México, Uthea. 838p. Consultado, 12 abril 2012 disponible http://www.pv.fagro.edu.uy/fitopato/cursos/fitopato/practicas/hongos.html.
Bell, D., Wells, H and Markman, C. 1982. In vitro antagonism of Trichoderma species against six fungal plant pathogens. Phytopathology 72: p 379-382.
Biocontrol. 2005. Trichoderma: fungicida biológico, estimulador de crecimiento en plantas y degrada algunos grupos de pesticidas, Bolo san Isidro, Grano de Oro, Km. 5 Vía PalmiraCandelaria. Palmira. Colombia.
Carsolio C, Benhamou N, Haran S, Cortés C, Gutierrez A, Chet I, Herrera-Estrella A. 1999. Role of the Trichoderma harzianum endochitinase gene, ech42, in mycoparasitim. Appl Environ Microbiol. 65:929-935.
César E. 2007. “Validación de biopesticidas para el control de la moniliasis y manejo sustentable del cacao fino y de aroma en el Ecuador”. Publicación científica. Sangolquí Ecuador. p 38.
Dennis L, Webster J. 1971. Antagonistic properties of species groups of Trichoderma. III Hyphal interaction. Trans Br Mycol Soc. 57:363-369.
Esposito, E. y DaSilva M. 1998. Systematics and enviromentai application of the genus Trichoderma. Critical review in microbiology. 24: 89-98.
Hjeljord L, Tronsmo A. 1998. Trichoderma and Gliocladium in biological control: an overview. In: Trichoderma & Gliocladium: Enzymes, biological control and commercial applications. Harman GE, Kubice CP. (Eds). 2:131-151.
Taylor & Francis. Hoopen, M., R. Rees, P. Aisa, T. Stirrup and U. Krauss. 2003. Population dynamics of epiphytic mycoparasites of the genera Clonostachysand Fusariumfor the biocontrol of black pod (Phytophthora palmivora) and moniliasis (Moniliophthora roreri) on cocoa (Theobroma cacao). Mycological Research 107(5): 587-596.
Krauss, U. and W. Soberanis. 2001b. Biocontrol of cocoa pod diseases with mycoparasite mixtures. Biological Control 22(2): 149-158.
Hoopen, M., R. Rees, P. Aisa, T. Stirrup and U. Krauss. 2003. Population dynamics of epiphytic mycoparasites of the genera Clonostachysand Fusariumfor the biocontrol of black pod (Phytophthora palmivora) and moniliasis (Moniliophthora roreri) on cocoa (Theobroma cacao). Mycological Research 107(5): 587-596.
Marzuly R y Domenico P. 2010. Diversidad de Trichoderma spp., en plantaciones de Theobroma cacao L. del estado Carabobo Venezuela, y su capacidad biocontroladora sobre Crinipellis pernicosa (stahel) Singer. VOL. 35 Nº 10:789-783.
Mejía, A, y C. Arguello. 2000. Manejo integrado de la monilia en cacao (Theobroma cacaoL.) en Santander. pp. 74-84. En: Tecnología para mejoramiento del sistema de producción de cacao. Convenio Corpoica Regional 7 – Ministerio de Agricultura, Bucaramanga. Colombia. 144 p.
Panizo, M.; Reviakina, V., Montes, W.; Gonzalez, G. 2005. Mantenimiento y preservación de hongos en agua destilada y aceite mineral. Revista Sociedad Venezolana de Microbiología. Vol. 25 (no 1): 35-40.
Rifai, M. 1969. A Revision of the generus Trichoderma, Conmonwelth Mycological Institute. England.
Santander, D. Oliva, R. Solís, K. Gramacho, K. Suárez, C. s.f. Caracterización de aislados ecuatorianos de Crinipellis perniciosa y Moniliophthora roreri, mediantes marcadores moleculares microsatelitales. CIP. Quito. INIAP-Pichilingue, Ecuador.
Solís K. 1999. “Determinación de organismos antagónicos a Monilia roreri a partir de mazorcas de cacao dejadas en el suelo”. Tesis. Ing. Agrónomo. U.F.C.A. Guayaquil. EC. p 28.
Solís K., Carmen S 2006. Uso de Trichoderma spp para control del complejo MoniliasisEscoba de Bruja de cacao en Ecuador. INIAP-Pichilingue, Quevedo Ecuador.
Stefanova M., Leiva A., Larrinaga L., Coronado M., 1999. Actividad metabólica de cepas de Trichoderma spp., para el control de hongos fitopatógenos del suelo.
Suárez, L y C. Cabrales. 2008. Identificación de las especies de cepas nativas de Trichodermasp. y Bacillussp. y evaluación de su potencial antagonista in vitrofrente al hongo fitopatógeno nativo M. rorerien el departamento de Norte de Santander. Universidad Francisco de Paula Santander 13(1): 45-56.
Torres, E., J. Iannacone and H. Gómez. 2008. Biocontrol del moho foliar del tomate Cladosporium fulvum empleando cuatro hongos antagonistas. Bragantia 67(1): 169-178.
Villamil J, Blanco J y Viteri S. 2012. Evaluacion in vitro de microorganismos nativos por su antagonismo contra Moniliophthora roreri y Crinipellis perniciosa, en cacao (Theobroma cacao). Universidad Pedagógica y tecnológica de Colobia. (En Línea). Consultado, 20 de febrero de 2013. Formato PDF. Rev.Fac.Nal.agr. Medellín. Disponible en la web: www.scielo.org.co/pdf/rfnam/v65n1a02.pdf.
Villegas, M. 2005. Características generales de Trichodermay su potencial biólogico en la agricultura sostenible. consultado enero 2011 http://www.oriusbiotecnologia.com/escritos -tecnicos/128-trichoderma-pers-caracteristicas-generales-y-su-potencial-biologico-en-la agricultura-sostenible. 1 p.
Yánez V. 2003. Agentes de biocontrol. En: Produccion y formulación de biopesticidas a base de Pseudomonas cepacia, Bacillus subtilis y Trichoderma spp. Para el control biológico de la moniliasis en cacao. Boletín técnico Nº. 2, EdiEspe. p 7-8.