INTRODUCCIÓN
El manejo de malezas en las primeras etapas de un cultivo es fundamental para lograr un buen establecimiento y evitar mermas en el rendimiento. Durante muchos años, la fumigación de suelos y sustratos con bromuro de metilo fue una práctica generalizada y de buenos resultados, para controlar malezas y otras plagas en las producciones hortícolas y florícolas (especialmente en los cultivos bajo invernáculo), tabacaleras y en los cultivos de frutilla. Debido a la prohibición del uso del bromuro de metilo a causa de su efecto nocivo sobre la capa de ozono (MBTOC, 1994), se lo sustituyó gradualmente por algunos pesticidas sintéticos y también por otros métodos, como el cultivo sin suelo en almacigueras de tabaco, la solarización y la inyección de vapor de agua (Biaggi et al., 2011; Pizano, 2014). Es importante continuar con la búsqueda de nuevas alternativas para el control de malezas y otras plagas del suelo que sean efectivas y amigables con el medio ambiente.
Una de esas alternativas es la biofumigación, que puede definirse como el control de plagas y patógenos edáficos por medio de la liberación en el suelo de compuestos, en su mayoría volátiles, originados por la descomposición de residuos orgánicos (Gimsing & Kirkegaard, 2006). Como biofumigantes se pueden emplear estiércoles, residuos de las cosechas y agroindustriales, incorporación de plantas de Brassicáceas, sorgo, maíz, etc. A diferencia de los pesticidas químicos, como el metam sodio y el dazomet, la incorporación de enmiendas biofumigantes aumenta el contenido de materia orgánica del suelo, mejora la estructura y la penetración del agua y reduce el encostramiento y la erosión (Kirkegaard & Matthiessen, 2004; Pung et al., 2008).
Durante el proceso de biofumigación, como resultado de la descomposición del material orgánico, se generan en el suelo sustancias con actividad biocida tales como amonio, ácido acético, compuestos azufrados, etc. Además, si el material en descomposición es un abono de Brassicáceas, los glucosinolatos presentes en sus tejidos (Kjaer, 1976), se hidrolizan por la acción de la enzima mirosinasa produciendo diferentes tipos de isotiocianatos, con variable grado de toxicidad frente a diversos organismos (Gowers, 2008; Harding & Wicks, 2001; Molina-Vargas & Bentura-Castellanos, 2009).
Según algunos autores, la biofumigación puede inhibir la emergencia y el crecimiento de las malezas (Anderson et al., 2008, Boydston, 2008; Boydston et al., 2008; 2011; Lopez-Martinez et al., 2006; Mattner et al., 2008; Norsworthy et al., 2005; Pereyra et al., 2008; Perniola et al., 2011; Webber et al., 2012). Otros investigadores han demostrado la eficacia de esta técnica para reducir las poblaciones de nemátodos (Kruger et al., 2011; Mitidieri et al., 2005; 2009; Pattison et al., 2003), insectos (Noble et al., 2002) y hongos fitopatógenos (Charron & Sams, 1999; Dunne et al., 2003; Iriarte et al., 2011; Kirkegaard et al., 1996; Mayton et al., 1996; Perniola et al., 2012; 2014; Riches et al., 2011; Zurera et al., 2007).
Actualmente, la información disponible sobre el control de malezas mediante biofumigación es escasa, por lo que resulta importante investigar en esta área dado las ventajas ecológicas que presenta la biofumigación sobre los productos químicos sintéticos.
El objetivo de este trabajo fue determinar in vitro el efecto herbicida de la biofumigación con Brassica juncea L. Czerniak (mostaza parda) y Sinapis alba L. (mostaza blanca), en el estadio de fin de fructificación, sobre la germinación y el crecimiento de plántulas de Anoda cristata (L.) Schltdl. (malva cimarrona), Picris echiodes L. y Portulaca oleracea L. (verdolaga), especies arvenses frecuentes en los cultivos del cinturón verde de Buenos Aires.
MATERIALES Y MÉTODOS
Los materiales vegetales utilizados como biofumigantes fueron dos especies de Brassicáceas: B. juncea (mostaza parda) y S. alba (mostaza blanca). Ambas especies se sembraron en el campo experimental del Instituto Fitotécnico de Santa Catalina, Llavallol, Argentina, en mayo de 2012 y cuando los cultivos alcanzaron el estadio de fin de fructificación (en octubre del mismo año), se cosechó la parte aérea.
Las especies arvenses evaluadas fueron A. cristata (malva cimarrona), P. echiodes y P. oleracea (verdolaga), que crecen en forma espontánea en la zona. Sus semillas se cosecharon en otoño de 2011 y se conservaron en heladera hasta el momento del ensayo.
El bioensayo realizado se basó en la metodología llevada a cabo por otros autores para probar el efecto de sustancias naturales o sintéticas sobre la germinación y/o para detectar semillas resistentes a herbicidas (Calle Fernández, 2010; Díaz et al., 2009; Retrum & Forcella, 2002).
Los dos tercios superiores de la parte aérea de las plantas de B. juncea y S. alba, se segaron y se llevaron al laboratorio. El material cosechado se lavó con agua destilada estéril, se cortó en trozos pequeños y se trituró en una procesadora durante aproximadamente un minuto. El material triturado de cada especie de mostaza se colocó por separado en recipientes de plástico de 900 ml, en dos dosis de 10 y 40 g.
En cajas de Petri se colocaron 10 discos superpuestos de papel absorbente de 46 g/m2 y se embebieron con 8,5 ml de agua destilada con pH 6,5. Sobre el papel se apoyaron 50 semillas de una especie de maleza. Se realizó el mismo procedimiento para cada arvense evaluada.
Previo al ensayo, las semillas de A. cristata fueron escarificadas con ácido sulfúrico concentrado durante 20 minutos e inmediatamente lavadas con abundante agua destilada, a fin de superar la dormición (Puricelli et al., 2005).
Las cajas de Petri se introdujeron en los recipientes que contenían el biofumigante, apoyadas sobre soportes de plástico, quedando suspendidas 3 cm por encima del material vegetal triturado. Los recipientes se cerraron con tapas plásticas. Para el tratamiento control se siguió la misma técnica pero no se utilizó material vegetal biofumigante.
La incubación se realizó en cámara de cultivo, a 24 ± 2ºC, con fotoperíodo de 12h/12h luz-oscuridad. La primera etapa del ensayo (“etapa biofumigante”) se extendió por 8 días, durante los cuales las semillas de las malezas estuvieron expuestas a la acción directa de los gases biofumigantes. Al cabo de 8 días se extrajo el material biofumigante de los recipientes de plástico y se prosiguió con la incubación hasta el día 21 (“etapa postbiofumigante”), con el objeto de estudiar el comportamiento de las semillas y plántulas después de haber estado expuestas a los gases. Las mediciones se efectuaron al finalizar cada una de las etapas, es decir, a los 8 y 21 días de incubación.
Los parámetros evaluados fueron: porcentaje de plántulas sobrevivientes normales (International Seed Testing Association, 2010), porcentaje de semillas no germinadas y porcentaje de plántulas muertas. Al 8° día se midió la longitud total de las plántulas normales (radícula más hipocótile) y se calculó el promedio.
Se utilizó un diseño experimental completamente aleatorizado con cuatro repeticiones por tratamiento. Los datos se analizaron por separado para cada especie arvense. Los tratamientos consistieron en las dos dosis de cada especie de mostaza. Para los casos en los que los datos cumplieron con los supuestos necesarios para analizar la varianza, se practicó ANOVA simple y las medias fueron comparadas mediante la prueba de Tukey o, cuando el número de datos fue desbalanceado, la prueba de Fisher LSD. Cuando los datos no cumplieron con los supuestos de aleatoriedad, homocedasticidad y normalidad, se transformaron mediante la aplicación de la raíz cuadrada o el arcoseno de la raíz cuadrada y se sometieron al mismo análisis estadístico. Los datos que no registraron varianza fueron analizados con la prueba no paramétrica de Kruskal-Wallis. En todos los casos, los análisis fueron efectuados con el programa Statistica 7.
RESULTADOS
Efecto de la biofumigación con mostaza parda y blanca sobre la germinación de A. cristata
Etapa biofumigante
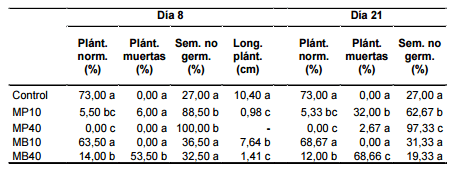
Las mediciones realizadas al 8° día del ensayo (Tabla 1) mostraron bajos porcentajes de plántulas normales de A. cristata en los tratamientos con 10 g de mostaza parda (MP10), 40 g de mostaza parda (MP40) y 40 g de mostaza blanca (MB40) (5,5 %, 0 % y 14 %, respectivamente); estos tratamientos mostraron diferencias altamente significativas con el control y el tratamiento con 10 g de mostaza blanca (MB10) (p < 2,78 x 10-5). No se hallaron diferencias significativas entre el control y MB10.
Las longitudes medias de las plántulas normales (Tabla 1) en MP10 y MB40 fueron las de menor magnitud registradas (0,98 cm y 1,41 cm, respectivamente), y mostraron diferencias significativas con las de MB10 (7,64 cm), que a su vez fueron significativamente más cortas que las del control (10,4 cm).
Con respecto al parámetro plántulas muertas (Tabla 1), el tratamiento MB40 difirió significativamente del resto y presentó el mayor porcentaje (53,5 %); en los demás tratamientos el porcentaje de plántulas muertas osciló entre 0 y 6 %.
Los tratamientos MP10 y MP40 presentaron elevados porcentajes de semillas no germinadas y difirieron significativamente del control, MB10 y MB40 (Tabla 1).
Etapa post-biofumigante
Al finalizar esta etapa, los tratamientos MP10, MP40 y MB40 registraron bajos porcentajes de plántulas normales de A. cristata (5,33 %, 0 % y 12 %, respectivamente), y mostraron diferencias altamente significativas con MB10 y el control (p value = 1,76 x 10-5). No se hallaron diferencias significativas entre el control y MB10 (Tabla 1).
En todos los tratamientos no se registraron diferencias significativas en el porcentaje de plántulas normales entre las dos etapas.
En MP10 y MB40 se observaron los mayores porcentajes de plántulas muertas (32 % y 68,66 %, respectivamente); estos tratamientos mostraron diferencias significativas con el control, MP40 y MB10 (Tabla 1).
Los tratamientos MP10 y MP40 registraron los porcentajes más elevados de semillas no germinadas de A. cristata (62,67 % y 97,33 %, respectivamente), y difirieron significativamente de los otros tratamientos (Tabla 1).
Con respecto a la primera etapa, en los tratamientos MP10 y MB40 disminuyó significativamente el porcentaje de semillas no germinadas y se incrementó significativamente el porcentaje de plántulas muertas.
Tabla 1: Germinación in vitro de A. cristata en presencia de los biofumigantes mostaza parda y mostaza blanca. Mediciones realizadas a los 8 y 21 días del inicio del ensayo. Plánt. norm.: plántulas normales; Plánt. muertas: plántulas muertas; Sem. no germ.: semillas no germinadas; Long. plánt.: longitud de plántulas; MP10: mostaza parda 10 g; MP40: mostaza parda 40 g; MB10: mostaza blanca 10 g; MB40: mostaza blanca 40 g. Los valores con letras distintas en una misma columna indican diferencias significativas por la prueba de Tukey (p < 0,05).
Efecto de la biofumigación con mostaza parda y blanca sobre la germinación de P. echiodes
Etapa biofumigante
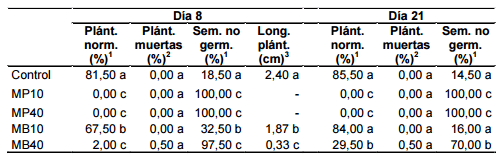
Los tratamientos MP10, MP40 y MB40 mostraron porcentajes de plántulas normales de P. echiodes inferiores al 2 %, y registraron diferencias altamente significativas con MB10 y el control (p value = 1,5 x 10-5), los cuales a su vez difirieron entre sí (p value = 9,05 x 10-4) (Tabla 2).
El tratamiento MB40 registró el menor promedio de longitud de plántula (0,33 cm) y difirió significativamente de MB10 (1,87 cm), que a su vez registró un promedio significativamente inferior al del control (2,4 cm) (Tabla 2).
No se observaron diferencias entre tratamientos en el porcentaje de plántulas muertas de P. echiodes, que en ningún caso superó el 0,5 % (Tabla 2).
Los tratamientos MP10, MP40 y MB40 presentaron los más altos porcentajes de semillas no germinadas y difirieron significativamente de MB10 y del control (Tabla 2).
Etapa post-biofumigante
Al finalizar la segunda etapa, el porcentaje de plántulas normales de P. echiodes en los tratamientos MP10, MP40 y MB40 resultó significativamente inferior al del control y MB10 (p value = 1,5 x 10-5) (Tabla 2). En los tratamientos MP10 y MP40, dicho parámetro permaneció sin modificaciones con respecto a la etapa biofumigante (0 % en ambos casos); en MB40 se registró un incremento significativo del porcentaje de plántulas normales, aunque el valor final alcanzado al 21.er día fue bajo (29,5 %); en cambio, en MB10 el porcentaje de plántulas normales no fue significativamente diferente al de la etapa anterior, sin embargo alcanzó un valor similar al del control (84 %) (Tabla 2).
En todos los tratamientos evaluados, el porcentaje de plántulas muertas de P. echiodes no tuvo variaciones con respecto al día 8 y no registró diferencias significativas entre tratamientos (Tabla 2).
Los tratamientos MP10, MP40 y MB40 mostraron los porcentajes más elevados de semillas no germinadas (100 %, 100 % y 70 %, respectivamente), y difirieron significativamente de los demás tratamientos (Tabla 2). Con respecto a la primera etapa, en los tratamientos MB10 y MB40 disminuyó significativamente el porcentaje de semillas no germinadas, mientras que en los tratamientos con mostaza parda no se registraron diferencias entre las dos etapas para este parámetro.
Tabla 2: Germinación in vitro de P. echiodes en presencia de los biofumigantes mostaza parda y mostaza blanca. Mediciones realizadas a los 8 y 21 días del inicio del ensayo. Plánt. norm.: plántulas normales; Plánt. muertas: plántulas muertas; Sem. no germ.: semillas no germinadas; Long. plánt.: longitud de plántulas; MP10: mostaza parda 10 g; MP40: mostaza parda 40 g; MB10: mostaza blanca 10 g; MB40: mostaza blanca 40 g. Los valores con letras distintas en una misma columna indican diferencias significativas por la prueba de Tukey (1 ), Kruskal-Wallis (2 ) o Fisher LSD (3 ) (p < 0,05).
Efecto de la biofumigación con mostaza parda y blanca sobre la germinación de P. oleracea
Etapa biofumigante
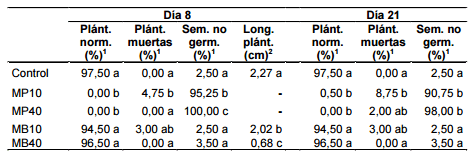
En los dos tratamientos con mostaza parda el porcentaje de plántulas normales de P. oleracea fue nulo y difirió significativamente del observado en MB10, MB40 y el control (p value = 1,5 x 10-5), que registraron valores superiores a 94,5 % (Tabla 3); no se hallaron diferencias significativas entre el control, MB10 y MB40. El tratamiento MB40 registró el menor promedio de longitud de plántula (0,68 cm) y difirió significativamente de MB10 (2,02 cm), que a su vez tuvo un promedio significativamente inferior al del control (2,27 cm) (Tabla 3).
En MP10 y MB10 se observaron los mayores porcentajes de plántulas muertas de P. oleracea (4,75 % y 3 %, respectivamente); estos tratamientos difirieron de resto, en los que no se encontraron plántulas muertas (Tabla 3).
Los porcentajes de semillas no germinadas alcanzaron valores mayores al 95 % en los tratamientos con mostaza parda y difirieron significativamente del control y de los tratamientos con mostaza blanca, que no superaron el 3,5 %.
Etapa post-biofumigante
En todos los tratamientos no se registraron variaciones significativas de ningún parámetro con respecto a la etapa biofumigante.
Los porcentajes de plántulas normales de P. oleracea en los tratamientos con mostaza parda fueron prácticamente nulos, y resultaron significativamente inferiores a los observados en MB10, MB40 y el control (p value = 1,5 x 10-5). Al igual que en la primera etapa, los tratamientos con mostaza blanca no difirieron del control y registraron valores superiores a 94,5 % (Tabla 3).
Tabla 3: Germinación in vitro de P. oleracea en presencia de los biofumigantes mostaza parda y mostaza blanca. Mediciones realizadas a los 8 y 21 días del inicio del ensayo. Plánt. norm.: plántulas normales; Plánt. muertas: plántulas muertas; Sem. no germ.: semillas no germinadas; Long. plánt.: longitud de plántulas; MP10: mostaza parda 10 g; MP40: mostaza parda 40 g; MB10: mostaza blanca 10 g; MB40: mostaza blanca 40 g. Los valores con letras distintas en una misma columna indican diferencias significativas por la prueba de Tukey (1) o Fisher LSD (2) (p < 0,05).
Con respecto a la etapa biofumigante, en MP10 y MP40 el porcentaje de semillas no germinadas disminuyó levemente y el porcentaje de plántulas muertas se incrementó en aproximadamente la misma magnitud (Tabla 3).
DISCUSIÓN
Efecto de la biofumigación con mostaza parda y blanca sobre la germinación de A. cristata
Al 8° día de incubación, el porcentaje de germinación no difirió significativamente entre el control y MB10, pero se presentaron diferencias significativas en la longitud de plántula a favor del control. En el tratamiento MB40 los gases biofumigantes no inhibieron la germinación pero provocaron la muerte de la mayoría de las plántulas. En cambio en MP10 y MP40, los gases biofumigantes actuaron inhibiendo directamente el proceso de germinación, impidiendo el crecimiento inicial del embrión de la semilla.
Al finalizar la etapa post-biofumigante, el porcentaje de plántulas normales fue similar al registrado en el día 8. En los tratamientos MP10 y MB40 se produjo una reactivación de la germinación cuando se extrajo el material fumigante, no obstante murió la totalidad de las nuevas plántulas. Se observó un efecto tóxico residual en los tratamientos MP10, MP40 y MB40 que interfirió con la germinación impidiendo el crecimiento inicial del embrión y/o provocó muerte de plántulas.
El tratamiento MB10 fue el único que no resultó efectivo para inhibir la germinación in vitro de A. cristata, sin embargo, ralentizó el crecimiento de las plántulas.
Efecto de la biofumigación con mostaza parda y blanca sobre la germinación de P. echiodes
Al finalizar la primera etapa, en el tratamiento MB10 los gases biofumigantes inhibieron levemente la germinación, pero ralentizaron significativamente el crecimiento de las plántulas, que tuvieron menor longitud que las del control. En los tratamientos MB40, MP10 y MP40, los gases inhibieron drásticamente el proceso de germinación, impidiendo el crecimiento inicial del embrión de la semilla. En MB10 no se observó un efecto fitotóxico importante sobre las plántulas, que provocara su muerte.
Al retirar el material biofumigante, se reactivó la germinación en los tratamientos con mostaza blanca. Al 21.er día el porcentaje de plántulas normales en MB10 fue similar al del control. En MB40 el 70 % de las semillas permaneció sin germinar.
En los tratamientos con mostaza parda no hubo reactivación de la germinación: el 100 % de las semillas no germinó. Se observó un efecto tóxico residual en los tratamientos MP10, MP40 y MB40 que interfirió con la germinación impidiendo total o parcialmente el crecimiento inicial del embrión. En ningún tratamiento se observó un efecto fitotóxico que incrementara el porcentaje de plántulas muertas.
El tratamiento MB10 fue el único que no resultó efectivo para inhibir la germinación in vitro de P. echiodes, sin embargo provocó una disminución en la velocidad de crecimiento de las plántulas.
Efecto de la biofumigación con mostaza parda y blanca sobre la germinación de P. oleracea
Al 8.° día, el porcentaje de plántulas normales no difirió significativamente entre el control, MB10 y MB40, pero se presentaron diferencias significativas en la longitud de plántula, siendo de mayor tamaño en el control, seguidas por MB10 y por último MB40. En los tratamientos con mostaza parda, los gases biofumigantes actuaron inhibiendo directamente el proceso de germinación, impidiendo el crecimiento inicial del embrión de la semilla. Esta inhibición fue parcial en MP10, ya que un 4,75 % de las semillas germinó pero las plántulas murieron posteriormente.
Al retirar el material biofumigante, en los tratamientos con mostaza parda hubo una pobre reactivación de la germinación, sin embargo la mayoría de las nuevas plántulas murieron antes del 21.er día. Se observó un efecto tóxico residual en los tratamientos con mostaza parda que interfirió con la germinación y provocó muerte de plántulas.
Los tratamientos con mostaza blanca no fueron efectivos para inhibir la germinación in vitro de P. oleracea, sin embargo lentificaron el crecimiento de las plántulas.
Efectividad de la biofumigación con mostazas sobre el control de malezas
En todos los tratamientos biofumigantes se observó algún efecto tóxico de los gases sobre las malezas estudiadas, que: 1) interfirió con la germinación impidiendo el crecimiento inicial del embrión, 2) ralentizó el crecimiento de la plántula y/o 3) provocó muerte de plántulas.
La mostaza parda, en ambas dosis evaluadas, mostró un efecto inhibidor de la germinación sobre las tres especies arvenses estudiadas: A. cristata, P. echiodes y P. oleracea. Este efecto continuó aún después de extraer el material biofumigante.
La mostaza blanca, en dosis de 10 g, no resultó efectiva para inhibir la germinación; en dosis de 40 g inhibió significativamente la germinación de A. cristata y P. echiodes pero no la de P. oleracea. En ambas dosis, la mostaza blanca ralentizó significativamente el crecimiento de las plántulas de las tres malezas evaluadas.
En un estudio previo donde se evaluó el efecto de la biofumigación con B. juncea y S. alba sobre la densidad de malezas en condiciones de campo (Perniola et al., 2011), se observó que ambas mostazas fueron eficientes para reducir la emergencia de P. oleracea y A. cristata.
Los resultados obtenidos en este trabajo, relacionados con el efecto herbicida de la biofumigación con B. juncea y S. alba, son similares a los observados por otros autores. Cabe aclarar que en los ensayos citados en la bibliografía existente, se utilizó mayoritariamente harina de semilla de mostaza (HSM) como material biofumigante, que es un subproducto de la industria aceitera; en cambio, en el presente trabajo el biofumigante fue la parte aérea de plantas de mostaza en el estadio de fin de fructificación. Boydston et al. (2008) estudiaron el efecto de la HSM de S. alba var. IdaGold sobre la emergencia de algunas malezas y observaron reducción del número de plántulas emergidas de Poa annua L. y Stellaria media L. En pruebas en invernadero con HSM de S. alba, Yu & Morishita (2014) observaron menores tasas de emergencia de Kochia scoparia (L.) Schrad., Chenopodium album L. y Echinochloa crus-galli (L.) Beauv., en comparación con el testigo sin mostaza. Norsworthy et al. (2005) encontraron menor biomasa de malezas en cultivos de Vigna unguiculata (L.) Walp precedidos por abonos verdes mixtos de B. juncea y S. alba, aunque esa reducción fue variable según la localidad donde se realizó el ensayo. Earlywine et al. (2010) determinaron que la biofumigación con HSM de B. juncea suprimiría la emergencia y el crecimiento de varias especies de malezas comunes en el césped, y tendría potencial selectividad para Cynodon dactylon (L.) Pers. Vaughn et al. (2006) hallaron inhibición completa de la emergencia de plántulas de trigo (Triticum aestivum L.) y de la maleza Senna obtusifolia (L.) H. S. Irwin & Barneby sembradas en macetas, cuando se incorporaron al sustrato 0,1 y 0,5 % (peso/peso) de HSM de B. juncea , respectivamente. Boydston (2008) observó menor número de malezas en cultivos de papa (Solanum tuberosum L.) y menta (Mentha × piperita L.) recién implantados, cuando se aplicó HSM de S. alba var. IdaGold sobre la superficie del suelo. Boydston et al. (2011) aplicaron HSM de S. alba en plantaciones de cebolla y observaron reducción de la cantidad de malezas emergidas pero también lesiones y mermas en el rendimiento del cultivo, variables según el estadio fenológico de la cebolla y el año ensayado. Handiseni et al. (2011) observaron que la HSM de B. juncea tuvo significativamente mayor eficacia como herbicida de gramíneas que la HSM de S. alba, que fue más efectiva en el control de malezas de hoja ancha. En un ensayo in vitro, Lefebvre et al. (2013) biofumigaron semillas de cinco especies de malezas (C. album, Ambrosia artemisiifolia L., Setaria viridis (L.) P. Beauv., Vicia cracca L. y Daucus carota L.) con plantas secas trituradas de B. juncea cv. Caliente 199 en floración, y observaron reducción de la germinación y de la supervivencia de semillas dormidas e incremento de la mortalidad de plántulas.
Nuestros resultados no coincidieron con los obtenidos por Hoagland et al. (2008) que determinaron que la biofumigación con S. alba produce una mayor y más consistente supresión de malezas que la biofumigación con B. juncea .
CONCLUSIONES
Los resultados obtenidos in vitro sugieren que la mostaza parda, en el estadio de fin de fructificación, es una especie con potencial de utilización para el biocontrol de las arvenses A. cristata, P. echiodes y P. oleracea, debido a su marcado efecto inhibidor de la germinación. La biofumigación con esta Brassicácea podría representar una herramienta alternativa para el manejo integrado de malezas.
Por otro lado, la biofumigación con mostaza blanca tendría un efecto herbicida menos marcado que el de mostaza parda, variable según la dosis y la especie arvense evaluadas. Posiblemente sean necesarias dosis mayores de mostaza blanca para obtener un mejor control de las malezas.
BIBLIOGRAFÍA
- Anderson, D., J.B. Masiunas, S. Bossu & M. Kushad. 2008. Mustards as biofumigants: current status and future prospects. North Central Weed Sci. Soc. Abstr. 63: 172. [CD-ROM computer file]. North Central Weed Sci. Soc., Champaign, Illinois, USA.
- Biaggi, C., F. Mondzak & A. Valeiro. 2011. Problemas ambientales, oportunidades de desarrollo: la experiencia del Proyecto INTA Prozono. Ediciones INTA. Tucumán. 118 pp.
- Boydston, R.A. 2008. Mustard seed meal suppresses weeds in potato and peppermint. Proceedings of Western Society of Weed Science Meeting. Anaheim, CA, USA. 61: 37.
- Boydston, R.A., T. Anderson & S.F. Vaughn. 2008. Mustard (Sinapis alba) seed meal suppresses weeds in container-grown ornamentals. HortScience 43(3): 800- 803.pDisponiblepen:uhttp://hortsci.ashspublications.org/ content/43/3/800.full.pdf+html?sid=bec1ac02-1cd04c8b- 9ea2-bf9f217e14f1. Último acceso: abril de 2016.
- Boydston, R.A., M.J. Morra, V. Borek, L. Clayton & S.F. Vaughn. 2011. Onion and weed response to mustard (Sinapis alba) seed meal. Weed Science 59: 546-552.
- Calle Fernández, M. 2010. Control de la germinación in vitro de Araujia sericifera con aceites esenciales de Laurus nobilis, Myrtus communis, Citrus sinensis y Citrus limon. M. Sc. Tesis. Escuela Técnica Superior Ingenieros Agrónomos, Departamento de Ecosistemas Agroforestales, Universidad Politécnica de Valencia, Valencia, España. 59 pp. Disponible en: http://riunet.upv.es/bitstream/handle/10251/11348/Contr ol_de_la_germinaci%C3%B3n.pdf?sequence=1. Último acceso: abril de 2016.
- Charron, C.S. & C.E. Sams. 1999. Inhibition of Pythium ultimum and Rhizoctonia solani by shredded leaves of Brassica species. J. Amer. Soc. Hort. Sci. 124(5): 462- 467.
- Díaz, J., N. Espinoza & R. Galdames. 2009. Test de germinación in vitro para detectar malezas resistentes a herbicidas. Procede de Seminario internacional “Diagnóstico y manejo de la resistencia a herbicidas”. Temuco,oChile.uDisponibleken: http://www2.inia.cl/medios/biblioteca/serieactas/NR3635 7.pdf. Último acceso: abril de 2016.
- Dunne, C.P., B. Dell & G.E.S. Hardy. 2003. The effect of biofumigants on the vegetative growth of five Phytophthora species in vitro. Acta Hortic. 602: 45-51.
- Earlywine, D.T., R.J. Smeda, T.C. Teuton, C.E. Sams & X. Xiong. 2010. Evaluation of oriental mustard (Brassica juncea) seed meal for weed suppression in turf. Weed Technology 24(4): 440-445.
- Gimsing, A.L. & J.A. Kirkegaard. 2006. Glucosinolate and isothiocyanate concentration in soil following incorporation of Brassica biofumigants. Soil Biology and Biochemistry 38: 2255-2264.
- Gowers, S. 2008. Selection of B. napus and B. rapa lines for biofumigation potential. Proceedings of Third International Biofumigation Symposium. Canberra, Australia. pp. 79.
- Handiseni, M., J. Brown, R. Zemetra & M. Mazzola. 2011. Herbicidal activity of Brassicaceae seed meal on wild oat (Avena fatua), italian ryegrass (Lolium multiflorum), redroot pigweed (Amaranthus retroflexus), and prickly lettuce (Lactuca serriola). Weed Technology 25(1): 127-134.
- Harding, R.B. & T.J. Wicks. 2001. Effects of incorporating Brassica and cereal cover crop residues on soil populations of Verticillium dahliae. Proceedings of Second Soilborne Diseases Conference. Lorne, Victoria. pp. 148-149.
- Hoagland, L., L. Carpenter-Boggs, J.P. Reganold & M. Mazzola. 2008. Role of native soil biology in Brassicaceous seed meal-induced weed suppression. Soil Biology and Biochemistry 40: 1689-1697. International Seed Testing Association. 2010. International rules for seed testing. Basserdorf, CHSwitzerland. 300 pp.
- Iriarte, L.E., M.C. Sosa & G.E. Reybet. 2011. Efecto de la biofumigación con repollo sobre el control de Fusarium oxysporum en suelo. RIA 37(3): 231-237. Disponiblenen: http://www.redalyc.org/articulo.oa?id=86421245007. Último acceso: abril de 2016.
- Kjaer, A. 1976. Glucosinolates in cruciferae. En: The Biology and Chemistry of the Cruciferae. Academic Press, London. pp. 207-219.
- Kirkegaard, J.A. & J.N. Matthiessen. 2004. Developing and refining the biofumigation concept. Proceedings of First International Biofumigation Symposium. Florence, Italy. pp. 3-4. Kirkegaard, J.A., P.T.W. Wong & J.M. Desmarchelier. 1996. In vitro supression of fungal root pathogens of cereals by Brassica tissues. Plant Pathol. 45: 593-603.
- Kruger, N., J. Fourie & A. Malan. 2011. The role of cover crops in supressing plant-parasitic nematodes in vineyards. Proceedings of Biofumigation & Biopesticides Symposium. Saskatoon, Canada. pp. 63.
- Lefebvre, M., M. Leblanc & A.K. Watson. 2013. Germination et survie de semences de mauvaises herbes à la biofumigation. Procede de 18e édition Les Journées horticoles. Saint-Rémi, Canadá. Disponible en: https://www.mapaq.gouv.qc.ca/SiteCollectionDocument s/Regions/MonteregieOuest/Journees_horticoles_2013/ 5_decembre/Horticulture_biologique/15h15_Sensibilite_ MLefebvre.pdf. Último acceso: abril de 2016.
- Lopez-Martinez, N., S. Castillo, I. Aguirre, J.E. Gonzalez-Zamora, C. Avilla & J. Lopez-Medina. 2006. Effect of biofumigation on typical weeds of strawberry fields. Acta Hort. (ISHS) 708: 193-196.
- Mattner, S.W., I.J. Porter, R.K. Gounder, A.L. Shanks, D.J. Wren & D. Allen. 2008. Factors that impact on the ability of biofumigants to suppress fungal pathogens and weeds of strawberry. Crop Protection 27(8): 1165-1173.
- Mayton, H.S., C. Olivier, S.F. Vaughn & R. Loria. 1996. Correlation of fungicidal activity of Brassica species with allyl-isotiocyanate production in macerated leaf tissue. Phytopathology 86: 267-271. Disponible en: http://www.apsnet.org/publications/phytopathology/backi ssues/Documents/1996Articles/Phyto86n03_267.pdf?ori gin=publication_detail. Último acceso: abril de 2016.
- MBTOC (Methyl Bromide Technical Options Committee). 1994. Report of the Methyl Bromide Technical Options Committee. Montreal Protocol on substances that deplete the ozone layer. UNEP, Kenya. pp. 304.
- Mitidieri, M.S., M.V. Brambilla, J. Gabilondo, V. Saliva & M. Piris. 2005. Efectos de la solarización y biofumigación sobre la incidencia de podredumbres radiculares en cultivo de tomate bajo cubierta. Procede de XIII Congreso Latinoamericano de Fitopatología. Villa Carlos Paz, Córdoba, Argentina. pp. 519.
- Mitidieri, M., V. Brambilla, V. Saliva, E. Piris, M. Piris, R. Celié, C. Pereyra, K. Del Pardo, E. Chaves & J. González. 2009. Efecto de distintas secuencias de tratamientos de biofumigación sobre parámetros fisicoquímicos y biológicos del suelo, el rendimiento y la salinidad de cultivos de tomate y lechuga bajo cubierta. Horticultura Argentina 28(67): 5-17. Disponible en: http://www.horticulturaar.com.ar/publicaciones-10.htm. Último acceso: abril de 2016.
- Molina-Vargas, L.F. & J.U. Bentura-Castellanos. 2009. Efecto inhibitorio in vitro de cinco isotiocianatos sobre Rhizoctonia solani Kühn AG-3. Revista de Investigación Agraria y Ambiental: 37-40. Disponible en: http://dialnet.unirioja.es/servlet/articulo?codigo=390849 7. Último acceso: abril de 2016.
- Noble, R.R.P., S.G. Harvey & C.E. Sams. 2002. Toxicity of Indian mustard and allyl isothiocyanate to masked chafer beetle larvae. Plant Health Progress [Online].rDisponiblegen: http://www.plantmanagementnetwork.org/pub/php/resea rch/chafer/. Último acceso: abril de 2016.
- Norsworthy, J.K., L. Brandenberger, N.R. Burgos & M. Riley. 2005. Weed suppression in Vigna unguiculata with a spring-seeded brassicaceae green manure. Crop Protection 24(5): 441-447.
- Pattison, T., T. Martin, S. Akiew, C. Versteeg & J. Kirkegaard. 2003. Can Brassicas be used to manage root-knot nematode in tropical vegetal production? Australasian Nematology Newsletter 14(2): 16-19.
- Pereyra, S.M., A. de L. Avila & E. Orecchia. 2008. La biofumigación y el metam sodio como alternativas al uso de bromuro de metilo. Efecto sobre el control de malezas y las características químicas del suelo. Agriscientia XXV(2): 75-79. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pi d=S1668-298X2008000200003. Último acceso: abril de 2016.
- Perniola, O.S., S.E. Chorzempa, S. Staltari, H. Rodriguez & M. del C. Molina. 2011. Incidencia de la biofumigación sobre el control de malezas. Procede de VIII Simposio Nacional de Biotecnología REDBIO. C.A.B.A., Argentina. Sección 3. 54.
- Perniola, O.S., S. Staltari, S.E. Chorzempa & M. del C. Molina. 2012. Biofumigación con Brassicáceas: actividad supresora sobre Fusarium graminearum. Rev. Fac. Agron. 111(1): 48-53. Disponible en: http://www.agro.unlp.edu.ar/revista/index.php/revagro/ar ticle/view/71/46. Último acceso: abril de 2016.
- Perniola, O.S., S. Staltari, S.E. Chorzempa, M.M. Astiz Gassó & M. del C. Molina. 2014. Control biológico de Fusarium graminearum: utilización de Trichoderma spp. y biofumigación con parte aérea de Brassica juncea. Rev Fac Cienc Agrar. 46(2): 45-56. Disponible en: http://revista.fca.uncu.edu.arhttps://images.engormix.com/stories/pdfs/2014- 02/Cp04_Perniola.pdf. Último acceso: abril de 2016.
- Pizano, M. 2014. Eliminación del bromuro de metilo en países en vías de desarrollo. Una historia de éxito y sus retos. Programa de las Naciones Unidas para el Medio Ambiente. París. 60 pp.
- Pung, H., S. Cross & D. Patten. 2008. The use of biofumigant green manure crops for soil-borne disease management in Tasmania. Proceedings of Third International Biofumigation Symposium. Canberra, Australia. pp. 26.
- Puricelli, E., G. Orioli & M.R. Sabatini. 2005. Efecto de la temperatura sobre la germinación de Anoda cristata. Revista de Investigaciones de la Facultad de Ciencias Agrarias (UNR) VII: 25-31. Disponible en: http://rephip.unr.edu.ar/bitstream/handle/2133/815/El%2 0efecto%20de%20la%20temperatura%20sobre%20la% 20germinaci%C3%B3n%20de%20anoda%20cristata.pd f?sequence=1. Último acceso: abril de 2016.
- Retrum, J. & F. Forcella. 2002. Giant foxtail (Seteria faberi) seedling assay for resistance to sethoxydim. Weed Technology 16: 464-466. Disponible en: http://naldc.nal.usda.gov/naldc/download.xhtml?id=1488 3&content=PDF. Último acceso: abril de 2016.
- Riches, D., O.N. Villalta, D. Wite, J. Kirkegaard, S.W. Mattner, C.A. Scoble, E.C. Donald & I.J. Porter. 2011. In vitro antifungal activity of volatiles from biofumigant brassicas against soilborne pathogens of vegetables. Proceedings of Biofumigation & Biopesticides Symposium. Saskatoon, Canada. pp. 69.
- Vaughn, S.F., D.E. Palmquist, S.M. Duval & M.A. Berhow. 2006. Herbicidal activity of glucosinolatecontaining seedmeals. Weed Science 54: 743-748. Disponiblecen: http://naldc.nal.usda.gov/naldc/download.xhtml?id=2141 &content=PDF. Último acceso: abril de 2016.
- Webber, C.L., J.W. Shrefler & L.P. Brandenberger. 2012. Organic Weed Control. En: Herbicides - Environmental impact studies and management approaches. Ruben Alvarez-Fernandez (Ed.). Publisher: InTech. pp. 185-198. Disponible en: http://cdn.intechweb.org/pdfs/25998.pdf. Último acceso: abril de 2016.
- Yu, J. & D.W. Morishita. 2014. Response of seven weed species to corn gluten meal and white mustard (Sinapis alba) seed meal rates. Weed Technology 28(1): 259-265.
- Zurera, C., E. Romero, M. Porras, C. Barrau & F. Romero. 2007. Efecto biofumigante de especies de Brassica en el crecimiento de Phytophthora spp. in vitro. Procede de XI Congreso Sociedad Española de Ciencias Hortícolas. Albacete, España. Actas de Horticultura 48: 306-309.